Similar presentations:
Лекция 1. Общая химия. Химическая термодинамика. Термохимия
1.
Общая химия- раздел химической науки,
изучающий основные
законы, описывающие
химические процессы,
протекающие в живой и
неживой природе.
2.
ХимическаяТермодинамика
раздел химии, изучающий
взаимные превращения
энергии, теплоты и работы
в термодинамических
системах разных типов.
3.
Термодинамическийметод познания
является ведущим в
современном
естествознании.
4.
Он позволяетрассчитать:
•тепловые эффекты
химических реакций и физикохимических превращений;
•направление
преимущественного
протекания процессов;
5.
• максимальный выходпродуктов реакции;
• максимальную работу,
совершаемую в ходе
процесса
6.
Лекция 1Первый закон
термодинамики.
Термохимия
7. П Л А Н
ПЛАН1.1 Основные понятия
химической
термодинамики
1.2 Первый закон
термодинамики
1.3 Термохимия
8.
1.1 ЭНЕРГИЯ –способность совершать
работу (кДж, ккал)
1 ккал = 4,184 кДж
9.
Виды энергии• Потенциальная
энергия взаимодействия
• Кинетическая
энергия движения
10.
По видам совершаемыхработ различают:
•Химическую,
•Электрическую,
•Световую,
11. По видам совершаемых работ различают:
•Механическую,•Звуковую,
•Поверхностную,
и др. виды энергии
12.
В классической механикеРабота (А)
определяется как
произведение силы на
длину пути:
А = f dℓ
13.
В термодинамикеработа имеет
более широкое
толкование
14.
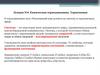
Электрическая=
Е dq
работа
разность
электрический
потенциалов
заряд
15.
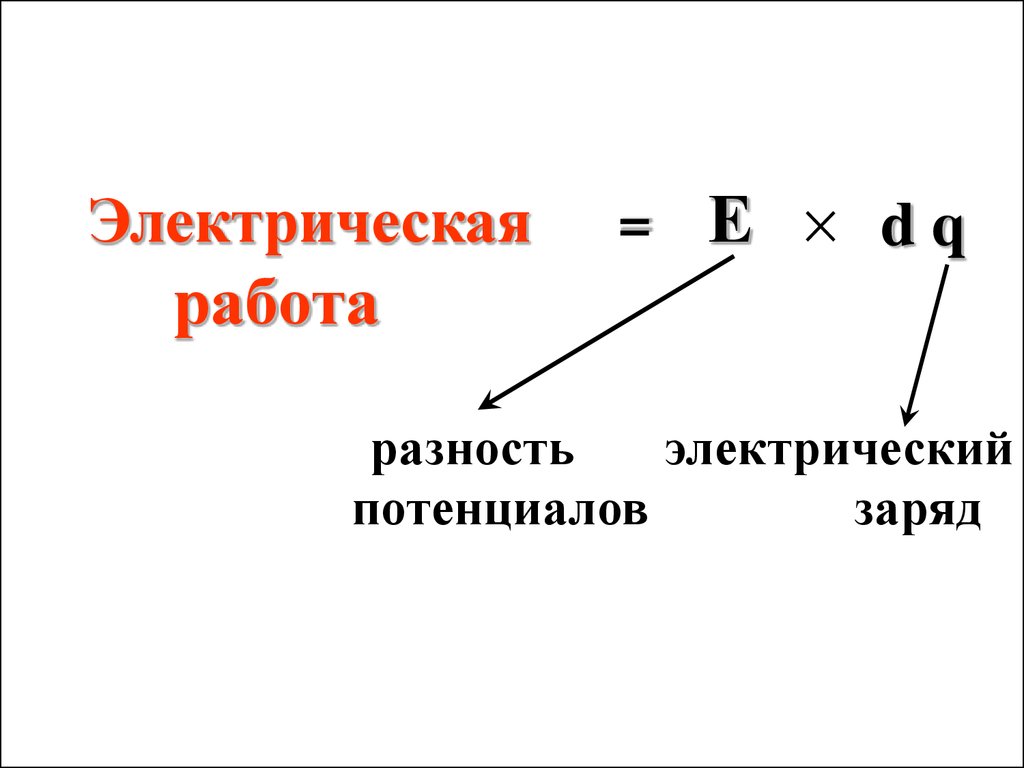
Поверхностнаяработа
dS
Поверхностное
натяжение
Изменение
площади
16.
В термодинамике различают:• работу расширения газа =
= р ΔV
(ΔV – изменение
объема)
полезную работу А΄
17.
Важнейшими видамиполезной работы
в организме являются:
1) механическая
работа – выполняется
при сокращении
мышц;
18.
2) осмотическая работапочек и
цитоплазматических
мембран по переносу
веществ против
градиента
концентраций
19.
3) электрическаяработа нервной
ткани и мозга по
переносу
заряженных
частиц.
20.
ТЕПЛОТА (Q) –перенос энергии между
двумя телами,
имеющими разные
температуры.
21.
ТЕРМОДИНАМИЧЕСКАЯСИСТЕМА
– это тело или группа тел,
отделенных от окружающей
среды термодинамической
оболочкой, которая может
быть реальной физической
или абстрактной
математической.
22.
23.
ОТКРЫТЫЕСИСТЕМЫ
обмениваются с
окружающей средой и
веществом, и энергией
(живая клетка, человек
и др. биосистемы);
24.
За 40 летчеловек
потребляет
40 т воды и
12 млн. л
кислорода
25.
10 тысячплиток
шоколада,
проливает
69 литров
слез
26.
ЗАКРЫТЫЕСИСТЕМЫ
обмениваются с
окружающей средой
только энергией;
обмен веществом
отсутствует
(запанная ампула)
27.
ИЗОЛИРОВАННЫЕСИСТЕМЫ
не обмениваются с
окружающей средой ни
веществом, ни энергией. Они
не существуют в природе и
являются удобными
упрощенными моделями
реальных процессов
28.
Термодинамическое описаниесистемы включает:
набор
термодинамических
параметров:
Т, р, V, ν, m,
изменение которых
свидетельствует о протекании
термодинамических процессов;
29.
набор термодинамических функций,описывающих
способность
системы совершать
работу.
30.
ТЕРМОДИНАМИЧЕСКИЕФУНКЦИИ
Функции
состояния
Их изменения зависят
от начального и
конечного состояния
системы и не зависят
от числа
промежуточных
стадий процесса
Функции
процесса
Их изменения
зависят числа
промежуточных
стадий
AиQ
31.
Примером функции состоянияявляется внутренняя
энергия системы (U) –
это совокупность
потенциальной и
кинетической энергии всех
структурных единиц
системы
32.
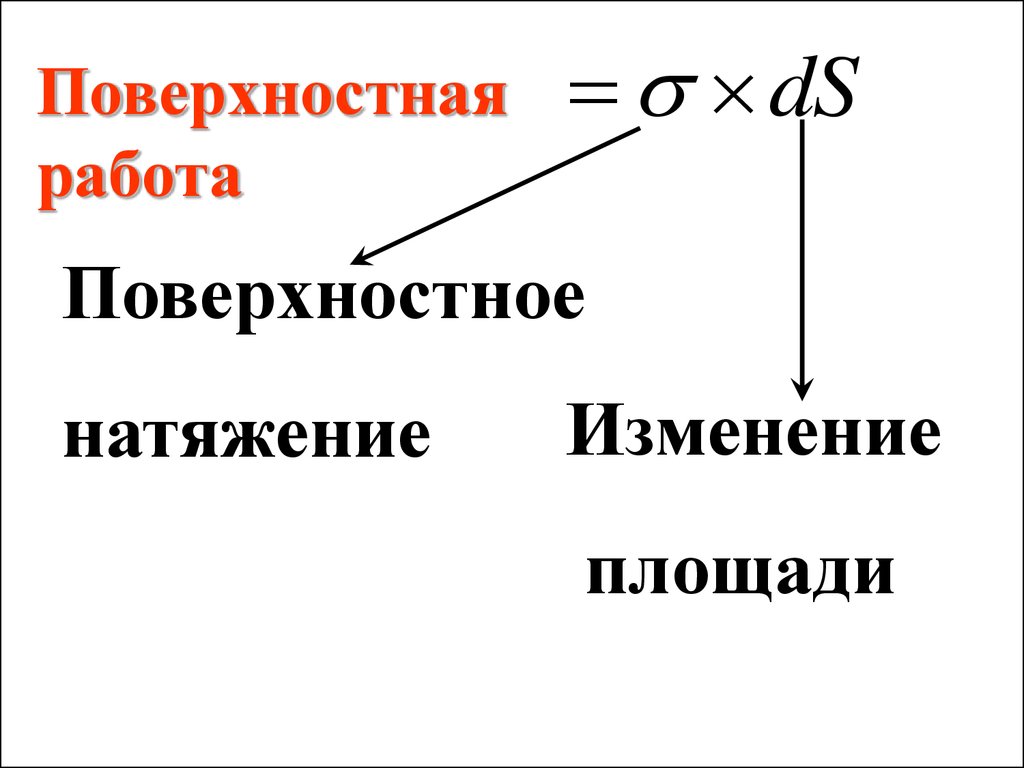
∆U = U2 – U1u2
u1
33.
1.2 Первый закон термодинамикиявляется выражением всеобщего
закона сохранения энергии:
энергия не создается и не
разрушается, она
превращается из одного вида
в другой или переходит их
одной системы в другую.
34.
Первый законтермодинамики был
сформулирован в середине
XIX в. Значительный вклад
в развитие идей
термодинамики сделали
Б. Томпсон, Р. Майер и
Дж. Джоуль.
35. В организме человека превращение одного вида энергии в другой сопровождается совершением работы:
Химическая энергия пищиработа мышц
Механическая энергия
36.
Химическая энергияработа
нервной ткани
Электрическая энергия
37.
Звуковая энергияРабота
внутреннего
уха
Электрическая энергия
38.
Световая энергияРабота
сетчатки
глаза
Электрическая энергия
39.
Первый закон термодинамикине имеет доказательств, но
является результатом опыта,
накопленного человечеством.
Ярким доказательством его
справедливости служит
невозможность создания вечного
двигателя первого рода.
40.
Вечный двигательпервого рода
– это машина,
совершающая работу без
поглощения энергии из
окружающей среды
41.
Первые проекты вечного двигателяпоявились в 13 веке
В 1775 году Парижская
Академия Наук приняла
решения не рассматривать
заявки на патентование вечного
двигателя из-за очевидной
невозможности их создания.
42.
Вечный двигатель Иоганна ЭрнстаЭлиаса Беслера (1680-1745)
43.
44.
Математическое выражение первогозакона термодинамики для различных
типов систем:
1. Внутренняя энергия
изолированной системы
постоянна:
U = const, ΔU = 0
45.
2. Теплота, подводимая кзакрытой системе,
расходуется на увеличение ее
внутренней энергии и на
совершение работы:
Q = ΔU + A
или
Q = ΔU + А΄ + pΔV
46.
Для изобарного процесса(р = const ), при условии А΄ = 0
Q= ΔU + pΔV = ( U2 – U1) + p( V2 – V1) =
= (U2 + pV2) – (U1 + pV1)
U + pV = Н,
где Н – термодинамическая функция
состояния, называемая энтальпией
или теплосодержанием системы
47.
СоответственноQр = H2 – H1 = ΔH,
где ΔH – тепловой эффект изобарного
процесса
для экзотермического процесса ΔH < 0,
для эндотермического процесса ΔH > 0
48.
3. Внутренняя энергия открытой системывозрастает как при ее нагревании, так и
при увеличении количества вещества в
ней:
ΔU = Q ± μΔν – A,
где μ – коэффициент
пропорциональности, называемый
химическим потенциалом,
Δν – изменение количества
вещества, моль
49.
1.3 Термохимия –раздел химической термодинамики,
изучающий тепловые эффекты
химических реакций.
Тепловые эффекты (теплота)
химической реакции обозначается ΔrН
и выражаются в кДж или ккал.
50. ΔrH0298 – это стандартная теплота реакции
0ΔrH 298
– это стандартная
теплота реакции
т.е. теплота,
измеренная при
стандартных условиях
( Т = 298 К,
р = 101,3 кПа,
СМ = 1 М, рН = 7)
51.
Уравнения химическихреакций, в которых указаны
тепловые эффекты и
агрегатное состояние
веществ называются
термохимическими
уравнениями.
52.
N2O4 (ж) → 2 NO2 (г),0
ΔrH = + 58,4 кДж
O2(г) + 2H2S (г)→3S (к) + 2H2О (г),
ΔrH0 = –234 кДж
С6Н12О6(aq) + 6О2(г) → 6 СО2 (г)+6 Н2О(ж),
ΔrН0 = – 2817 кДж
53.
Центральнымзаконом
термохимии
является закон,
сформулированный
в 1840 г.
профессором
СанктПетербургского
университета
Гессом
Герман Гесс
(1802 - 1850)
54.
Закон Гесса (1840)Тепловой эффект химической
реакции, протекающей при
постоянном давлении или объеме,
зависит от состояния исходных
веществ и продуктов реакции и не
зависит от числа промежуточных
стадий процесса.
55.
Закон Гесса есть следствиепервого закона термодинамики,
так как энтальпия является
функцией состояния и ее
изменение определяется лишь
энергетическим состоянием
реагентов и продуктов:
H = H2 – H1
56. Следствия из закона Гесса:
Следствия из закона Гесса:1. Расчет теплового эффекта реакции
по теплотам образования
индивидуальных веществ.
ΔfH – теплота образования
(кДж/моль) – это тепловой эффект
образования одного моль сложного
вещества из простых веществ.
57.
Стандартные теплотыобразования простых
веществ в их наиболее
устойчивых формах
равны нулю
58.
Для условной химическойреакции:
аА + bB → сС + dD
ΔrH = c ΔfH(C) + d ΔfH(D) – a ΔfH(А) –
– b ΔfH(В)
59.
2. Расчеттеплового эффекта
химической реакции по
теплотам сгорания индивидуальных веществ.
ΔсгН – теплота сгорания
–
тепловой эффект окисления одного
моль вещества в чистом кислороде
до высших оксидов
60.
Для условной реакции:ΔrH = а ΔcгH(A) +
+ b ΔcгH(B) – c ΔcгH(C) –
- d ΔcгH(D)
61.
Термохимия является основойдиетологии, науки о рациональном питании.
Приведенные теплоты
сгорания (кДж/г или ккал/г)
пищевых продуктов характеризуют их энергетическую
ценность.
62.
Калорийность важнейшихкомпонентов пищи
Жиры
~ 9 ккал/г
Белки
~ 4 ккал/г
Углеводы
~ 4 ккал/г
63.
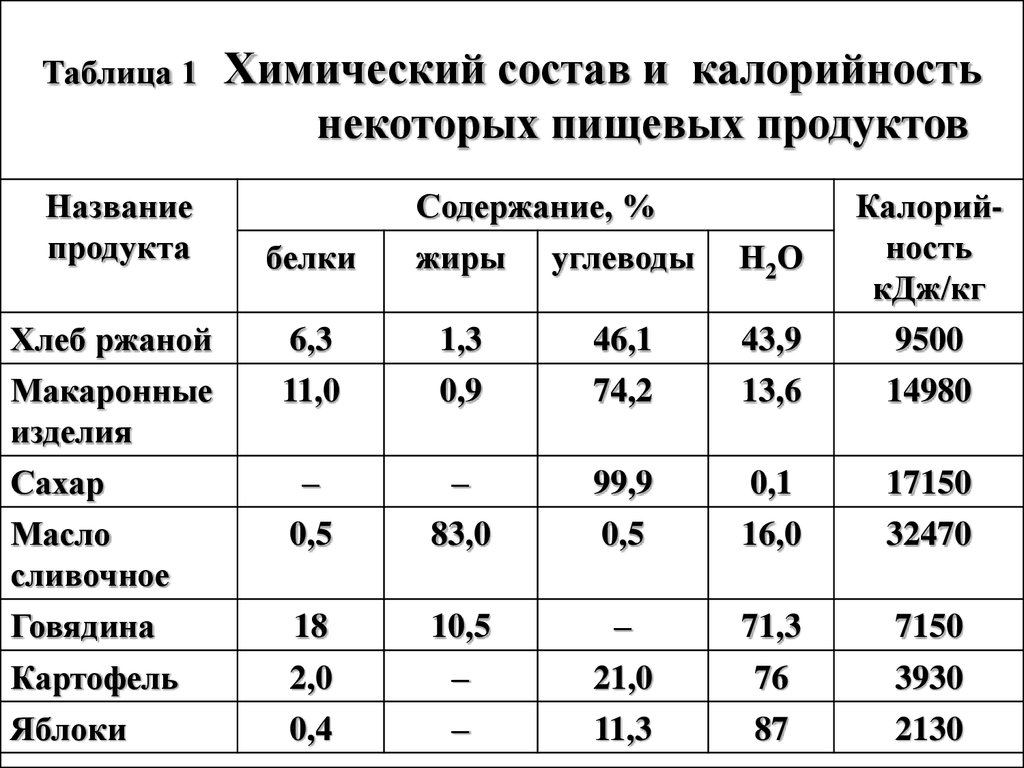
Таблица 1Название
продукта
Хлеб ржаной
Макаронные
изделия
Сахар
Масло
сливочное
Говядина
Картофель
Яблоки
Химический состав и калорийность
некоторых пищевых продуктов
6,3
11,0
1,3
0,9
46,1
74,2
43,9
13,6
Калорийность
кДж/кг
9500
14980
–
–
99,9
0,1
17150
0,5
83,0
0,5
16,0
32470
18
10,5
–
71,3
7150
2,0
–
21,0
76
3930
0,4
–
11,3
87
2130
белки
Содержание, %
жиры углеводы
Н2О
64. Суточная потребность человека в энергии составляет:
• при легкой мышечной работе – 2500 ккал,• при умеренной и напряженной мышечной
работе (студенты, врачи и др.) – 3500 ккал,
• при тяжелом физическом труде
(литейщики, каменщики и др.) – 4500 ккал,
• при особо тяжелом физическом труде
(спортсмены) – 7000 ккал.
65.
Высокая физическая активностьспособствует увеличению
энергозатрат организма на 30-50%.
Энергозатраты организма
возрастают при различных
заболеваниях. Например, при
ревмотоидном артрите
энергетическая прибавка на
болезнь составляет ~10 %.
66.
Мозг человека, как вовремя сна, так и в
период напряженной
творческой
деятельности,
стабильно окисляет 5-6г
глюкозы.
67.
Увеличение калорийности пищипри одновременном снижении
мышечной активности являются
главными причинами ожирения.
Ожирение – не
инфекционная эпидемия 21
века.
68.
По данным ВОЗ в мирезарегистрировано 300 млн.
больных ожирением. В
развитых странах число
страдающих от ожирения
составляет 30 % от общего
числа населения
69.
70.
71.
Масса (кг)Индекс
=
массы тела
2
Рост (м)
Если ИМТ >30
имеет место ожирение
72.
Ожирение повышаетриск сердечнососудистых
заболеваний,
диабета и рака.
73.
Благодаримза
внимание!!!



































































 chemistry
chemistry