Similar presentations:
Термодинамика. Химическая термодинамика
1. Химическая термодинамика изучает:
Термодинамика (ТД)– наука о взаимопревращениях различных видов
энергии в химических и физико-химических
процессах и законах этих превращений.
Химическая термодинамика изучает:
превращения энергии при химических реакциях;
энергетические эффекты, сопровождающие
различные химические процессы и их
зависимость от условий протекания процесса.
2. Химическая термодинамика позволяет:
Рассчитывать тепловые эффекты процессов иэнергии связей на основе первого закона ТД.
Определять направления самопроизвольного
протекания процесса при фиксированных
внешних условиях на основе второго закона ТД.
Рассчитывать константы равновесия химических
реакций и равновесный состав систем, а также
определять оптимальные условия проведения
реакций на основе третьего закона ТД.
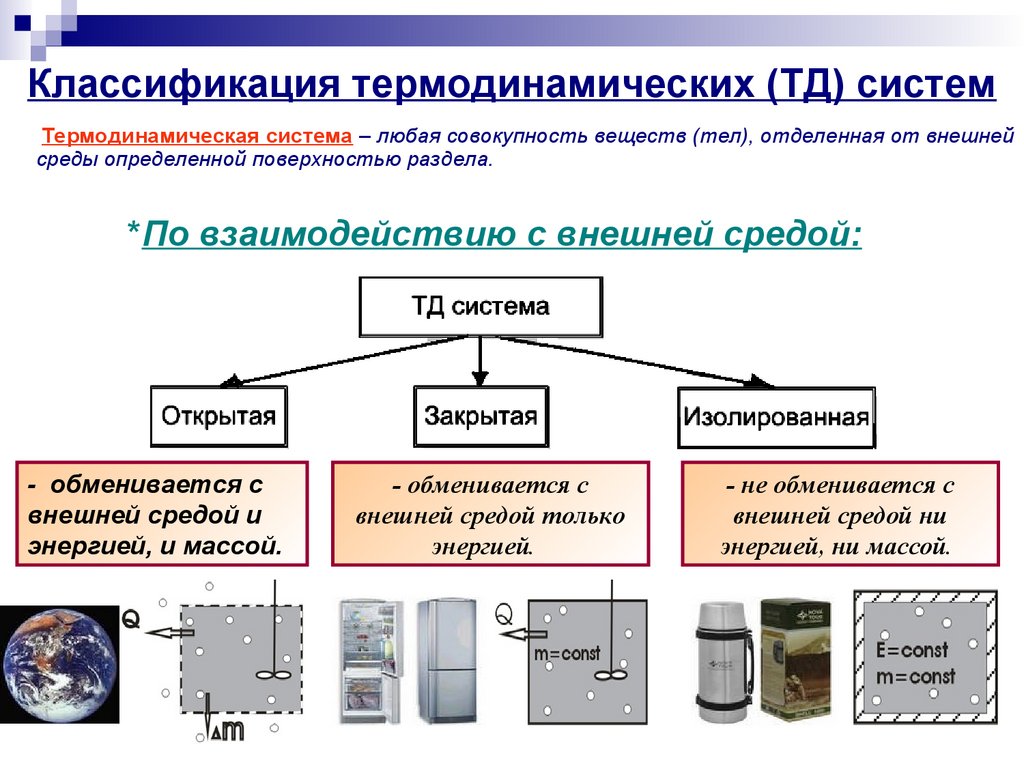
3. Классификация термодинамических (ТД) систем
Термодинамическая система – любая совокупность веществ (тел), отделенная от внешнейсреды определенной поверхностью раздела.
*По взаимодействию с внешней средой:
- обменивается с
внешней средой и
энергией, и массой.
- обменивается с
внешней средой только
энергией.
- не обменивается с
внешней средой ни
энергией, ни массой.
4.
* По агрегатному состоянию ТД подразделяются на:Гомогенные – состоящие из одной фазы.
Пример: водный раствор соли, сплав серебра и золота.
Гетерогенные состоящие из двух и более фаз, отделенных
одна от другой поверхностями раздела.
Пример: смесь воды и масла, раствор соли с ее осадком.
Фаза – однородная часть системы, ограниченная поверхностью
раздела и характеризующаяся в отсутствие внешних сил
постоянством физических и химических свойств во всех точках
5. Состояние системы - характеризуется термодинамическими параметрами и функциями.
Термодинамические параметры состояния– это переменные величины, которые могут быть непосредственно
заданы и измерены: температура Т, объем V, давление p.
Уравнение, описывающее взаимосвязь параметров состояния,
называется уравнением состояния:
pV = n·RT
6. – это переменные величины, которые не могут быть непосредственно измерены и зависят от параметров состояния.
Термодинамические функции состояния– это переменные величины, которые не могут быть
непосредственно измерены и зависят от параметров состояния.
1. Внутренняя энергия
2. Энтальпия
Н
3. Энтропия
S
U
4. Энергия Гиббса G
Термодинамические функции определяются параметрами:
Меняются параметры ↔ изменяются функции
7. Термодинамический процесс - любое изменение параметров системы.
В зависимости от условий протекания различаютследующие виды процессов:
Изотермический (Т = const );
Изобарный (Р = const);
Изохорный (V = const);
Изохорно-изотермический (V = const, Т = const);
Изобарно-изотермический (Р = const, Т = const);
Адиабатный (Q = const).
В качестве идеализированного химического процесса в ТД, как
правило, рассматривают реакцию,
протекающую в изобарно-изотермических условиях.
8. Внутренняя энергия U
Характеризует общий запас энергии в системе:Eк – кинетическая энергия движения частиц;
Eп – потенциальная энергия межмолекулярного взаимодействия;
Ех – энергия химической связи внутри молекулы;
Еа – атомная энергия взаимодействия частиц в ядре атома.
U = Eк + Eп + Ех + Еа
Абсолютное значение внутренней энергии измерить или вычислить
нельзя, можно лишь определить ее изменение при переходе системы
из состояния 1 в состояние 2:
Δ U = U2 – U1
9. Энергия в химических процессах может передаваться от одной системы к другой двумя путями:
В виде теплоты Q - при столкновении хаотически движущихсямолекул и атомов соприкасающихся веществ, энергия передается
от более нагретых частей системы к менее нагретым.
При совершении работы A против внешних сил.
В химических процессах под работой внешних сил подразумевается
работа против внешнего давления.
Обычно она совершается за счет расширения (или сжатия)
системы. Например выделение газа в ходе протекания реакции.
А > 0 - система совершает работу расширения;
А < 0 - внешняя среда совершает работу сжатия над системой.
Взаимосвязь между внутренней энергией, теплотой и работой
устанавливается первым законом термодинамики
10. Первый закон термодинамики
это закон сохранения энергии в изолированной системеТеплота Q, переданная системе, идет на увеличение ее
внутренней энергии ΔU и на совершение работы А системой
против внешних сил:
Q=U+А
Закон: сумма изменения внутренней энергии и совершенной
системой работы равна сообщаемой теплоте
Механическая работа расширения или сжатия равна произведению давления
(Р) и имению объема системы (V) при переходе из одного состояния в другое:
А = р(V2 – V1) = p·ΔV,
11. Приложение первого закона ТД к различным процессам
Изохорный процесс (V=const), отсюда:Q = U + А; А = p·ΔV = 0, тогда
Q = ΔU
В изохорном процессе теплота, сообщенная системе, полностью
расходуется на увеличение ее внутренней энергии.
Изотермический процесс (Т=const, U=const):
Q = U + А; тогда
Q=А
В изотермическом процессе теплота, сообщенная системе,
полностью расходуется на совершение работы расширения.
Адиабатный процесс (Q=0):
Q = U + А, тогда
А = - ΔU
В адиабатном процессе механическая работа может совершаться
только за счет убыли внутренней энергии системы.
12.
Изобарный процесс (p=const):Q= U + А
Q= U2 – U1 + p·(V2 – V1)
Q= U2 – U1 + pV2 – pV1
Q= (U2 + pV2) – (U1 + pV1)
Обозначим значение (U + pV) через Н, тогда:
Q= Н2 – Н1 = ΔН (– энтальпия)
В изобарном процессе теплота, сообщенная системе, расходуется
на увеличение ее внутренней энергии и совершение работы, т.е.
на изменение энтальпии системы.
Энтальпия - функция состояния системы, характеризующая
ее теплосодержание.
13.
Практическое применение первого закона термодинамикик химическим процессам изучает раздел термохимии:
- тепловые эффекты химических реакций;
- тепловые эффекты физ.-хим. процессов:
(гидратация, растворение, кристаллизация …)
Тепловой эффект химической реакции – это
изменение внутренней энергии системы при
протекании в ней химической реакции.
Так как химические процессы в основном протекают при р=const,
следовательно тепловой эффект химических реакций и есть
изменение энтальпии
ΔН [Дж/моль или кДж/моль]
14.
Если система находится в стандартном состоянии, тотепловой эффект реакции называют стандартным
0
изменением энтальпии:
ΔН298
• Стандартное состояние: Р = 101 Па
T = 298 К
• Нормальное состояние:
(1 атм);
(25 0С)
Р = 101 Па (1 атм);
T = 273 К (0 0С)
По значению теплового эффекта химической реакции (- или +)
можно судить об изменении запаса ее внутренней энергии
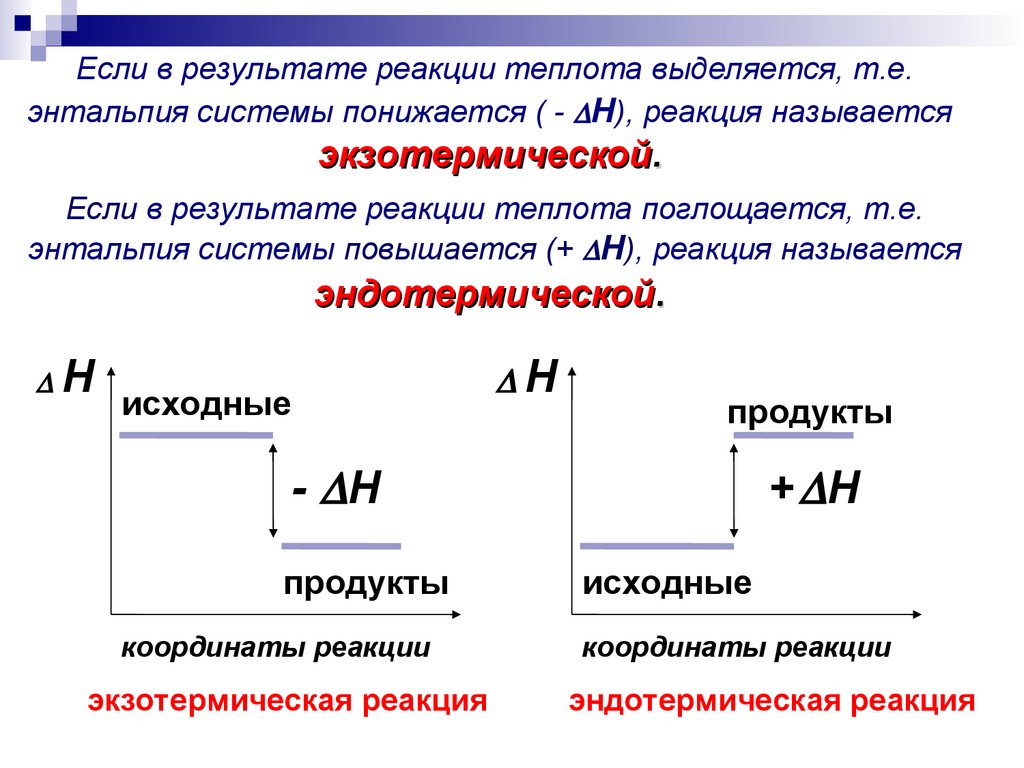
15.
Если в результате реакции теплота выделяется, т.е.энтальпия системы понижается ( - H), реакция называется
экзотермической.
Если в результате реакции теплота поглощается, т.е.
энтальпия системы повышается (+ H), реакция называется
эндотермической.
H
H
исходные
продукты
- H
продукты
координаты реакции
экзотермическая реакция
+ H
исходные
координаты реакции
эндотермическая реакция
16.
Тепловые эффекты при растворении веществ.Теплота гидратации соли.
(ΔНгидр)
Теплота (энтальпия) гидратации соли
– количество теплоты выделившееся или поглотившееся при растворении 1
моль соли воде при стандартных условиях.
- Растворение ионного соединения протекает в две стадии:
разрушение кристаллической решетки вещества ΔНреш.
процесс эндотермический
гидратация ионов (взаимодействие вещества с Н 2О) ΔНгидр.
процесс экзотермический
ΔНрастворения = ΔНреш + ΔНгидр
Значение энергии кристаллической решетки величина справочная, следовательно теплоту растворения вещества можно определить экспериментально.
17. Основные термохимические законы
Закон Лавуазье–Лапласа: Теплота разложения данного химическогосоединения на простые вещества численно равна теплоте образования
этого соединения из соответствующих простых веществ, но имеет
противоположный знак.
СН4(г) → С(графит) + 2Н2 (г),
ΔН° = +74,9 кДж/моль
С(графит) + 2Н2 (г) → СН4(г),
ΔН° = -74 ,9 кДж/моль
Энтальпия (теплота) образования Δ Нf ° сложного вещества это
тепловой эффект образования 1 моль этого вещества из простых
веществ при стандартных условиях. (величина справочная)
* Стандартные энтальпии образования простых веществ равны нулю.
* Если вещество может иметь несколько аллотропных модификаций,
то нулю будет равна наиболее устойчивая модификация вещества.
* Если вещество при стандартных условиях имеет два агрегатных
состояния, то нулю будет равна ΔНf ° наиболее устойчивой фазы.
18. Термохимические уравнения
Химические уравнения, в которых указаны тепловыеэффекты реакций и агрегатные состояния веществ,
называют термохимическими.
2Н2(г) + О2(г) = 2Н2О(ж), ΔН° = -571,6 кДж
Чтобы показать тепловой эффект при образовании
1 моль вещества в термохимических уравнениях
применяют дробные коэффициенты:
Н2(г) + ½О2(г) = Н2О(ж), ΔН° = -285,8 кДж
По термохимическим уравнениям реакций можно
проводить различные расчеты.
19. Закон Гесса
Энтальпия реакции, т.е. тепловой эффект реакции прир,T=const, зависит от природы и агрегатного состояния
исходных веществ и конечных продуктов, но не
зависит от пути протекания реакции
С( ) + О2 (г) = СО2(г)
С(тв) + ½ О2(г) = СО(г)
СО(г) + О2(г) = СО2(г)
ТВ
Н1
Н2
Н3
Н1 = Н2 + Н3
1 следствие из закона Гесса:
+ Н прямой реакции = – Н обратной реакции
ΔН° + 583,9 кДж
Al2O3(к) + 3SO3(г) = Al2(SO4)3(к)
ΔН° − 583,9 кДж
20.
2 следствие из закона Гесса: с термохимическими уравнениямиможно оперировать так же, как и с алгебраическими.
Задача 1. Вычислить тепловой эффект реакции, термохимическое
уравнение которой имеет вид:
2 С(графит) + 3 Н2(г) = С2Н6(г); ΔН°х.р. = ?
исходя из следующих данных:
а) С2Н6 (г) + 3,5 О2 = 2 СО2(г) + 3Н2О(ж);
ΔН° = - 1559,87 кДж
б) С(графит) + О2(г) = СО2(г) ;
ΔН° = - 393,51 кДж
в) Н2(г) + 0,5 О2(г) = Н2О(ж);
ΔН° =- 285,84 кДж
Для получения искомого результата следует уравнение (б) умножить на 2,
уравнение (в) умножить на 3, а затем из суммы этих уравнений вычесть
уравнение (а) : (2 б + 3 в) - а
2С(графит) + 2О2(г) = 2СО2(г) ;
ΔН° = - 787,02 кДж
3Н2(г) + 1,5 О2(г) = 3Н2О(ж);
ΔН° = - 857,52 кДж
2С(графит) + 3Н2(г) + 3,5 О2(г) = 2СО2(г)+ 3Н2О(ж) Δr Н° = - 1644,54 кДж
Тогда:
ΔН°х.р. = -1644,54 – (-1559,87) = -84,57 кДж/моль
21. 3 следствие из закона Гесса: энтальпия реакции равна сумме энтальпий образования продуктов за вычетом суммы энтальпий
образования реагентов с учетом ихстехиометрических коэффициентов.
Н х.р = ni Н f (продукты) — ni Н f (исх.в-в)
22. Задача 2. При взаимодействии кристаллического оксида алюминия и газообразного оксида серы(VI) получен кристаллический сульфат
алюминия. Составьте термохимическое уравнение реакции, вычислитетепловой эффект, укажите тип реакции: экзо- или эндотермическая.
1.
2.
Составляем уравнение реакции: Al2O3 + 3SO3 = Al2(SO4)3
Из справочника выписываем значения Δf Н°298 для веществ,
входящих в уравнение реакции:
Н(Al2O3,к) = −1669,8 кДж/моль; Δf Н(SO3,г) = −396,1 кДж/моль;
Δf Н(Al2(SO4)3,к) = −3442,0 кДж/моль.
3.
Δf
Вычисляем тепловой эффект реакции:
Δ Н°х.р. = [Δf Н(Al2(SO4)3,к)] − [Δf Н(Al2O3,к) + 3Δf Н(SO3,г)] =
= −3442,0 − (−1669,8 + 3·(−396,1)) = −583,9 (кДж)
Записываем термохимическое уравнение реакции:
Al2O3(к) + 3SO3(г) = Al2(SO4)3(к), Δr Н° = −583,9 кДж
1.
Δr Н < 0, следовательно реакция экзотермическая, протекает с
выделением тепла.
23. Задача 3. Учитывая термохимическое уравнение реакции: Н2(г) + F2(г) = 2HF(г) Δr Н° = − 537,2 кДж, найдите массу фтора,
вступившего в реакцию, если количествовыделившейся теплоты составило 429,76 кДж.
1.
Находим количество вещества фтора, которое вступило в
реакцию:
по ур-нию р-ции: 1 моль F2 − 537,2 кДж
фактически: х моль F2 − 429,76 кДж, откуда
х = 429,76/537,2 = 0,8 моль (F2)
2.
Находим массу фтора, вступившего в реакцию:
М = m/n; m = M·n;
m (F2) = 38г/моль· 0,8 моль = 30,4 г
Ответ: m(F2) = 30,4 г
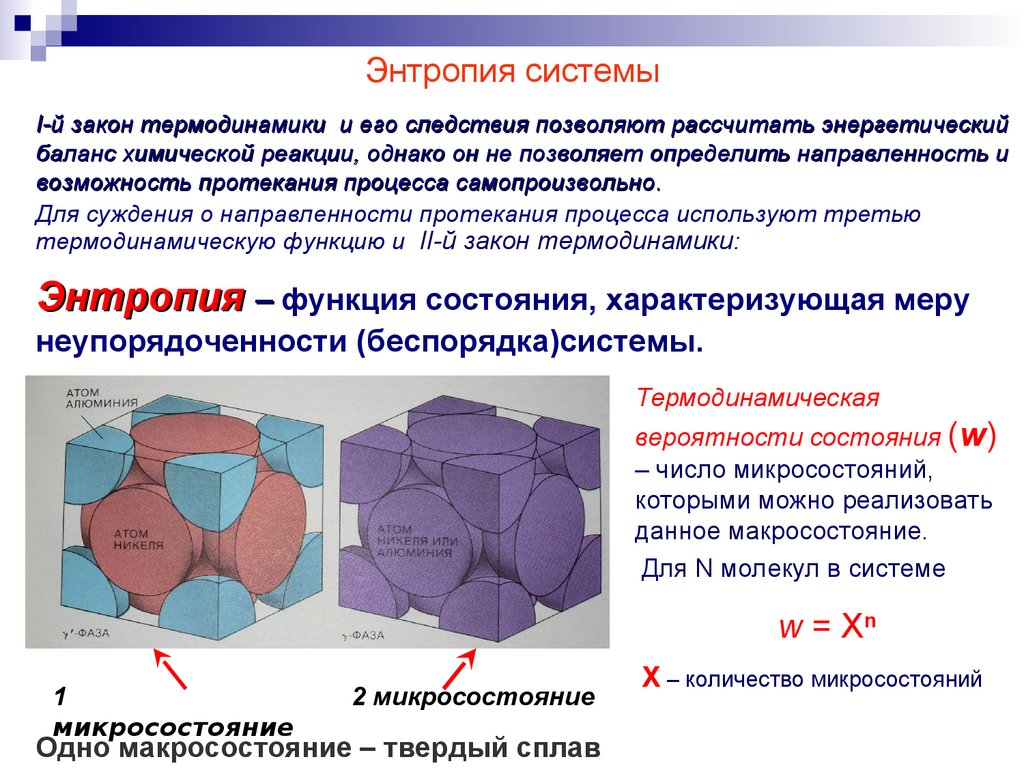
24.
Энтропия системыI-й закон термодинамики и его следствия позволяют рассчитать энергетический
баланс химической реакции, однако он не позволяет определить направленность и
возможность протекания процесса самопроизвольно.
Для суждения о направленности протекания процесса используют третью
термодинамическую функцию и II-й закон термодинамики:
Энтропия – функция состояния, характеризующая меру
неупорядоченности (беспорядка)системы.
Термодинамическая
вероятности состояния (w)
– число микросостояний,
которыми можно реализовать
данное макросостояние.
Для N молекул в системе
w = Xn
1
микросостояние
2 микросостояние
Одно макросостояние – твердый сплав
Х – количество микросостояний
25.
Процесс самопроизвольный, если он осуществляется без каких-либовоздействий со стороны окружающей среды.
II закон термодинамики: В изолированной системе
самопроизвольные процессы происходят в направлении увеличения энтропии.
S 0
любая изолированная система, предоставленная самой себе,
изменяется в направлении состояния, обладающего
максимальной вероятностью.
Взаимосвязь энтропии системы и параметра термодинамической вероятности
ее состояния отображена в уравнении Больцмана.
уравнение Больцмана:
где k = R/NA = 1,38·10-23 Дж/К – постоянная Больцмана
26. Изменение энтропии при различных процессах
1.2.
Нагревание вещества: ΔS > 0;
Охлаждение: ΔS < 0.
При Т→ абсолютный ноль (-2730С): S → 0.
Агрегатное состояние вещества:
Н2Отв Н2Ож Н2Огаз
S0 (Дж/моль×К) 39
69
189
3. Энтропия возрастает при увеличении объема
системы и числа частиц в ней:
а) СаСО3(тв) → СаО(тв) + СО2(г) 0 моль газа → 1 моль газа
б) Na2SO4(р-р) → Na+ + SO42- - растворение, диссоциация
27.
4.Сложность строения молекул:
Чем полярнее связь, тем меньше энтропия:
а) аллотропия – чем вещество тверже, тем меньше
энтропия:
S0(алмаз)= 2.37 Дж/моль×К
S0(графит)= 5.74 Дж/моль×К
б) в ряду аналогов с увеличением числа атомов в
молекуле (молярной массы) энтропия увеличивается:
S0(O2) = 205 Дж/моль×К
S0(O3) = 238.8 Дж/моль× К
S0(F2) < S0(Cl2) < S0(Br2) < S0(I2)
CH4
C2H6
C3H8
S0
44.5
54.8
64 (Дж/моль×К)
CH3-CH3
CH2=CH2
CH CH
S0
54.8
52.45
48 (Дж/моль×К)
SН О > SНCl > SNaCl
2
28. III Закон термодинамики (постулат Планка)
При температуре абсолютного нуля (Т = 0К) энтропияидеального кристалла любого простого или сложного
вещества равна нулю.
lim S = 0
T→0
Стандартная энтропия образования любого вещества
всегда положительная величина (S0298 > 0).
Стандартной энтропией S0298 называется энтропия
1 моль вещества в его стандартном состоянии.
29. Расчет энтропии
Изменение энтропии ΔS в каком –либо процессезависит только от начальной величины S1 и конечной
S2: ΔS = S2 - S1 и не зависит от пути проведения
процесса.
S0х.р. = ni·S0f (продуктов) – nj·S0f (реагентов)
Абсолютные значения энтропии приводятся в справочниках.
Единицы измерения энтропии: [Дж/моль×К]
30. Критерии направленности самопроизвольного процесса в изолированной системе
Изолированная система (dU=0; dV=0):ΔS > 0 – в системе самопроизвольно
протекает прямая реакция;
ΔS = 0 – система находится в состоянии
равновесия;
ΔS < 0 –
в системе протекает обратная
реакция.
31.
Свободная энергияГиббса (G)
В качестве критерия самопроизвольности процессов
целесообразно ввести новую функцию состояния,
которая учитывает влияние обоих факторов:
энтальпийного и энтропийного
ΔG = ΔН - ТΔS
Дж. Гиббс
(1839-1903)
только для состояний при P=const и
T=const
ΔG = 0,
0 система находится в состоянии
равновесия
ΔG
<
0,
самопроизвольно
ΔG > 0,
процесс
процесс
не
может
протекать
может
протекать
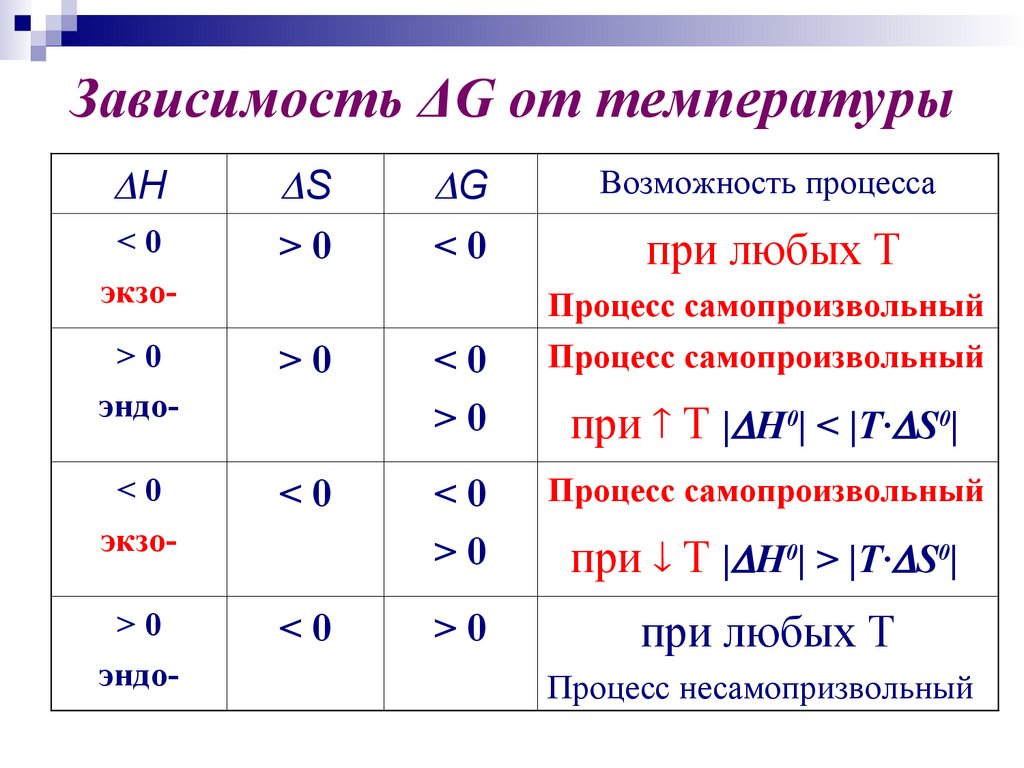
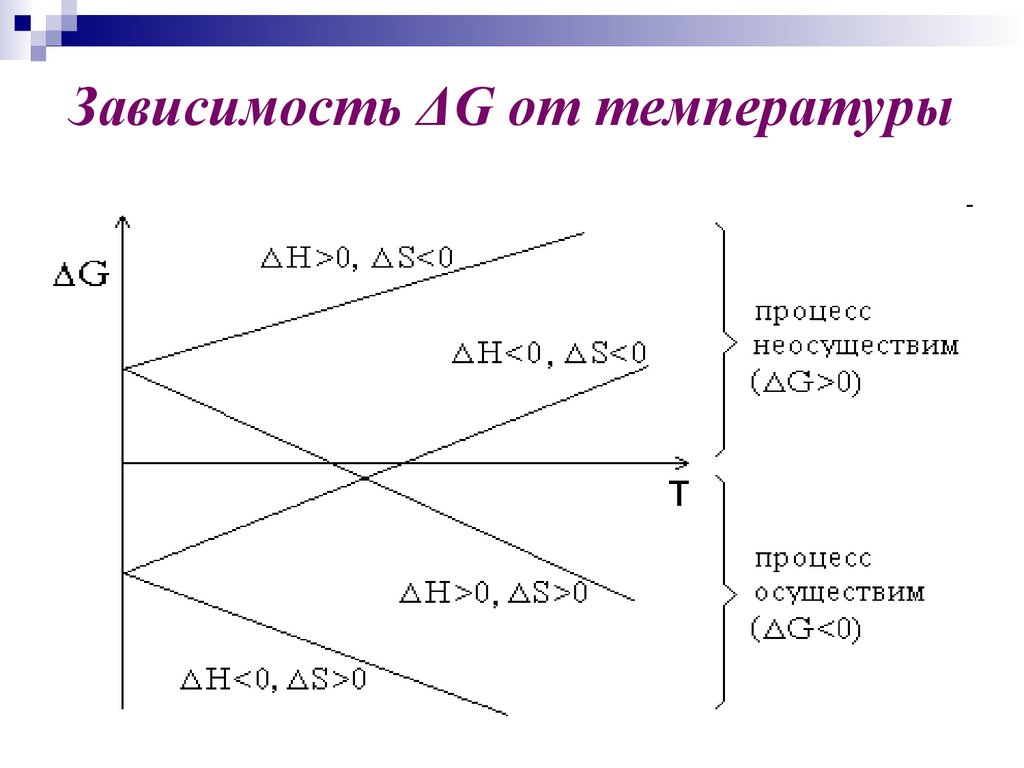
32. Зависимость ΔG от температуры
H<0
экзо-
S
>0
G
<0
Возможность процесса
при любых Т
Процесс самопроизвольный
>0
эндо-
>0
<0
экзо-
<0
>0
эндо-
<0
<0
>0
Процесс самопроизвольный
<0
>0
Процесс самопроизвольный
>0
при любых Т
при Т | H0| < |T· S0|
при Т | H0| > |T· S0|
Процесс несамопризвольный
33. Зависимость ΔG от температуры
34. Расчет энергии Гиббса
Изменение энергии Гиббса можно вычислить по формуле:G0Т = H0298 - T· S0298 ,
предварительно определить тепловой эффект реакции H0298 и изменение
энтропии S0298 и пренебречь их зависимостью от Т.
При стандартных условия G0х.р рассчитывают по формуле:
G0реакции = ni·G0обр (продуктов) - nj·G0обр (реагентов)
G0обр(простых веществ) = 0
Единицы измерения: кДж/моль
Тр = H0/ S0 – температура начала реакции
35. Задача 4. При взаимодействии кристаллического оксида алюминия и газообразного оксида серы(VI) получен кристаллический сульфат
алюминия. Составьте термохимическое уравнение реакции, вычислитетепловой эффект, укажите тип реакции: экзо- или эндотермическая.
1.
2.
Составляем уравнение реакции: Al2O3 + 3SO3 = Al2(SO4)3
Из справочника выписываем значения Δf Н°298 для веществ,
входящих в уравнение реакции:
Н(Al2O3,к) = −1669,8 кДж/моль; Δf Н(SO3,г) = −396,1 кДж/моль;
Δf Н(Al2(SO4)3,к) = −3442,0 кДж/моль.
3.
Δf
Вычисляем тепловой эффект реакции:
Δ Н°х.р. = [Δf Н(Al2(SO4)3,к)] − [Δf Н(Al2O3,к) + 3Δf Н(SO3,г)] =
= −3442,0 − (−1669,8 + 3·(−396,1)) = −583,9 (кДж)
Записываем термохимическое уравнение реакции:
Al2O3(к) + 3SO3(г) = Al2(SO4)3(к), Δr Н° = −583,9 кДж
1.
Δr Н < 0, следовательно реакция экзотермическая, протекает с
выделением тепла.






























 chemistry
chemistry








