Similar presentations:
Термохимия. Термохимические уравнения
1.
2. Термохимия
•Термохимические уравнения•Термохимическая и термодинамическая система знаков
•Измерение тепловых эффектов химических реакций
•Закон Гесса
•Следствия из закона Гесса
•Теплота (энтальпия) образования
•Стандартные условия
•Расчет тепловых эффектов химических реакций
•Температурная зависимость тепловых эффектов химических
реакций. Закон Кирхгоффа
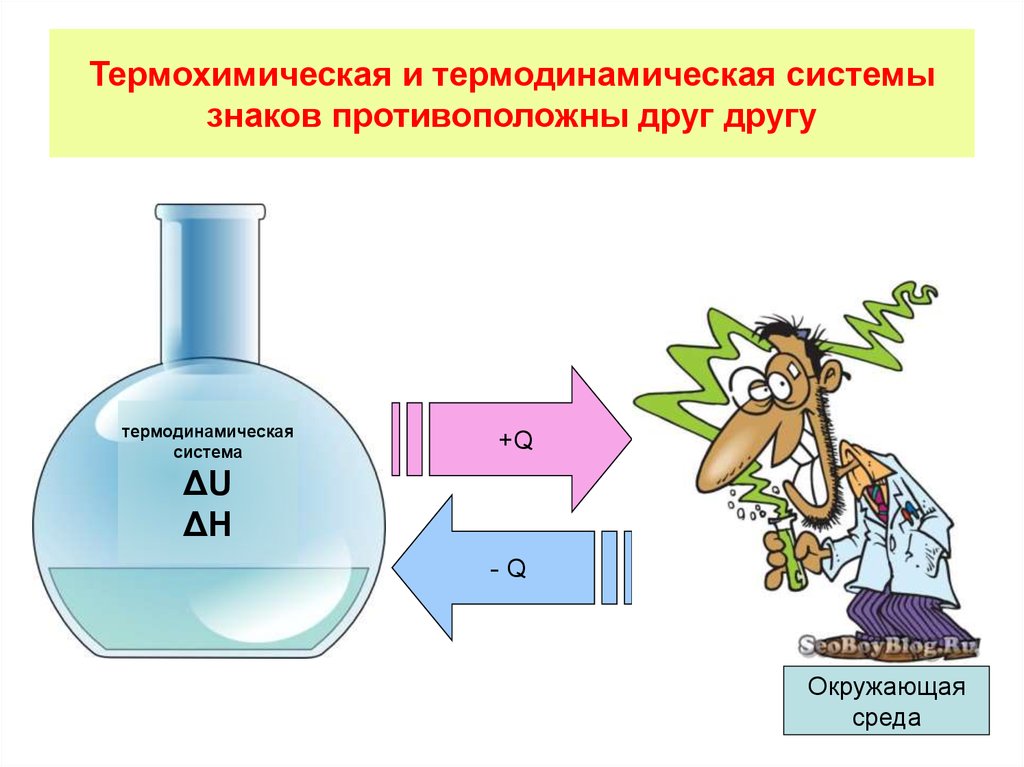
3. Термохимическая и термодинамическая системы знаков противоположны друг другу
термодинамическаясистема
+Q
ΔU
ΔH
-Q
Окружающая
среда
4. Термохимические уравнения
термохимическая система знаковаА + вВ = сС + dD Q
4Fe(тв) + 3O 2(г) = 2Fe 2 O3(тв) - 1648кДж (эндотермический процесс)
C(г) +CO 2(г) = 2CO(г) + 173кДж (экзотермический процесс)
термодинамическая система знаков
4Fe(тв) + 3O 2(г) = 2Fe 2 O3(тв) ; Δ r H= +1648кДж
C(г) +CO 2(г) = 2CO (г) ; Δ r H= - 173кДж
5. Термохимическое уравнение должно содержать указание на агрегатные состояния веществ – участников реакции
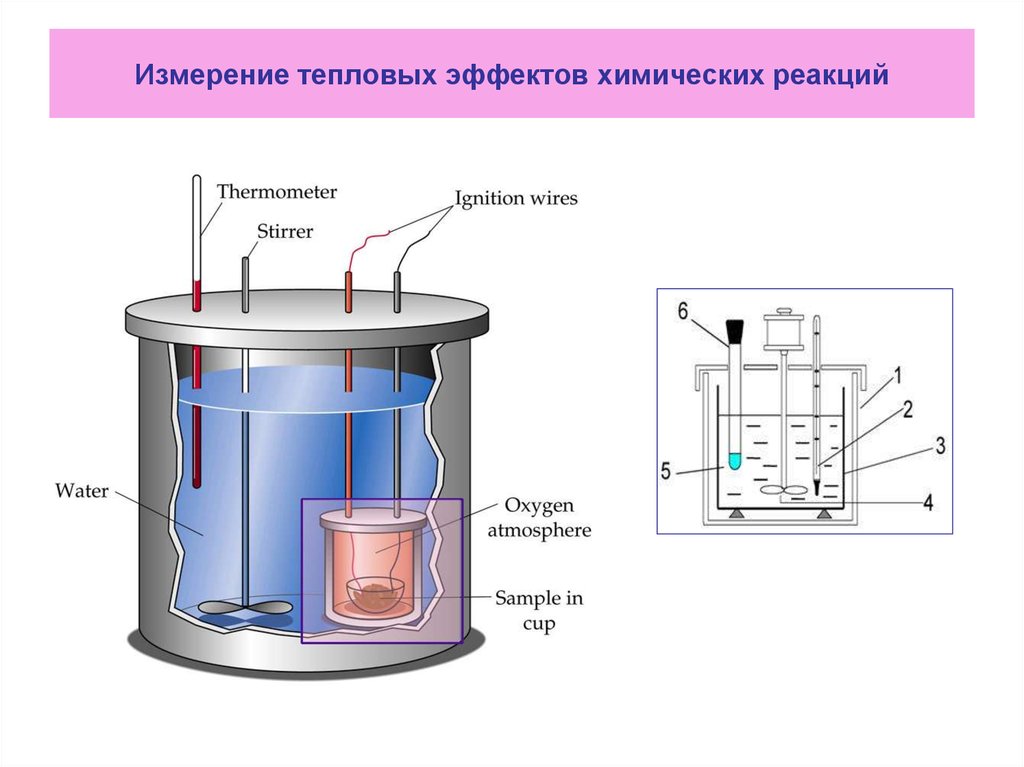
6. Измерение тепловых эффектов химических реакций
7. В химической лаборатории кафедры ОиСХ ИАТЭ НИЯУ МИФИ
8. Следствия первого закона термодинамики
dU Q p dVV const
P const
QV dU
Qp dU d ( p V ) d (U pV )
QV U U 2 U1
H U pV
QP H H 2 H1
• Новая функция состояния системы – ЭНТАЛЬПИЯ
(теплосодержание)
H U pV
• Для изобарно-изотермических и изохорно-изотермических
процессов тепловой эффект химической реакции не
зависит от пути проведения химической реакции
9. Закон Гесса
• Тепловой эффект химической реакции,проводимой при P=const или V=const не
зависит от пути проведения процесса, а
определяется только природой и
физическим состоянием исходных
веществ и продуктов реакции
10.
С(гр.) +1/2(О 2 )(г) = СО(г) ; ΔН1 = -110,6 кДжСО(г) +1/2(О2 )(г) = СО2(г) ; ΔН 2 = -283,4 кДж
ΔН1 ΔН1 ΔН 2 394 кДж
С(гр.) +О 2(г) = СО2(г) ; ΔН 2 = -394 кДж
ΔН1 ΔН 2
-110,6
СО+1/2(О2)
Сграфит+О2
-283,4
-394
СО2
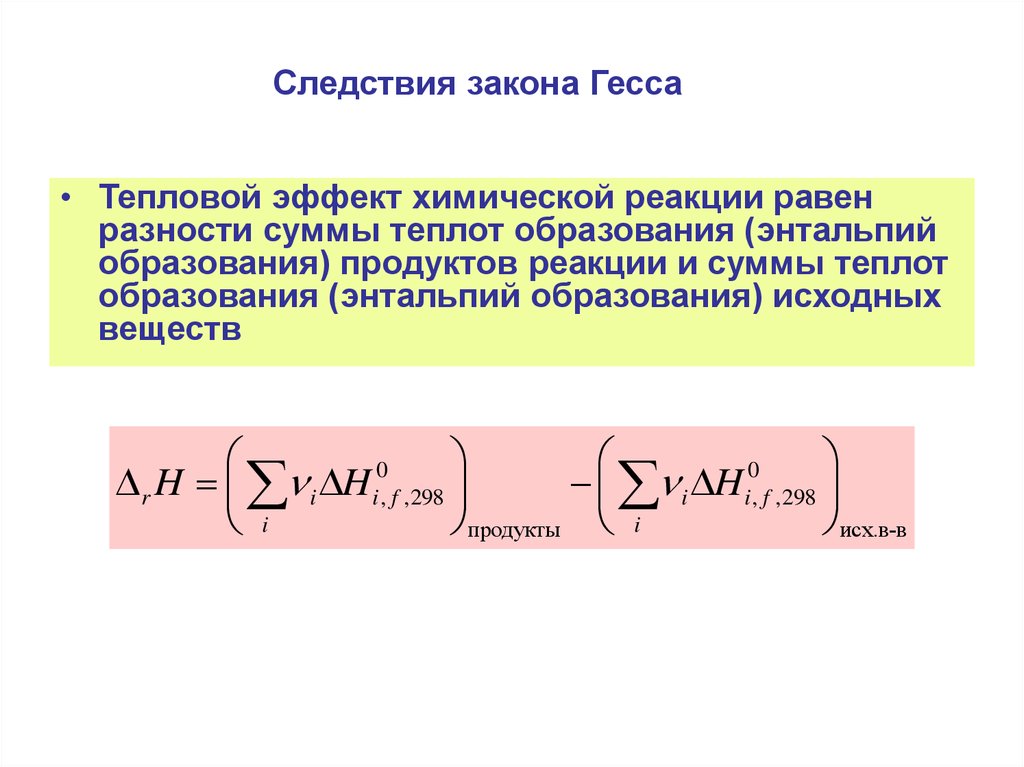
11. Следствия закона Гесса
• Тепловой эффект прямой реакции равен по величине ипротивоположен по знаку тепловому эффекту обратной
реакции
Н
Исходные вещества
Продукты
Н
Н Н Н 0
Н Н
12.
Н Н13. Следствия закона Гесса
• Тепловой эффект химической реакции равенразности суммы теплот образования (энтальпий
образования) продуктов реакции и суммы теплот
образования (энтальпий образования) исходных
веществ
0
0
r H i H i , f ,298
i H i , f ,298
i
продукты i
исх.в-в
14. Теплота образования сложного вещества
Под теплотой образования (энтальпией образования) сложного
вещества подразумевают тепловой эффект химической реакции
образования одного моля сложного вещества из простых веществ
2Na (тв) +C(гр) +3/2(O 2(г) ) = Na 2CO3 ; ΔH f (Na 2 CO3 )
• Теплота образования
(энтальпия образования)
простого вещества равна
нулю
ВСЕГДА ПОМНИ, ЧТО
Q f =-ΔH f
15. Стандартные условия
• Давление 1 атмосфера (0,1 мПа)• Температура (как правило) 298 К
• Наиболее устойчивое для заданных условий агрегатное
состояние вещества
• Единичные концентрации веществ
Под стандартной теплотой образования (энтальпией образования)
сложного вещества подразумевают тепловой эффект химической
реакции образования одного моля сложного вещества из простых
веществ при стандартных условиях
Стандартное состояние
H
o
f ,298
ВСЕГДА ПОМНИ, ЧТО
Q0f =-ΔH f0
Табличная величина
16.
17.
00
r H i H i , f ,298
i H i , f ,298
i
продукты i
исх.в-в
Δr H
3Na 2CO3 (тв) + 2H3PO4 (тв) = 2Na 3PO 4 (тв) + 3H 2O(ж) + 3CO2 (г)
ΔH (2)
3ΔH 0f ,298 Na 2 CO3 (тв) +
2ΔH 0f ,298 H 3 PO 4 (тв) +
ΔH (1)
2ΔH 0f ,298 Na 3 PO 4 (тв) +
ΔH(2)
ΔH(1)
Δr H
3ΔH 0f ,298 H 2 O(ж) +
H (2) i H i0, f ,298
r H
i
исх.в-в
ΔH(1) = ΔH(2)
6Na(тв) ; 2P(тв); 3C(гр.)
3H 2 (г);
17
O 2 (г)
2
3ΔH 0f ,298 CO 2 (г)
H (1) i H i0, f ,298
i
продукты
18. Абсолютные значения энтальпии не могут быть определены. Приняв в качестве «точки отсчета» теплоту образования простого
вещества,исчезает необходимость при расчете теплового эффекта химических
реакций знать абсолютные значения энтальпии. Если берем разность
величин теплот образования, исчисленных относительно одного и того же
«базиса»,то при расчетах он «исчезает»
Исходные вещества
химической реакции
r
Продукты
реакции
1
2
0
i H i , f ,298
i
исх.в-в
0
H
i i , f ,298
i
продукты
Начальное состояние системы
в виде простых веществ
Теплота образования простого вещества принимается равной нулю
19.
0H
i i , f ,298
i
продукты
0
H
i i , f ,298
i
исх.в-в
r H i H i0, f ,298
i H i0, f ,298
i
продукты i
исх.в-в
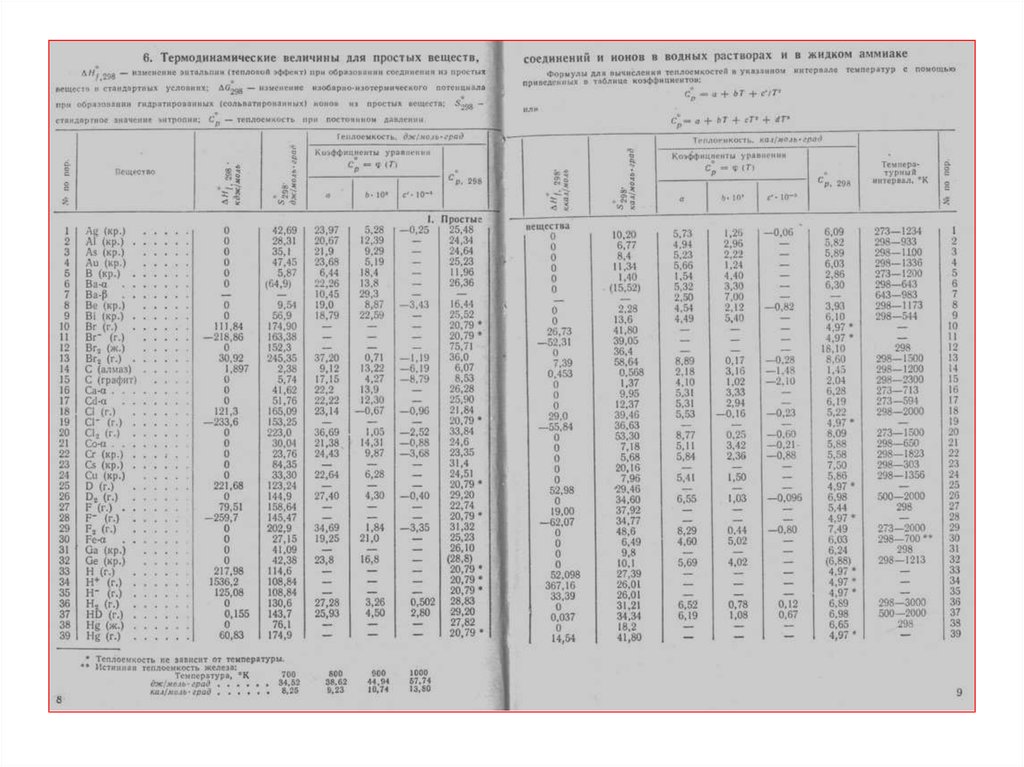
20. Типовые задачи
21. Задача
Используя справочные данные, рассчитать тепловой эффект
реакции обжига пирита. Записать термохимическое уравнение
4FeS2 (тв) + 11O2 (г) = 2Fe2O3 (тв) + 8SO2 (г)
вещество
FeS2 (тв)
O 2 (г)
ΔH 0f,298 , кДж/моль
-177
0
Fe2 O3 (тв)
-821,3
SO2 (г)
-296,9
0
0
0
Δ r H = 2ΔH0f,298 (Fe2O3 ) + 8ΔHf,298
(SO2 ) - 4ΔHf,298
(FeS2 ) -11ΔH f,298
(O2 )
Δ r H = 2(-821,3) + 8(-296,9) - 4(-177) -11(0) = -3309,8кДж
4FeS2 (тв) + 11O2 (г) = 2Fe2O3 (тв) + 8SO2 (г); Δ r H = -3309,8кДж;
4FeS2 (тв) + 11O2 (г) = 2Fe2O3 (тв) + 8SO2 (г) + 3309,8кДж;
22. Задача
Тепловой эффект реакцииравен Δ H = - 234,5кДж;
SO2 (г) + 2 H2S(г) = 3S(ромб) + 2H2O(ж);
r
Определить стандартную теплоту образования сероводорода,
используя стандартные энтальпии образования оксида серы (IV) и
воды (взять из справочника)
вещество
S(ромб)
ΔH 0f,298 , кДж/моль
0
SO2 (г)
-296,9
H 2 O(ж)
-285,8
Н 2S(г)
?
SO 2 (г) + 2 H 2S(г) = 3S(ромб) + 2H 2O(ж); Δ r H 234,5 кДж
0
0
Δ r H = 2ΔH 0f,298 (H 2O)+3ΔH f,298
(S) - ΔH 0f,298 (SO 2 )- 2ΔH f,298
(H 2S)
Δ r H = 2 (-285,8) +3 0 - (-296,6) - 2 x = -234,5
ΔH 0f,298 (H 2S)
234,5 + 2 (-285,8) - (-296,6)
20,3 кДж/моль
2
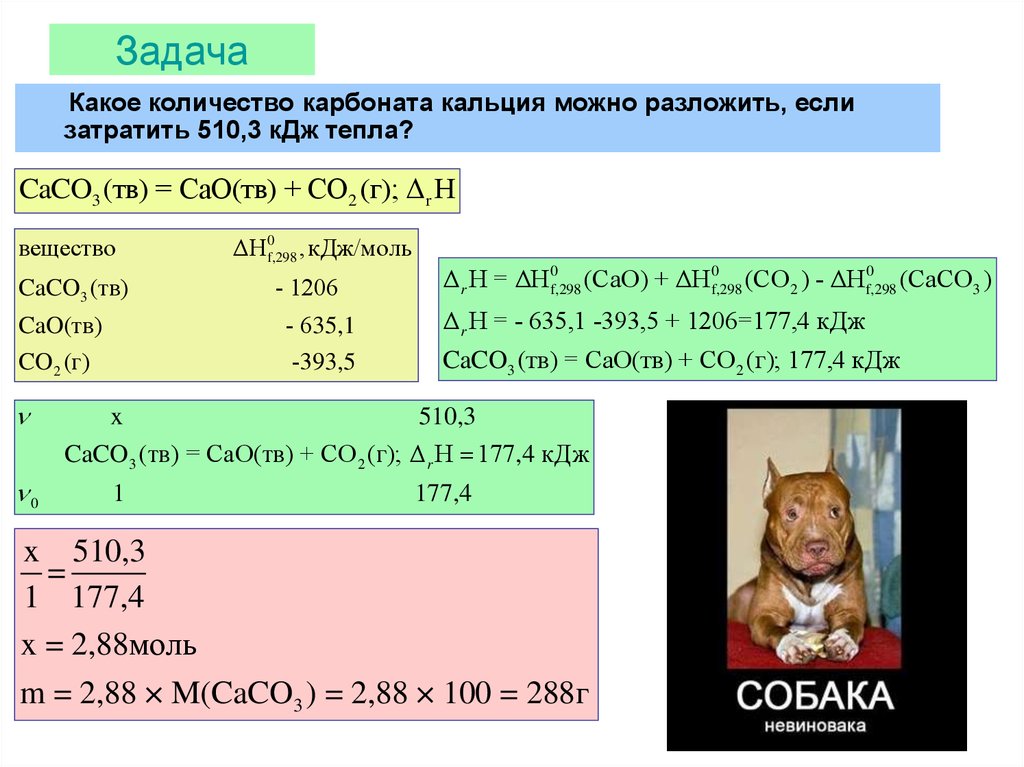
23. Задача
Какое количество карбоната кальция можно разложить, еслизатратить 510,3 кДж тепла?
CaCO3 (тв) = CaO(тв) + CO2 (г); Δr H
вещество
CaCO3 (тв)
ΔH 0f,298 , кДж/моль
- 1206
0
0
Δ r H = ΔH 0f,298 (CaO) + ΔH f,298
(CO2 ) - ΔHf,298
(CaCO3 )
CaO(тв)
- 635,1
Δ r H = - 635,1 -393,5 + 1206=177,4 кДж
CO 2 (г)
-393,5
CaCO3 (тв) = CaO(тв) + CO2 (г); 177,4 кДж
x
510,3
CaCO3 (тв) = CaO(тв) + CO 2 (г); Δ r H 177,4 кДж
0
1
177,4
x 510,3
=
1 177,4
x = 2,88моль
m = 2,88 × M(CaCO3 ) = 2,88 × 100 = 288г
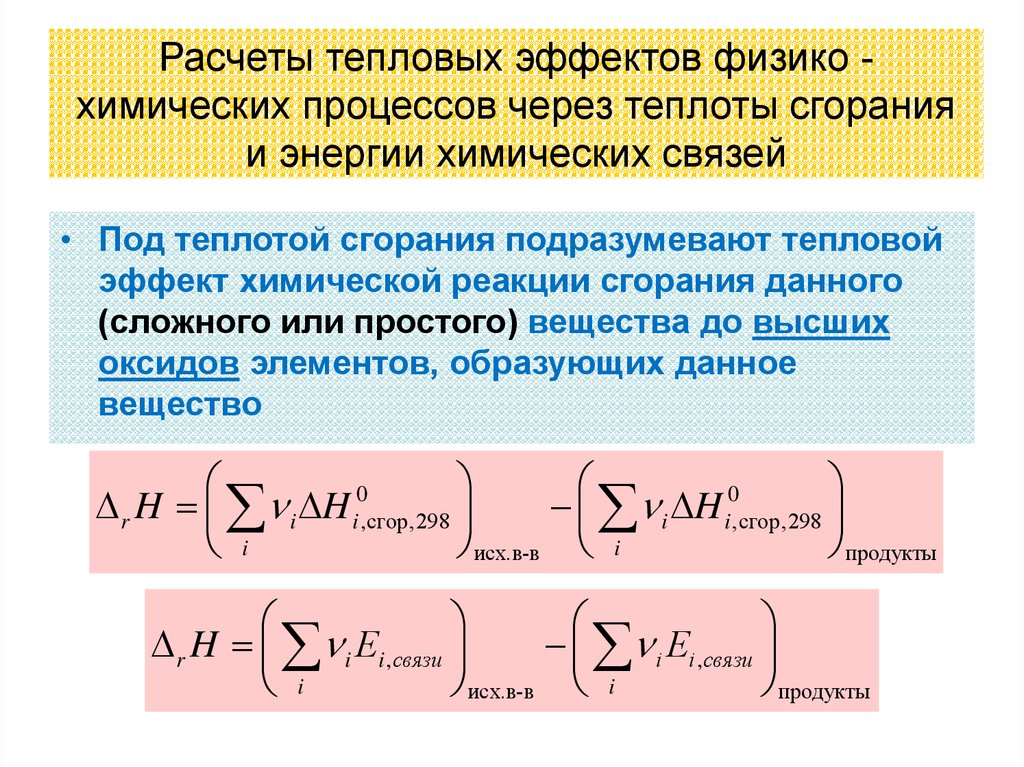
24. Расчеты тепловых эффектов физико -химических процессов через теплоты сгорания и энергии химических связей
Расчеты тепловых эффектов физико химических процессов через теплоты сгоранияи энергии химических связей
• Под теплотой сгорания подразумевают тепловой
эффект химической реакции сгорания данного
(сложного или простого) вещества до высших
оксидов элементов, образующих данное
вещество
0
0
r H i H i ,сгор,298
i H i ,сгор,298
i
исх.в-в i
продукты
r H i Еi ,связи
i Еi ,связи
i
исх.в-в i
продукты
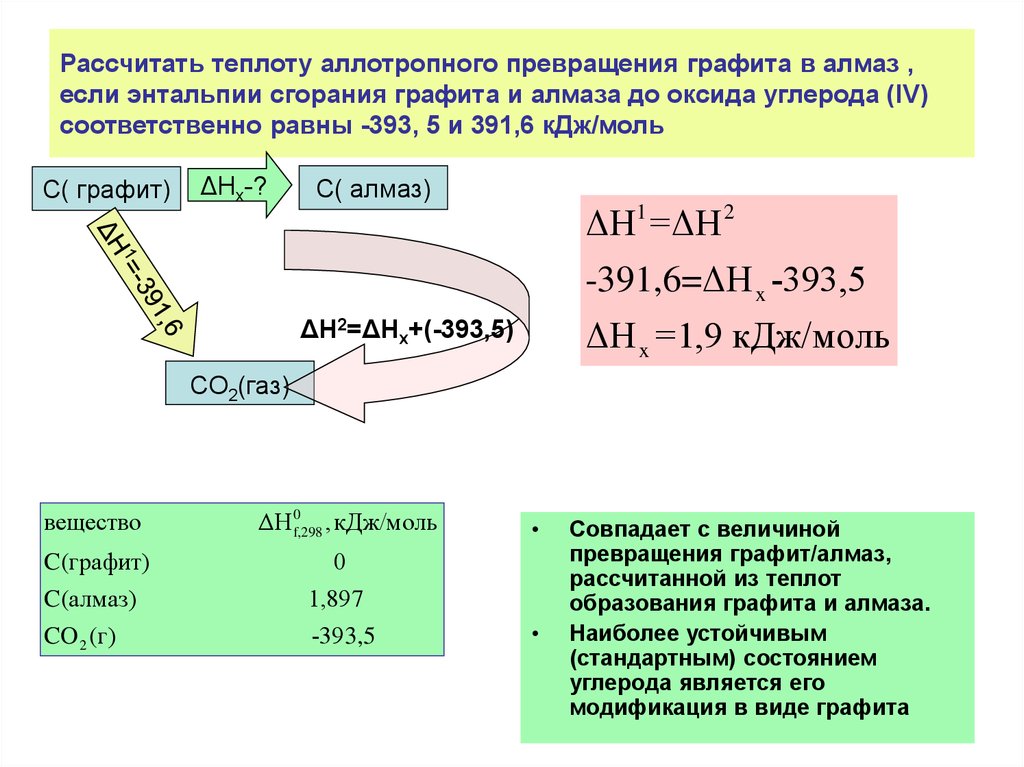
25. Рассчитать теплоту аллотропного превращения графита в алмаз , если энтальпии сгорания графита и алмаза до оксида углерода (IV)
соответственно равны -393, 5 и 391,6 кДж/мольС( графит)
ΔНх-?
С( алмаз)
ΔH1 =ΔH 2
-391,6=ΔH x -393,5
ΔН2=ΔНx+(-393,5)
ΔH x =1,9 кДж/моль
СО2(газ)
вещество
ΔH 0f,298 , кДж/моль
C(графит)
0
C(алмаз)
1,897
CO 2 (г)
-393,5
Совпадает с величиной
превращения графит/алмаз,
рассчитанной из теплот
образования графита и алмаза.
Наиболее устойчивым
(стандартным) состоянием
углерода является его
модификация в виде графита
26. С целью расчета тепловых эффектов реакций, данные о которых отсутствуют в справочниках или не могут быть экспериментально
измерены, выстраивают циклы из термохимических уравнений сизвестными тепловыми эффектами.
Термохимические уравнения можно комбинировать, применяя к ним
любые арифметические действия (сложения, умножения, деления,
вычитания).
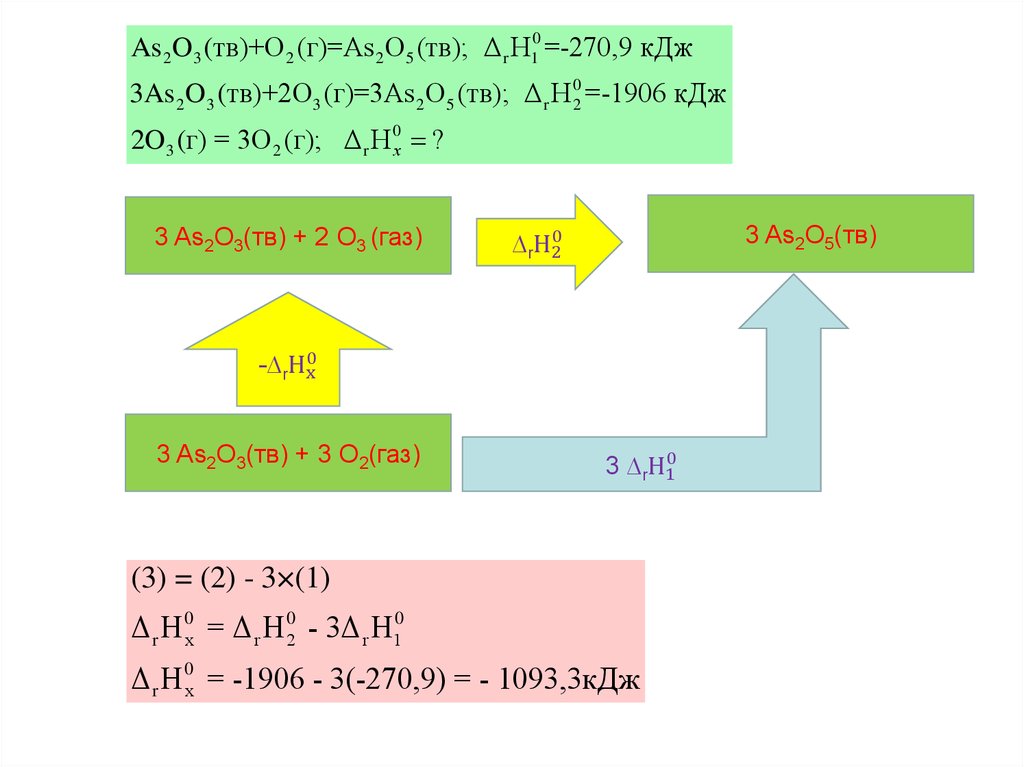
27. Задача
• Исходя из данных для реакций окисления оксида мышьяка(III) кислородом и озоном, написать термохимическое
уравнение разложения озона
As 2 O3 (тв)+O 2 (г)=As 2 O5 (тв); Δ r H10 =-270,9 кДж
3As 2 O3 (тв)+2O3 (г)=3As 2 O5 (тв); Δ r H 02 =-1906 кДж
2O3 (г) = 3O 2 (г); Δ r H 0х ?
28.
As 2 O3 (тв)+O 2 (г)=As 2 O5 (тв); Δ r H10 =-270,9 кДж3As 2 O3 (тв)+2O3 (г)=3As 2 O5 (тв); Δ r H 02 =-1906 кДж
2O3 (г) = 3O 2 (г); Δ r H 0х ?
3 As2O3(тв) + 2 O3 (газ)
3 As2O5(тв)
∆rH20
-∆rHx0
3 As2O3(тв) + 3 O2(газ)
3 ∆rH10
(3) = (2) - 3×(1)
Δ r H 0х = Δ r H 02 - 3Δ r H10
Δ r H 0х = -1906 - 3(-270,9) = - 1093,3кДж
29. Расчет теплот фазовых переходов
Рассчитать теплоту плавления, испарения и сублимации воды
используя справочные данные об энтальпиях образования
вещество
Н2О (ж)
ΔН(пл)
Н2О (тв)
ΔН(субл)
Н2О (газ)
ΔH 0f,298 , кДж/моль
H 2 O (тв)
-291,9
H 2 O (ж)
-285,8
Н 2 О (г)
-241,8
H 2 O (тв) H 2 O (ж); Н пл.
H 2 O (ж) Н 2 О (г); Н исп.
H 2 O (тв) Н 2 О (г); Н субл.
0
0
Н пл. ΔH f,298
(H 2 O (ж)) - ΔH f,298
H 2O (тв) =-285,8 -(-291,9) = 6,1 кДж/моль
0
0
Н исп. ΔH f,298
(H 2 O (г)) - ΔH f,298
H 2O (ж) =-241,8 -(-285,8) = 44 кДж/моль
0
Н субл. =ΔH f,298
(H 2 O (г)) - ΔH 0f,298 H 2 O (тв) =-241,8 -(-291,9) = 50,1 кДж/моль
Н субл. Н пл. Н исп.
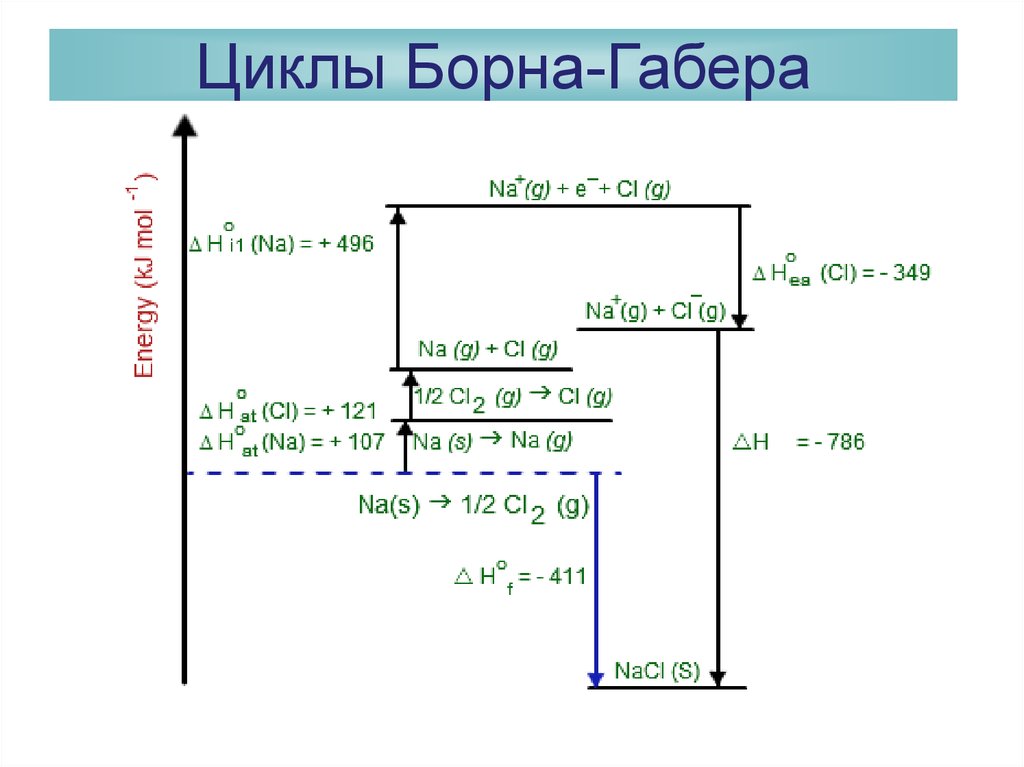
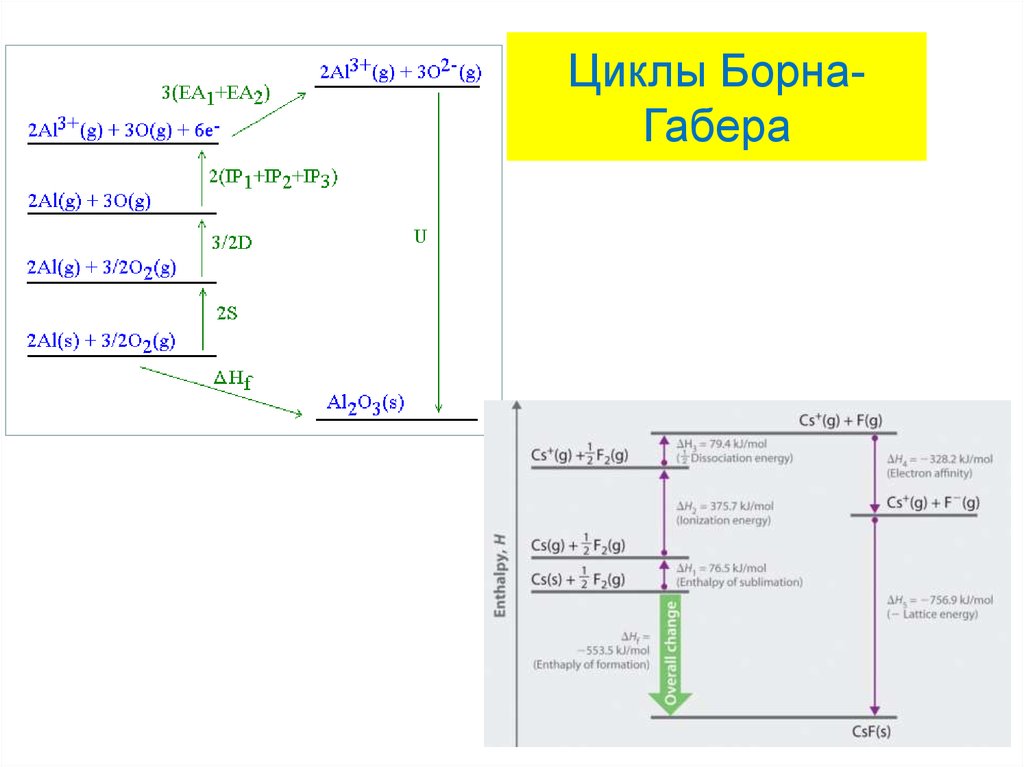
30. Расчет энергий кристаллических решеток Циклы Борна-Габера
Фриц Габер31. Циклы Борна-Габера
32. Циклы Борна-Габера
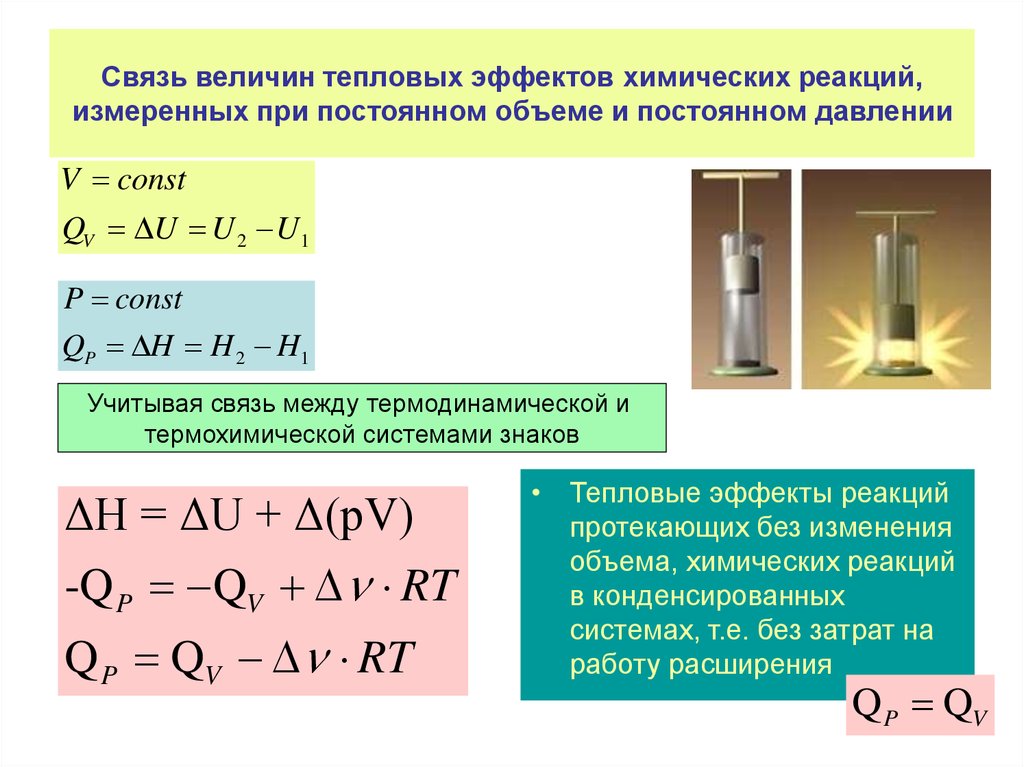
Циклы БорнаГабера33. Связь величин тепловых эффектов химических реакций, измеренных при постоянном объеме и постоянном давлении
V constQV U U 2 U1
P const
QP H H 2 H1
Учитывая связь между термодинамической и
термохимической системами знаков
ΔH = ΔU + Δ(pV)
-Q P QV RT
Q P QV RT
• Тепловые эффекты реакций
протекающих без изменения
объема, химических реакций
в конденсированных
системах, т.е. без затрат на
работу расширения
Q P QV
34. Температурная зависимость теплового эффекта химических реакций
Закон Кирхгофа• Температурный коэффициент теплового эффекта
химической реакции равен изменению
теплоемкости веществ, участвующих в данной
реакции.
dΔ r H
= ΔCp
dT p
аА + вВ = сС + dD
dΔ r U
= ΔCV
dT V
C P = i C P ,i
i C P ,i
i
продукты i
исх. в-в
35.
dΔ r H= ΔCp
dT p
T
Δ r HT Δ r HT0 ΔCp dT
T0
ΔCp = const F(T)
Δ r HT Δr HT0 ΔCp (T T0 )
T1
T2
T
T0
T1
T2
Δ r H T =Δ r HT0 + ΔCp (T) dT + Δф.п.1H T1 + ΔC*p (T) dT+ Δф.п.2 H T2 + ΔC**p (T) dT
T1
T2
T
T0
T1
T2
ΔH 0f ,T =ΔH 0f ,298 + Cp (T)×dT + Δф.п.1HT1 + C*p (T)×dT+ Δф.п.2 HT2 + C**p (T)×dT
36. Вывести аналитическую зависимость теплового эффекта (Дж) реакции от температуры
C P =a+bT+c, T -22Cu(тв) + O2 (г) = 2CuO(тв); Δ r H 0298
вещество
CP = F(T)
Cu (тв)
5,44 + 1,46 10 3T
O 2 (г)
8,27 + 0,26 10 3T 1,88 10 5T 2
10,87 + 3,58 10 3T 1,51 10 5T 2
CuО (тв)
C P = i C P ,i
i C P ,i
i
продукты i
исх. в-в
C
2CP CuО 2 10,87 + 3,58 10 3T 1,51 10 5T 2
i P ,i
i
продукты
C
=2CP Cu + CP O 2 =
i
P
,
i
i
исх. в-в
=2(5,44 + 1,46 10 3T)+ 8,27 + 0,26 10 3T 1,88 10 5T 2
ΔCP = 2,67 + 3,96 10-3T -1,14 10-5T -2
T1
T
Δ r H T =Δ r H 298 + ΔCp (T ) dT=Δ r H 298 + (2,67 + 3,96 10-3T -1,14 10 -5T -2 ) dT
0
0
0
T0
298
-1 T
Δ r H T =Δ r H 298 2,67 T 1,98 10 T+1,14 10 T
298
0
-3
-5
37. Зависимость теплового эффекта химической реакции от температуры определяется характером изменения ∆Сr
C R = i C P ,ii C P ,i
i
продукты i
исх. в-в
38.
ΔНиспΔНТ
ΔНпл
T2
C (T)×dT
p
T1




























 chemistry
chemistry