Similar presentations:
Регуляция активности ферментов. Активаторы ферментов
1.
1РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
2.
2Активаторы ферментов
Активаторы ферментов – вещества, которые
увеличивают активность ферментов
Активируют ферментативные реакции обычно
катионы (в таблице Менделеева с 19 по 30),
анионы (анионы хлора и других галогенов
активируют пепсин, амилазу, аденилатциклазу,
белки (апопротеин А-I активирует ЛХАТ,
апопротеин С-II – липопротеинлипазу),
вторичные внутриклеточные посредники
(циклические нуклеотиды – цАМФ, цГМФ)
3.
3Механизм действия активаторов
1) Формируют активный центр фермента (Co2+,
Mg2+, Zn2+, Fe2+, Са2+);
2) Облегчают образование ферментсубстратного комплекса (Мg2+);
3) Восстанавливают SH-группы (глутатион,
цистеин, меркаптоэтанол);
4) Стабилизируют нативную структуру белкафермента.
4.
4Ингибиторы ферментов
Ингибиторы ферментов – это
соединения, которые взаимодействуя с
ферментом, препятствуют
образованию нормального ферментсубстратного комплекса, уменьшая
скорость реакции или прекращая ее.
5.
5ИНГИБИТОРЫ
Неспецифические
Специфические
Необратимые
Обратимые
Неконкурентные Конкурентные
6.
6Неспецифические и специфические
ингибиторы
Ингибиторы делят на две группы -
неспецифические и специфические.
Неспецифические ингибиторы вызывают
денатурацию белка-фермента (соли тяжелых
металлов, кислоты, щелочи и др.) и их действие не
связано с механизмами ферментативного катализа.
Действие специфических ингибиторов связано
с механизмами ферментативного катализа.
Специфические ингибиторы делятся на 2 группы:
необратимые и обратимые.
7.
7Необратимые ингибиторы
При необратимом ингибировании происходит
непрерывная модификация молекул
фермента, в результате чего фермент
частично или полностью теряет свою
активность.
Такое действие оказывают вещества,
которые прочно и необратимо связывают
функциональные группы активного центра
или препятствуют изменению валентности
металла активного центра.
8.
8Группы необратимых ингибиторов
1) ингибиторы металлосодержащих ферментов (HCN,
RCN, HF, CO и др.). Эти соединения связываются с
металлами с переменной валентностью (Cu или Fe), в
результате чего нарушается процесс переноса
электронов по дыхательной цепи ферментов. Поэтому
эти ингибиторы называются дыхательными ядами.
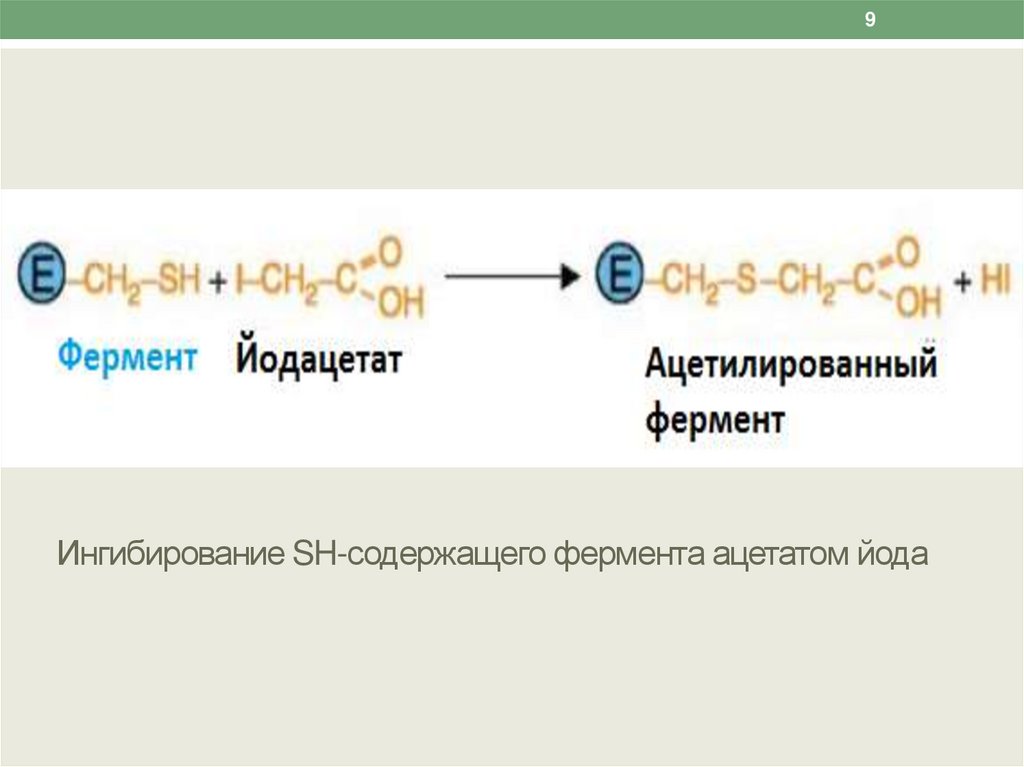
2) ингибиторы ферментов, содержащих SH-группы в
активном центре (монойодацетат, дийодацетат,
йодацетамид, соединения мышьяка и ртути).
3) ингибиторы ферментов, содержащих ОН-группу в
активном центре (фосфороорганические соединения,
инсектициды). Эти ингибиторы тормозят, прежде всего,
активность холинэстеразы – фермента, играющего
основную роль в деятельности нервной системы.
9.
9Ингибирование SH-содержащего фермента ацетатом йода
10.
10Ингибирование химотрипсина диизопропилфторфосфатом
11.
11Обратимое ингибирование
Обратимое ингибирование поддается
количественному изучению на основе уравнения
Михаэлиса-Ментен.
Обратимые ингибиторы делятся на
конкурентные и неконкурентные ингибиторы
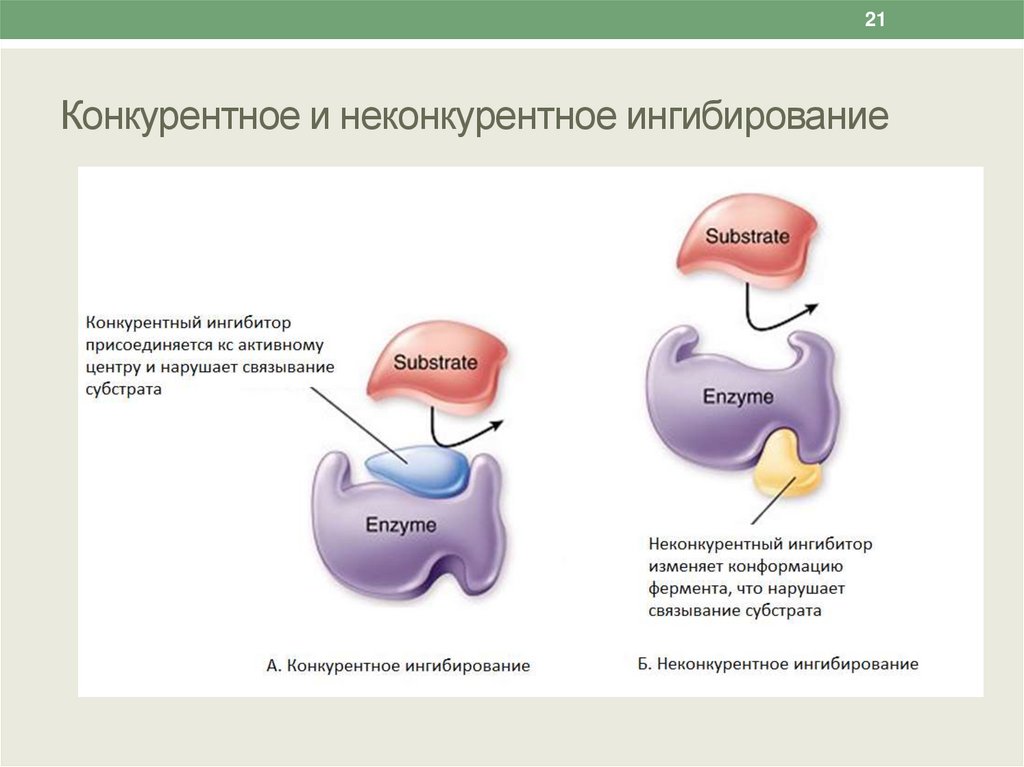
Конкурентные ингибиторы – это молекулы,
настолько похожие на молекулы субстратов реакций,
что ферменты «не могут их различить».
В результате связывания конкурентного ингибитора с
активным центром фермента уменьшается
количество истинных фермент-субстратных
комплексов и падает скорость катализируемой
реакции.
12.
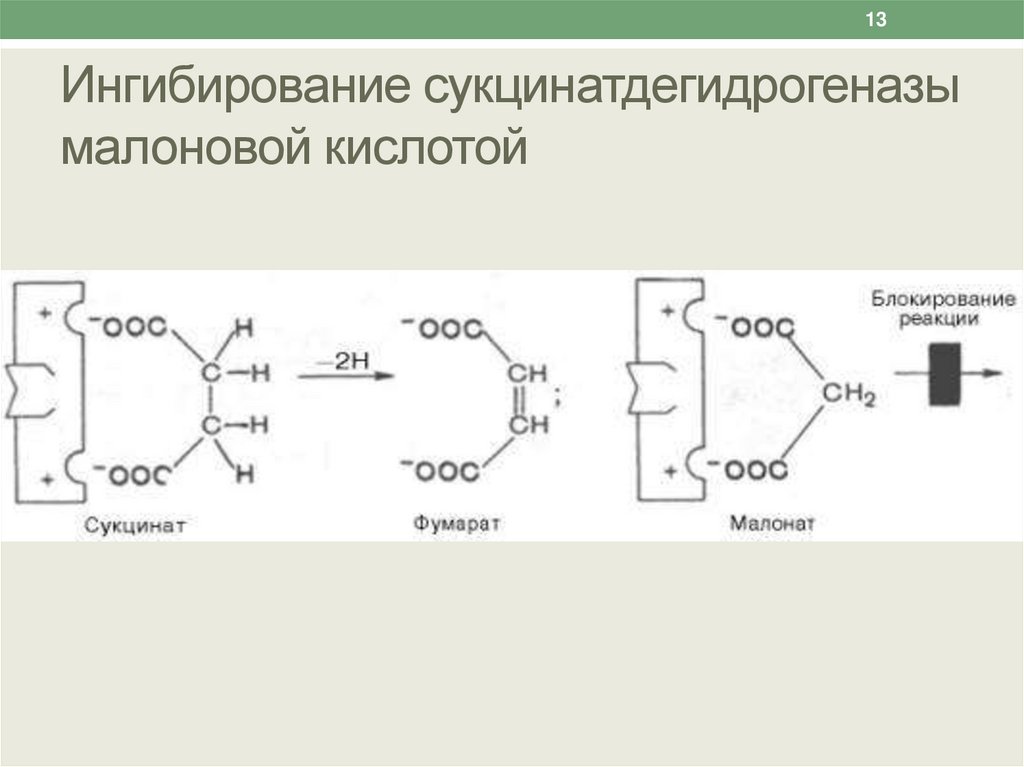
12Конкурентное ингибирование
Классическим примером конкурентного
ингибирования является торможение
сукцинатдегидрогеназы малоновой кислотой.
Сукцинатдегидрогеназа катализирует окисление
янтарной кислоты (сукцината) путем
дегидрирования в фумаровую кислоту.
Если в среду добавить малоновую кислоту
(ингибитор), то в результате структурного сходства с
истинным субстратом - сукцинатом он будет
реагировать с активным центром и образовывать
фермент-ингибиторный комплекс, который не
может подвергаться дальнейшим превращениям.
13.
13Ингибирование сукцинатдегидрогеназы
малоновой кислотой
14.
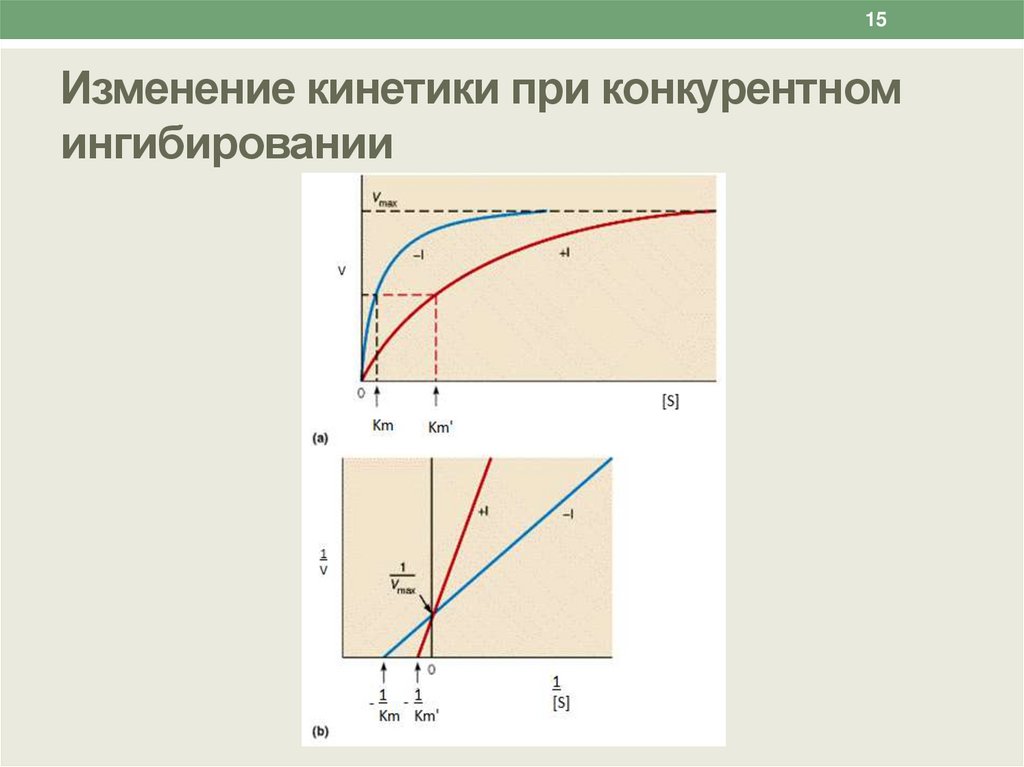
14Изменение кинетики ферментативной реакции
при действии конкурентных ингибиторов
Связывание конкурентного ингибитора не приводит
к повреждению структуры активного центра
фермента.
Действие такого ингибитора устраняется путем
увеличения концентрации субстрата.
Таким образом, конкурентный ингибитор дает
эффект «разбавления» субстрата.
Поэтому при конкурентном ингибировании
увеличивается значение Кm , но величина Vmax
остается постоянной.
15.
15Изменение кинетики при конкурентном
ингибировании
16.
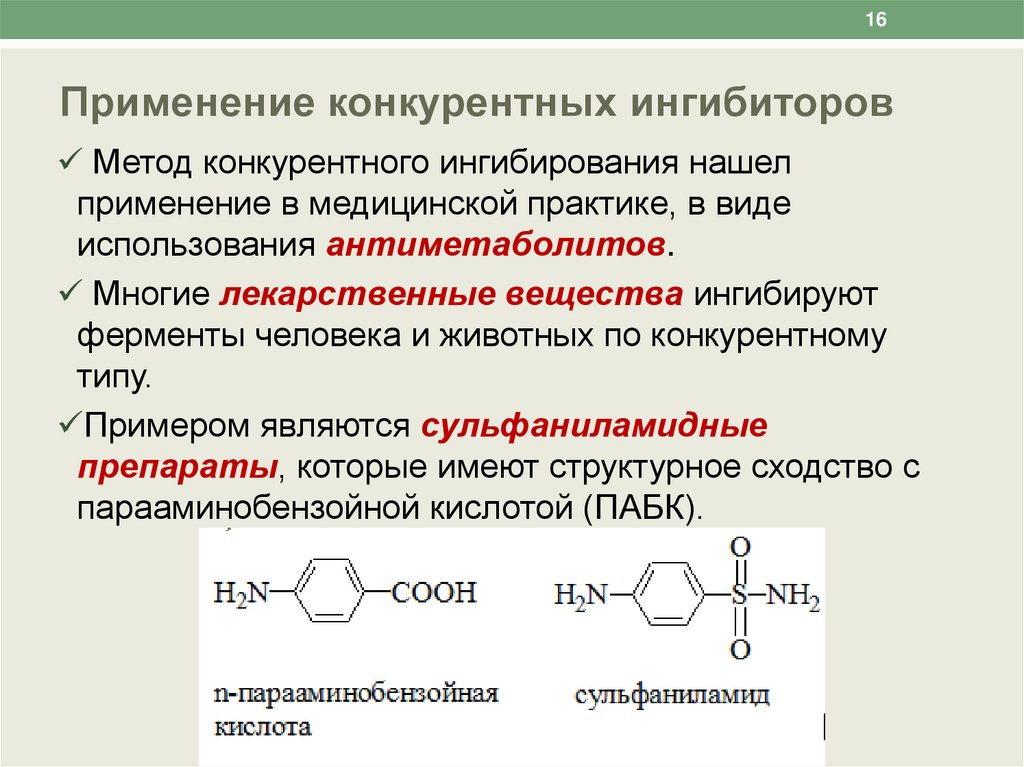
16Применение конкурентных ингибиторов
Метод конкурентного ингибирования нашел
применение в медицинской практике, в виде
использования антиметаболитов.
Многие лекарственные вещества ингибируют
ферменты человека и животных по конкурентному
типу.
Примером являются сульфаниламидные
препараты, которые имеют структурное сходство с
парааминобензойной кислотой (ПАБК).
17.
17Бактериальная клетка использует ПАБК для
синтеза фолиевой кислоты, необходимой для
образования нуклеиновых кислот.
Благодаря структурному сходству сульфаниламид
ингибирует ферменты метаболизма
парааминобензойной кислоты, что приводит к
снижению синтеза фолиевой кислоты, нуклеиновых
кислот и гибели микроорганизма.
18.
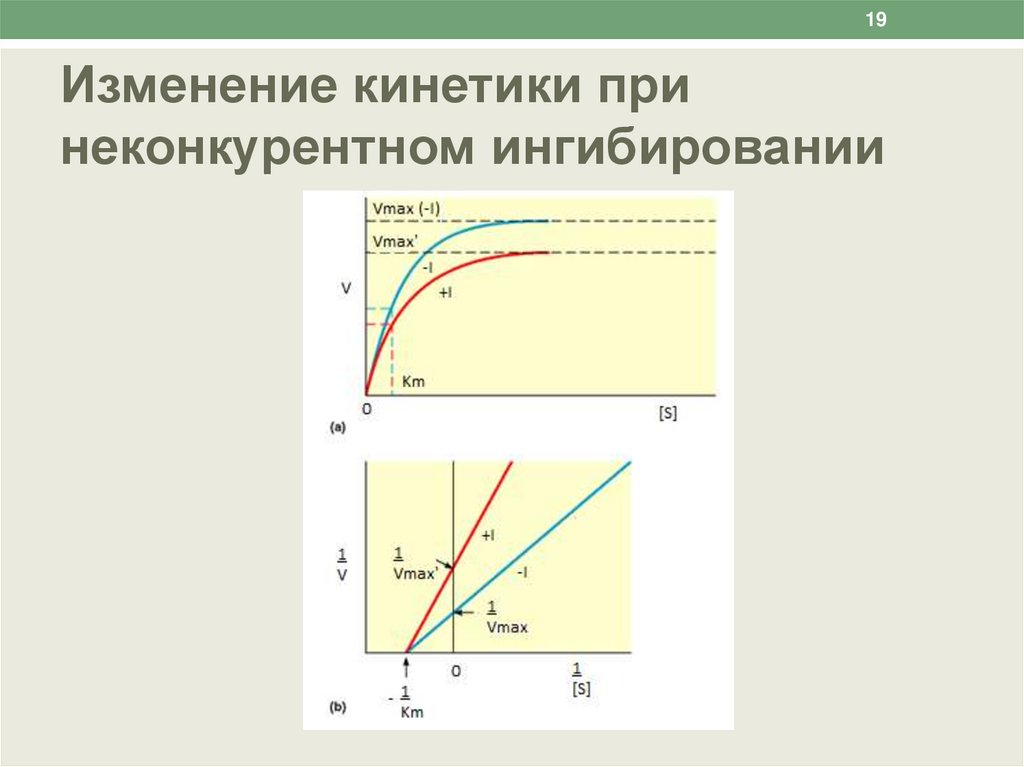
18Неконкурентные ингибиторы
• Неконкурентные ингибиторы – вещества, не имеющие
структурного сходства с субстратами.
• Неконкурентные ингибиторы связываются не с активным
центром, а в другом месте молекулы фермента, в том
числе и в области аллостерического центра.
• Неконкурентные ингибиторы понижают Vmax за счет
уменьшения количества действующих молекул фермента.
• Ингибиторы этого типа не мешают связыванию субстрата с
активным центром сохранившихся молекул фермента, в
результате величина Km не меняется.
• Механизм ингибирования состоит в снижении скорости
реакции за счет уменьшения количества нормальных
фермент-субстратных комплексов.
• Таким образом, при неконкурентном ингибировании:
Vmax уменьшается, а Km не изменяется
19.
19Изменение кинетики при
неконкурентном ингибировании
20.
20Смешанный тип ингибирования и
бесконкурентное ингибирование
Чаще встречается смешанный тип ингибирования,
когда снижение Vmax сочетается с одновременным
увеличением Km.
Это означает: при соединении ингибитора с ферментом
сохраняется возможность последующего присоединения
субстрата с образованием тройного комплекса, что
обеспечивает медленное превращению в продукт реакции.
В редких случаях возможно бесконкурентное
ингибирование, обнаруживаемое при повышении
концентрации субстрата. Один из возможных механизмов
этого эффекта связан с соединением ингибитора с
фермент-субстратным комплексом, что ведет к
образованию неактивного или медленно реагирующего
тройного комплекса.
21.
21Конкурентное и неконкурентное ингибирование
22.
22РЕГУЛЯЦИЯ АКТИВНОСТИ
ФЕРМЕНТОВ
23.
23Способы регуляции активности
ферментов
1. Активация профермента
2. Химическая модификация
3. Кооперативные эффекты (мультимерные белки)
симметричная модель (Моно и др.)
последовательная модель (Кошланд и др.)
4. Аллостерическая регуляция
гомотропная
гетеротропная
5. Регуляция по типу обратной связи
ретроингибирование
форактивация
24.
24Активация проферментов
Происходит путем отщепления части
полипептидной цепи от молекулы предшественника
с образованием активного центра фермента.
Такие ферменты функционируют, как правило, в
течение короткого времени, определяемого
временем жизни белковой молекулы.
Частичный протеолиз лежит в основе активации
пищеварительных протеолитических
ферментов (пепсин, трипсин, химотрипсин,
эластаза), пептидных гормонов (инсулин), белков
свертывающей системы крови и ряда других
белков.
25.
25Активация пепсиногена
26.
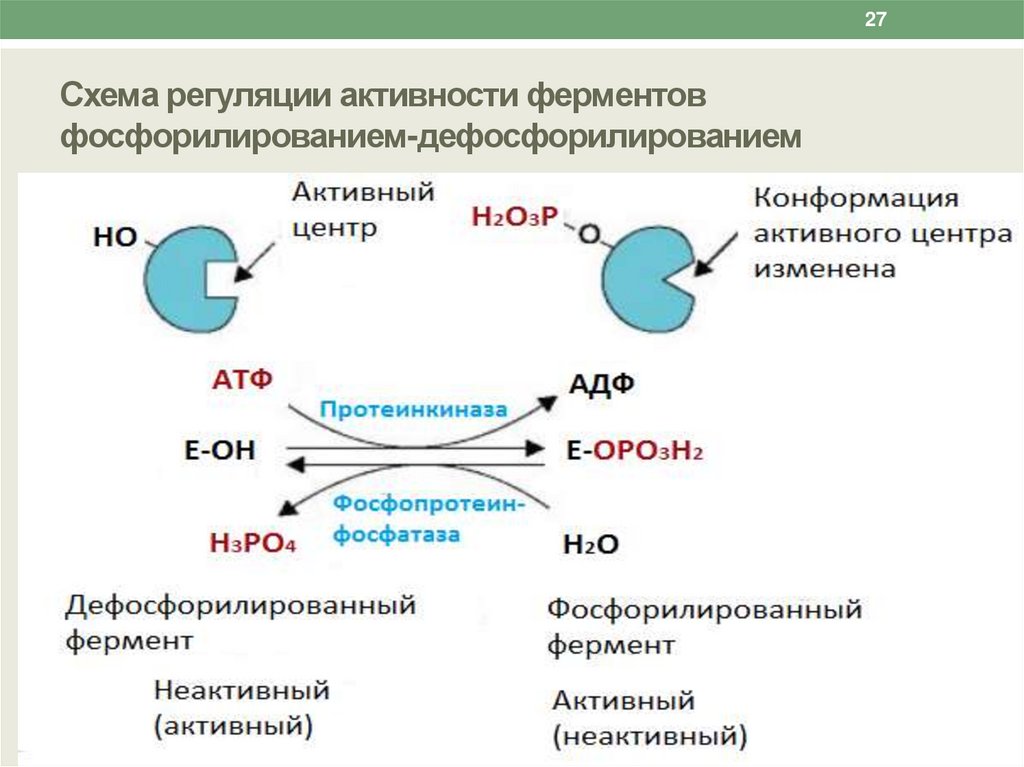
26Химическая (ковалентная) модификация
Заключается в присоединении к ферменту или отщеплении от него
низкомолекулярной молекулы, при котором происходит
активация или ингибирование фермента.
Быстрым и широко распространенным способом химической
модификации ферментов является их фосфорилированиедефосфорилирование.
Фосфорилирование ферментов происходит с помощью фермента
протеинкиназы.
Донором остатка фосфорной кислоты является молекула АТФ.
Фосфорилирование фермента изменяет его конформацию и
конформацию активного центра, что изменяет сродство
фермента к субстрату.
При этом некоторые ферменты при фосфорилировании
активируются, другие - ингибируются.
Обратный процесс - дефосфорилирование - вызывают ферменты
фосфопротеинфосфатазы, отщепляющие остаток фосфорной
кислоты от фермента и возвращающие фермент в исходное
состояние
27.
27Схема регуляции активности ферментов
фосфорилированием-дефосфорилированием
28.
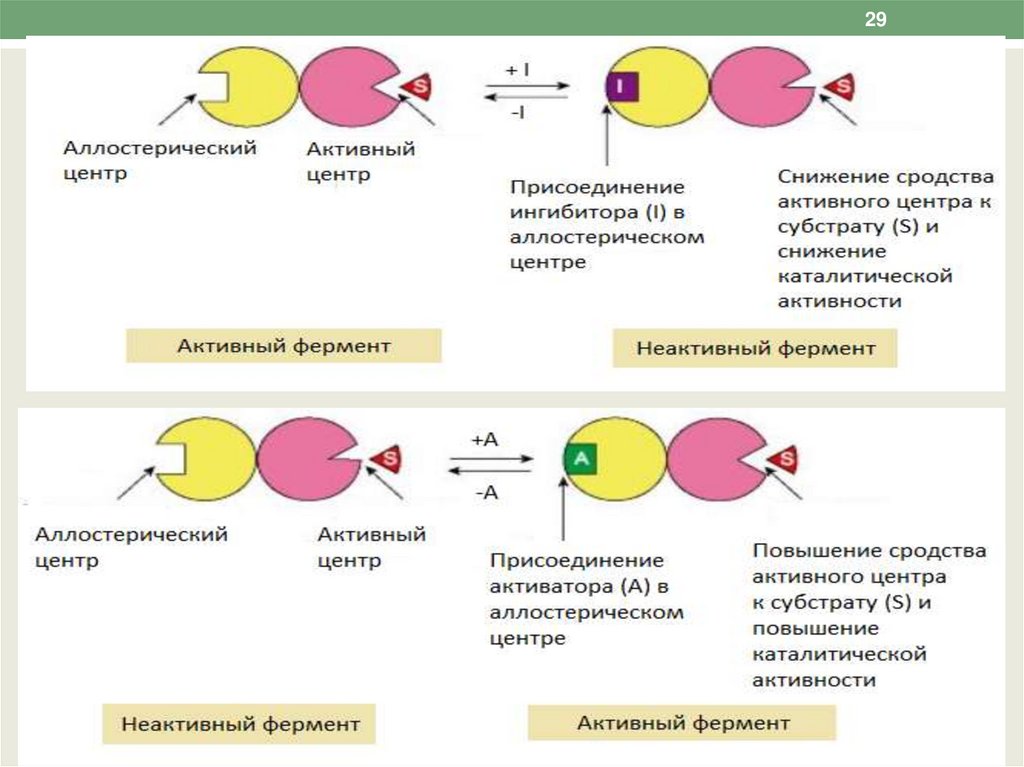
28Аллостерическая регуляция
Происходит путем присоединения к
аллостерическому центру фермента эффекторов –
активаторов и ингибиторов.
Если в роли активатора выступают молекулы
субстрата – гомотропная активация, если какой-то
другой метаболит – гетеротропная.
Регуляция аллостерических ферментов обратима:
отсоединение эффектора от регуляторной
субъединицы восстанавливает исходную
каталитическую активность фермента.
Аллостерические ферменты катализируют
ключевые реакции данного метаболического пути.
29.
2930.
30Характеристика аллостерических
ферментов
Аллостерические ферменты имеют четвертичную
структуру.
Субъединицы фермента могут находиться в 2-х
конформациях: R и Т. Конформация R (relax –
расслабление) обладает высоким сродством к
субстрату, конформация Т (tense – напряженная) –
низким сродством. Формы R и Т могут переходить
друг в друга.
31.
31Эффекторы связываются с T и R-конформациями
фермента. Аллостерический ингибитор
связывается преимущественно с Т-конформацией и
ее стабилизирует, что снижает сродство. фермента
к субстрату. Аллостерический активатор
связывается преимущественно с R-формой.
Субъединицы аллостерических ферментов связаны
между собой нековалентными связями.
Изменение конформации одной субъединицы
приводит к изменению конформации соседних
субъединиц (кооперативный эффект).
32.
32Модели кооперативного эффекта
Предложено 2 модели кооперативного эффекта.
Симметричная модель: субъединицы должны находится
в одном и том же конформационном состоянии, т.е.
возможны состояния RR и ТТ и невозможно состояние RT.
В отсутствие субстрата почти все молекулы фермента
находятся в Т-форме. Добавление субстрата приводит к
переходу T-формы в R-формы одновременно всех
субъединиц.
Последовательная модель. Согласно этой модели
каждая субъединица может существовать в одном из
возможных конформационных состояний (R или Т).
Связывание субстрата с одной субъединицей может
вызвать последовательное изменение конформации
соседней субъединицы или соседних субъединиц и в
результате увеличивать или их сродство к субстрату
33.
33Регуляция по принципу обратной связи
Характерен для многих многоступенчатых
биосинтетических процессов.
При данном способе регуляции конечный продукт
связывается с активным центром фермента и
ингибирует его.
Такие ферменты называются ключевыми, находятся
на первых этапах метаболического пути и
определяют скорость всего процесса.
34.
34Активация предшественником
При активации предшественником (форактивации)
– первый метаболит в многоступенчатом процессе
активирует фермент, катализирующий первую
или последнюю стадию.
35.
35Единицы измерения активности ферментов
Для выражения концентрации фермента используют
стандартную международную единицу и катал.
Стандартная международная единица (Е или U) –
количество фермента, которое в оптимальных
условиях катализирует превращение 1 мкмоль
субстрата в минуту (мкмоль/мин).
Катал - количество фермента, которое в
оптимальных условиях катализирует превращение 1
моль субстрата в секунду (моль/сек). 1 Е фермента
соответствует 16,67 нкат; 1 кат = 6×107 Е
36.
36Для выражения активности фермента используют
удельную и молярную активности.
Удельная активность – число единиц
ферментативной активности на 1 мг ферментативного
белка.
Молярная активность (число оборотов) – число
молекул субстрата, подвергающихся превращению
одной молекулой фермента в секунду




























 biology
biology








