Similar presentations:
Активность ферментов: влияние факторов, регуляция
1. Активность ферментов: влияние факторов, регуляция.
2. Факторы, влияющие на активность ферментов
1.2.
3.
4.
5.
Концентрация фермента (энзима) [E]
Концентрация субстрата [S]
Температура
Концентрация ионов Н (рН)
Низкомолекулярные продукты
3. Влияние [E]
[V][S]
[S] - const
4. Влияние [S]
Уравнение Михаэлиса - МентенV .[s]
Кm + [ s ]
MAX
V=
5.
[S][V]
0
Vmax . [ S ]
V=
Кm + [ S ]
V = [S]
[S]
6.
[S][V]
∞
Vmax . [ S ]
V=
Кm + [ S ]
V = Vmax
Vmax
[S]
7.
ЕслиVmax
2
1 =
2
v = ½ vmax
Vmax [ s ]
=
Km + [ s ]
s
Km + [ s ]
или
Km = [ s ]
Km + [ s ] = 2 [ s ]
8.
v1
vmax
2
Km
[s]
Для многих ферментов Km = 10-1 – 10-6 M
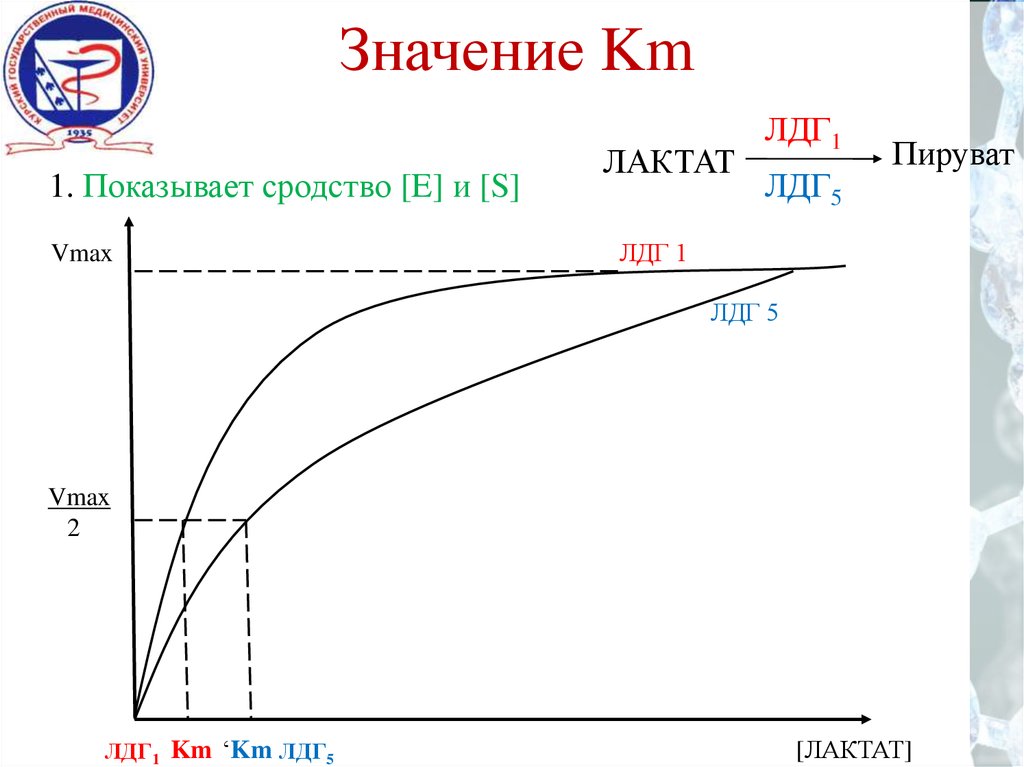
9. Значение Km
1. Показывает сродство [E] и [S]Vmax
ЛАКТАТ
ЛДГ1
ЛДГ5
Пируват
ЛДГ 1
ЛДГ 5
Vmax
2
ЛДГ1 Km ‘Km ЛДГ5
[ЛАКТАТ]
10.
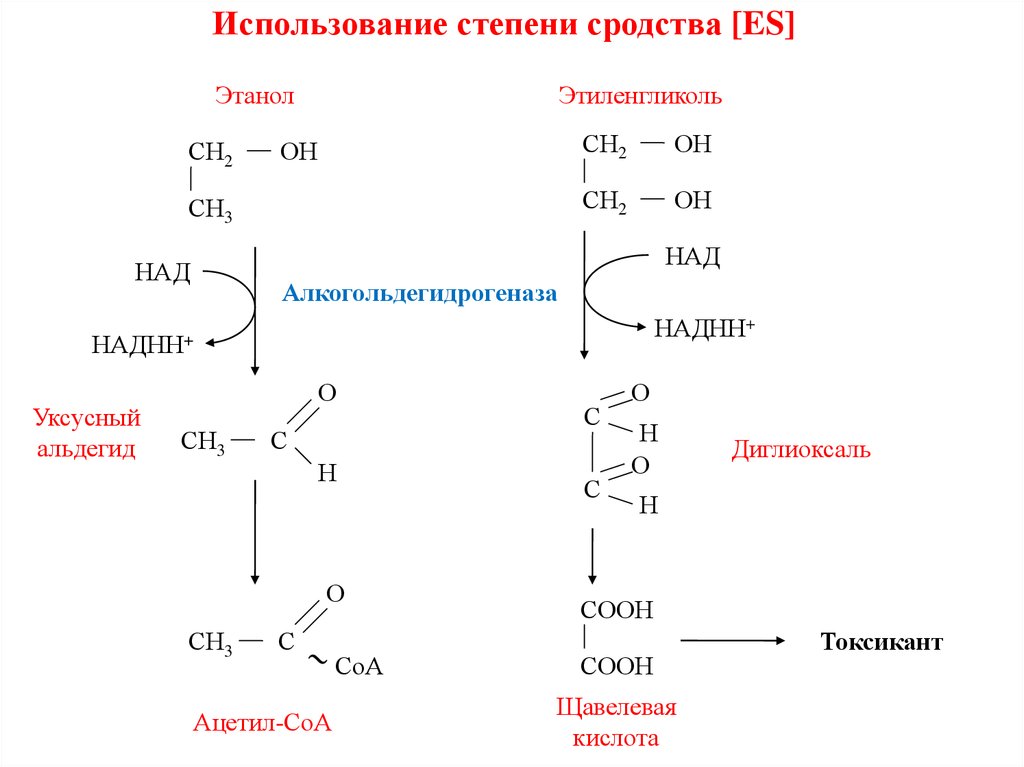
Использование степени сродства [ES]Этанол
СН2
Этиленгликоль
ОН
СН3
СН2
ОН
СН2
ОН
НАД
НАД
Алкогольдегидрогеназа
НАДНН+
НАДНН+
Уксусный
альдегид
О
СН3
С
Н
О
СН3
С
Ацетил-СоА
СоА
С
С
О
Н
О
Диглиоксаль
Н
СООН
СООН
Щавелевая
кислота
Токсикант
11.
VVmax
Km Этанол
Km Этиленгликоль
[S]
12. Значение Km
2. Km – важная количественная характеристика фермента,определяет с каким [S] будет наиболее эффективно он
связываться
[V]
ЛДГ1
Vmax
1
Vmax
2
Km
[ЛАКТАТ]
ЛДГ1
[V]
Vmax
1
Vmax
2
Km
[ПИРУВАТ]
13. Значение Km
3. Позволяет определить вид ингибированияфермента
4. Показывает сродство апофермента и кофактора
[V]
1
2
vmax
Km
[Ko]
14. Определение Km
1v
1
vmax
1
Km
1
[s]
График Лайнувера – Берка.
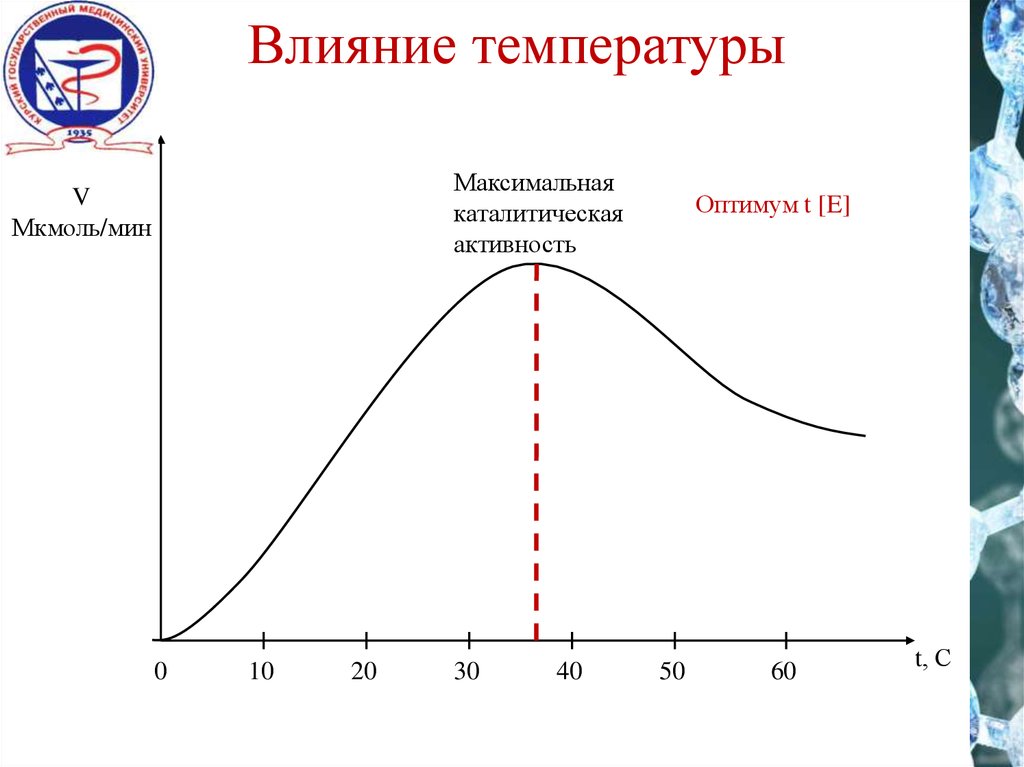
15. Влияние температуры
Максимальнаякаталитическая
активность
V
Мкмоль/мин
0
10
20
30
40
Оптимум t [E]
50
60
t, С
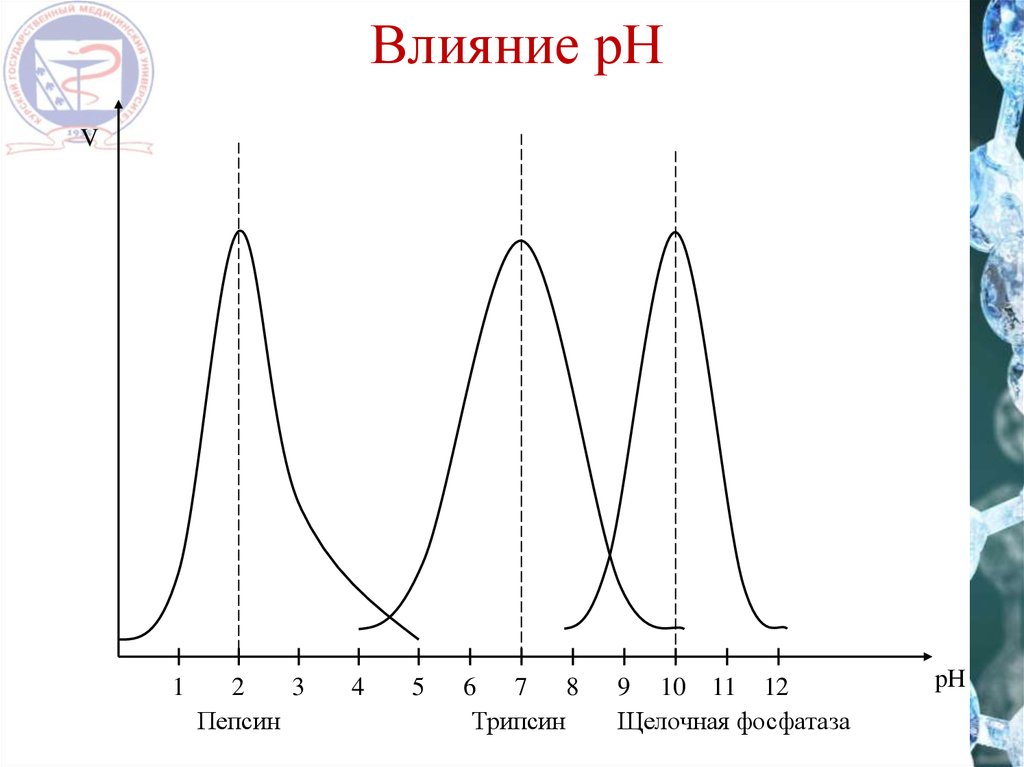
16. Влияние рН
V1
2
3
Пепсин
4
5
6 7 8
Трипсин
9 10 11 12
Щелочная фосфатаза
pH
17.
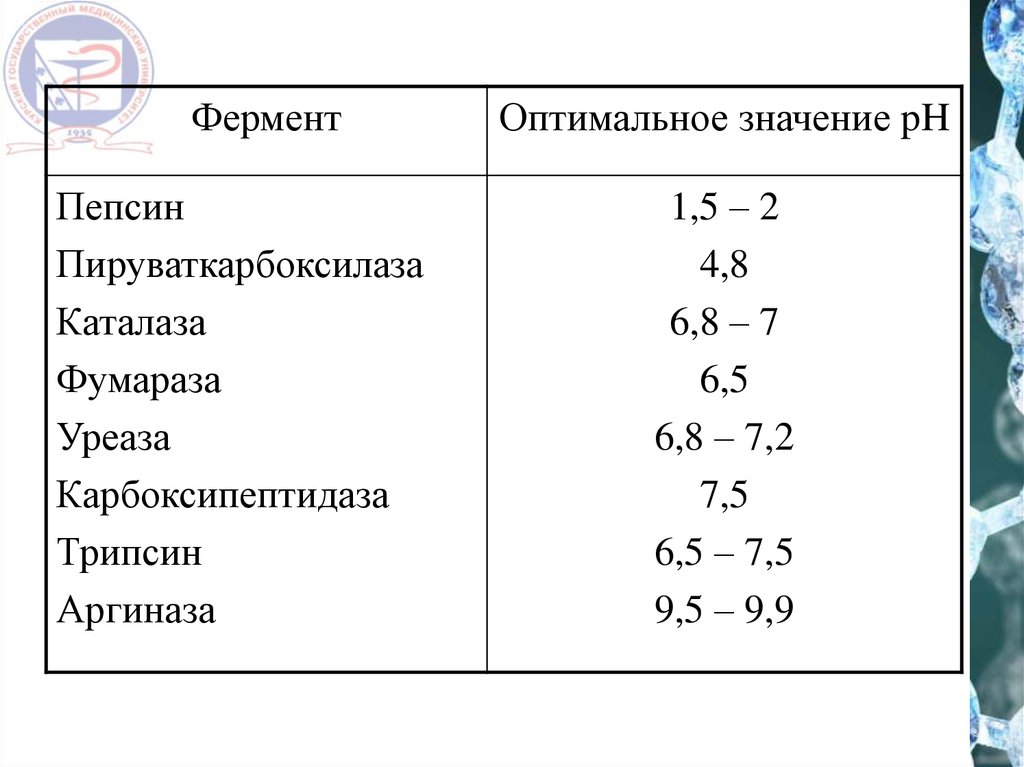
ФерментПепсин
Пируваткарбоксилаза
Каталаза
Фумараза
Уреаза
Карбоксипептидаза
Трипсин
Аргиназа
Оптимальное значение pH
1,5 – 2
4,8
6,8 – 7
6,5
6,8 – 7,2
7,5
6,5 – 7,5
9,5 – 9,9
18. Влияние низкомолекулярных продуктов
ИнгибиторыАктиваторы
Активаторы
1. Небелковая часть ферментов
2. Ионы металлов
19.
2.1. Ионы металлов – стабилизаторы молекулы субстрата:E – S - Me
Гексокиназа
Глюкоза
2+
Mg -АТФ
Глюкоза-6-фосфат
АДФ
2.2. Ионы металлов–стабилизаторы активного центра фермента:
E – Me - S
Такие функции выполняют:
2+
2+
2+
2+
Mg , Mn , Zn , Mo , Co
2+
20.
2.3. Ионы металлов - стабилизаторы третичной и четвертичнойструктуры апофермента
2+
2+
Zn
36 Кд 36 Кд
Zn
+4Zn
+4Zn
36 Кд
36 Кд
Фермент неактивен
2+
2+
151кДж Zn
Zn
Алкогольдегидрогеназа
Фермент активен
2.4. Ионы металлов - участники ферментативного катализа
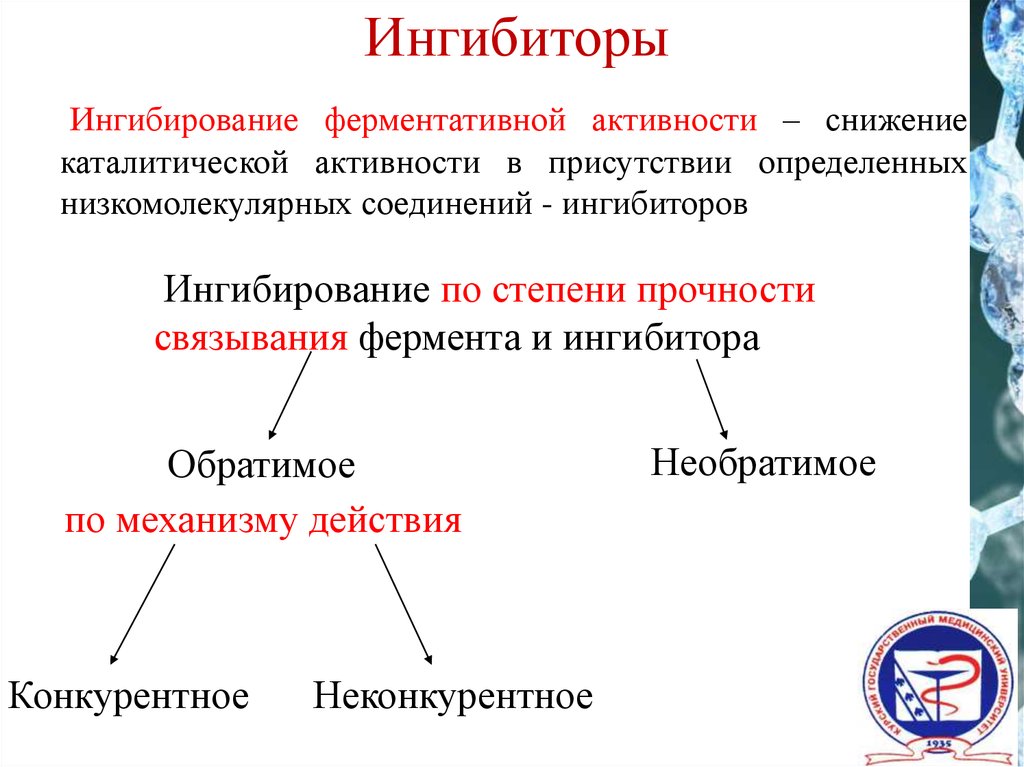
21. Ингибиторы
Ингибирование ферментативной активности – снижениекаталитической активности в присутствии определенных
низкомолекулярных соединений - ингибиторов
Ингибирование по степени прочности
связывания фермента и ингибитора
Обратимое
по механизму действия
Конкурентное
Неконкурентное
Необратимое
22.
Необратимое ингибирование – наблюдается в случаеобразования ковалентных стабильных связей между
молекулой ингибитора и фермента. К необратимым ингибиторам
относят ионы тяжелых металлов: ртуть (Hg2+ ), серебро (Ag+ ), мышьяк (As3+ ),
которые в малых концентрациях блокируют сульфгидрильные группы
активного центра.
E+I
EI
Hg
2+
23.
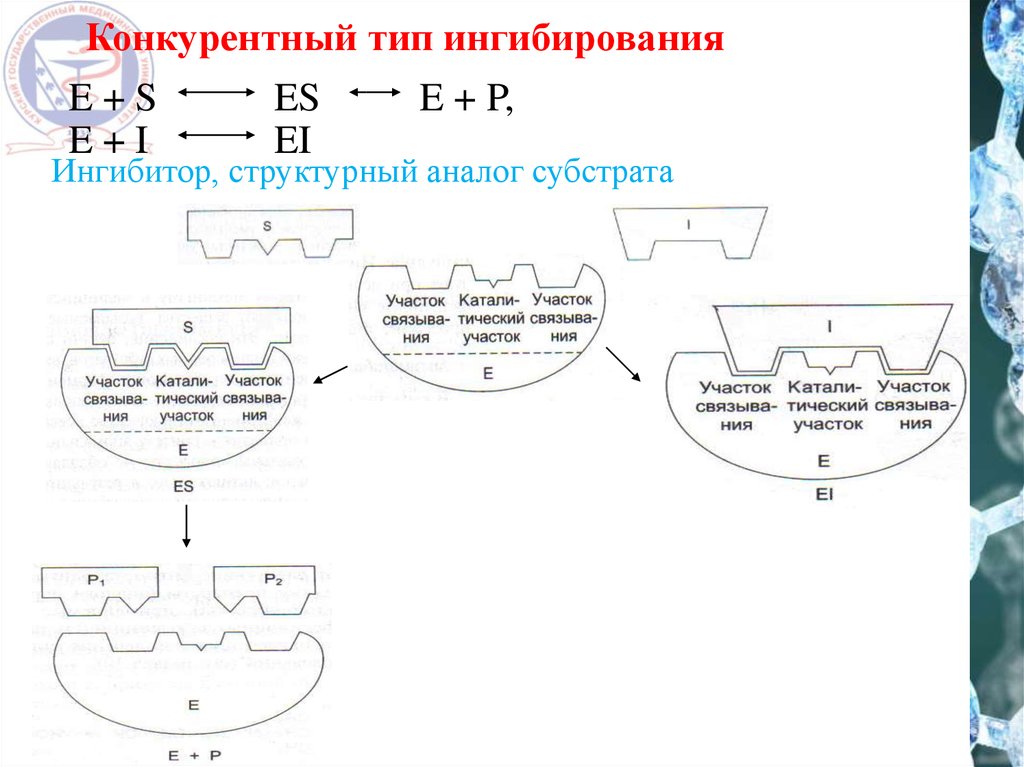
Конкурентный тип ингибированияE+S
E+I
ES
EI
E + P,
Ингибитор, структурный аналог субстрата
24.
Торможение активности СДГ малоновой кислотой+
Н
ООС
С
С
+
ООС
Сукцинат
Н
- 2Н
СН
Н
Н
+
ООС
Блокирование
реакции
ООС
СН
;
СН
ООС
Фумарат
+
ООС
Малонат
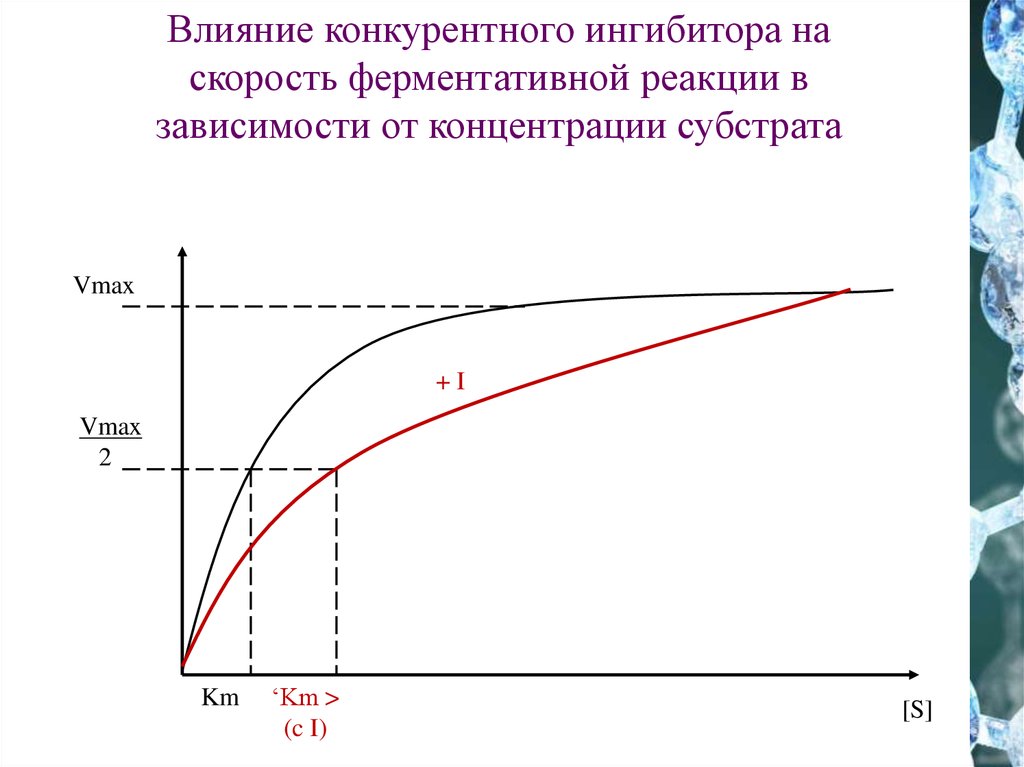
25.
Влияние конкурентного ингибитора наскорость ферментативной реакции в
зависимости от концентрации субстрата
Vmax
+I
Vmax
2
Km
‘Km >
(c I)
[S]
26.
Неконкурентное ингибирование – ингибиторвзаимодействует с ферментом в участке, не входящим в
состав активного центра
ES
E+P
E+I
IE
ES + I
SIE
I
Активный центр
EI + S
не комплементарен S
27.
График зависимости V от [S] в присутствиинеконкурентного ингибитора
V
Vmax
+I
Vmax (с I)
½ Vmax
½ Vmax
(с I)
снижение
Km
28.
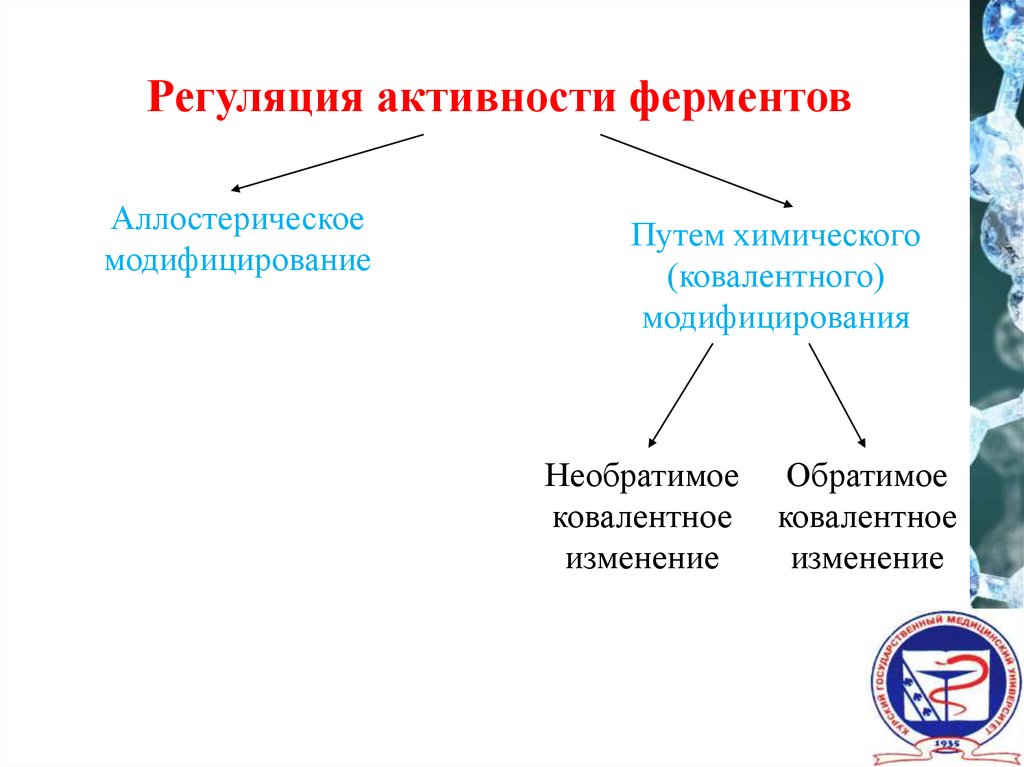
Регуляция активности ферментовАллостерическое
модифицирование
Путем химического
(ковалентного)
модифицирования
Необратимое
ковалентное
изменение
Обратимое
ковалентное
изменение
29.
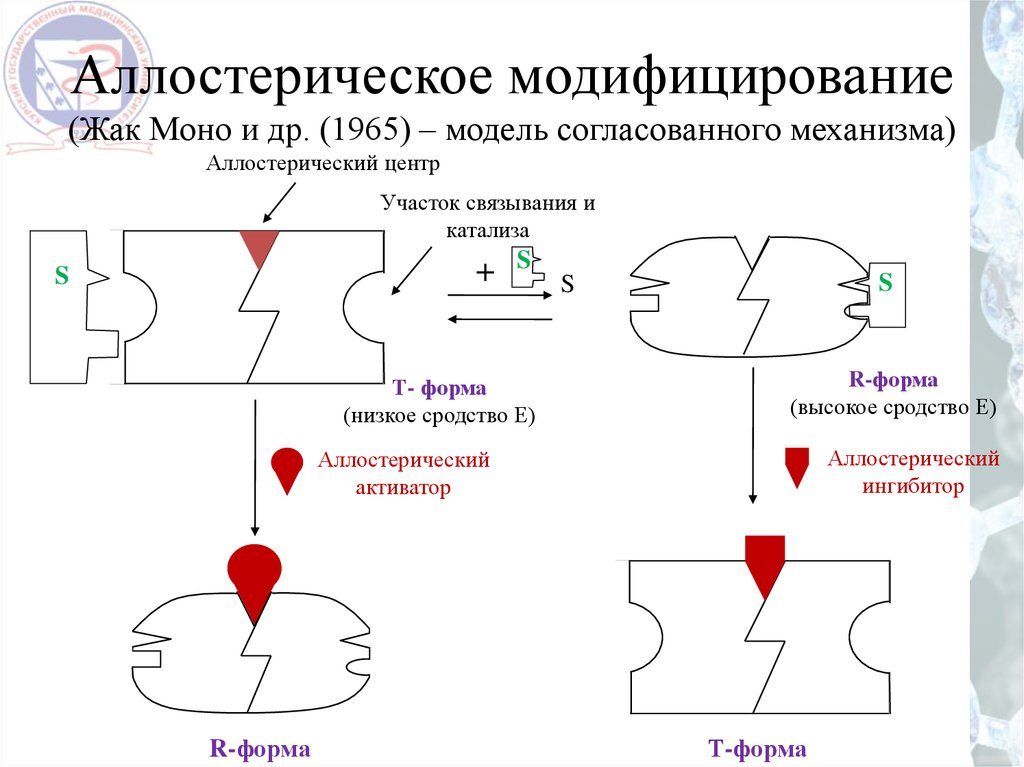
Аллостерическое модифицирование(Жак Моно и др. (1965) – модель согласованного механизма)
Аллостерический центр
Участок связывания и
катализа
+
S
S
Т- форма
(низкое сродство Е)
S
S
R-форма
(высокое сродство Е)
Аллостерический
ингибитор
Аллостерический
активатор
R-форма
Т-форма
30.
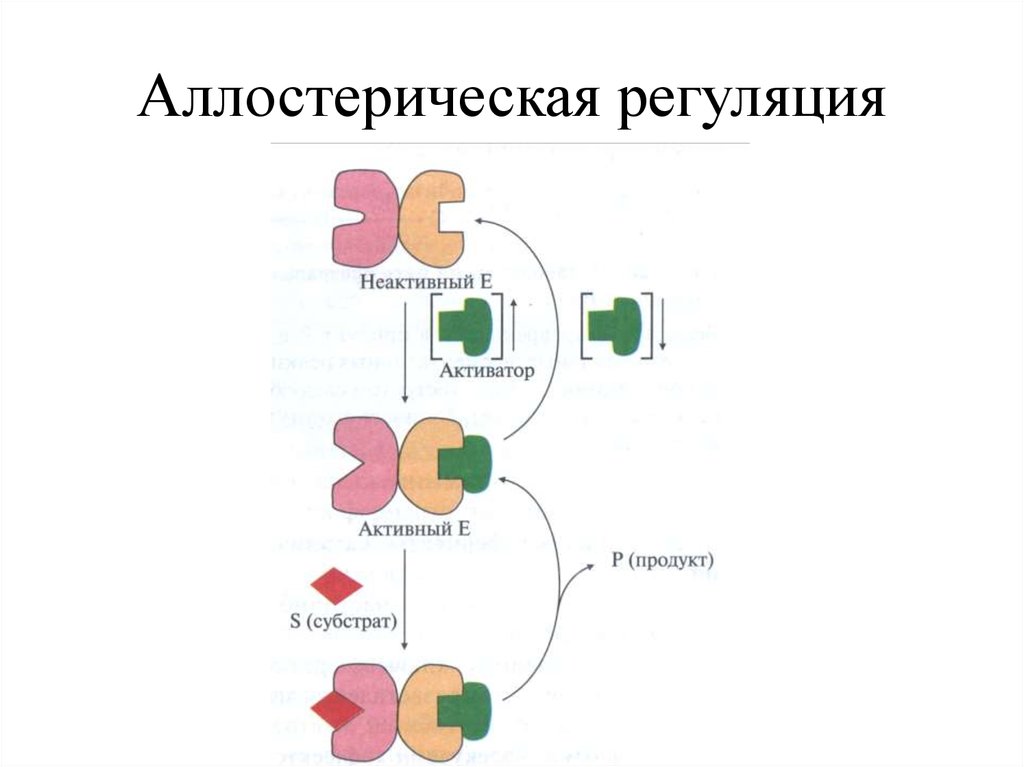
Аллостерическая регуляция31.
+ Активатор[V]
+ Ингибитор
[S]
+
S
E
E1
A
E2
B
E3
гомотропные
гетеротропные
гомогетеротропные
C
E4
P
E5
P
32.
Необратимое ковалентное изменениеЧастичный (ограниченный) протеолиз
пептид
E
E
S
пептид
S
Трипсиноген
энтеропептидаза (или трипсин)
(зимоген, профермент)
Трипсин
(активный фермент)
Гексапептид
33. Регуляция активности ферментов
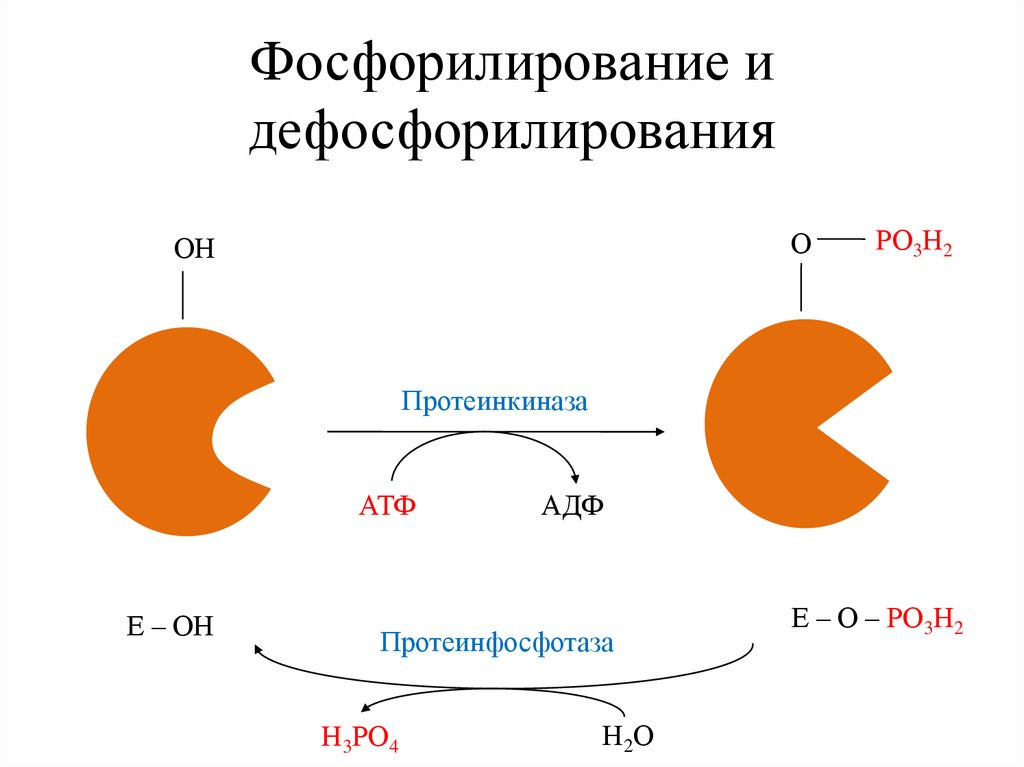
Фосфорилирование идефосфорилирования
О
ОН
РО3Н2
Протеинкиназа
АТФ
Е – ОН
АДФ
Протеинфосфотаза
Н3РО4
Н2 О
Е – О – РО3Н2
34. Аллостерическое модифицирование (Жак Моно и др. (1965) – модель согласованного механизма)
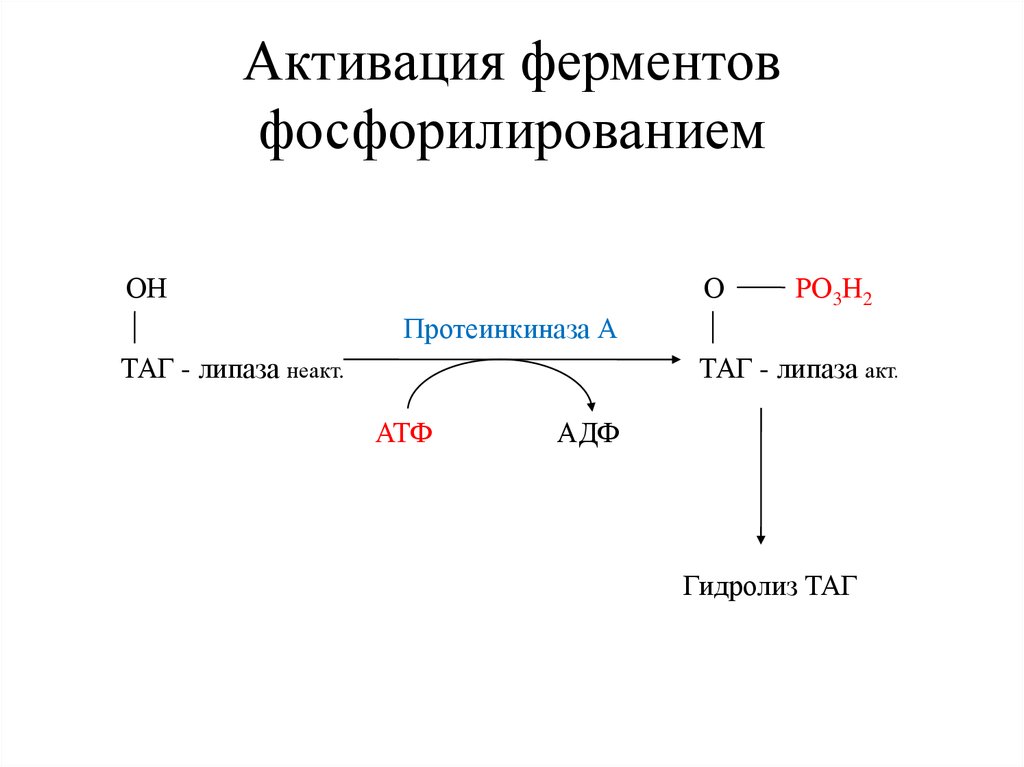
Активация ферментовфосфорилированием
ОН
О
РО3Н2
Протеинкиназа А
ТАГ - липаза неакт.
ТАГ - липаза акт.
АТФ
АДФ
Гидролиз ТАГ
35. Аллостерическая регуляция
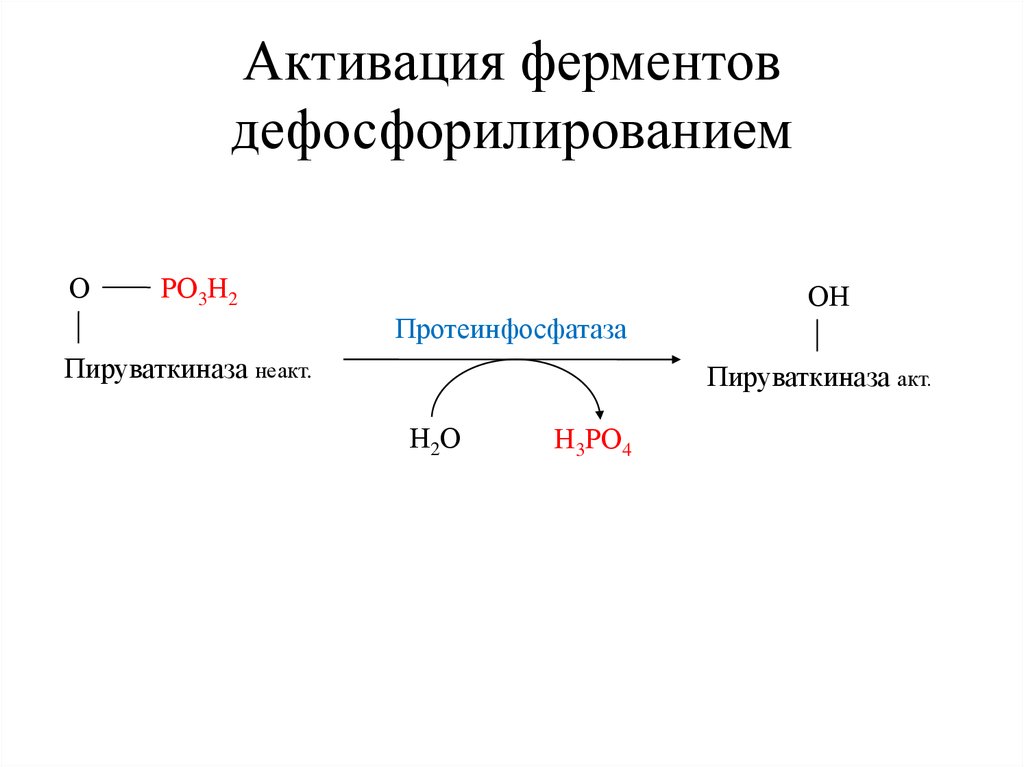
Активация ферментовдефосфорилированием
О
РО3Н2
ОН
Протеинфосфатаза
Пируваткиназа неакт.
Пируваткиназа акт.
Н2О
Н3РО4
36.
Классы ферментов1. Оксидоредуктазы
А. Дегидрогеназы
COOH
CH
COOH
OH +НАД
Малатдегидрогеназа
CH
CH2
CH2
COOH
COOH
+
O +НАД+ H
37.
Б. Оксидазы+4
+4е Цитохромоксидаза
2
В. Оксигеназы
OH
OH
OH
CH2
NH2
Дофамингидрокеназа
Аскорбиновая Дегидроаскорбиновая
кислота
кислота
CH2
Дофамин
OH
CH2
OH
CH2
NH2
Норадреналин
38.
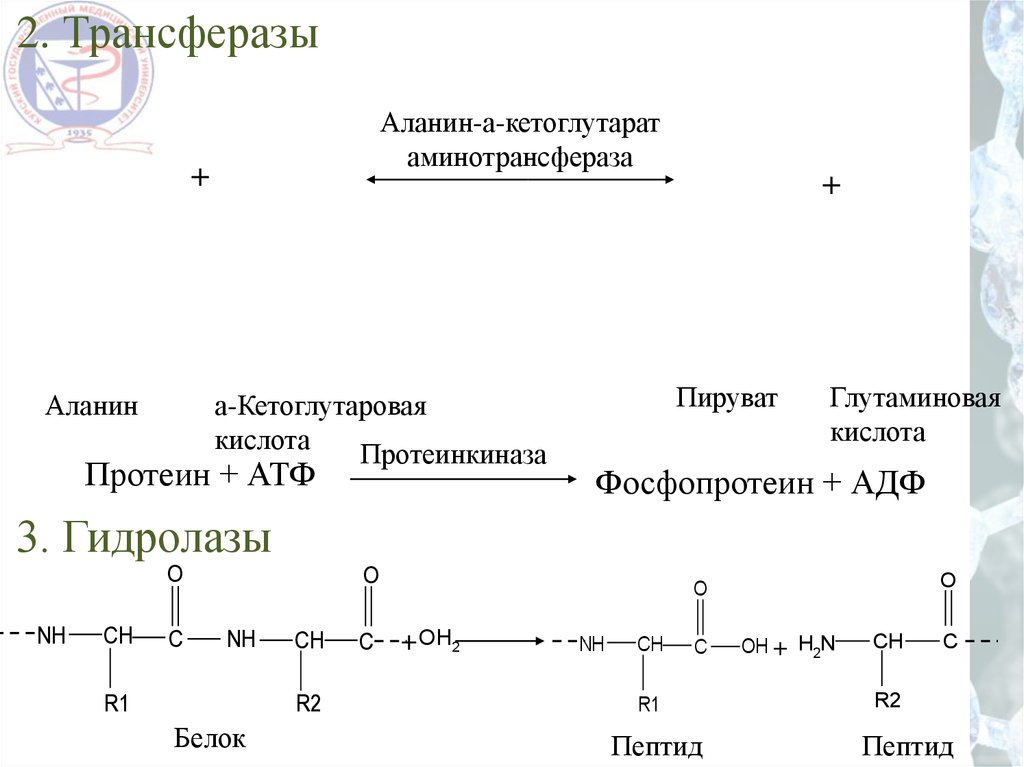
2. ТрансферазыАланин-а-кетоглутарат
аминотрансфераза
+
Аланин
а-Кетоглутаровая
кислота
Протеинкиназа
Протеин + АТФ
+
Пируват
Глутаминовая
кислота
Фосфопротеин + АДФ
3. Гидролазы
O
NH
CH
C
O
NH
R1
CH
R2
Белок
C
O
O
+ OH2
NH
CH
C
R1
Пептид
OH + H2N
CH
C
R2
Пептид
39.
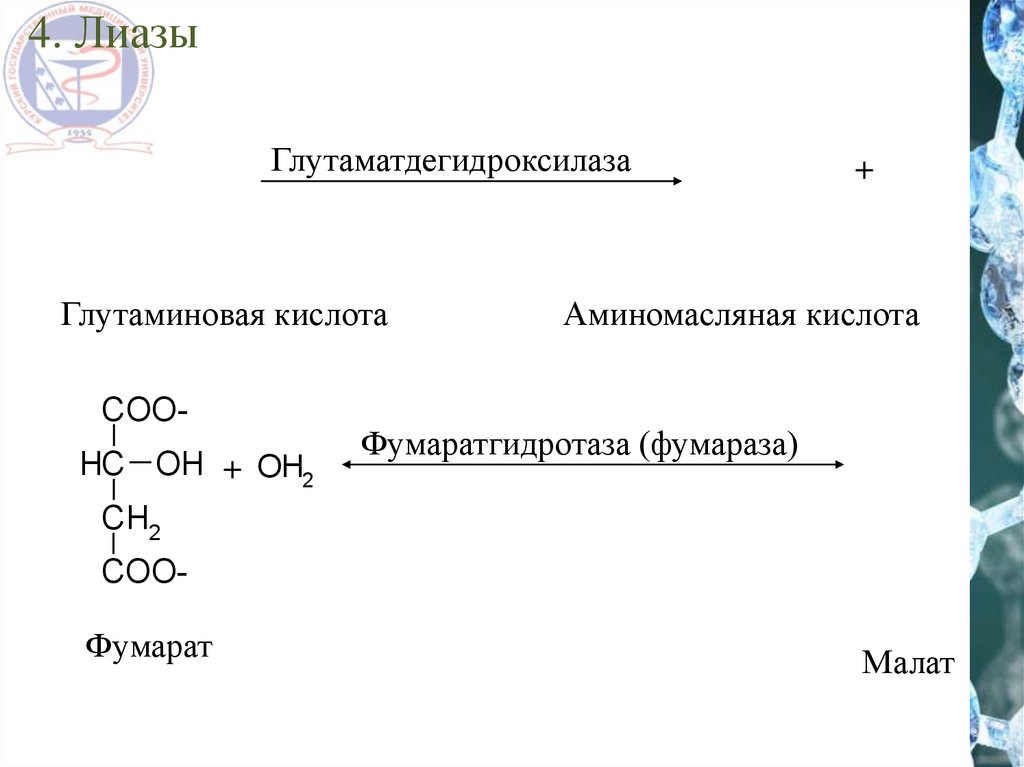
4. ЛиазыГлутаматдегидроксилаза
Глутаминовая кислота
COOHC OH + OH2
+
Аминомасляная кислота
Фумаратгидротаза (фумараза)
CH2
COO-
Фумарат
Малат
40. Фосфорилирование и дефосфорилирования
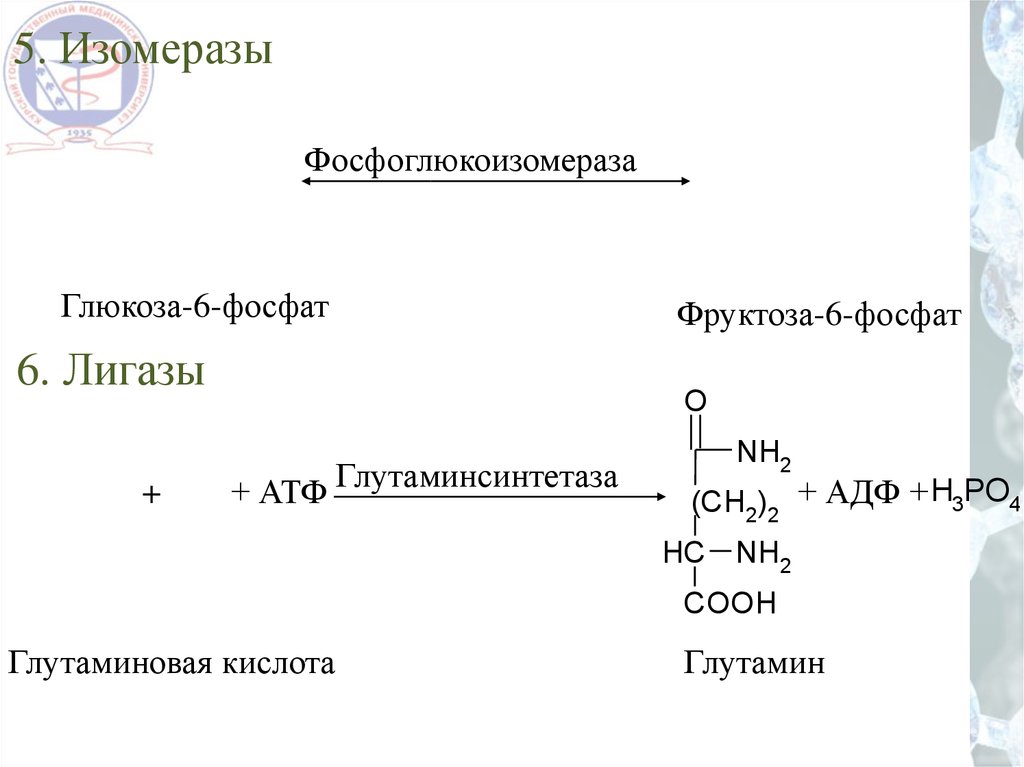
5. ИзомеразыФосфоглюкоизомераза
Глюкоза-6-фосфат
6. Лигазы
+
Фруктоза-6-фосфат
O
+ АТФ Глутаминсинтетаза
NH2
(CH2)2 + АДФ + H3PO4
HC NH2
COOH
Глутаминовая кислота
Глутамин


![Влияние [E] Влияние [E]](https://cf.ppt-online.org/files/slide/r/Rl7sfdrjVPM2xXqygQkStZwUKFnbLioD0JOa6p/slide-2.jpg)
![Влияние [S] Влияние [S]](https://cf.ppt-online.org/files/slide/r/Rl7sfdrjVPM2xXqygQkStZwUKFnbLioD0JOa6p/slide-3.jpg)


















 biology
biology








