Similar presentations:
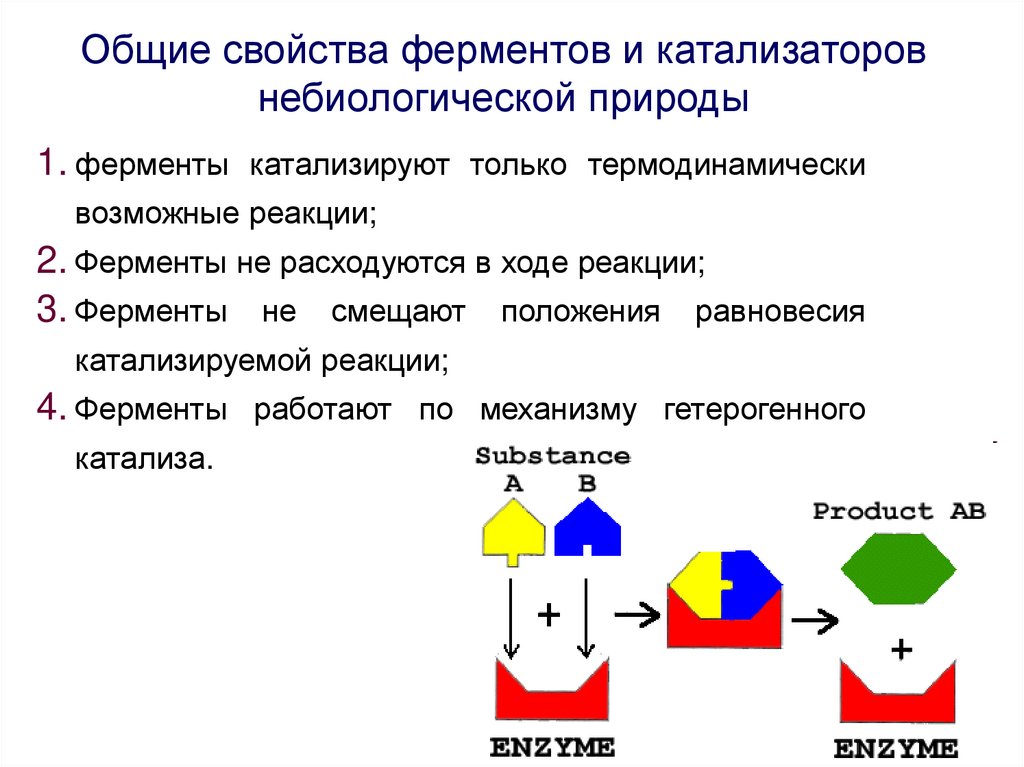
Общие свойства ферментов и катализаторов небиологической природы
1.
Общие свойства ферментов и катализаторовнебиологической природы
1. ферменты катализируют только термодинамически
возможные реакции;
2. Ферменты не расходуются в ходе реакции;
3. Ферменты не смещают положения равновесия
катализируемой реакции;
4. Ферменты работают по механизму гетерогенного
катализа.
2.
Специфические свойства ферментов1. Ферменты-белки и рибозимы работают в мягких условиях
(Т = 40–50 С; нейтральный pH, атмосферное давление и др.)
2. Очень высокая эффективность действия;
3. Специфичность действия ферментов к типу катализируемой
реакции и к структуре реагирующих соединений;
4. Регулируемость каталитической активности ферментов;
5. Отсутствие побочных продуктов реакции.
Комплекс топоизомеразы с ДНК
3.
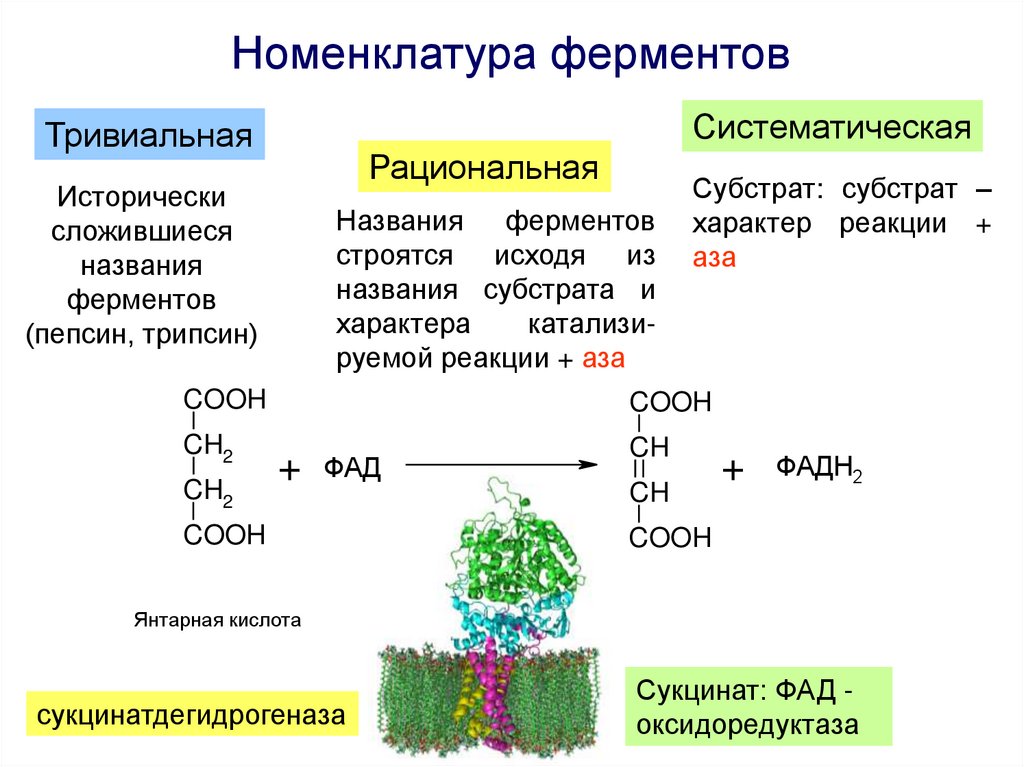
Номенклатура и классификация ферментов4.
Номенклатура ферментовСистематическая
Тривиальная
Рациональная
Исторически
сложившиеся
названия
ферментов
(пепсин, трипсин)
Названия ферментов
строятся исходя из
названия субстрата и
характера
катализируемой реакции + аза
COOH
CH2
CH2
Субстрат: субстрат –
характер реакции +
аза
COOH
+
ФАД
COOH
CH
CH
+
ФАДН2
COOH
Янтарная кислота
сукцинатдегидрогеназа
Сукцинат: ФАД оксидоредуктаза
5.
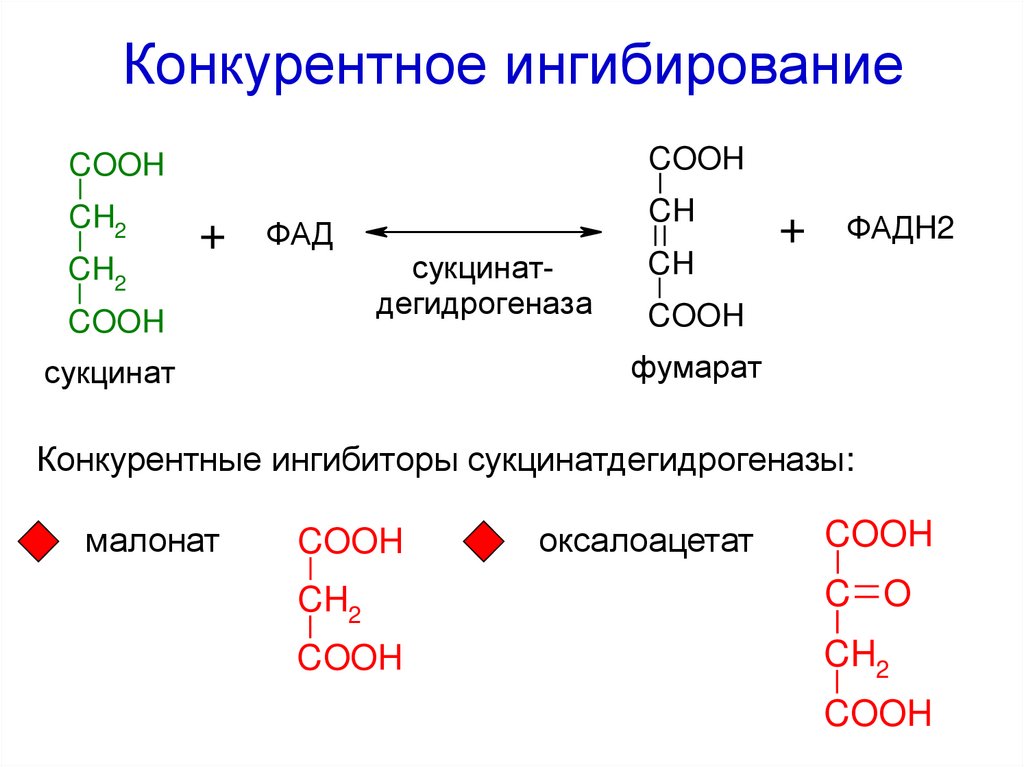
Международная классификация ферментовпо типу катализируемой реакции
I. Оксидоредуктазы
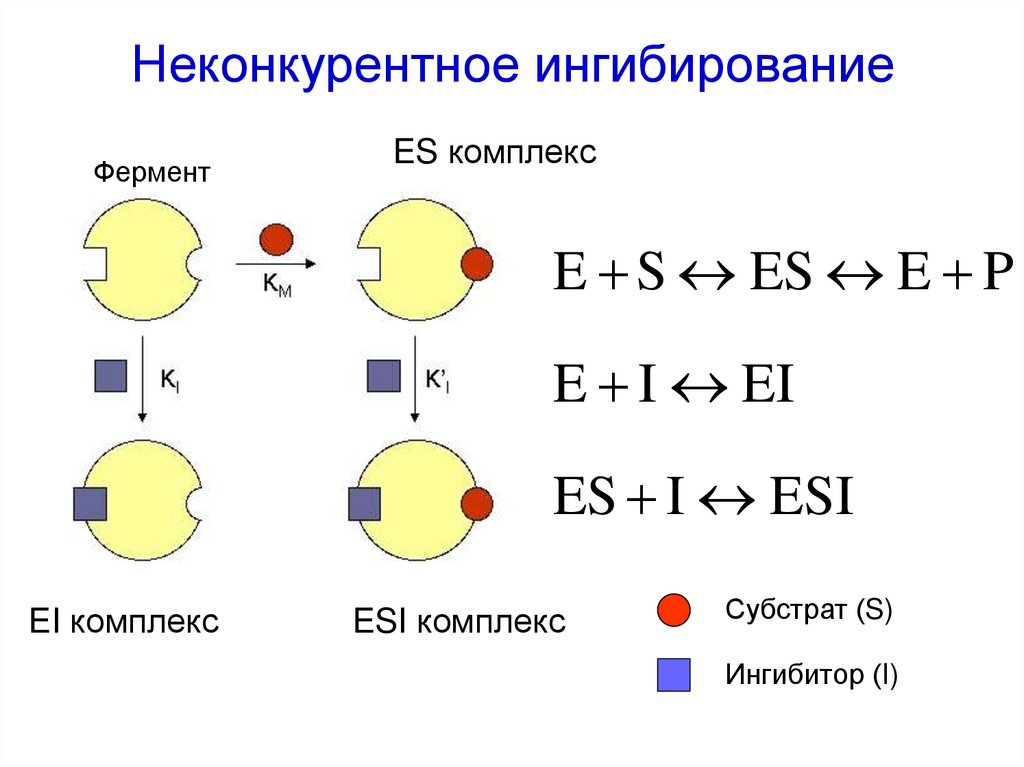
II. Трансферазы
III.Гидролазы
IV. Лиазы
V. Изомеразы
VI. Лигазы
Ared Box Aox Bred
A- B C A B -C
A - B H 2 O A - H B - OH
A B A- B
A изо - A
A B XTP A - B XDP
X A,G,U,C
6.
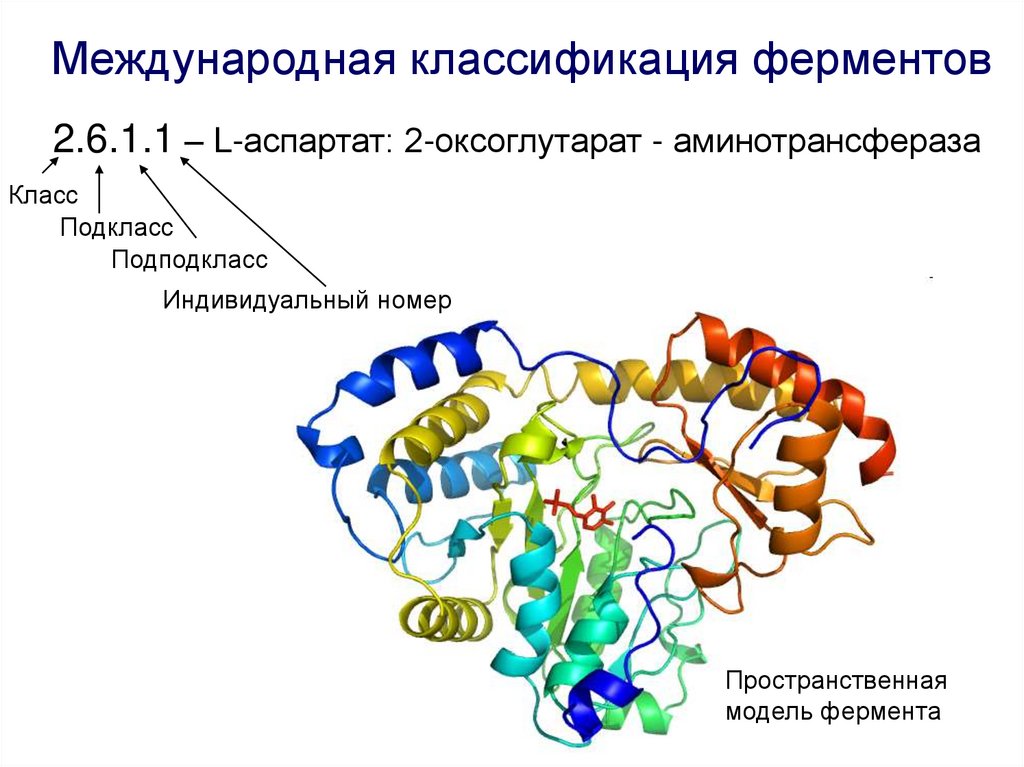
Международная классификация ферментов2.6.1.1 – L-аспартат: 2-оксоглутарат - аминотрансфераза
Класс
Подкласс
Подподкласс
Индивидуальный номер
Пространственная
модель фермента
7.
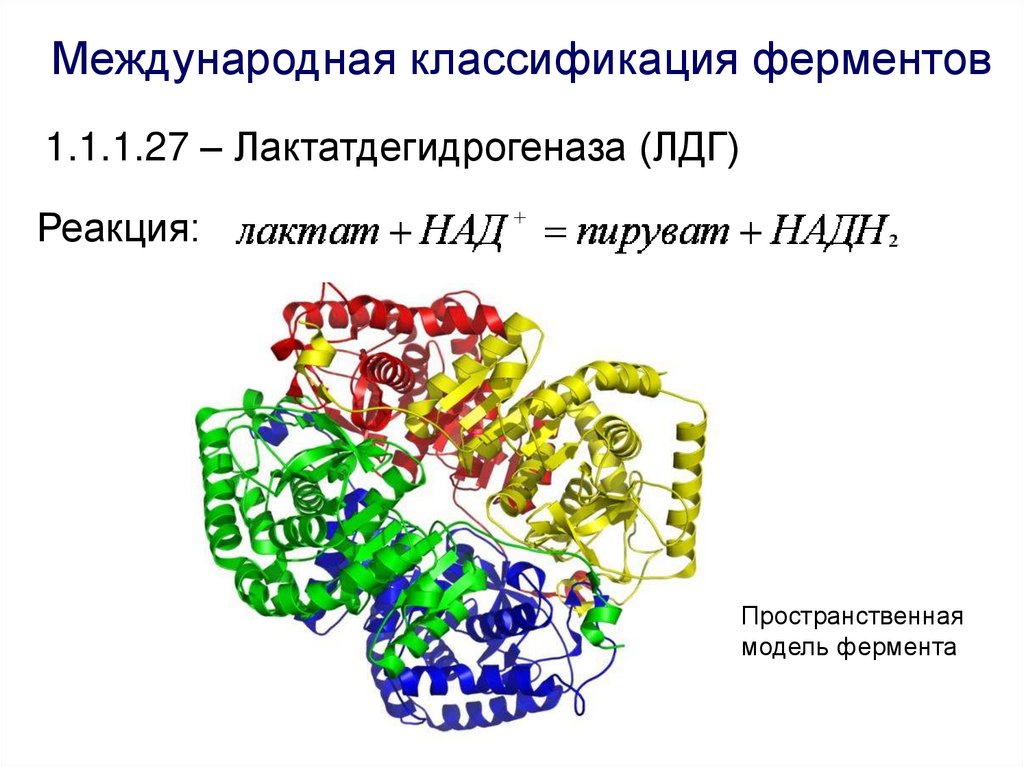
Международная классификация ферментов1.1.1.27 – Лактатдегидрогеназа (ЛДГ)
Реакция:
Пространственная
модель фермента
8.
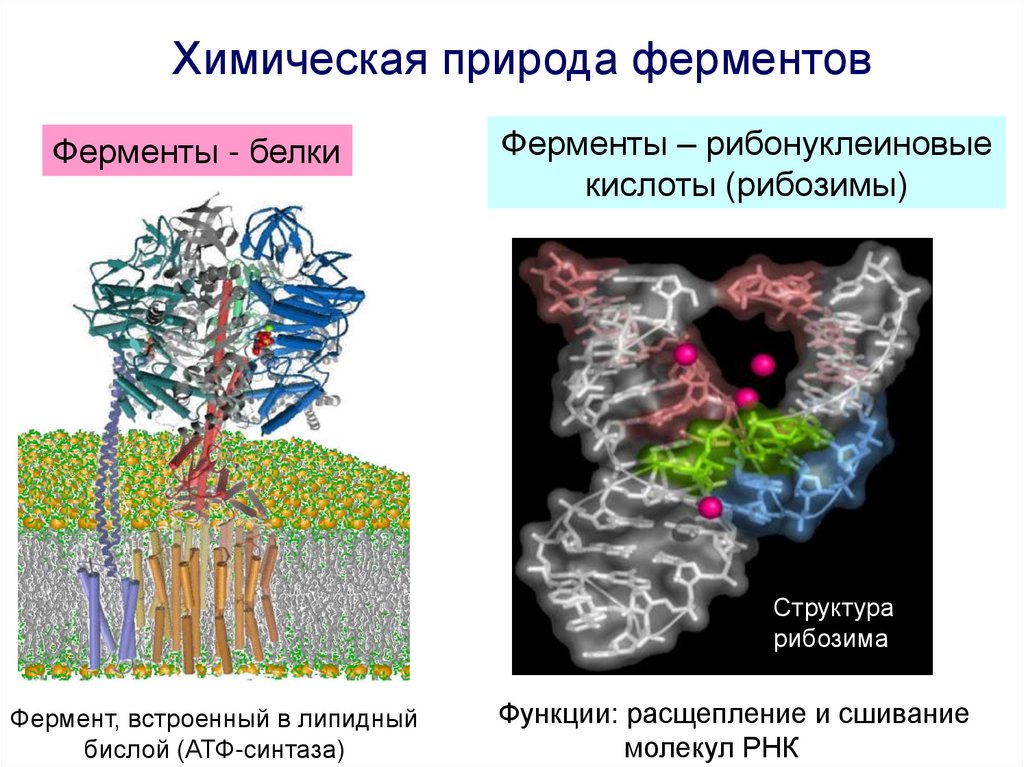
Химическая природа ферментовФерменты - белки
Ферменты – рибонуклеиновые
кислоты (рибозимы)
Структура
рибозима
Фермент, встроенный в липидный
бислой (АТФ-синтаза)
Функции: расщепление и сшивание
молекул РНК
9.
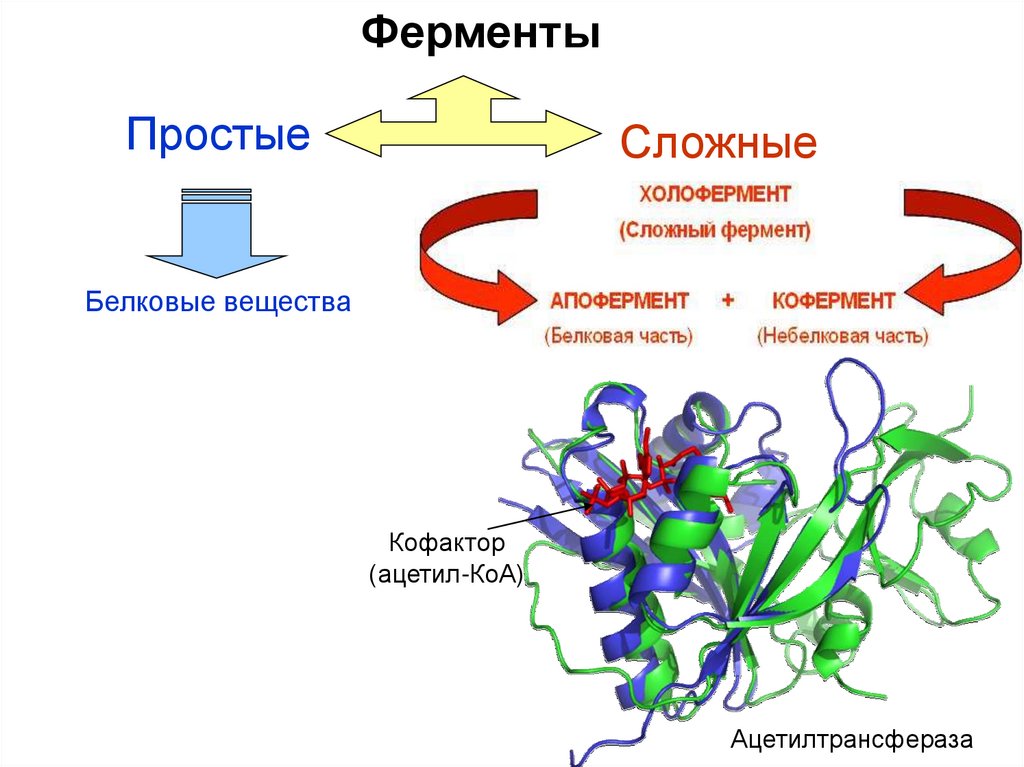
ФерментыПростые
Сложные
Белковые вещества
Кофактор
(ацетил-КоА)
Ацетилтрансфераза
10.
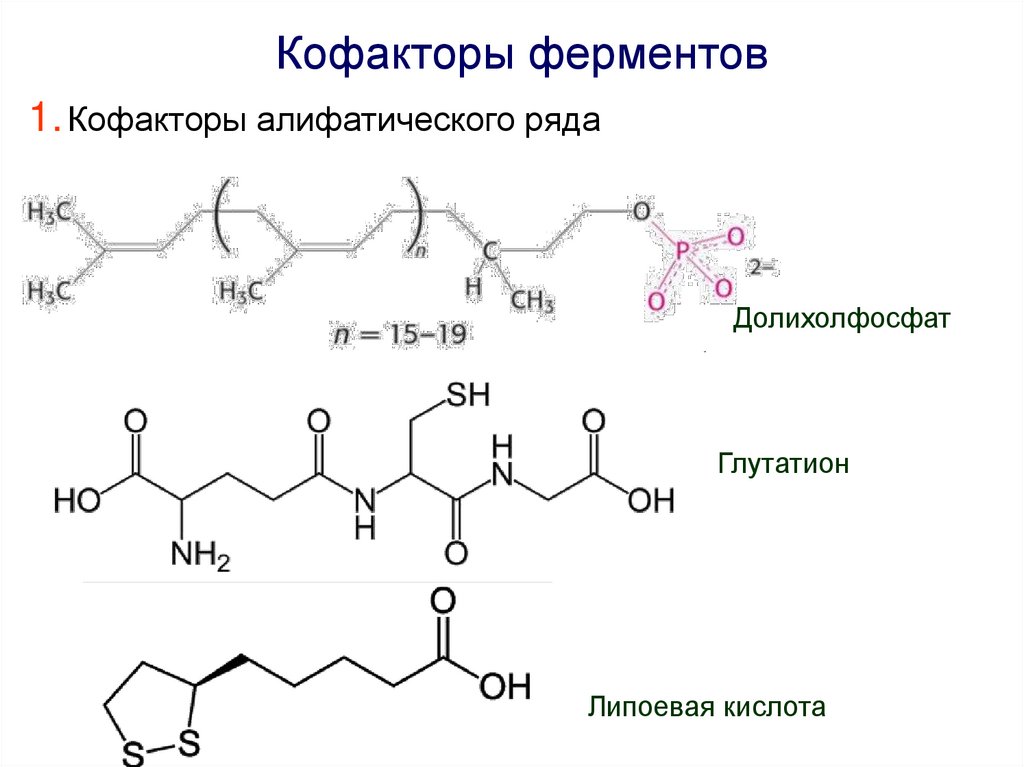
Кофакторы ферментов1. Кофакторы алифатического ряда
Долихолфосфат
Глутатион
Липоевая кислота
11.
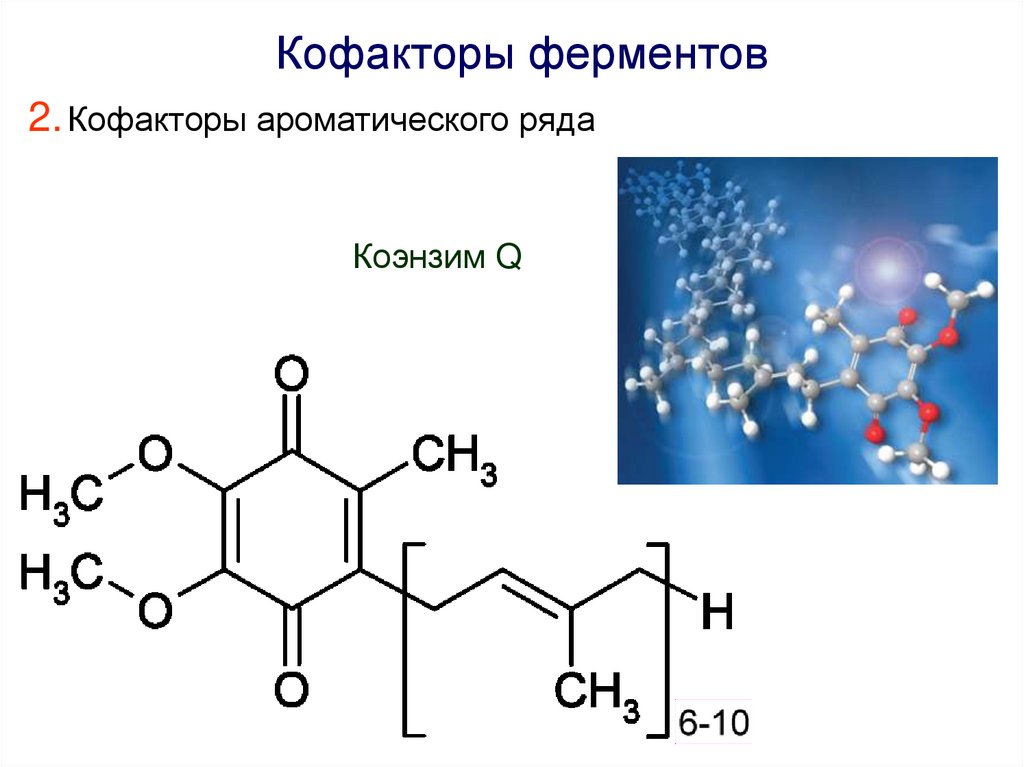
Кофакторы ферментов2. Кофакторы ароматического ряда
Коэнзим Q
12.
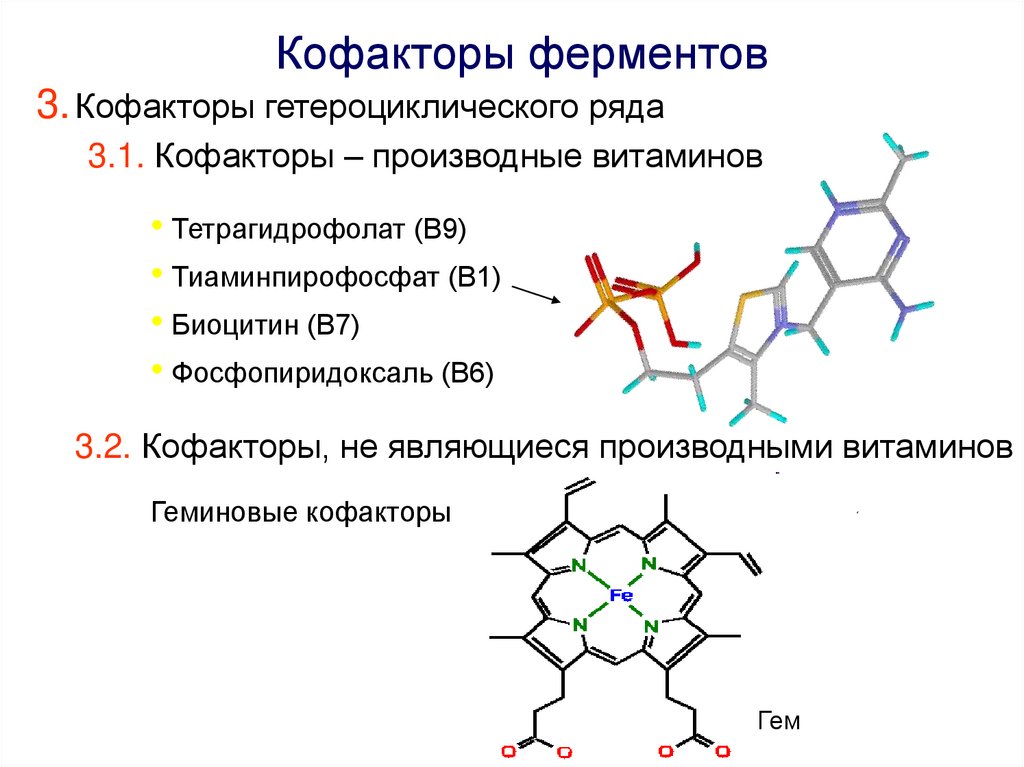
Кофакторы ферментов3. Кофакторы гетероциклического ряда
3.1. Кофакторы – производные витаминов
• Тетрагидрофолат (В9)
• Тиаминпирофосфат (В1)
• Биоцитин (В7)
• Фосфопиридоксаль (В6)
3.2. Кофакторы, не являющиеся производными витаминов
Геминовые кофакторы
Гем
13.
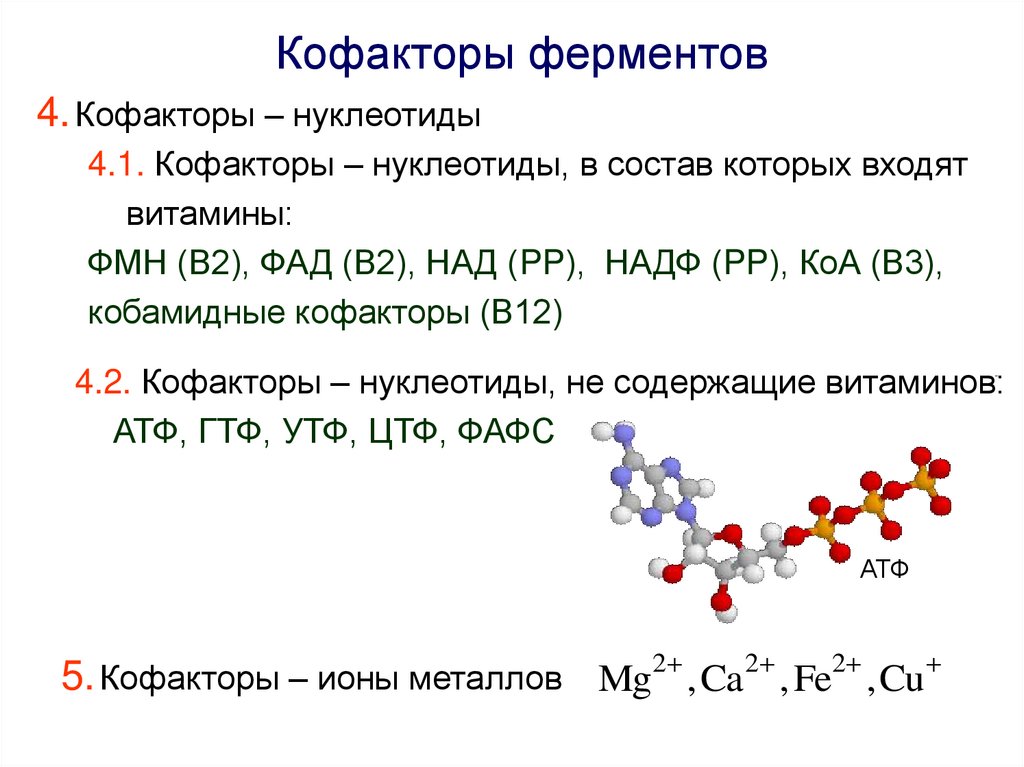
Кофакторы ферментов4. Кофакторы – нуклеотиды
4.1. Кофакторы – нуклеотиды, в состав которых входят
витамины:
ФМН (В2), ФАД (В2), НАД (PP), НАДФ (PP), КоА (В3),
кобамидные кофакторы (В12)
4.2. Кофакторы – нуклеотиды, не содержащие витаминов:
АТФ, ГТФ, УТФ, ЦТФ, ФАФС
АТФ
2
2
2
5. Кофакторы – ионы металлов Mg ,Ca , Fe ,Cu
14.
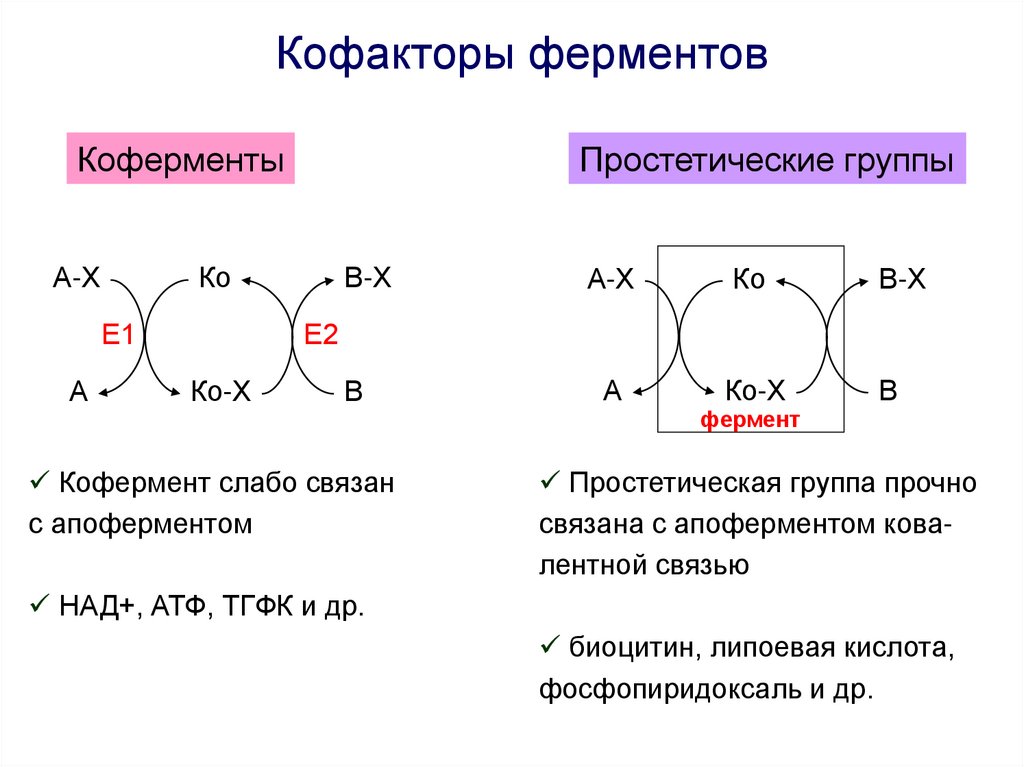
Кофакторы ферментовКоферменты
А-Х
Ко
Е1
А
Простетические группы
В-Х
А-Х
Ко
В-Х
А
Ко-Х
В
Е2
Ко-Х
В
Кофермент слабо связан
с апоферментом
фермент
Простетическая группа прочно
связана с апоферментом ковалентной связью
НАД+, АТФ, ТГФК и др.
биоцитин, липоевая кислота,
фосфопиридоксаль и др.
15.
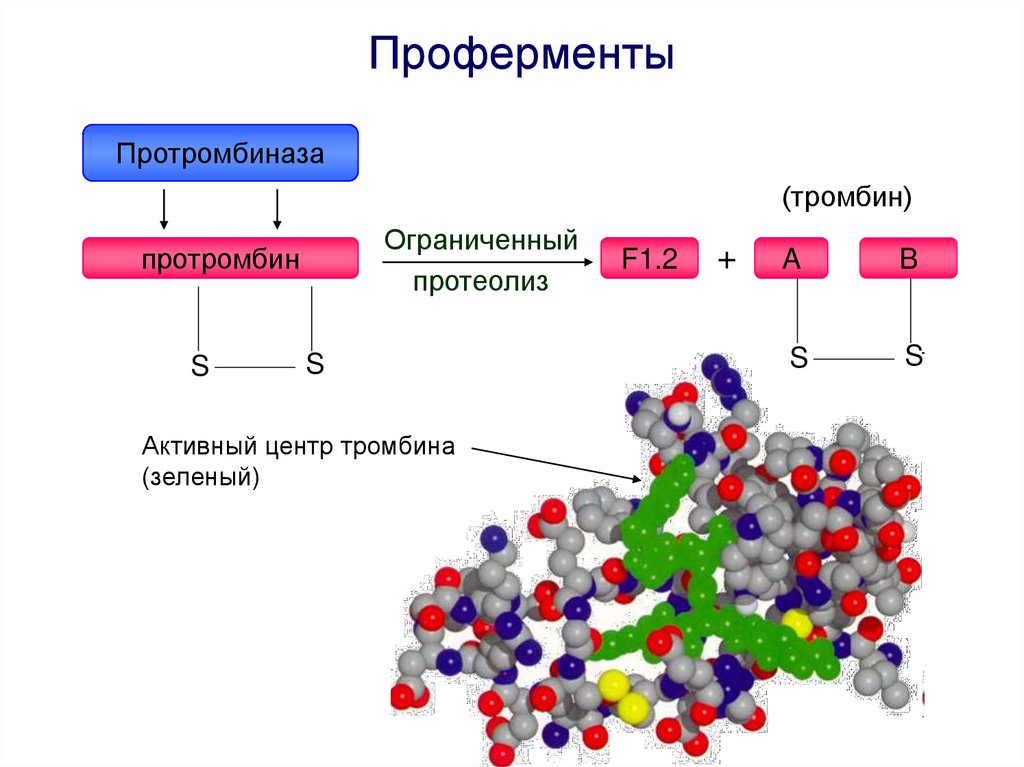
ПроферментыПротромбиназа
(тромбин)
Ограниченный
протеолиз
протромбин
S
S
Активный центр тромбина
(зеленый)
F1.2
+
A
B
S
S
16.
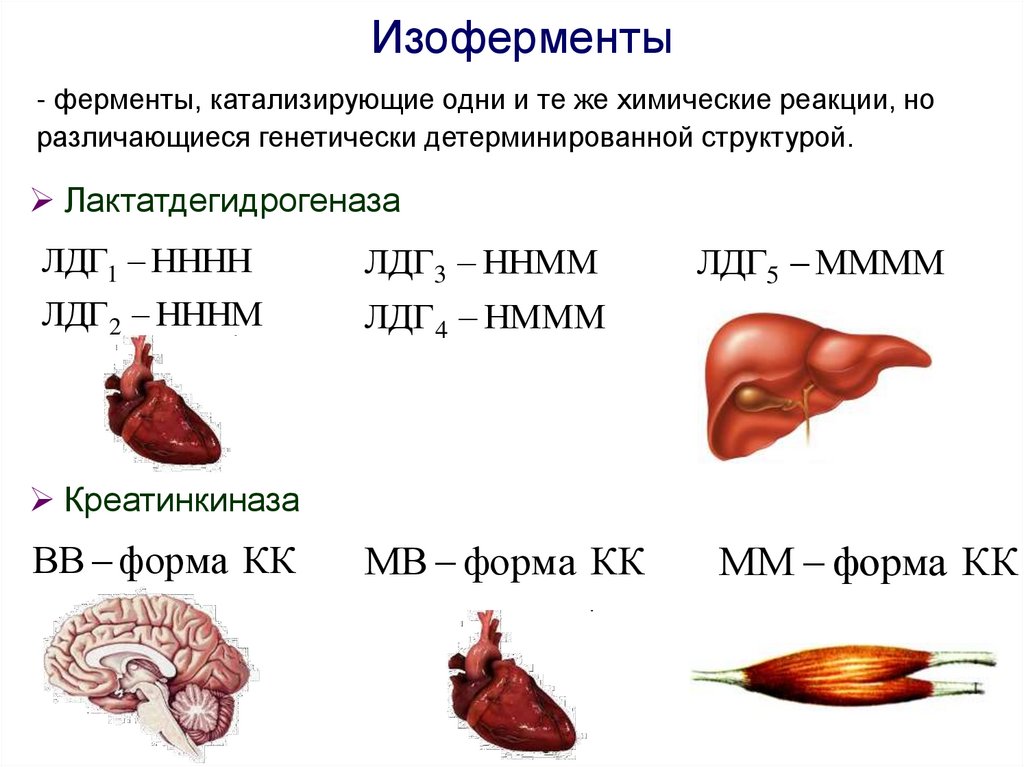
Изоферменты- ферменты, катализирующие одни и те же химические реакции, но
различающиеся генетически детерминированной структурой.
Лактатдегидрогеназа
ЛДГ1 НННН
ЛДГ3 ННММ
ЛДГ 2 НННМ
ЛДГ4 НМММ
ЛДГ5 ММММ
Креатинкиназа
ВВ форма КК
МВ форма КК
ММ форма КК
17. Реакция с участием фермента
E S E S E P E PE – фермент
S – субстрат
P – продукт реакции
ES и EP – нестабильные комплексы фермента с
субстратом и с продуктом реакции.
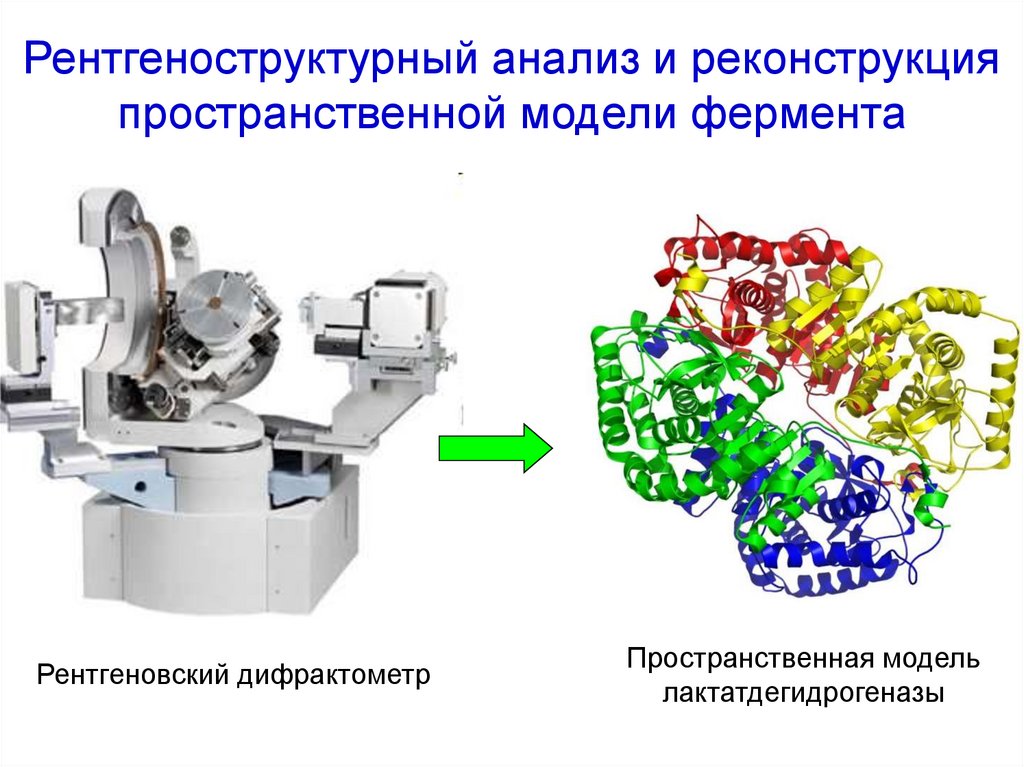
18. Рентгеноструктурный анализ и реконструкция пространственной модели фермента
Рентгеновский дифрактометрПространственная модель
лактатдегидрогеназы
19. Функциональные центры ферментов
1. Активный центрсубстратный центр
каталитический центр
2. Регуляторные центры
аллостерический центр
центр ковалентной модификации
центр белок-белкового взаимодействия
3. Контактные площадки
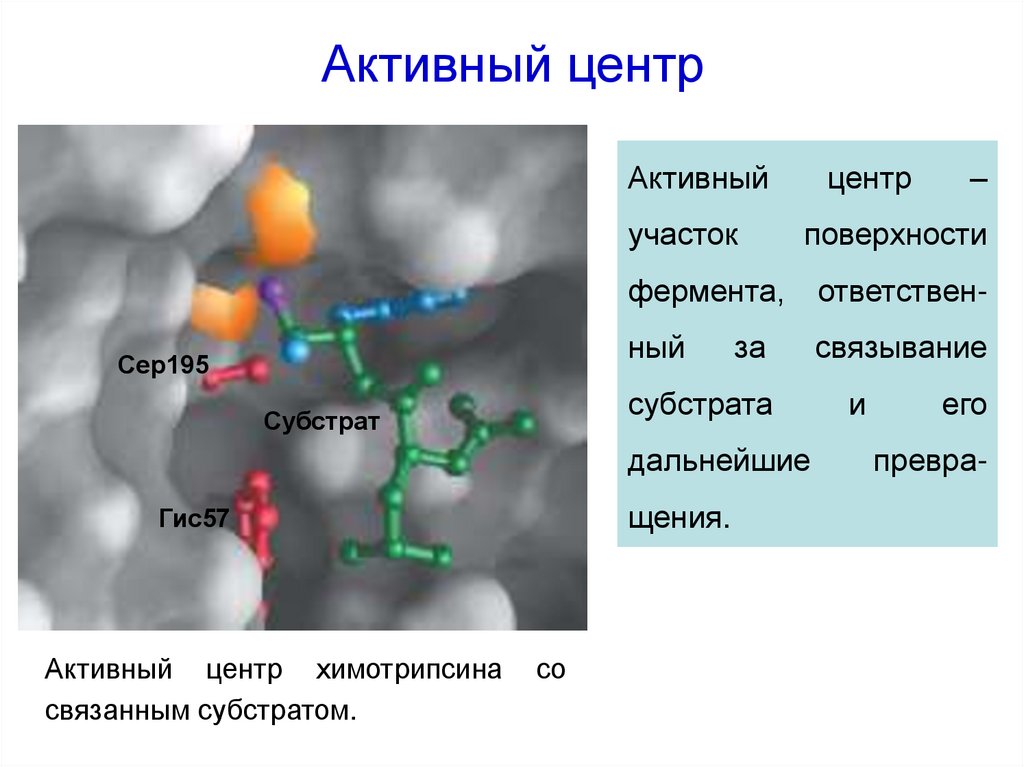
20. Активный центр
Активныйучасток
Сер195
центр
поверхности
фермента,
ответствен-
ный
связывание
за
субстрата
Субстрат
дальнейшие
щения.
Гис57
Активный центр химотрипсина
связанным субстратом.
со
–
и
его
превра-
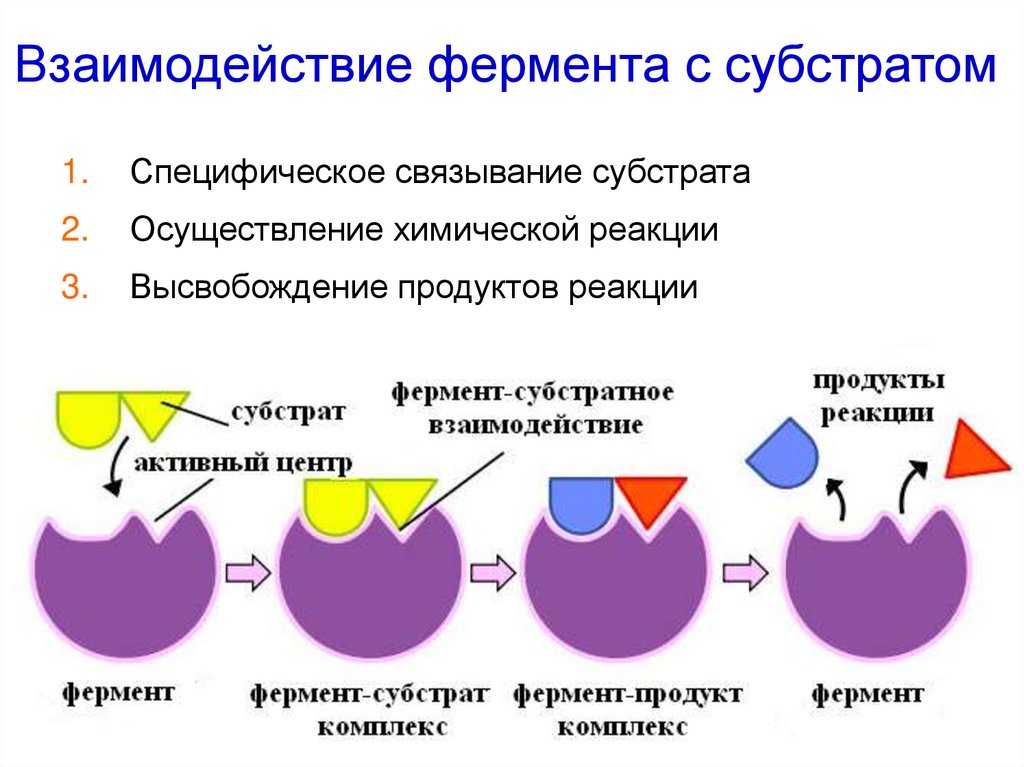
21. Взаимодействие фермента с субстратом
1.Специфическое связывание субстрата
2.
Осуществление химической реакции
3.
Высвобождение продуктов реакции
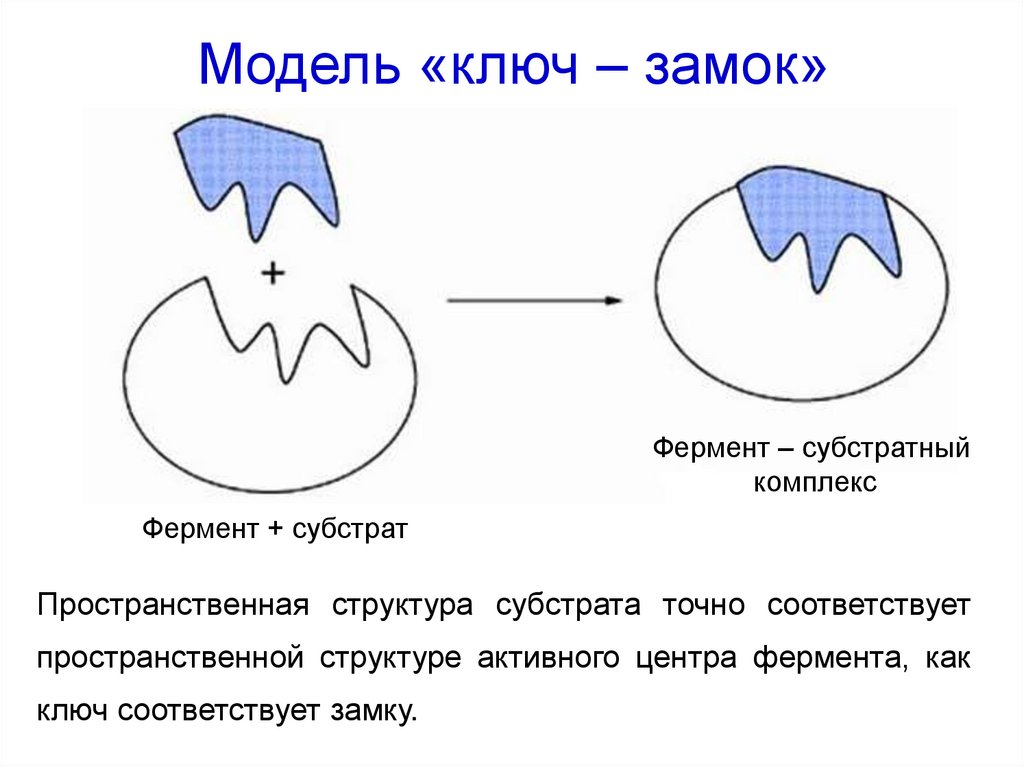
22. Модель «ключ – замок»
Фермент – субстратныйкомплекс
Фермент + субстрат
Пространственная структура субстрата точно соответствует
пространственной структуре активного центра фермента, как
ключ соответствует замку.
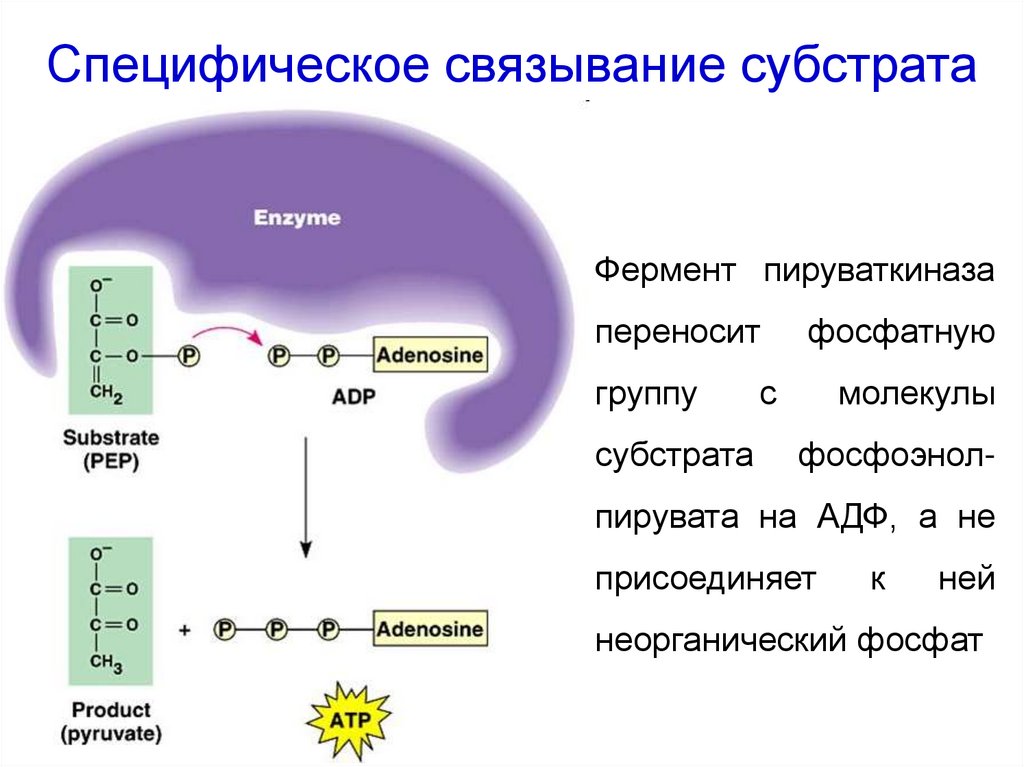
23. Специфическое связывание субстрата
Фермент пируваткиназапереносит
группу
субстрата
фосфатную
с
молекулы
фосфоэнол-
пирувата на АДФ, а не
присоединяет
к
ней
неорганический фосфат
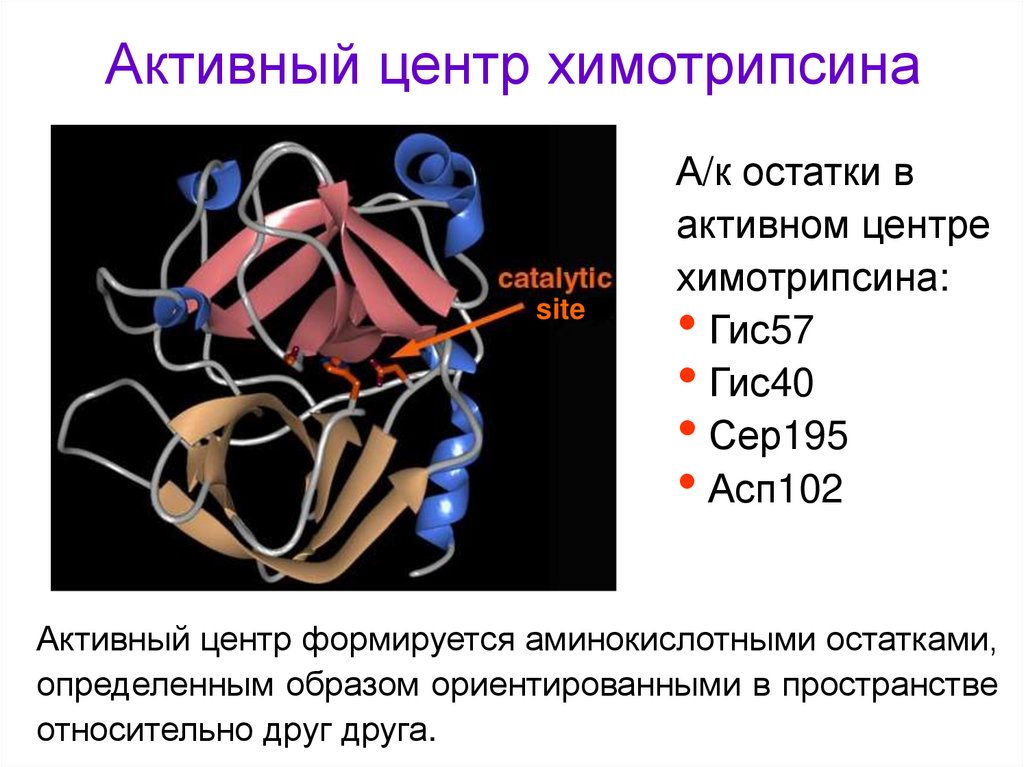
24. Активный центр химотрипсина
siteА/к остатки в
активном центре
химотрипсина:
• Гис57
• Гис40
• Сер195
• Асп102
Активный центр формируется аминокислотными остатками,
определенным образом ориентированными в пространстве
относительно друг друга.
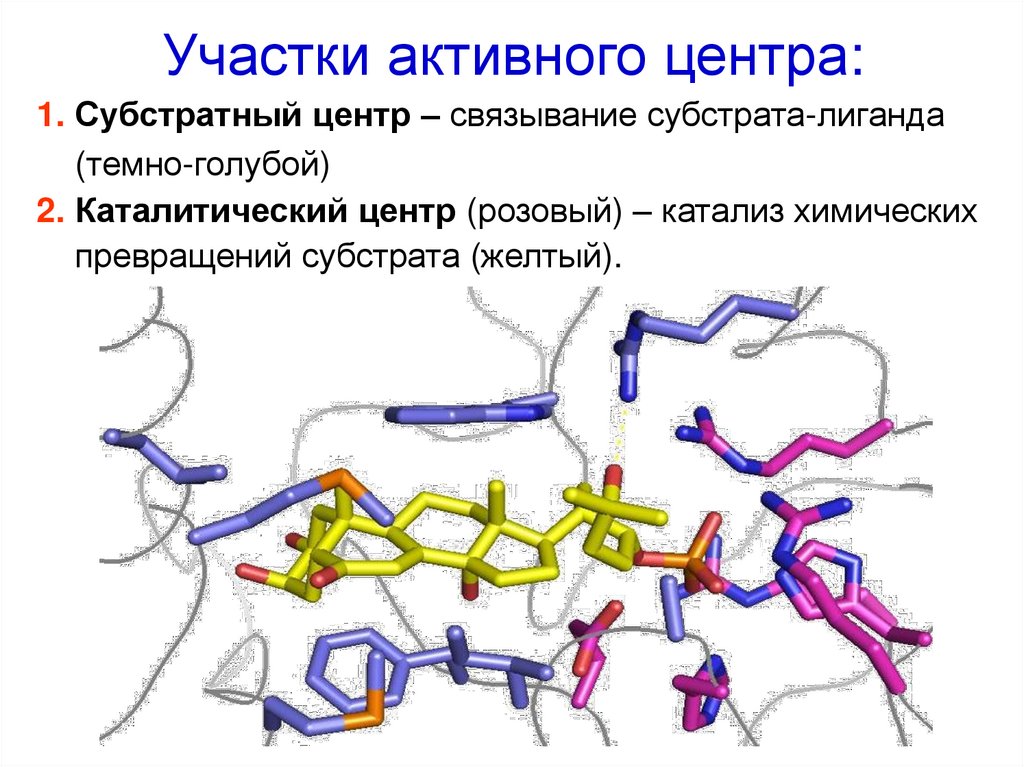
25. Участки активного центра:
1. Субстратный центр – связывание субстрата-лиганда(темно-голубой)
2. Каталитический центр (розовый) – катализ химических
превращений субстрата (желтый).
26. Функциональные группы, играющие важную роль в связывании субстрата и катализе
1. Функциональные группы аминокислотных остатков:a) гидроксильная b) тиоловая c) карбоксильная d) аминогруппа
группа
группа
группа
Сер – OH
Тир – OH
Тре – OH
Cys – SH
Глу – COOH Лиз – NH2
Асп – COOH Арг – NH2
2. Группировки остова полипептидной цепи:
– CO
и
– NH –
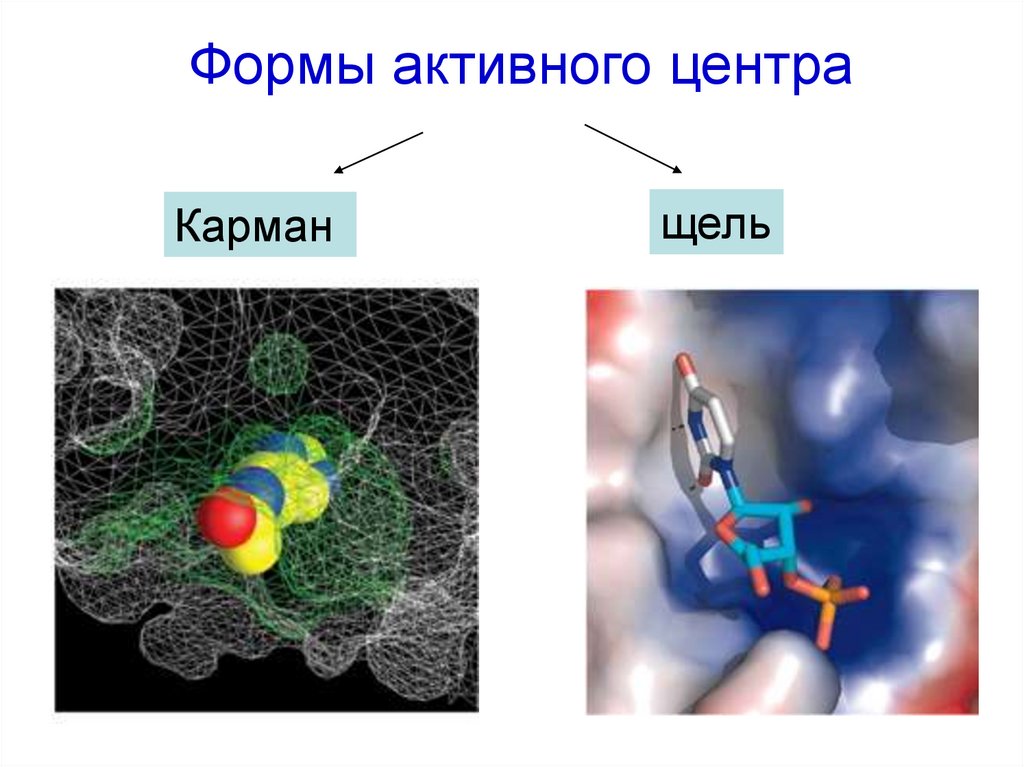
27. Формы активного центра
Карманщель
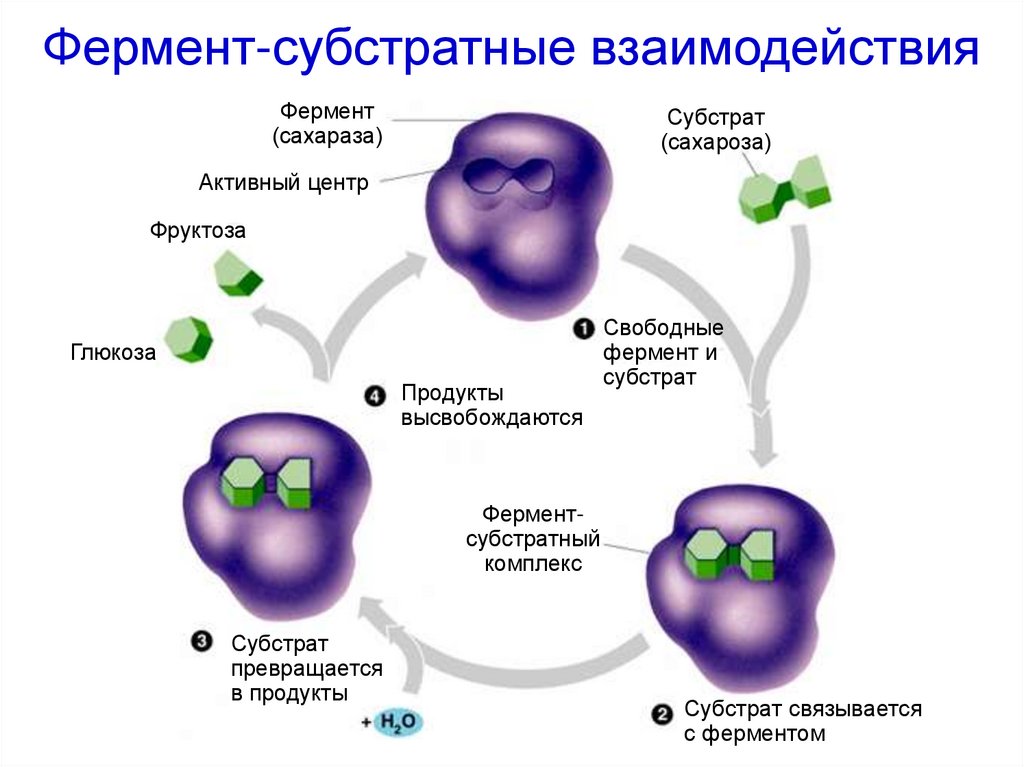
28. Фермент-субстратные взаимодействия
Фермент(сахараза)
Субстрат
(сахароза)
Активный центр
Фруктоза
Глюкоза
Продукты
высвобождаются
Свободные
фермент и
субстрат
Ферментсубстратный
комплекс
Субстрат
превращается
в продукты
Субстрат связывается
с ферментом
29.
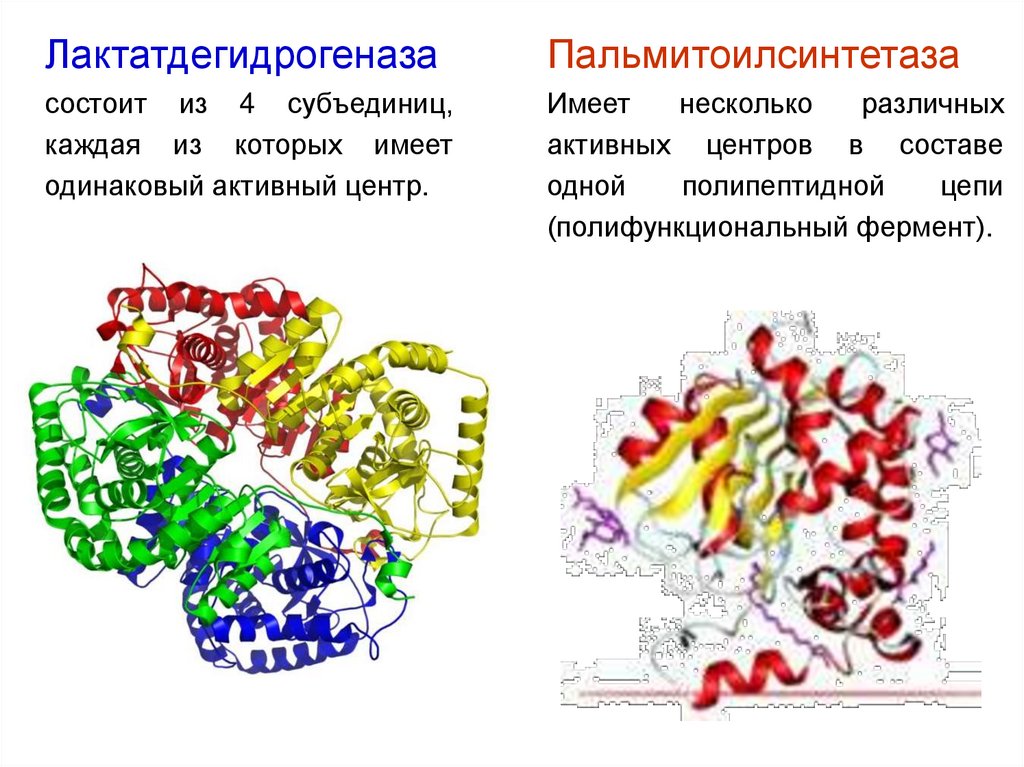
ЛактатдегидрогеназаПальмитоилсинтетаза
состоит из 4 субъединиц,
каждая из которых имеет
одинаковый активный центр.
Имеет
несколько
различных
активных центров в составе
одной
полипептидной
цепи
(полифункциональный фермент).
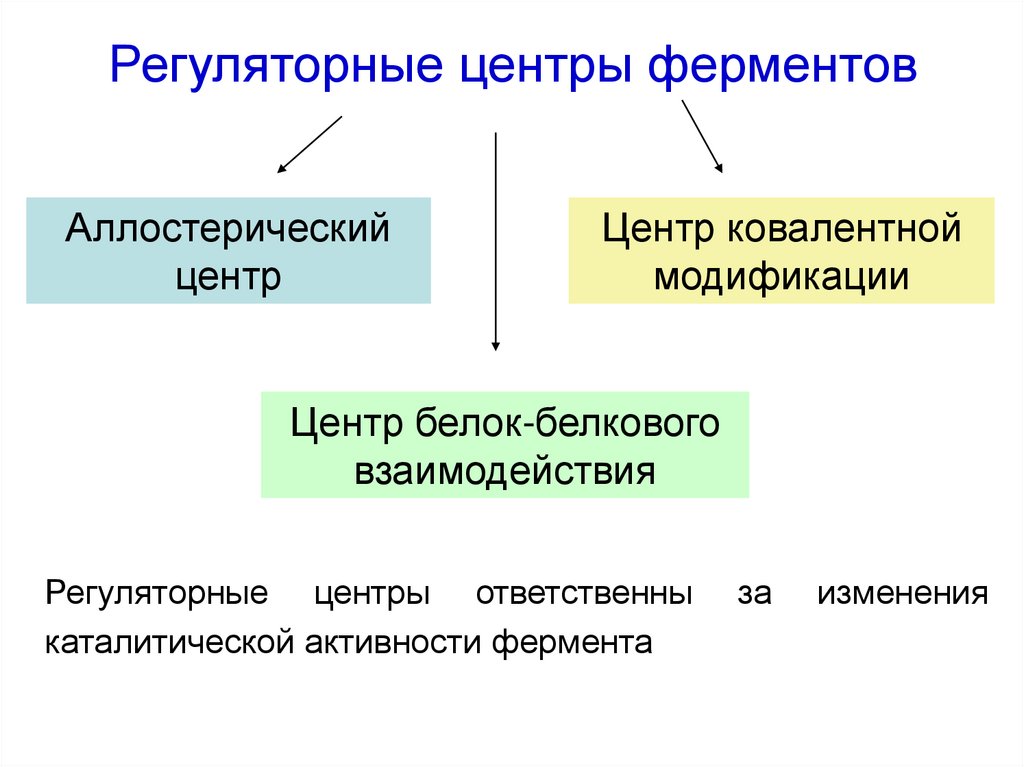
30. Регуляторные центры ферментов
Аллостерическийцентр
Центр ковалентной
модификации
Центр белок-белкового
взаимодействия
Регуляторные центры ответственны
каталитической активности фермента
за
изменения
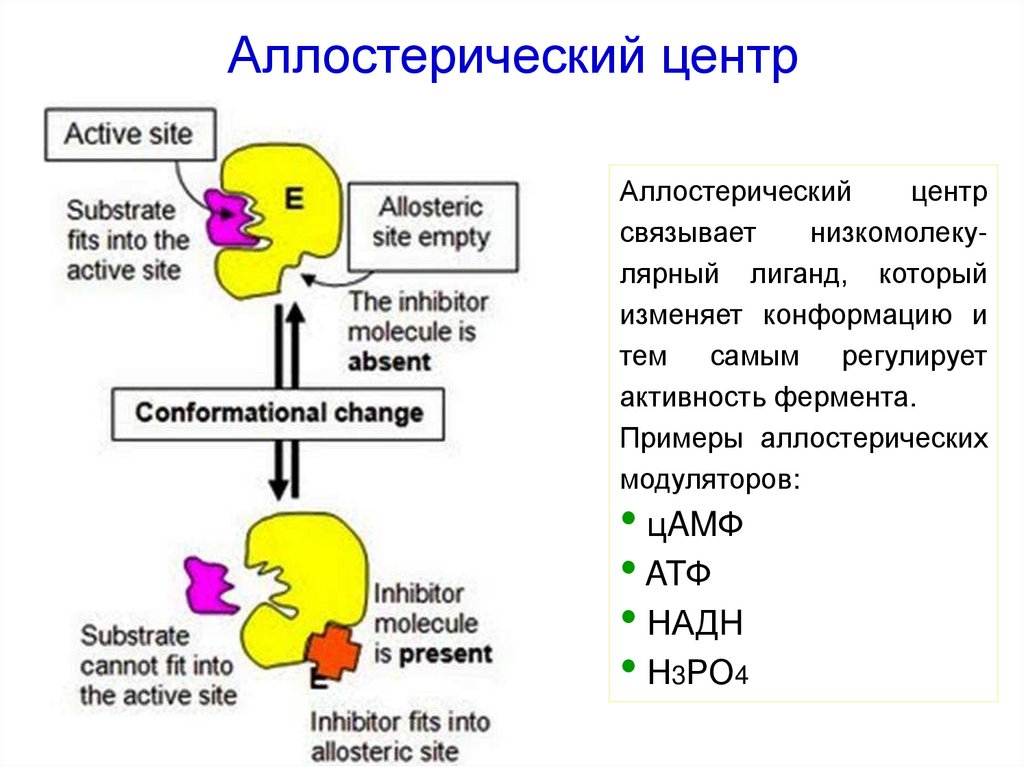
31. Аллостерический центр
Аллостерическийцентр
связывает
низкомолекулярный лиганд, который
изменяет конформацию и
тем самым регулирует
активность фермента.
Примеры аллостерических
модуляторов:
• цAMФ
• ATФ
• НАДH
• Н3РО4
32. Аллостерические модуляторы
• Аллостерическийактиватор – повышает
каталитическую активность фермента.
Аллостерический ингибитор – снижает
каталитическую активность фермента.
Фосфофруктокиназа
Фруктозо6-фосфат
Фруктозо1,6-бифосфат
ATФ
AДФ
Аллостерические
ингибиторы:
• ATФ
• Цитрат
Аллостерический
активатор:
AДФ
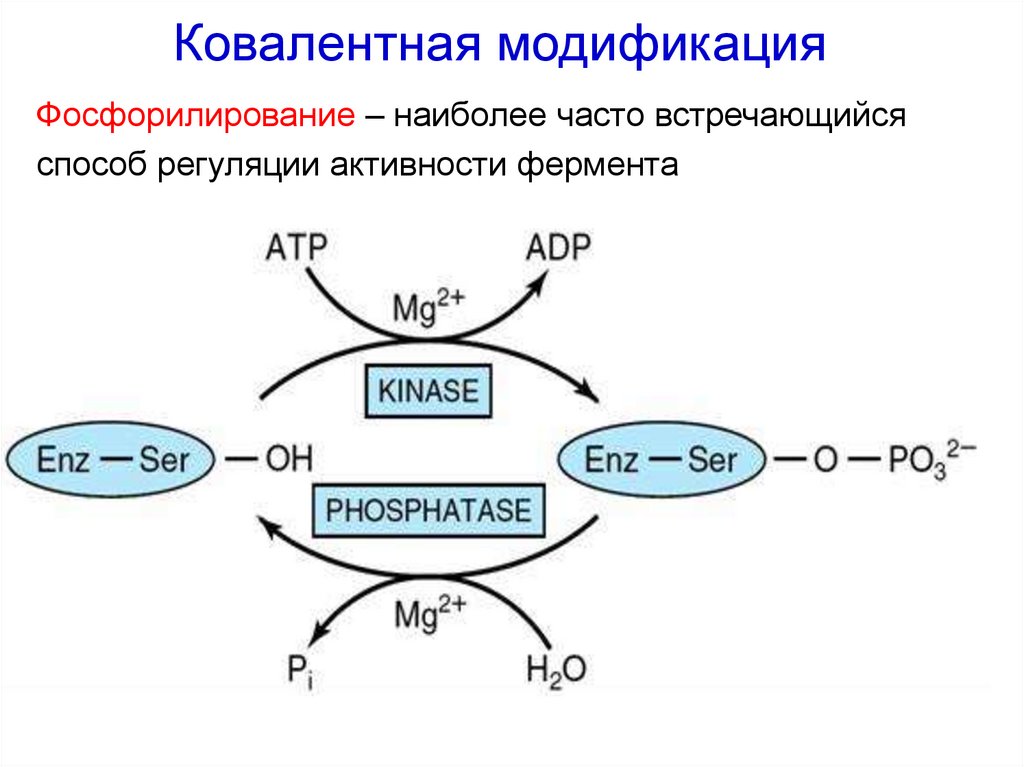
33. Ковалентная модификация
Фосфорилирование – наиболее часто встречающийсяспособ регуляции активности фермента
34. Центр белок-белкового взаимодейсвия
Регуляторный центр, в котором белок-регулятор (красный,A) взаимодействует с ферментом (зеленый, B).
Например, белок-модулятор кальмодулин может взаимодействовать с
различными ферментами, такими как киназа фосфорилазы в миоцитах
или фосфодиэстераза в клетках головного мозга.
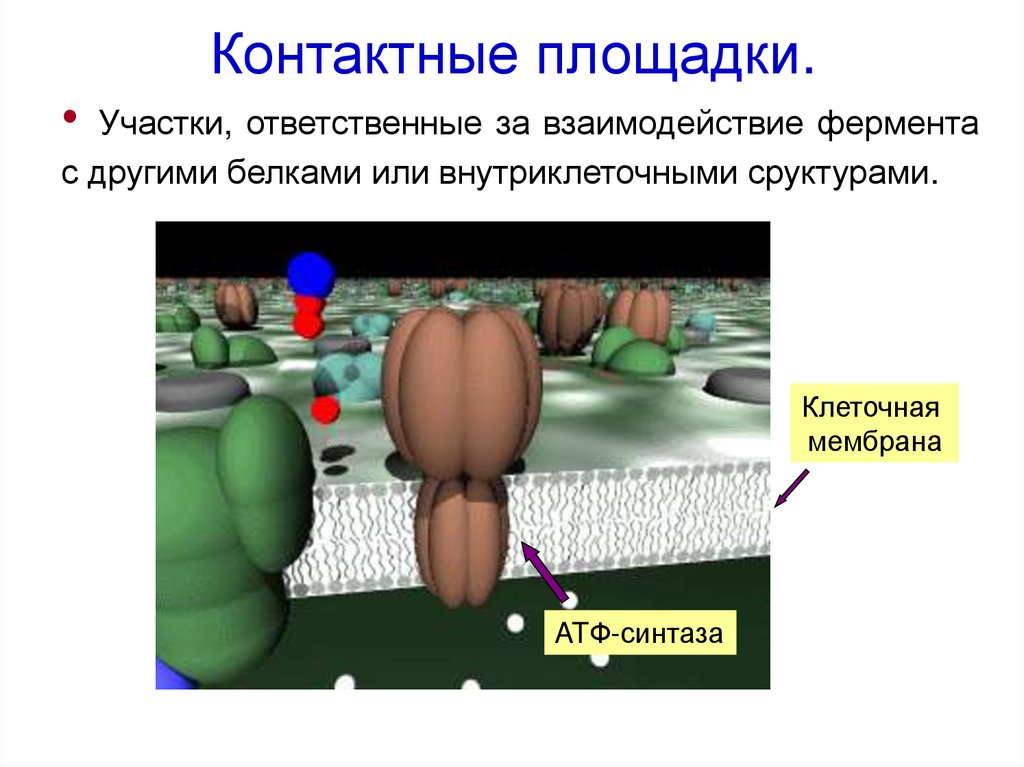
35. Контактные площадки.
Участки, ответственные за взаимодействие фермента
с другими белками или внутриклеточными сруктурами.
Клеточная
мембрана
ATФ-синтаза
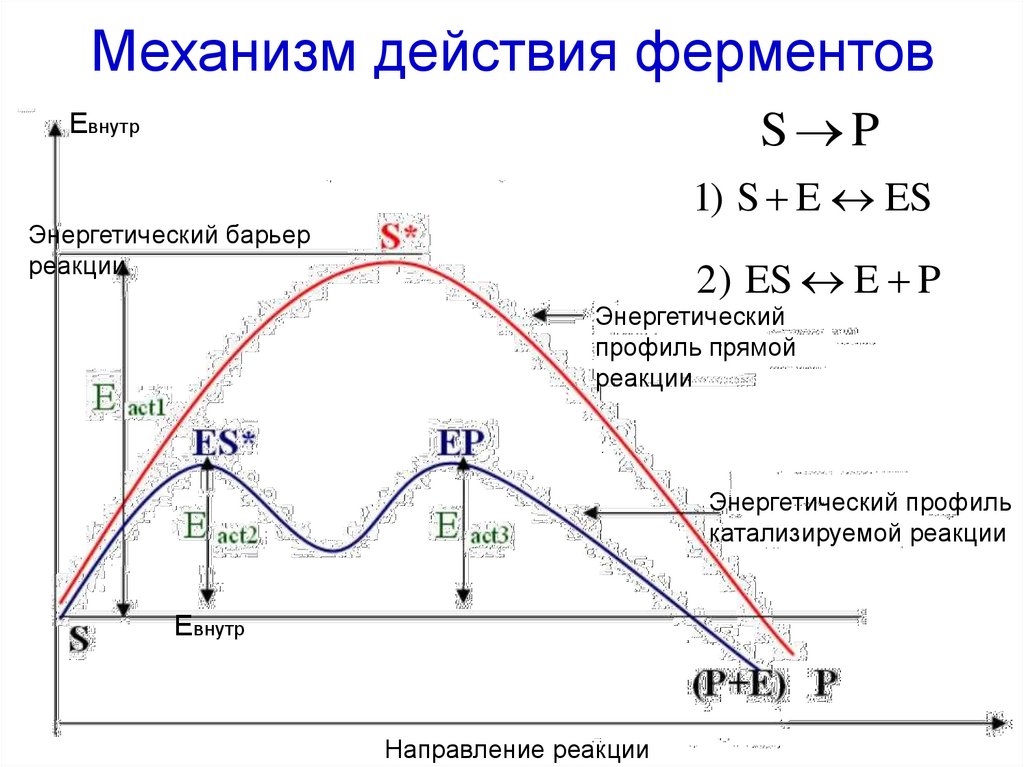
36. Механизм действия ферментов
S PЕвнутр
1) S E ES
Энергетический барьер
реакции
2) ES E P
Энергетический
профиль прямой
реакции
Энергетический профиль
катализируемой реакции
Евнутр
Направление реакции
37. Ферменты – наиболее эффективные катализаторы
Энергия активациисахароза H 2 O
глюкоза фруктоза 32ккал / моль
H
сахароза H 2 O
глюкоза фруктоза 25ккал / моль
сахараза
сахароза H 2 O
глюкоза фруктоза 9, 4ккал / моль
38. Каталитическая активность ферментов
Скорость ферментативной реакцииVреакци
Единица количества фермента (Е)
[S]
t
количество превращенного субстрата, мкM
X
количесво E
навеска ткани, г время инкубации, мин
Катал (СИ)
Катал – количество фермента, которое обеспечивает превращение
1 моля субстрата в 1 секунду.
9
1Е 16,67 10 катала
39. Каталитическая активность ферментов
Удельная активность ферментаnE
Удельная активность
X белка, мг
Молекулярная активность (число оборотов)
Молекулярная
активность
–
это
число
молекул
субстрата, превращаемых ферментом за 1 минуту в
расчете на 1 активный центр этого фермента.
Каталаза 5 10 молекул / мин
6
Карбоангидраза 36 10 молекул / мин
6
40. Модель Э. Фишера «ключ – замок»
СубстратФермент
Пространственная структура субстрата точно соответствует
пространственной структуре активного центра фермента, как
ключ соответствует замку.
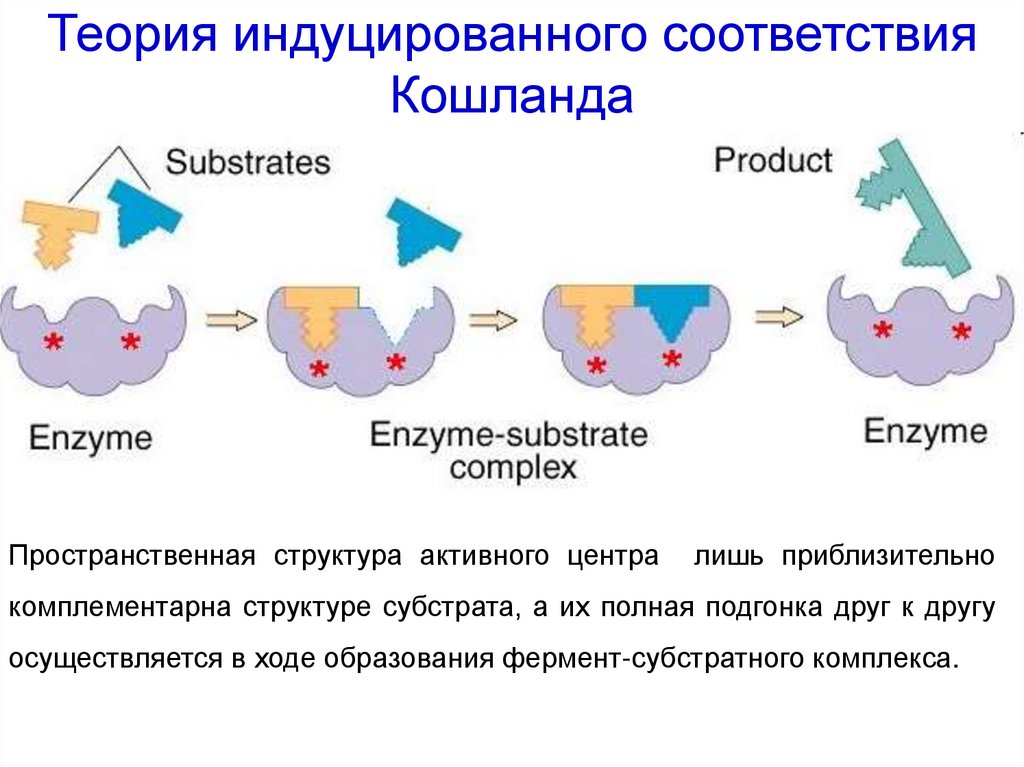
41. Теория индуцированного соответствия Кошланда
Пространственная структура активного централишь приблизительно
комплементарна структуре субстрата, а их полная подгонка друг к другу
осуществляется в ходе образования фермент-субстратного комплекса.
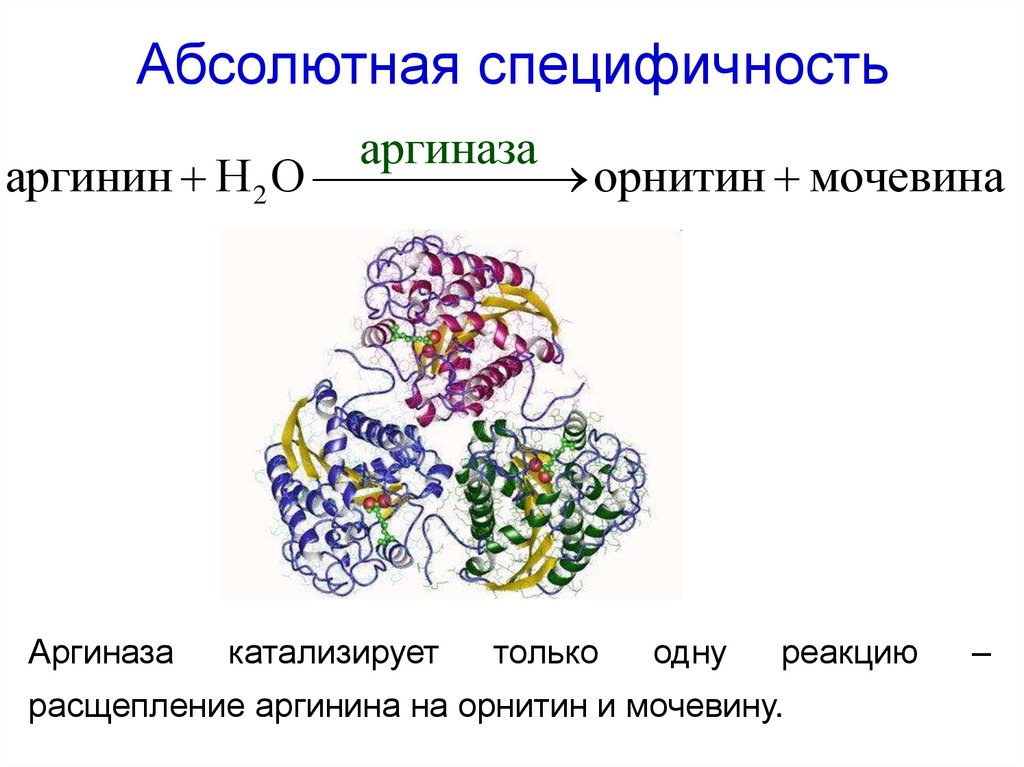
42. Абсолютная специфичность
аргиназааргинин H 2 O
орнитин мочевина
Аргиназа
катализирует
только
одну
реакцию
расщепление аргинина на орнитин и мочевину.
–
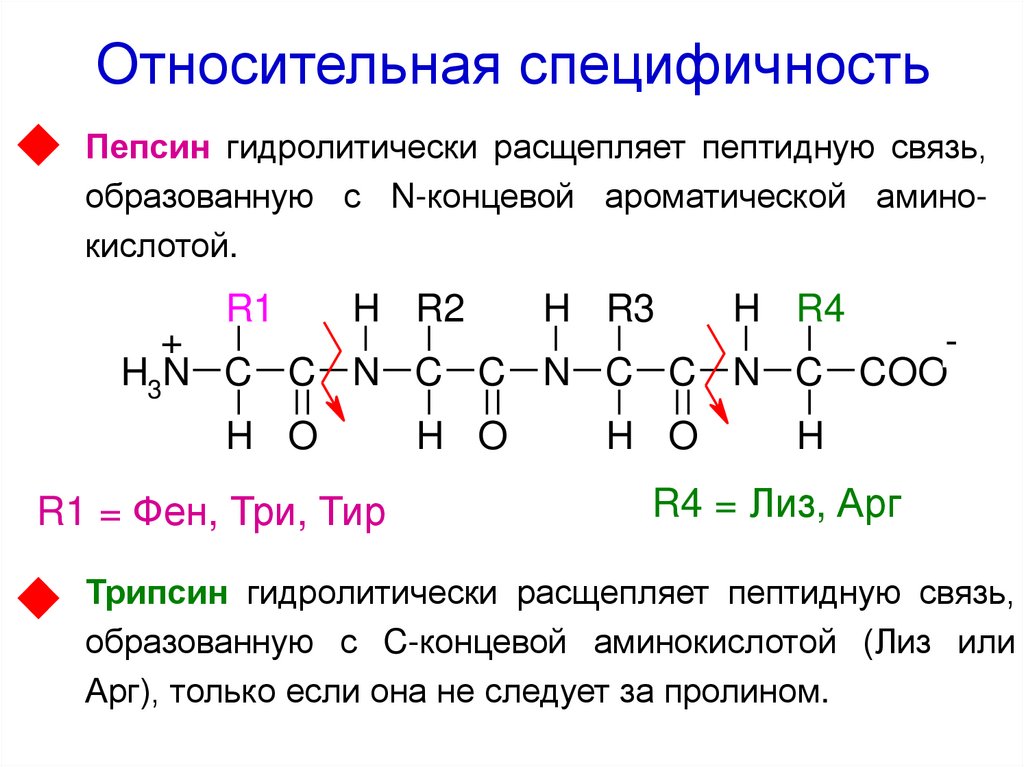
43. Относительная специфичность
Пепсин гидролитически расщепляет пептидную связь,образованную с N-концевой ароматической аминокислотой.
R1
H R2
H R3
H R4
+
H3N C C N C C N C C N C COO
H O
R1 = Фен, Три, Тир
H O
H O
H
R4 = Лиз, Арг
Трипсин гидролитически расщепляет пептидную связь,
образованную с C-концевой аминокислотой (Лиз или
Арг), только если она не следует за пролином.
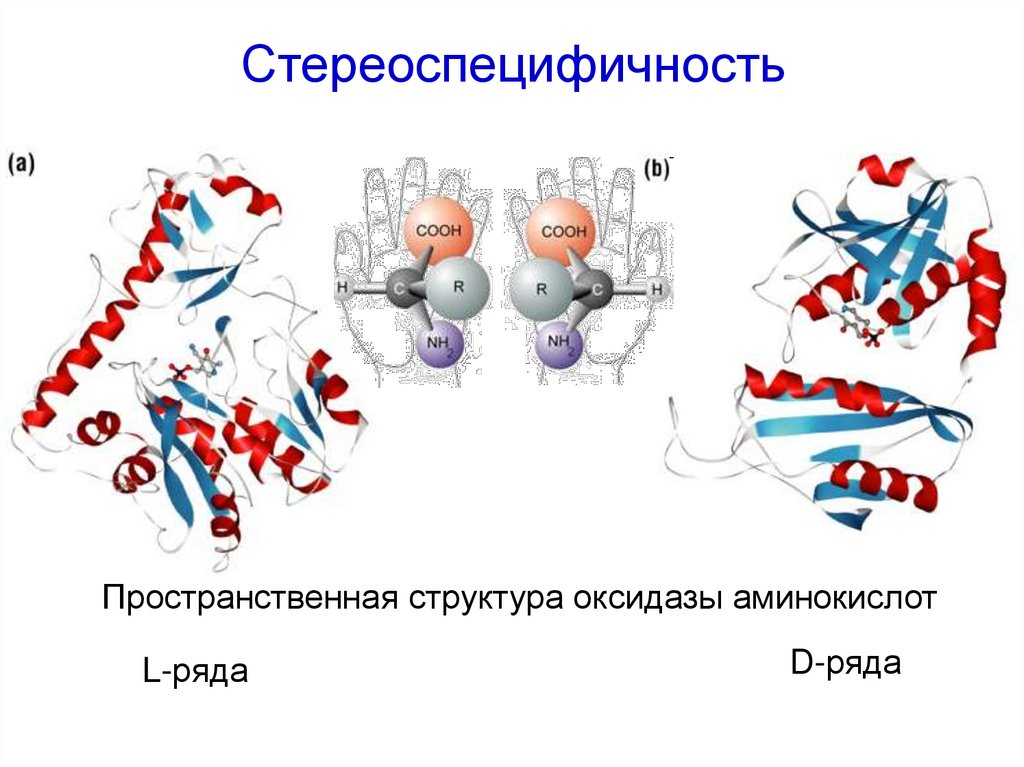
44. Стереоспецифичность
Пространственная структура оксидазы аминокислотL-ряда
D-ряда
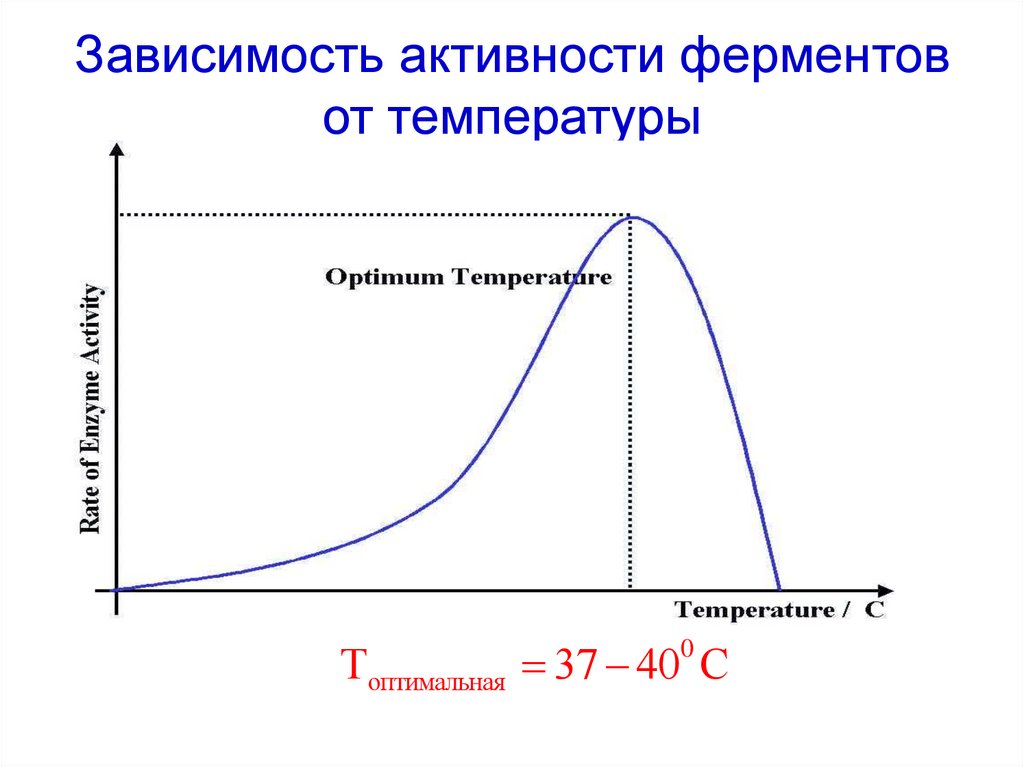
45. Зависимость активности ферментов от температуры
Топтимальная 37 40 С0
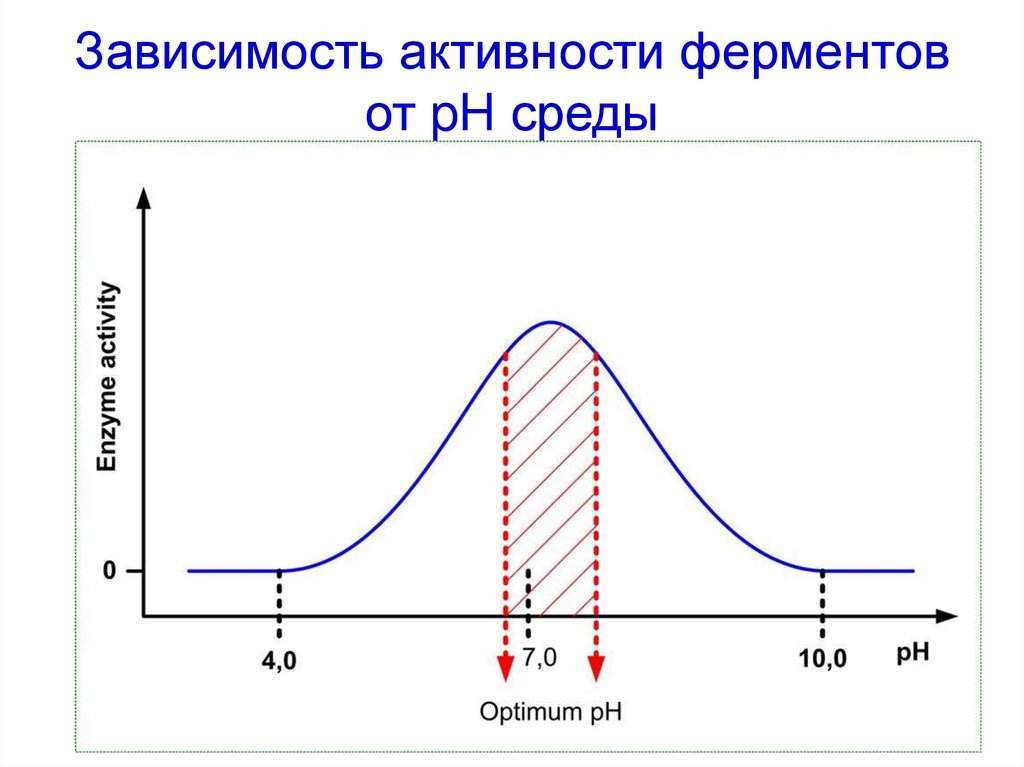
46. Зависимость активности ферментов от pH среды
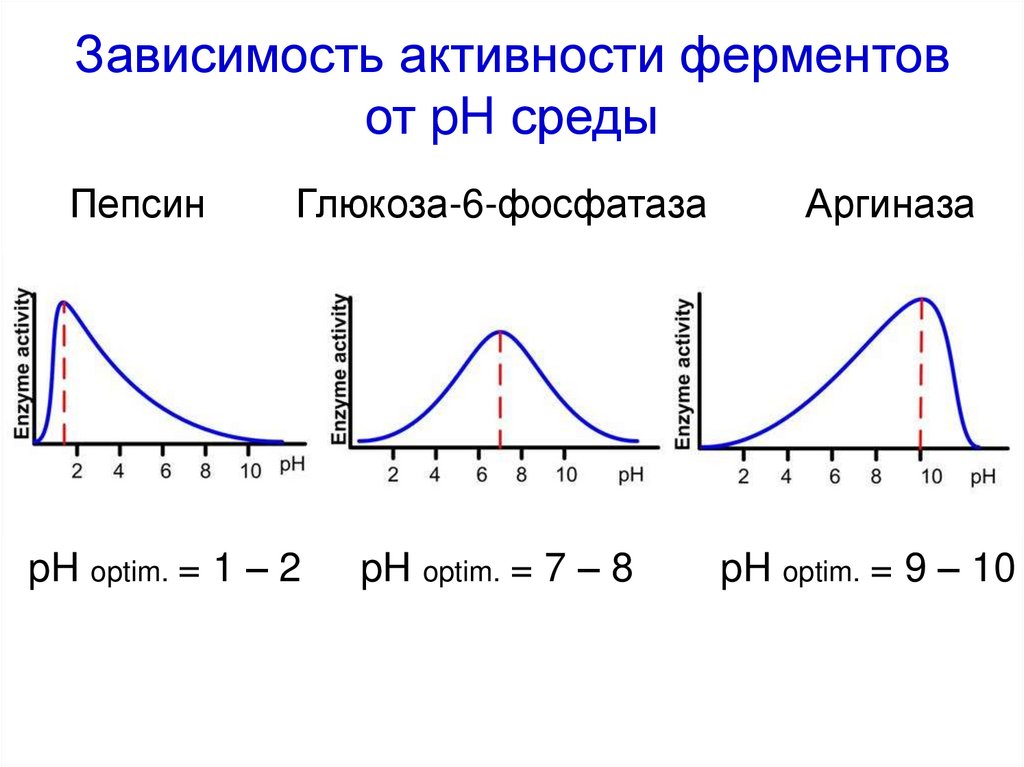
47. Зависимость активности ферментов от pH среды
ПепсинГлюкоза-6-фосфатаза
pH optim. = 1 – 2
pH optim. = 7 – 8
Аргиназа
pH optim. = 9 – 10
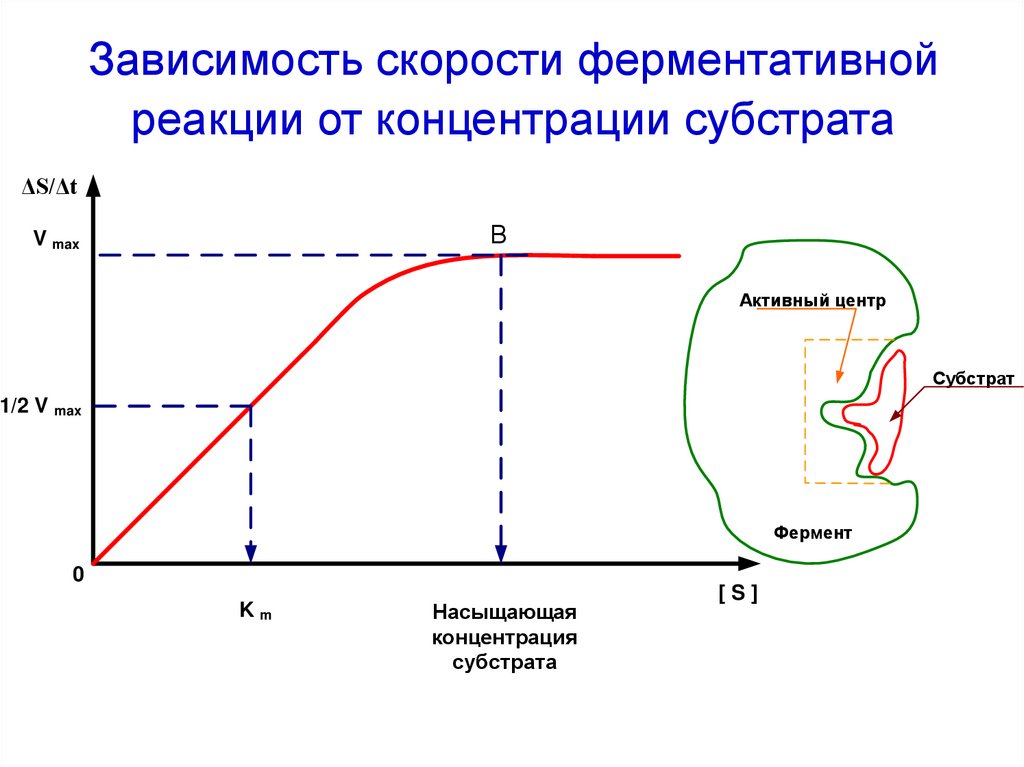
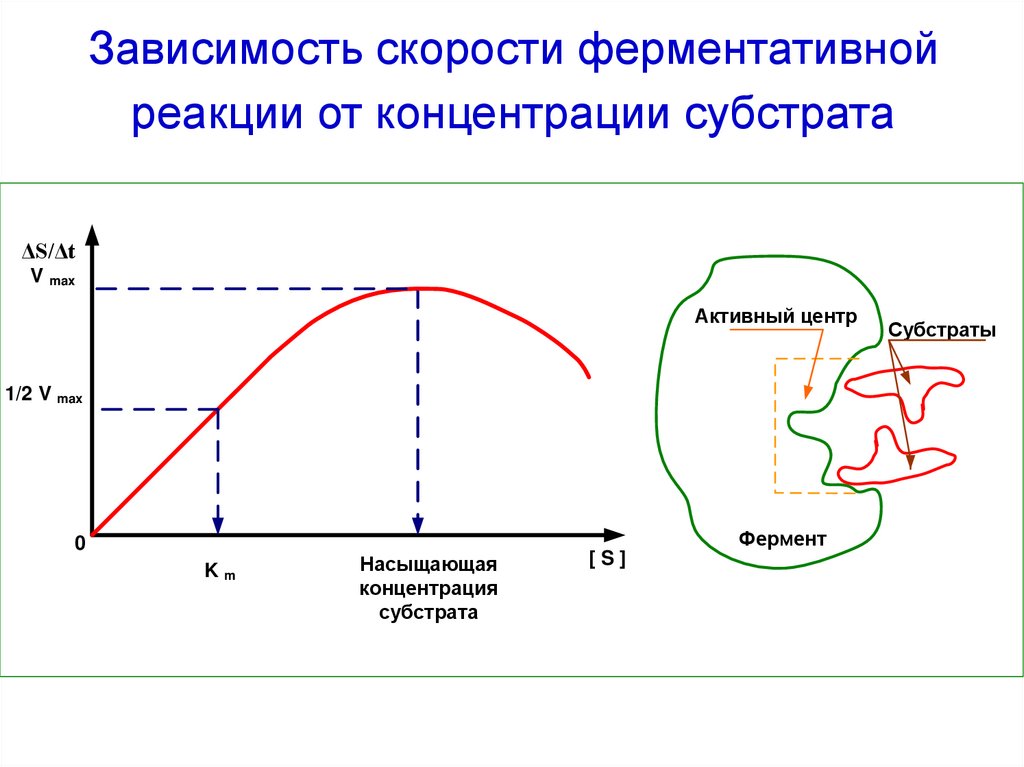
48. Зависимость скорости ферментативной реакции от концентрации субстрата
ΔS/ΔtВ
V max
Активный центр
Субстрат
1/2 V max
Фермент
0
Km
Насыщающая
концентрация
субстрата
[S]
49. Уравнение Михаэлиса-Ментен
Leonor Michaelis (1875-1949)Maud Menten (1879-1960)
Vmax [S]
V
K m [S]
Km (константа Михаэлиса) характеризует сродство фермента
к субстрату; она численно равна концентрации субстрата, при
которой скорость реакции равна половине Vmax.
50. Зависимость скорости ферментативной реакции от концентрации субстрата
ΔS/ΔtV max
Активный центр
1/2 V max
Фермент
0
Km
Насыщающая
концентрация
субстрата
[S]
Субстраты
51. Механизмы действия активаторов
Активатор может вытеснять ингибитор или отщеплять его отфермента.
Активатор может связываться с
субстратом
и
тем
самым
обеспечивать
его
более
эффективное взаимодействие с
активным центром фермента.
Например, АТФ образует комплекс с
ионами Mg 2 (зеленый).
Активатор может способствовать присоединению кофермента
к апоферменту.
Активатор может взаимодействоввать с аллостерическим
центром фермента.
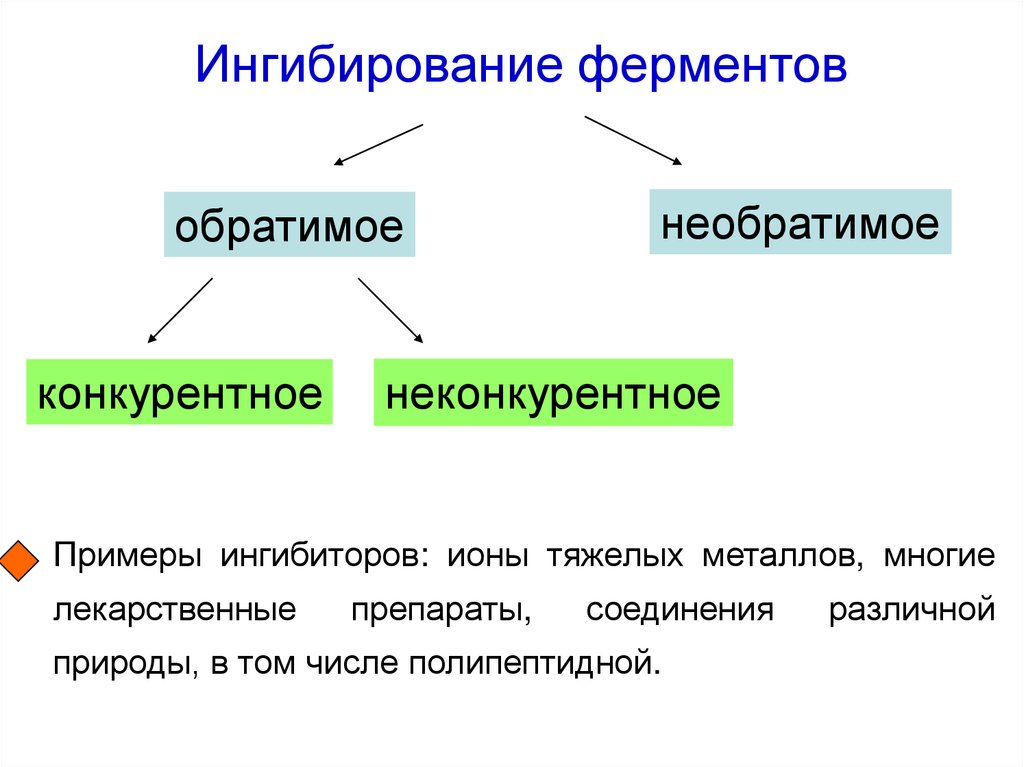
52. Ингибирование ферментов
обратимоеконкурентное
необратимое
неконкурентное
Примеры ингибиторов: ионы тяжелых металлов, многие
лекарственные
препараты,
соединения
природы, в том числе полипептидной.
различной
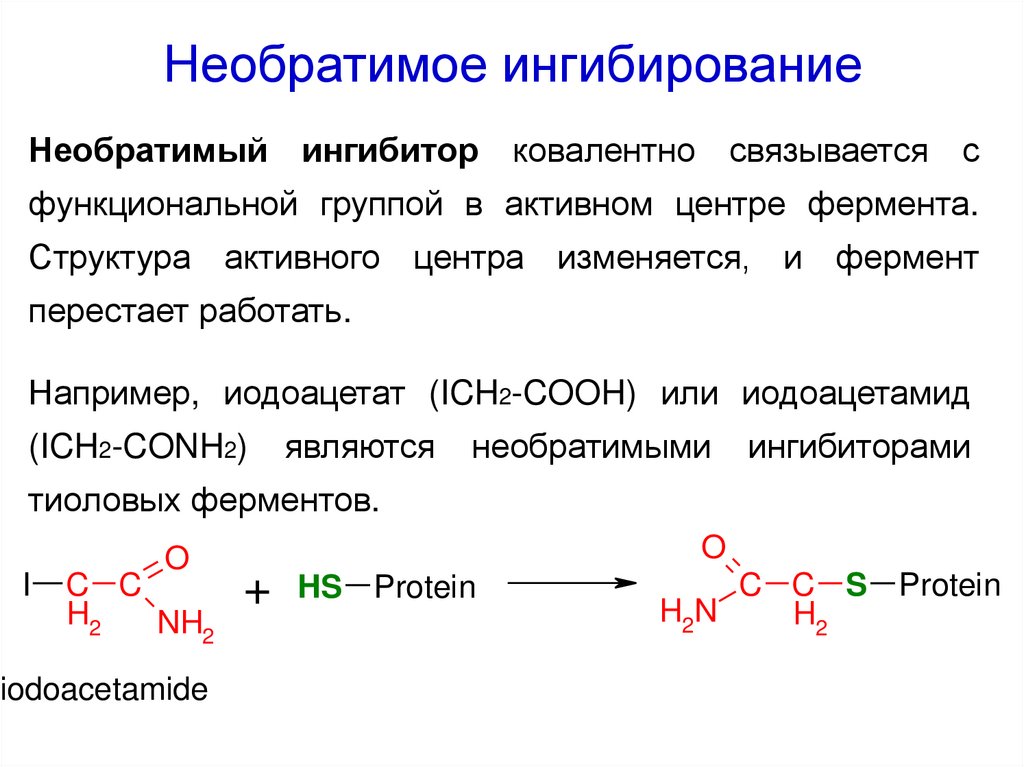
53. Необратимое ингибирование
Необратимый ингибитор ковалентно связывается сфункциональной группой в активном центре фермента.
Структура активного центра изменяется, и фермент
перестает работать.
Например, иодоацетат (ICH2-COOH) или иодоацетамид
(ICH2-CONH2)
являются
необратимыми
ингибиторами
тиоловых ферментов.
I
O
C C
H2
NH2
iodoacetamide
O
+
HS Protein
C C S Protein
H2N
H2
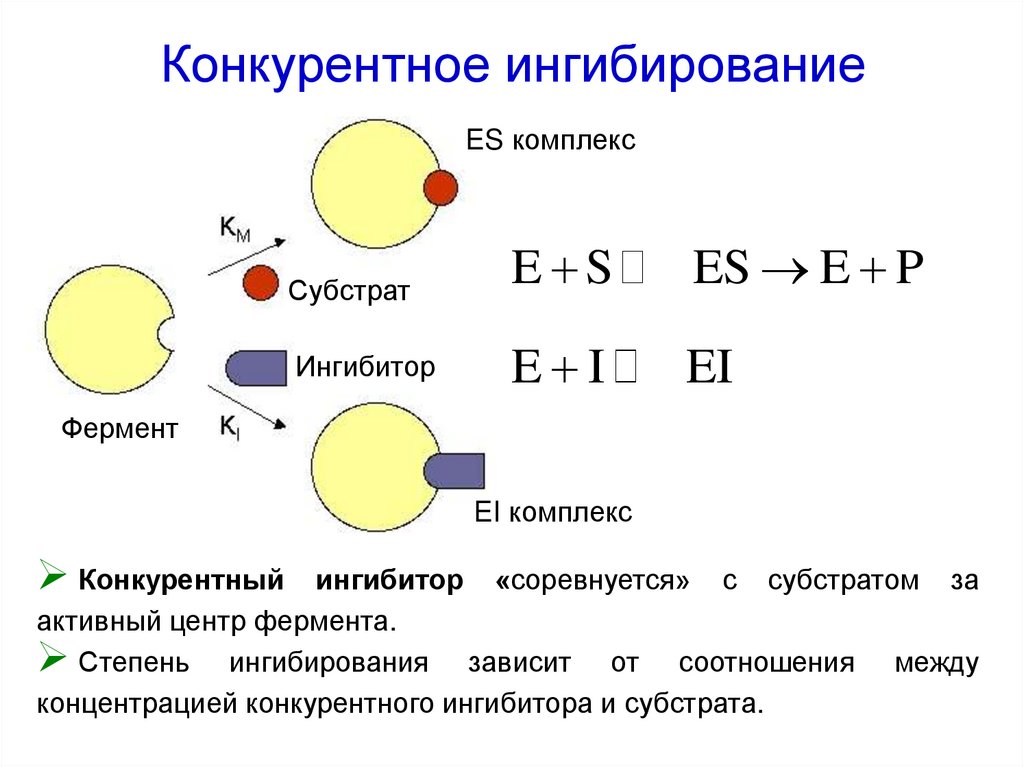
54. Конкурентное ингибирование
ES комплексСубстрат
E S
ES E P
Ингибитор
E I
EI
Фермент
EI комплекс
Конкурентный
ингибитор «соревнуется» с субстратом за
активный центр фермента.
Степень ингибирования зависит от соотношения между
концентрацией конкурентного ингибитора и субстрата.
55. Конкурентное ингибирование
COOHCOOH
CH2
CH
CH2
+
ФАД
COOH
сукцинатдегидрогеназа
CH
+
ФАДH2
COOH
фумарат
сукцинат
Конкурентные ингибиторы сукцинатдегидрогеназы:
малонат
COOH
оксалоацетат
COOH
CH2
C O
COOH
CH2
COOH
56. Неконкурентное ингибирование
ФерментES комплекс
E S ES E P
E I EI
ES I ESI
EI комплекс
ESI комплекс
Субстрат (S)
Ингибитор (I)
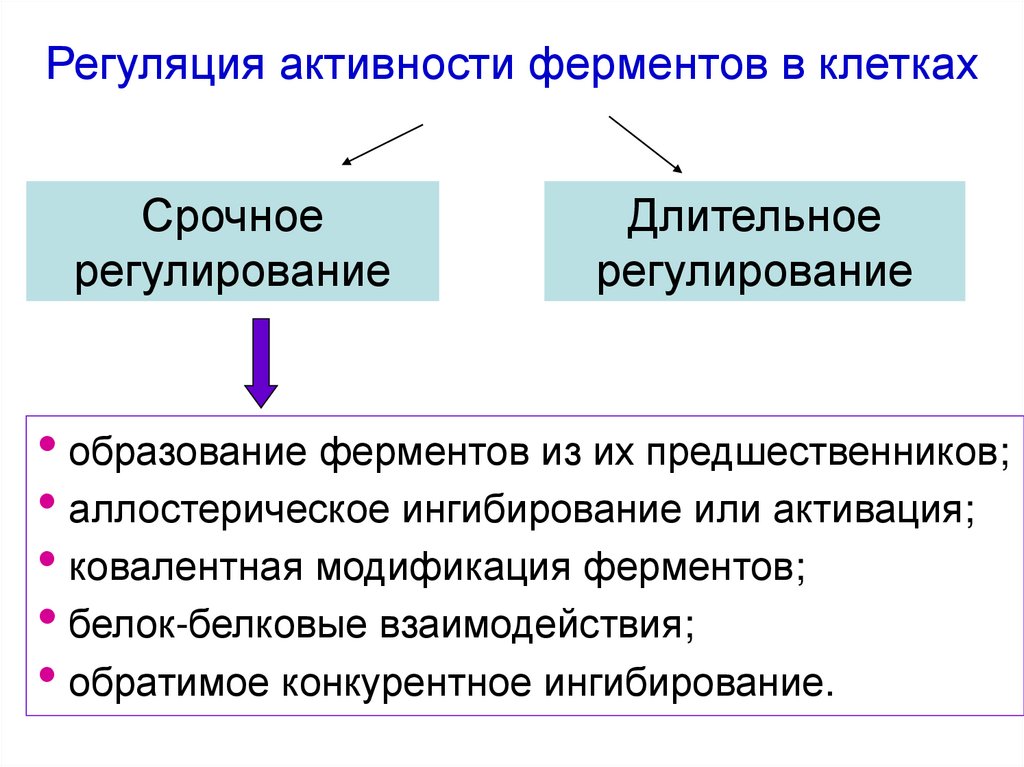
57. Регуляция активности ферментов в клетках
Срочноерегулирование
Длительное
регулирование
• образование ферментов из их предшественников;
• аллостерическое ингибирование или активация;
• ковалентная модификация ферментов;
• белок-белковые взаимодействия;
• обратимое конкурентное ингибирование.
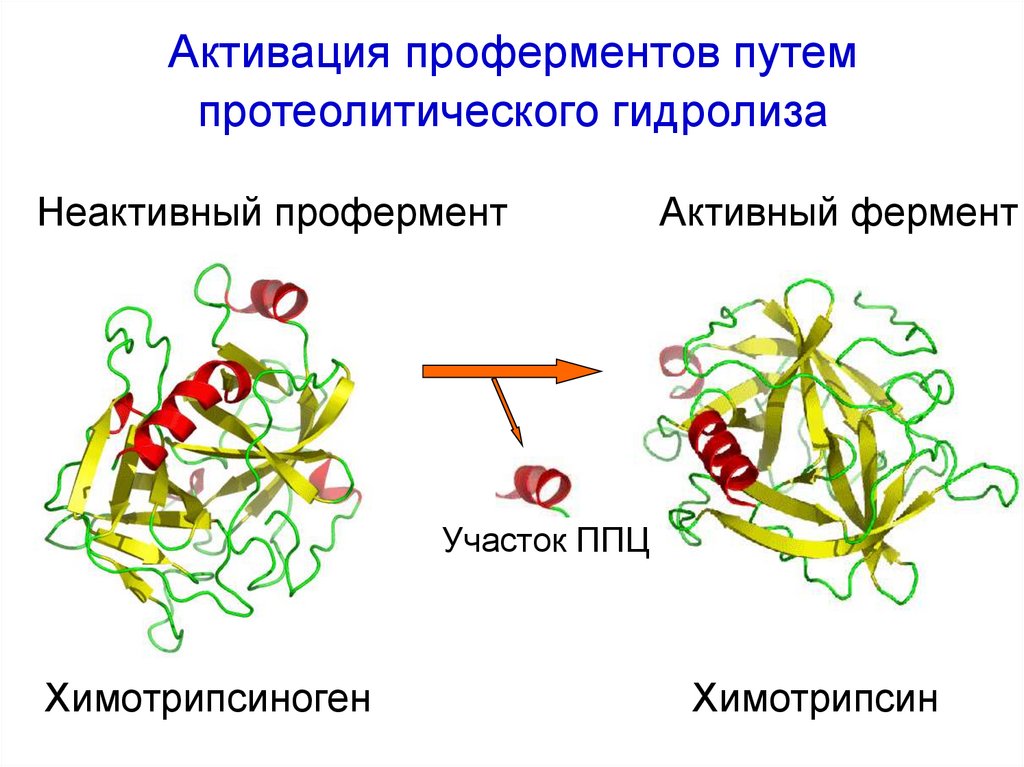
58. Активация проферментов путем протеолитического гидролиза
Неактивный проферментАктивный фермент
Участок ППЦ
Химотрипсиноген
Химотрипсин
59.
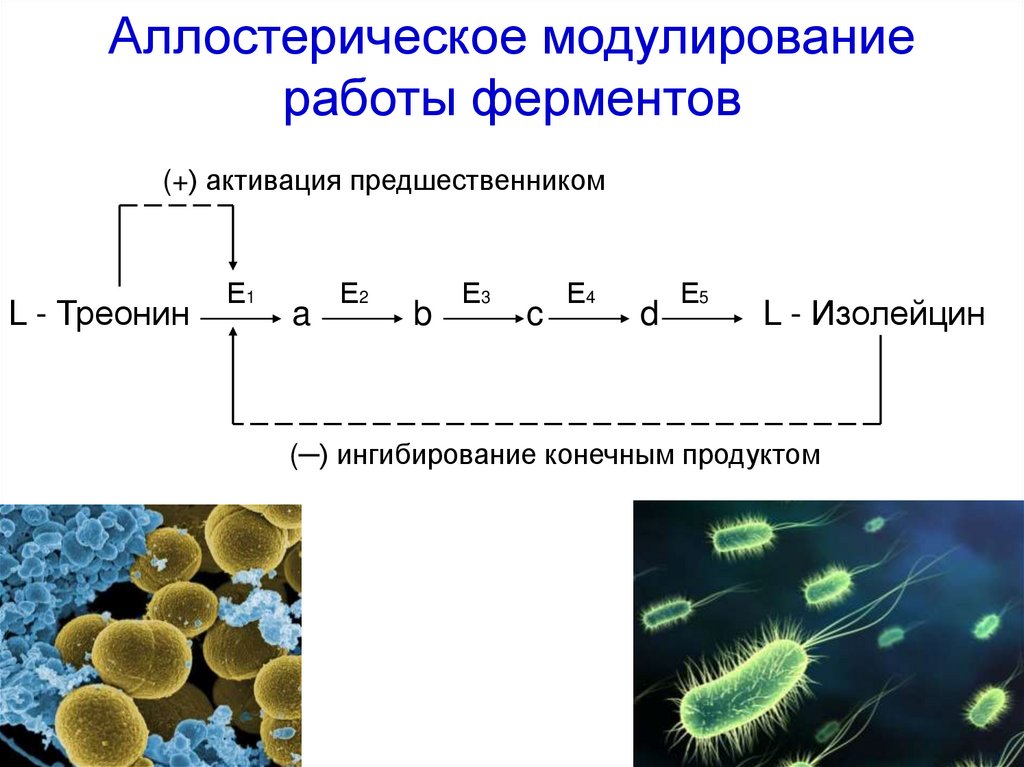
Аллостерическое модулированиеработы ферментов
(+) активация предшественником
L - Треонин
Е1
a
Е2
b
Е3
c
Е4
d
Е5
L - Изолейцин
(─) ингибирование конечным продуктом
60.
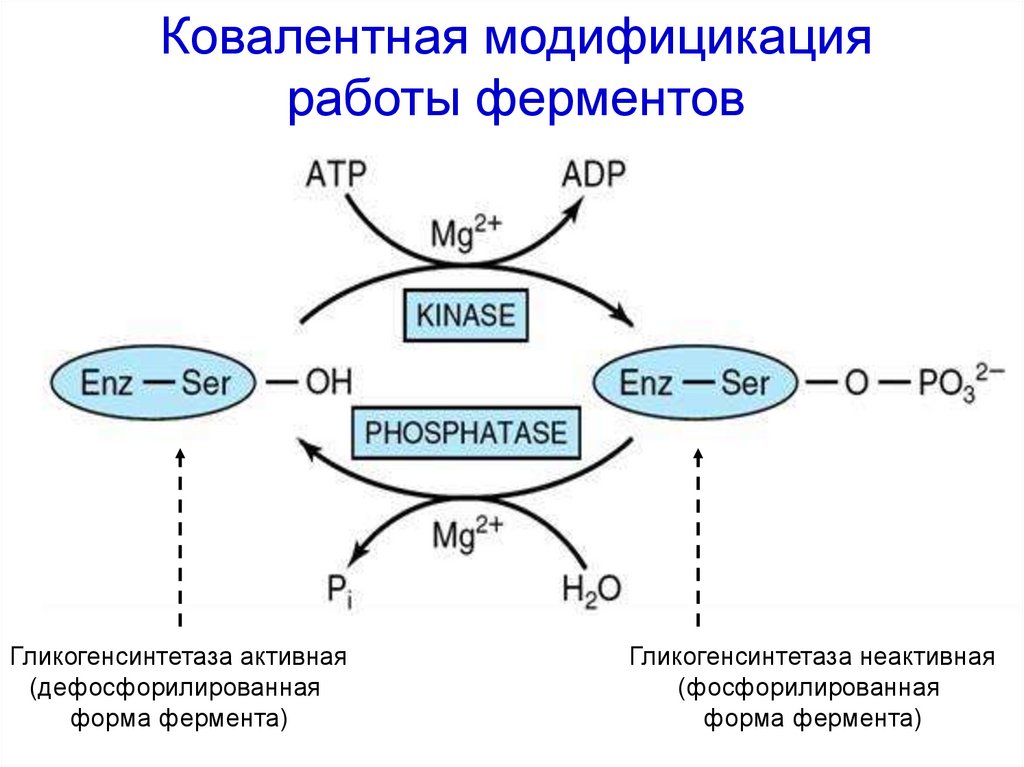
Ковалентная модифицикацияработы ферментов
Гликогенсинтетаза активная
(дефосфорилированная
форма фермента)
Гликогенсинтетаза неактивная
(фосфорилированная
форма фермента)
61.
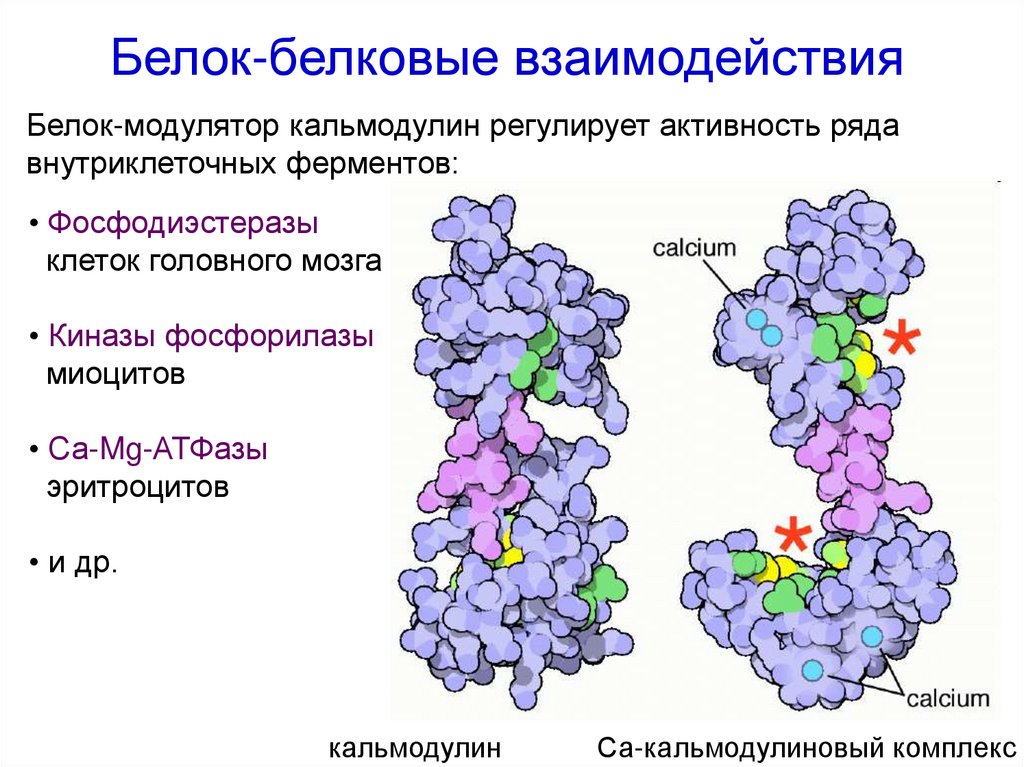
Белок-белковые взаимодействияБелок-модулятор кальмодулин регулирует активность ряда
внутриклеточных ферментов:
• Фосфодиэстеразы
клеток головного мозга
• Киназы фосфорилазы
миоцитов
• Са-Mg-АТФазы
эритроцитов
• и др.
кальмодулин
Са-кальмодулиновый комплекс
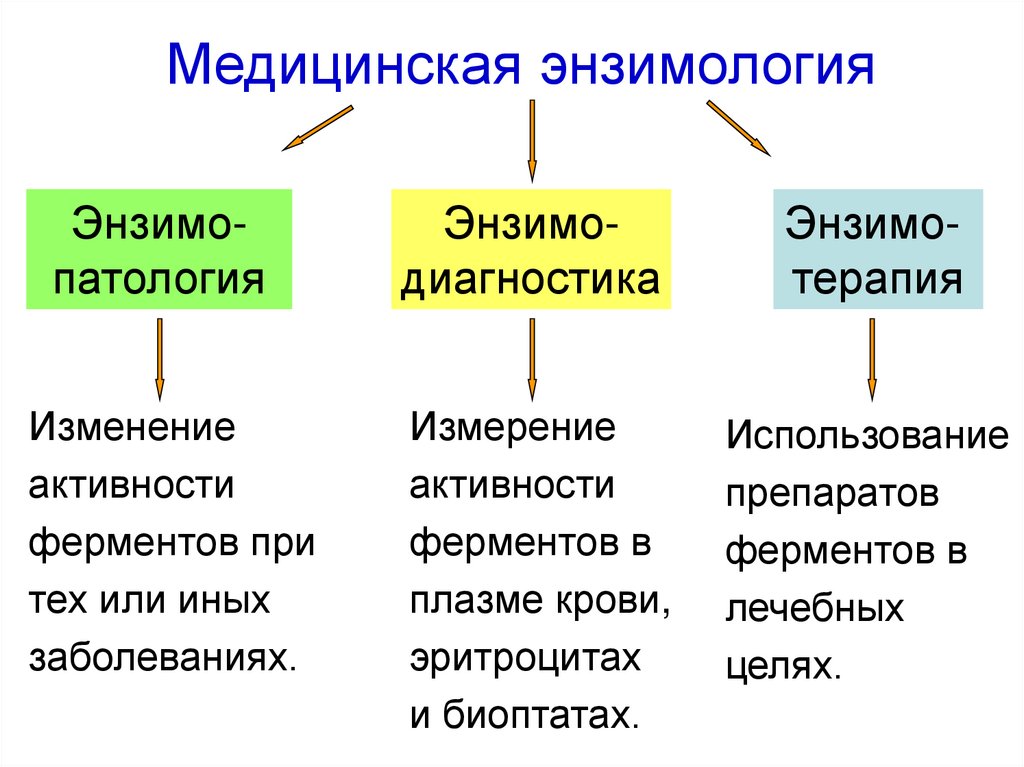
62. Медицинская энзимология
ЭнзимопатологияИзменение
активности
ферментов при
тех или иных
заболеваниях.
Энзимодиагностика
Энзимотерапия
Измерение
активности
ферментов в
плазме крови,
эритроцитах
и биоптатах.
Использование
препаратов
ферментов в
лечебных
целях.














 biology
biology








