Similar presentations:
Строение и свойства ферментов
1.
Строение исвойства
ферментов
2.
Ферментами называютбиологические катализаторы,
построенные из белков, способные высокоизбирательно
реагировать с веществами и
ускорять их превращения в
другие вещества.
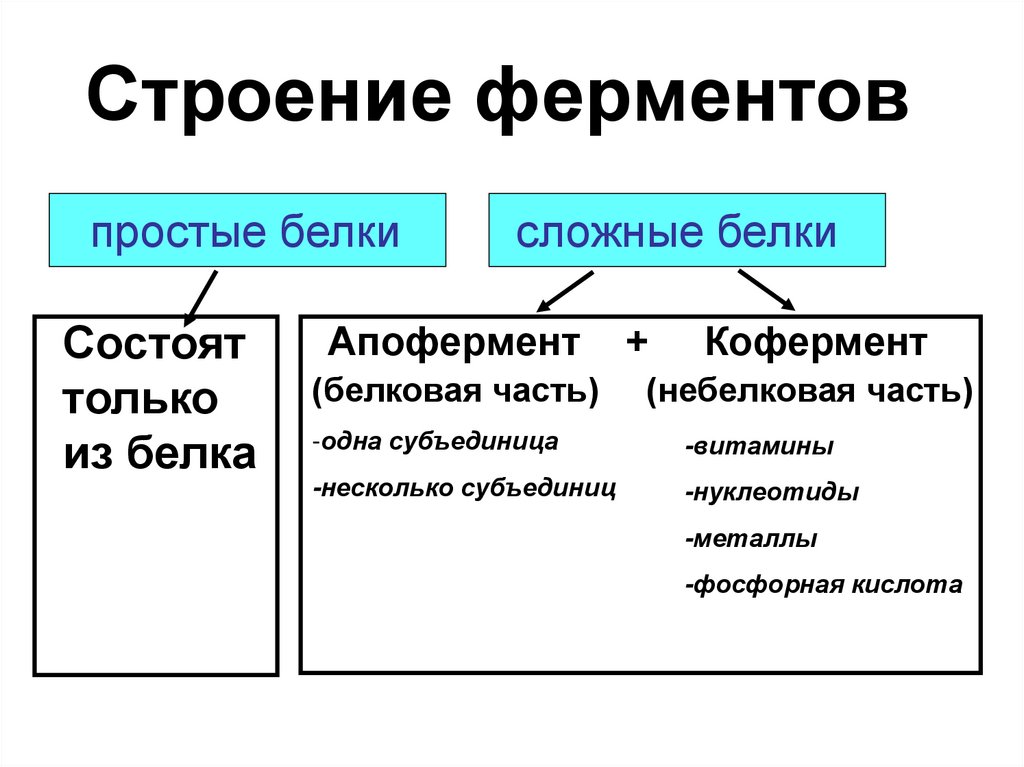
3. Строение ферментов
простые белкиСостоят
только
из белка
сложные белки
Апофермент
(белковая часть)
+
Кофермент
(небелковая часть)
-одна субъединица
-витамины
-несколько субъединиц
-нуклеотиды
-металлы
-фосфорная кислота
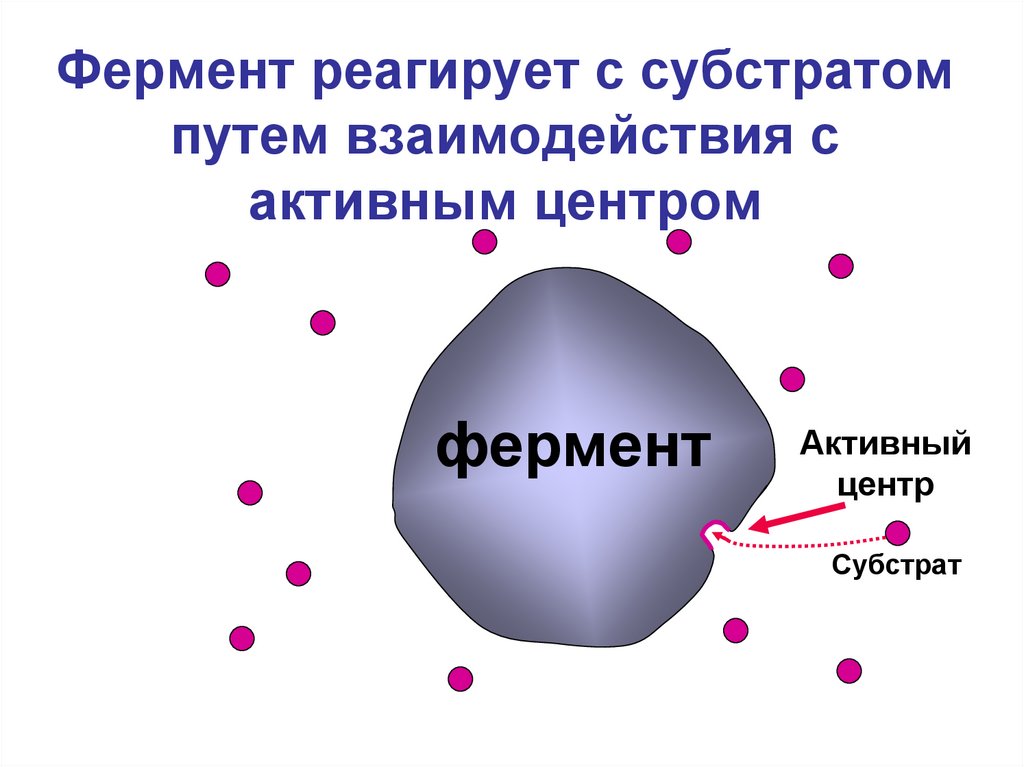
4. Фермент реагирует с субстратом путем взаимодействия с активным центром
ферментАктивный
центр
Субстрат
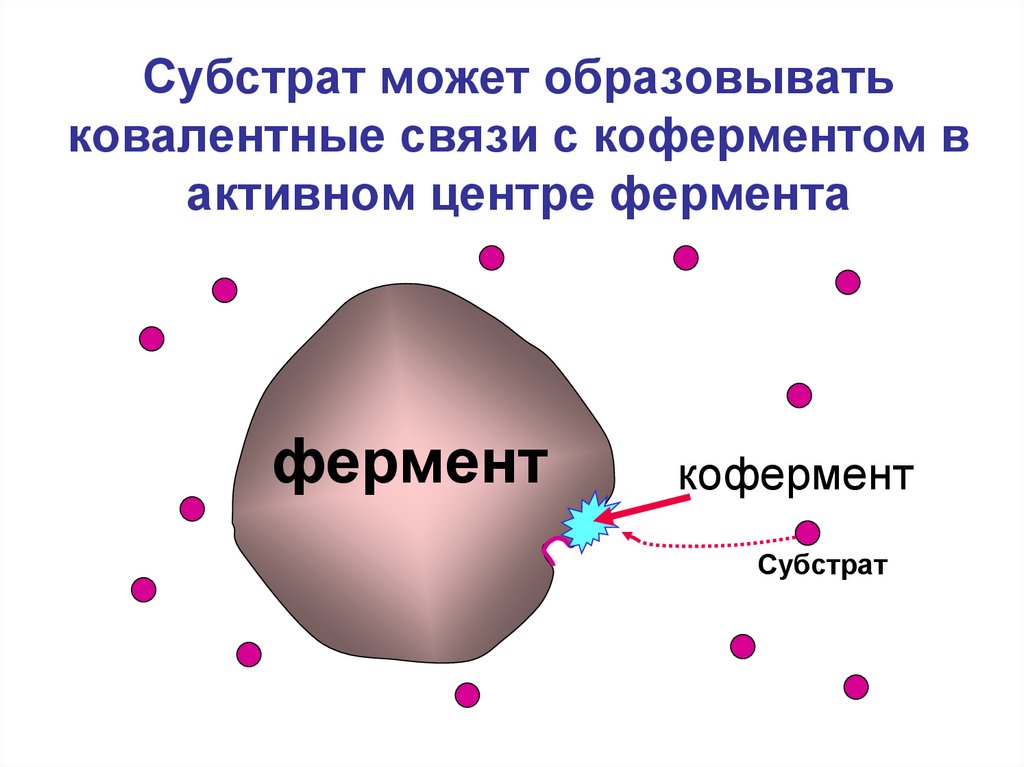
5. Субстрат может образовывать ковалентные связи с коферментом в активном центре фермента
ферменткофермент
Субстрат
6. Роль коферментов в ферментативной реакции
- Улучшают взаимодействие субстратас ферментом
- Образуют связи с субстратом
- Участвуют в превращении субстрата
- Принимают на себя и отдают другим
ферментам продукты реакции
7.
Свойстваферментов
8. Специфичность фермента – способность взаимодействовать только с определенным видом молекул (субстратом)
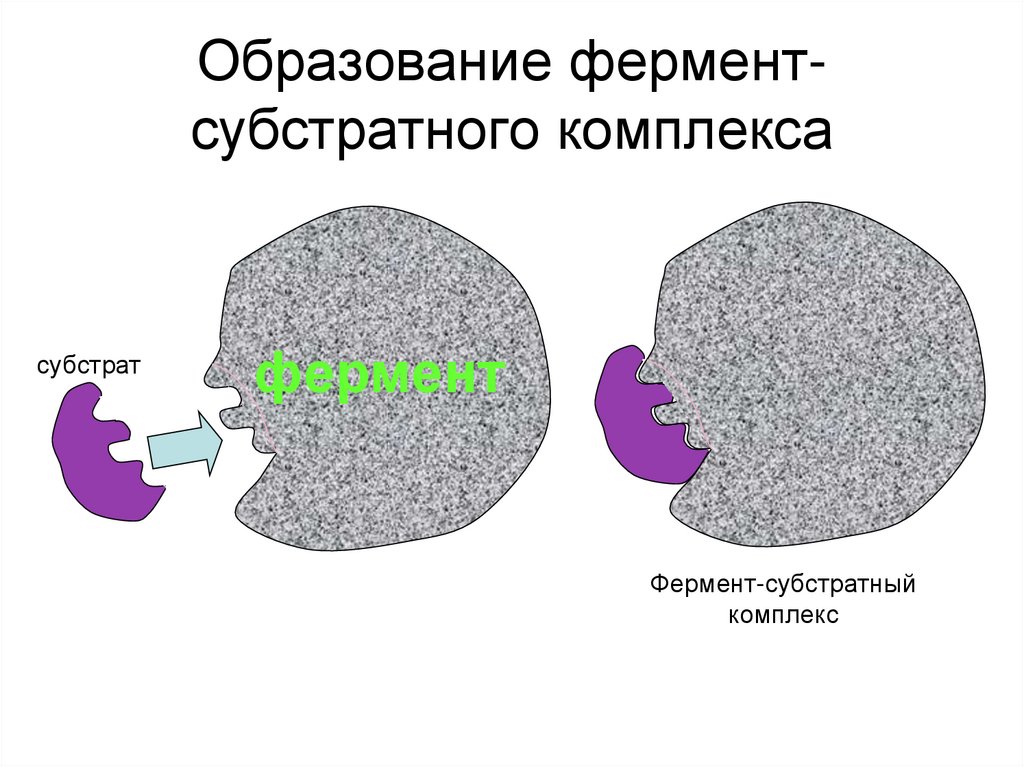
9. Образование фермент-субстратного комплекса
Образование ферментсубстратного комплексасубстрат
фермент
Фермент-субстратный
комплекс
10.
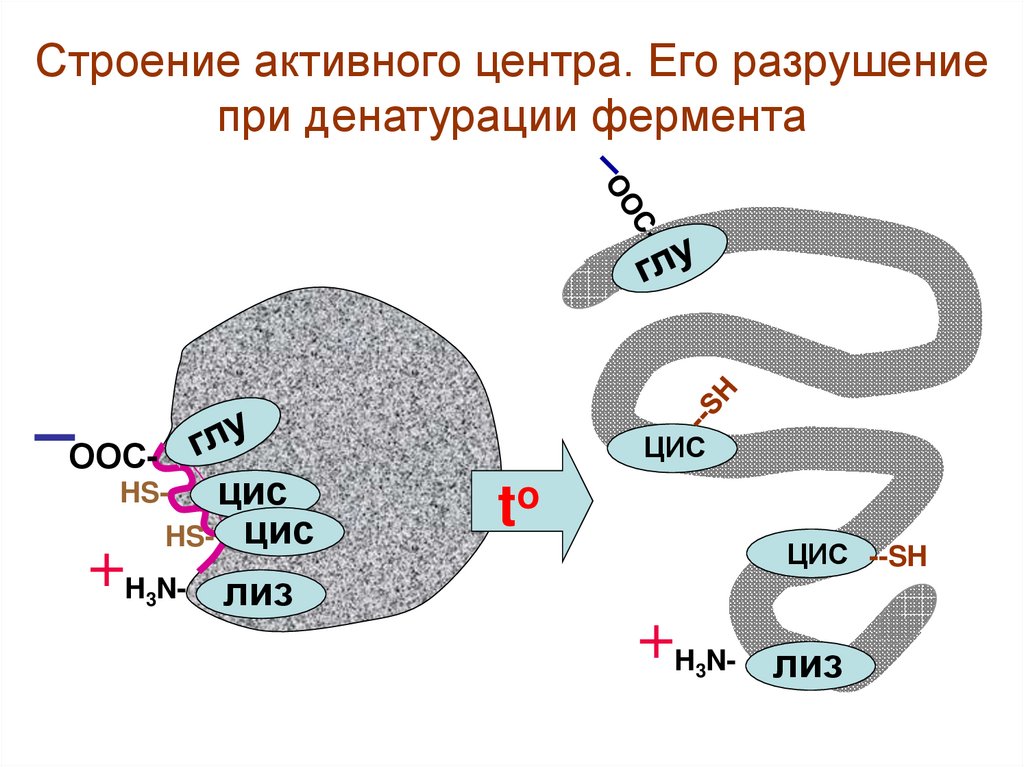
Строение активного центра. Его разрушениепри денатурации фермента
ООС-
ЦИС
цис
HS- цис
HS-
H3N-
to
ЦИС --SH
лиз
H3N-
лиз
11. Строение профермента
проферментАктивный
фермент
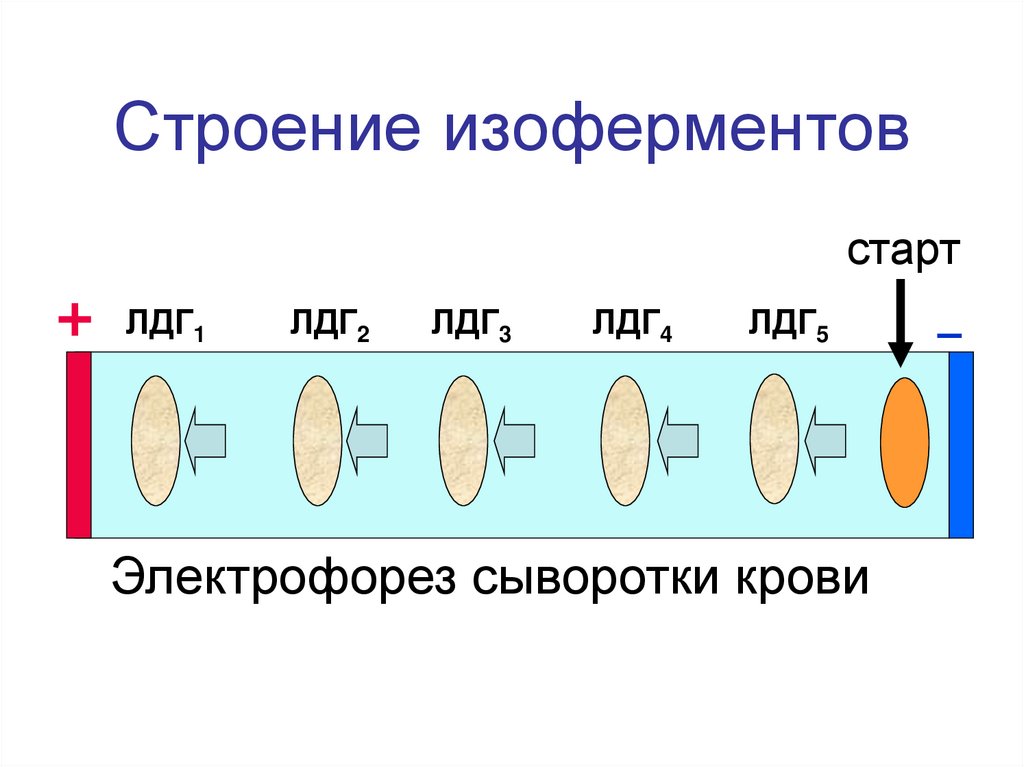
12. Строение изоферментов
стартЛДГ1
ЛДГ2
ЛДГ3
ЛДГ4
ЛДГ5
Электрофорез сыворотки крови
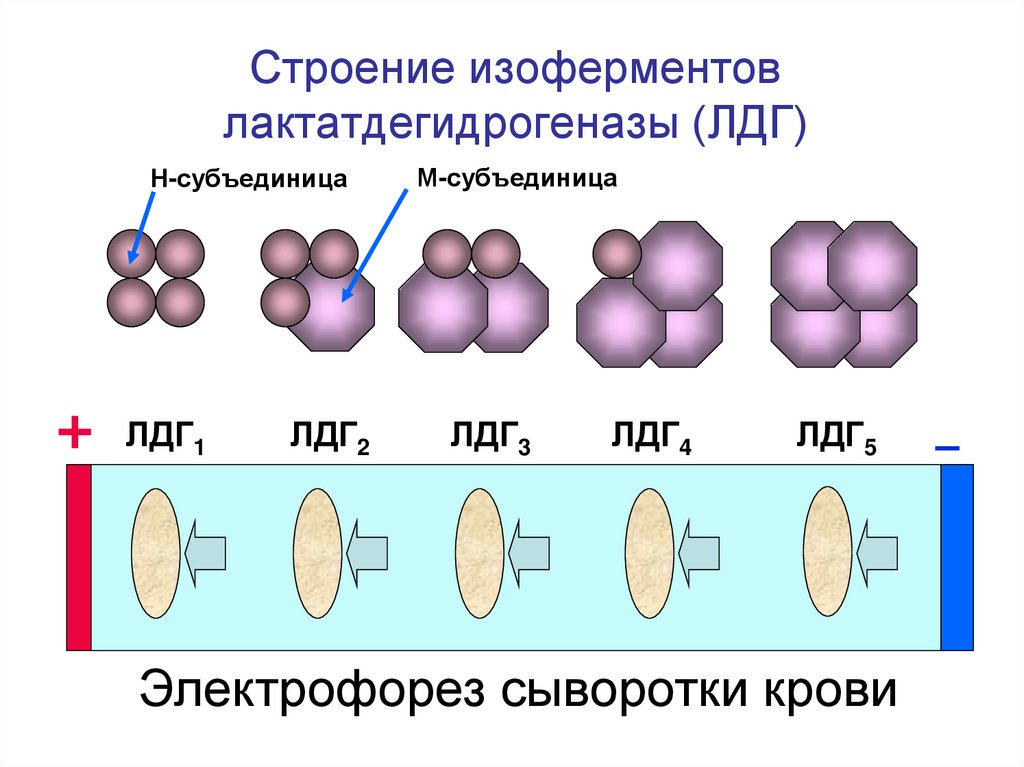
13. Строение изоферментов лактатдегидрогеназы (ЛДГ)
Н-субъединицаЛДГ1
ЛДГ2
М-субъединица
ЛДГ3
ЛДГ4
ЛДГ5
Электрофорез сыворотки крови
14. Факторы, влияющие на активность ферментов
Температура
Кислотность среды
Металлы
Коферменты
Концентрация субстрата
Концентрация продукта
реакции
• Ингибиторы
15. Влияние температуры на активность ферментов
мкмоль/с36о
0
10
20
30
40
50
60
70
80
90
температура
16. При низкой температуре хаотическое движение молекул прекращается. Столкновения субстрата с активным центром не происходят
фермент?
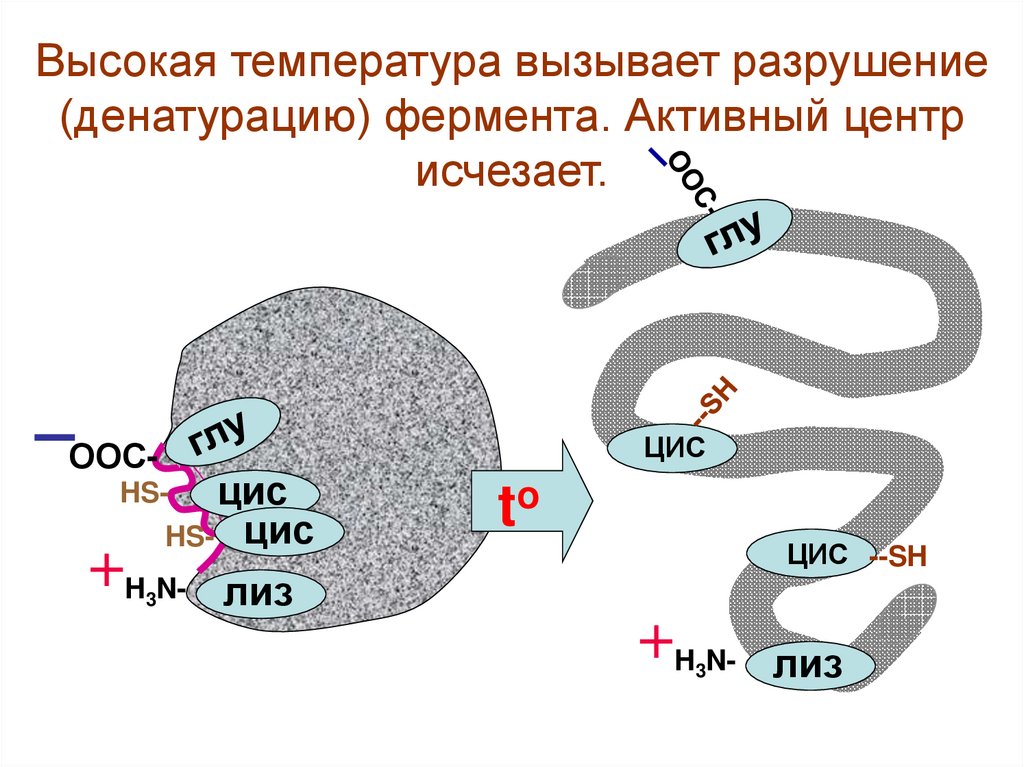
17.
Высокая температура вызывает разрушение(денатурацию) фермента. Активный центр
исчезает.
ООС-
ЦИС
цис
HS- цис
HS-
H3N-
to
ЦИС --SH
лиз
H3N-
лиз
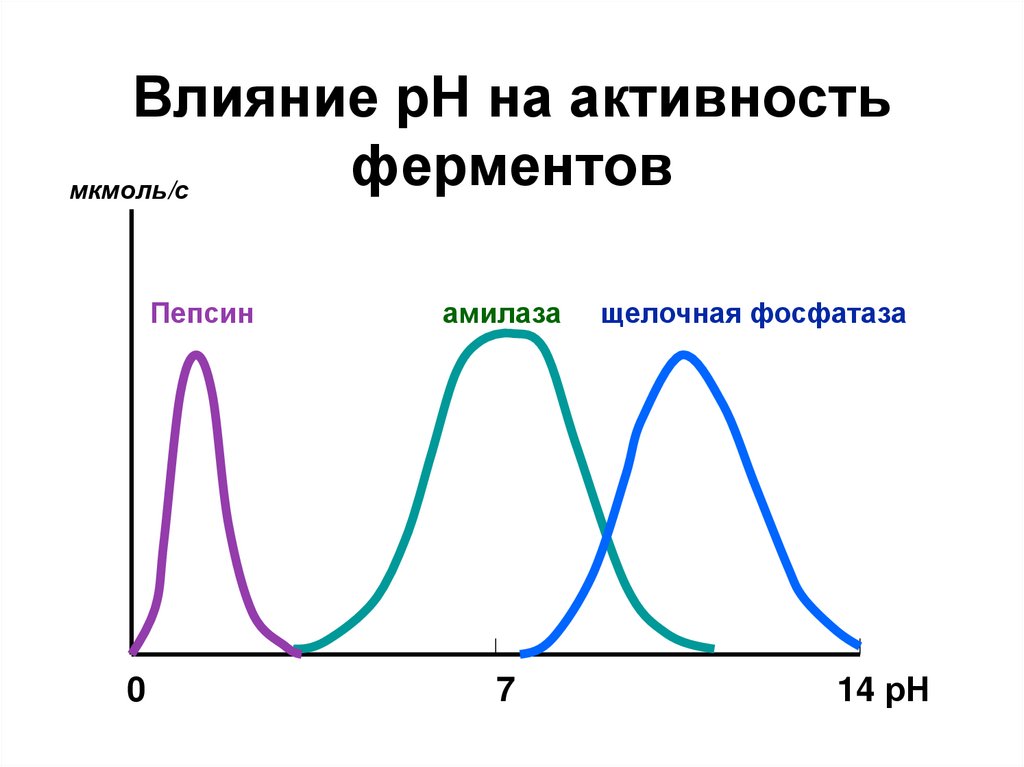
18. Влияние рН на активность ферментов
мкмоль/сПепсин
0
амилаза
7
щелочная фосфатаза
14 рН
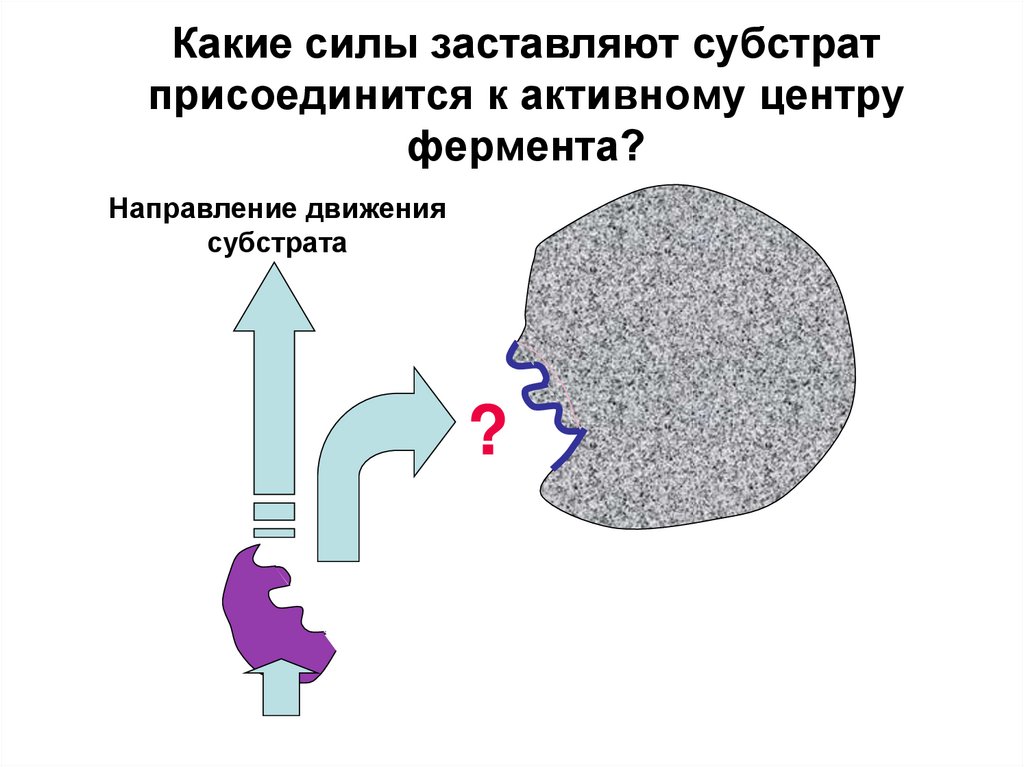
19. Какие силы заставляют субстрат присоединится к активному центру фермента?
Направление движениясубстрата
?
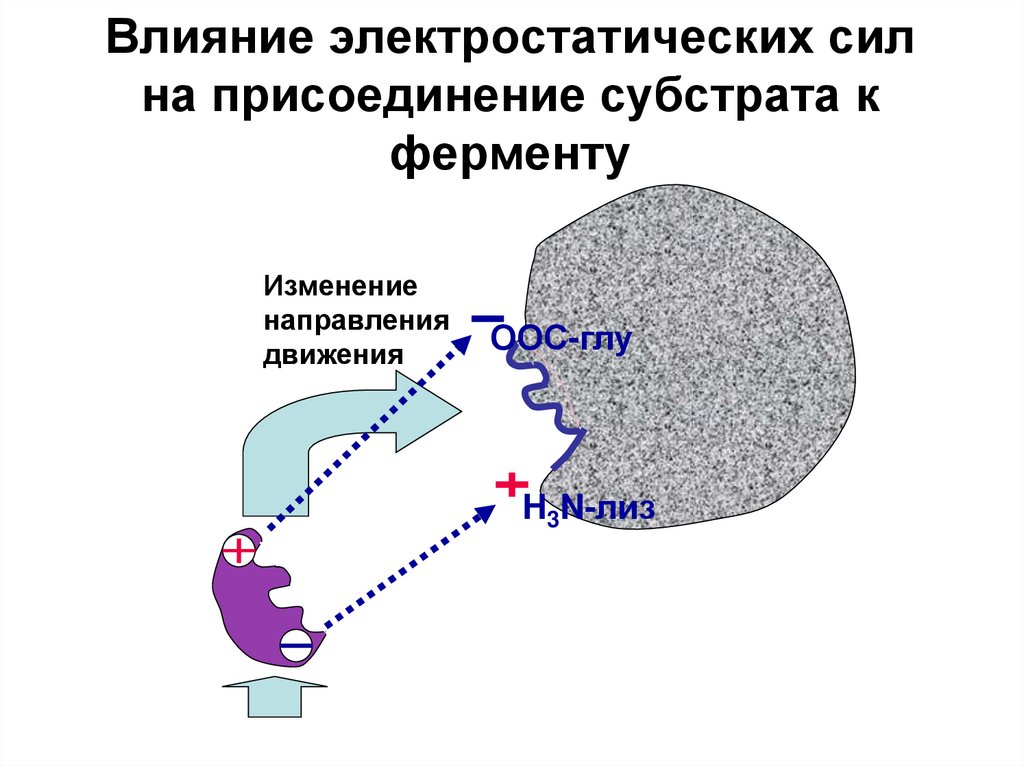
20. Влияние электростатических сил на присоединение субстрата к ферменту
Изменениенаправления
движения
ООС-глу
H3N-лиз
21.
Механизмингибирования
активности
фермента при
снижении рН внутри
клеток
22.
На активностьфермента оказывают
влияние металлы,
активаторы или
ингибиторы
ферментов.
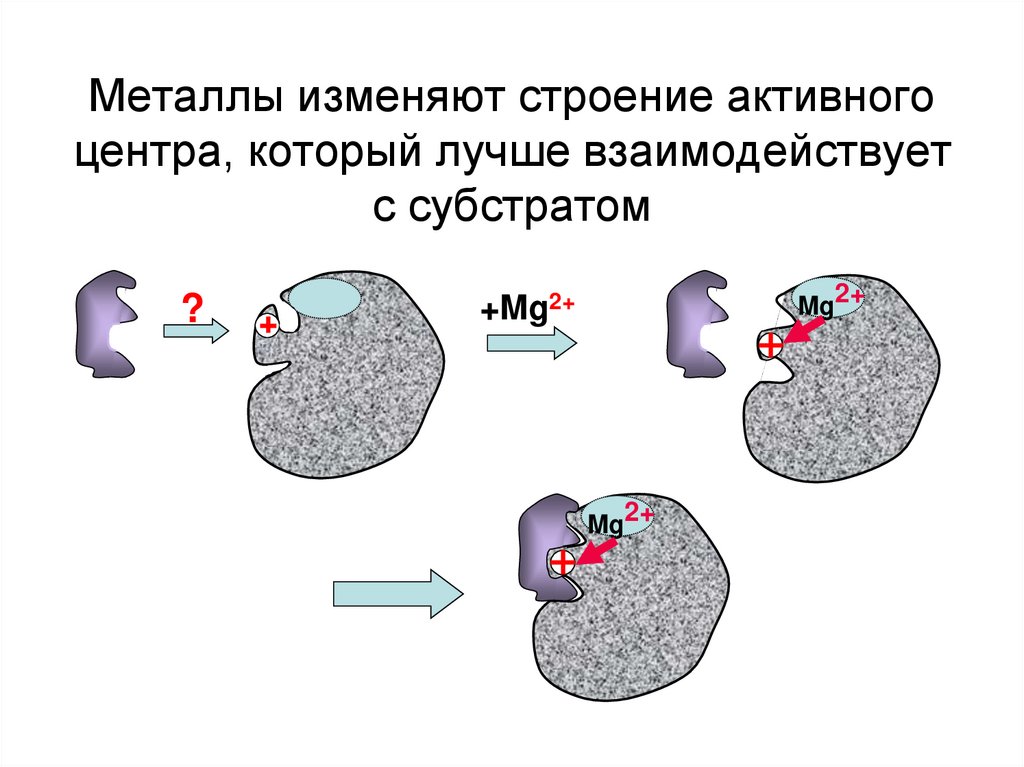
23. Металлы изменяют строение активного центра, который лучше взаимодействует с субстратом
?Mg2+
+Mg2+
Mg2+
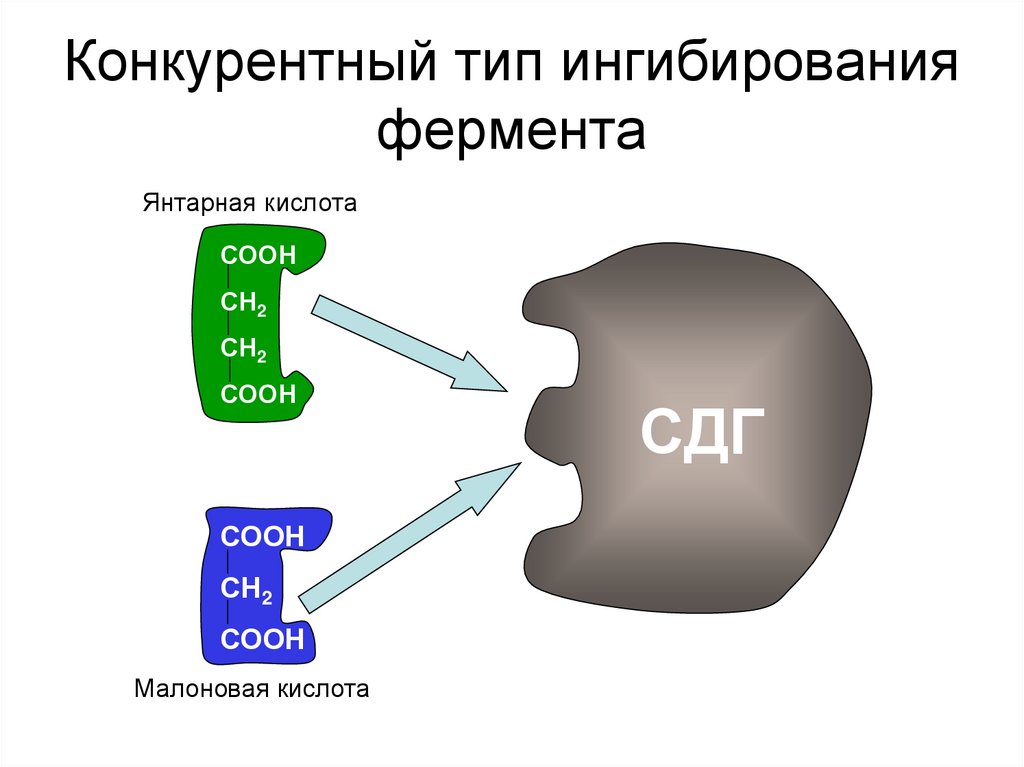
24. Конкурентный тип ингибирования фермента
Янтарная кислотаСООН
СН2
СН2
СООН
СООН
СН2
СООН
Малоновая кислота
СДГ
25. Неконкурентный тип ингибирования фермента
НS---S---
Hg
Hg2+
НS---
S---
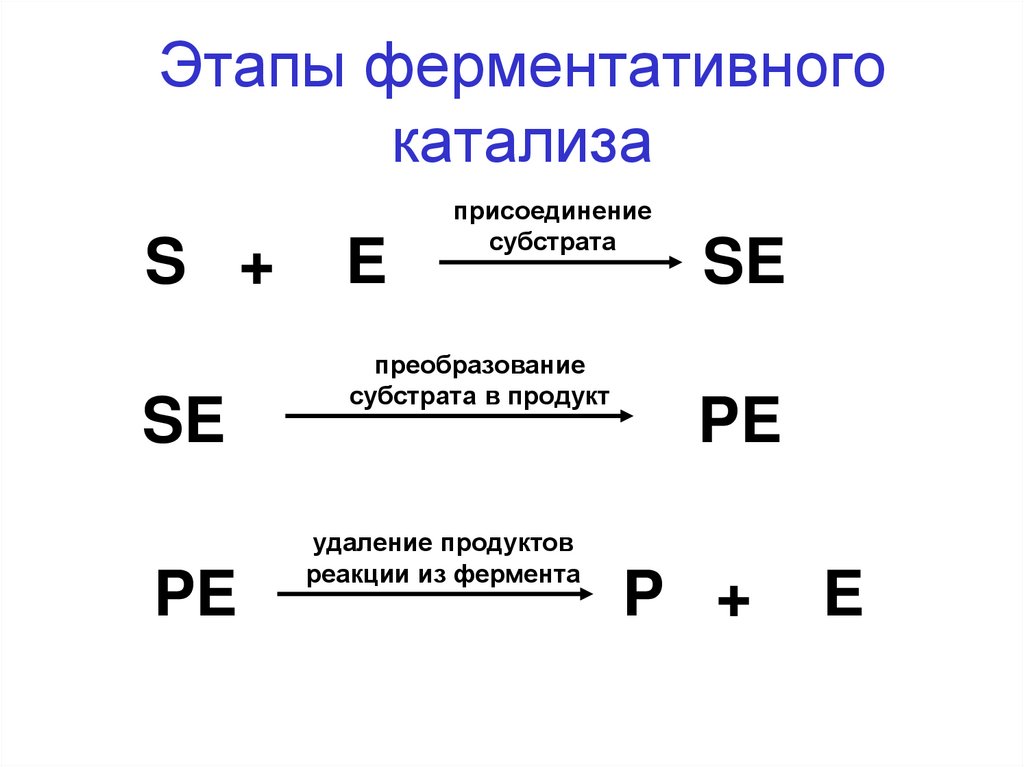
26. Этапы ферментативного катализа
1. Присоединение субстрата к активному центрус образованием единого молекулярного комплекса;
2. Конформационная перестройка молекулы белка
фермента и, соответственно, активного центра;
3. Преобразование субстрата в другую молекулу в
результате перераспределения электронных
плотностей в молекуле субстрата и разрыва (или
возникновения) новых ковалентных связей в
субстрате.
4. Удаление продукта реакции из активного центра.
27. Этапы ферментативного катализа
S +SE
PE
E
присоединение
субстрата
преобразование
субстрата в продукт
удаление продуктов
реакции из фермента
SE
PE
P +
E
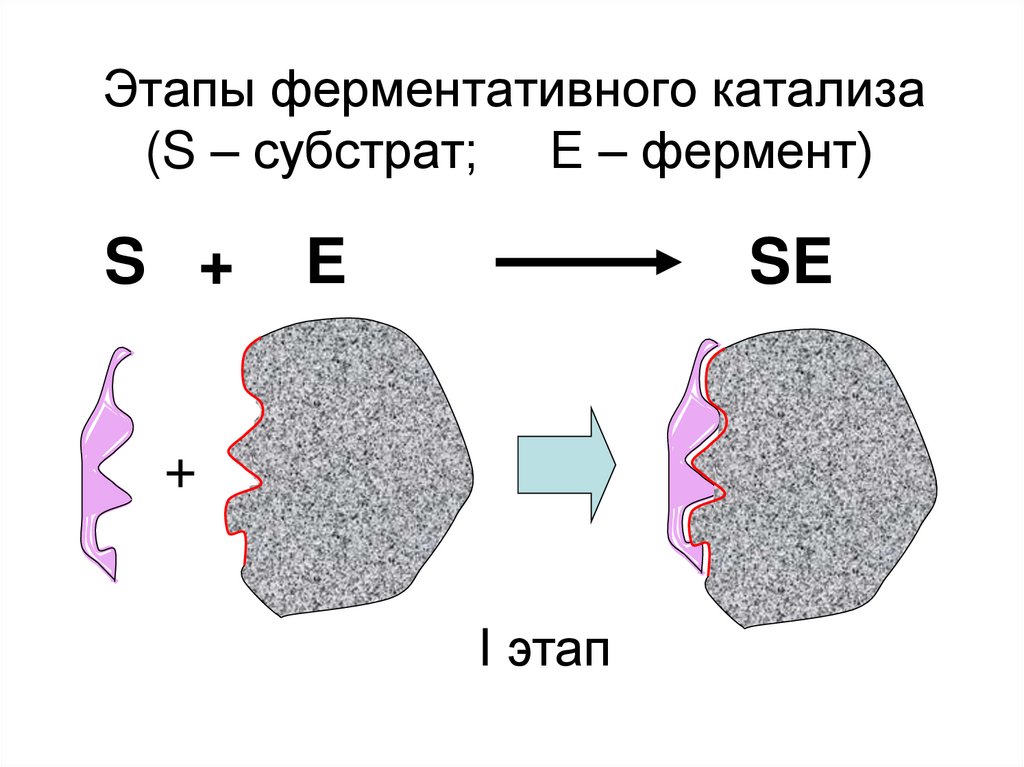
28. Этапы ферментативного катализа (S – субстрат; Е – фермент)
S +E
SE
+
I этап
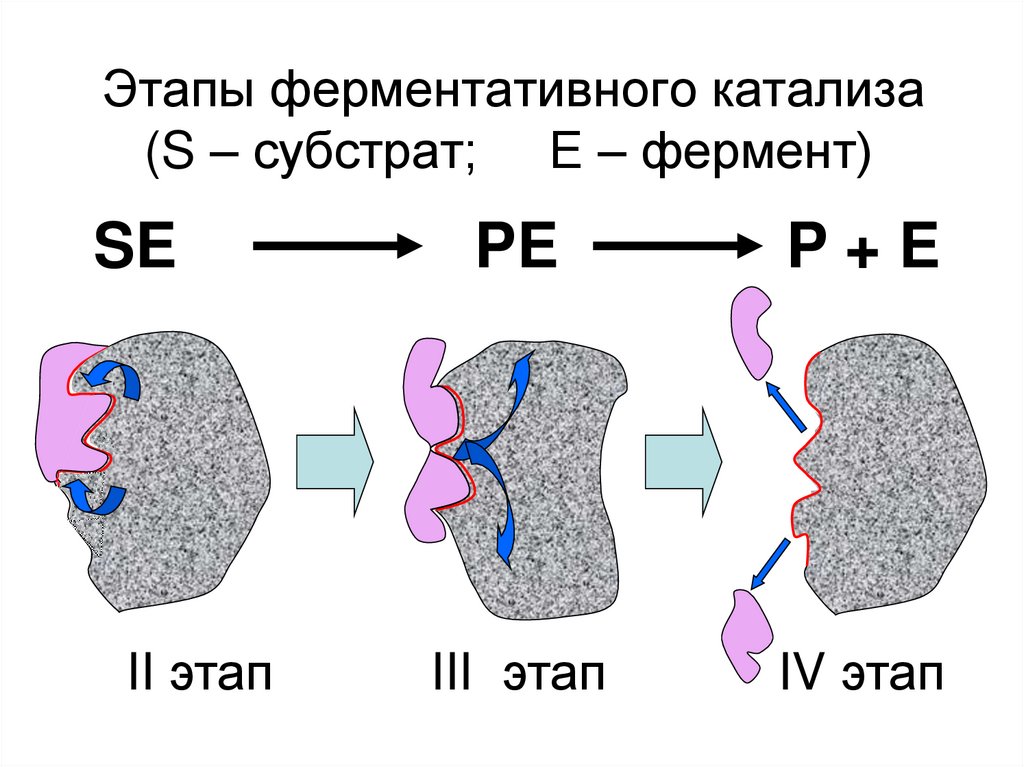
29.
Конформационная перестройкамолекулы белка фермента и,
соответственно, активного центра
II этап
30. Этапы ферментативного катализа (S – субстрат; Е – фермент)
SEII этап
PE
P+E
III этап
IV этап
31.
Динамика измененияактивности фермента
во время протекании
химической реакции
32.
Показатели активности ферментативнойреакции
СКОРОСТЬ РЕАКЦИИ (V) - определяют по
количеству молей субстрата превращенного
ферментом за секунду (моль/с).
КАТАЛ - единица активности фермента (моль/с)
МЕЖДУНАРОДНАЯ ЕДИНИЦА активности
фермента (U) рассчитывается в мкмоль
субстрата превращенного за одну минуту
U = мкмоль/мин)
(
УДЕЛЬНАЯ АКТИВНОСТЬ рассчитывается
количеством молей субстрата, превращаемого в
секунду одним килограммом ткани (моль/c•кг)
или (катал/кг ) или (мкмоль/мин•мг белка)
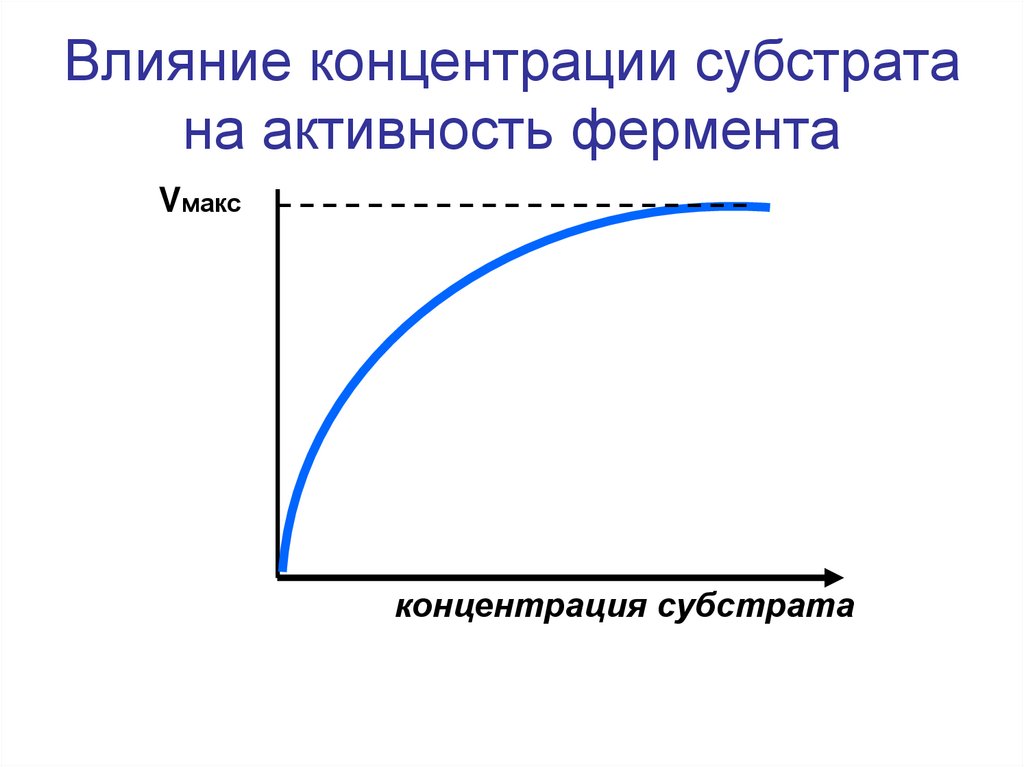
33. Влияние концентрации субстрата на активность фермента
Vмаксконцентрация субстрата
34. Уравнение Михаэлиса-Ментена
Уравнение МихаэлисаМентенаV макс
V=
Кm
1+
S
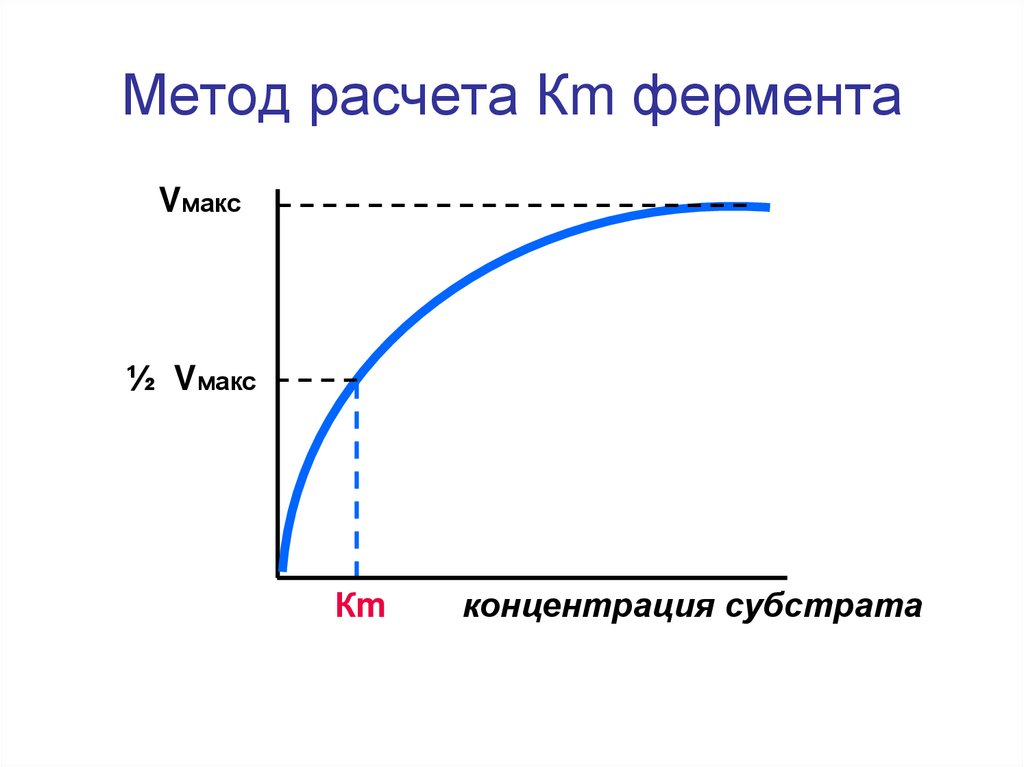
35. Метод расчета Кm фермента
Vмакс½ Vмакс
Кm
концентрация субстрата
36.
Оценка Кm в биохимической практике1.позволяет определить величину
сродства субстрата к активному
центру (чувствительность фермента
к субстрату);
2.позволяет дать более полную
характеристику каталитической
активности фермента.
37.
Механизм ускоренияхимической реакции
ферментом
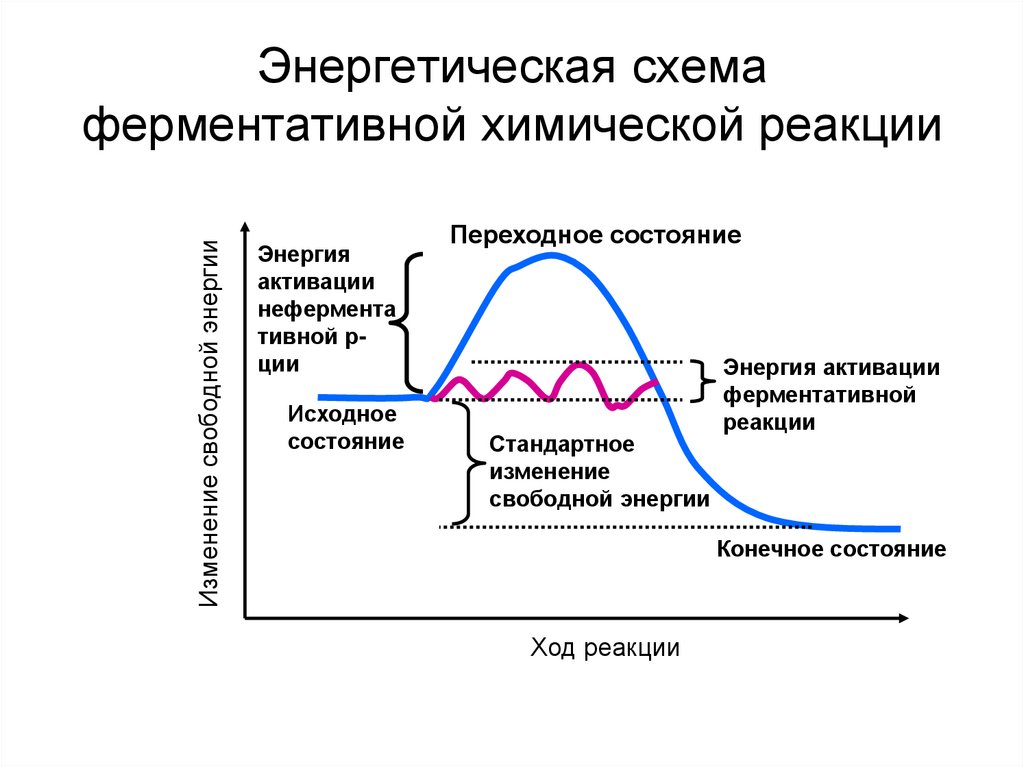
38. Энергетическая схема ферментативной химической реакции
Изменение свободной энергииЭнергетическая схема
ферментативной химической реакции
Энергия
активации
нефермента
тивной рции
Исходное
состояние
Переходное состояние
Стандартное
изменение
свободной энергии
Энергия активации
ферментативной
реакции
Конечное состояние
Ход реакции
39.
Регуляцияактивности
ферментов
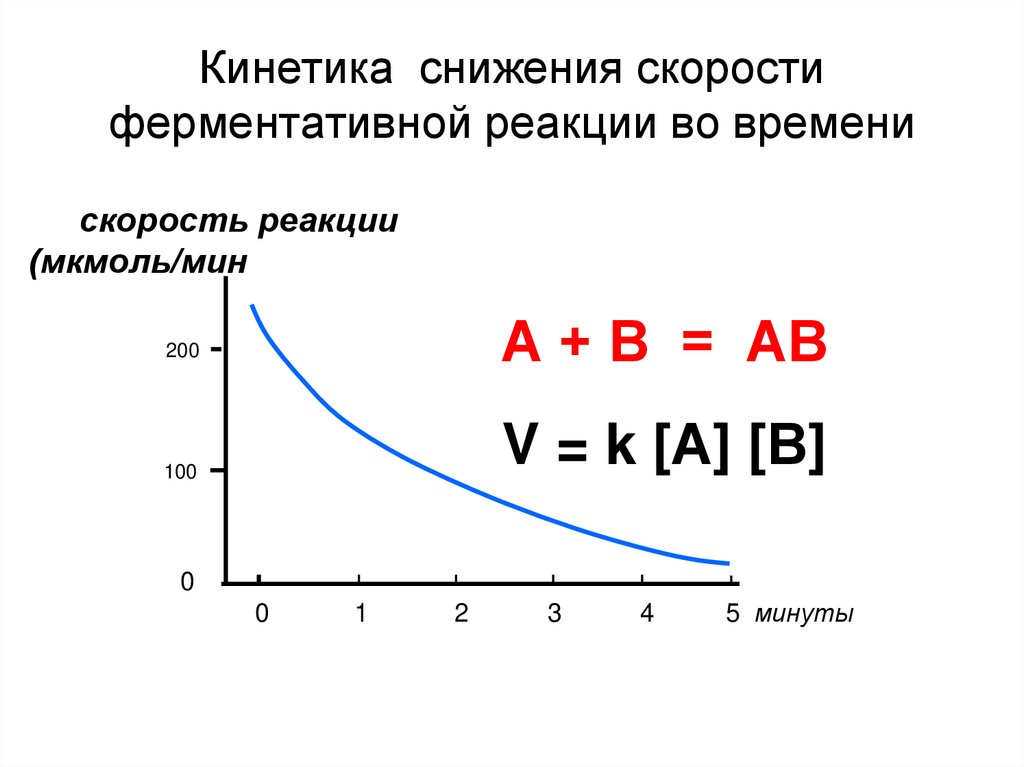
40. Кинетика снижения скорости ферментативной реакции во времени
скорость реакции(мкмоль/мин
А + В = АВ
200
V = k [А] [В]
100
0
0
1
2
3
4
5 минуты
41.
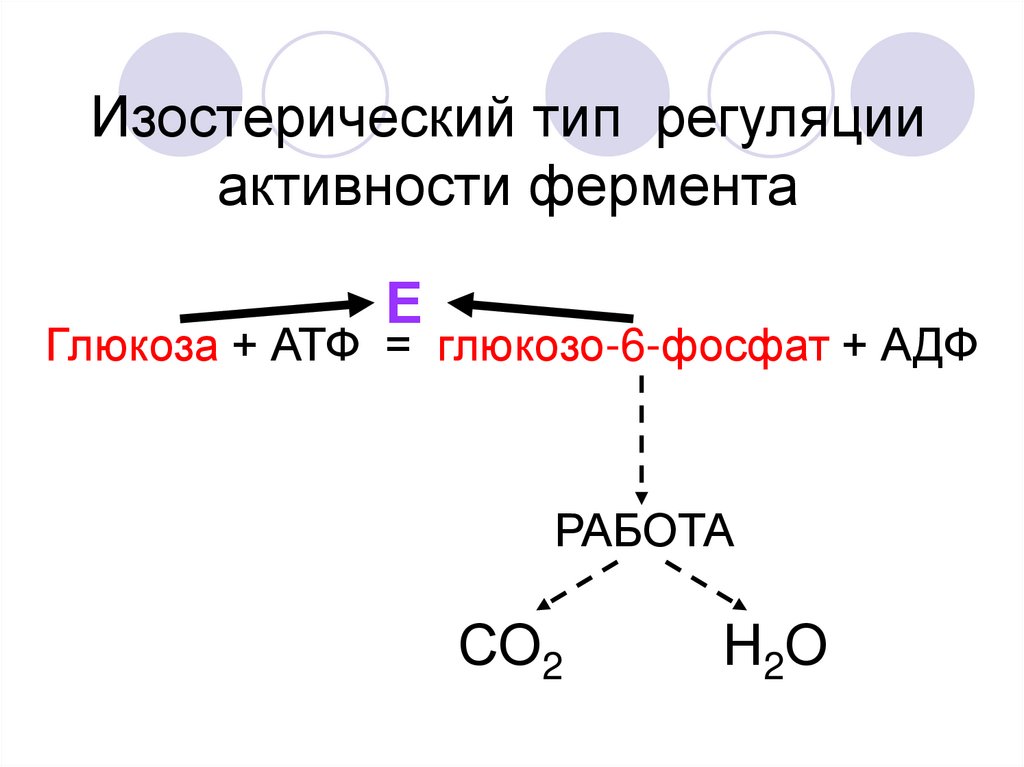
Изостерический тип регуляцииактивности фермента
Е
Глюкоза + АТФ = глюкозо-6-фосфат + АДФ
РАБОТА
СО2
Н2О
42.
Изостерический тип регуляцииактивности ферментов
глюкоза
Глюкозо6-фосфат
43.
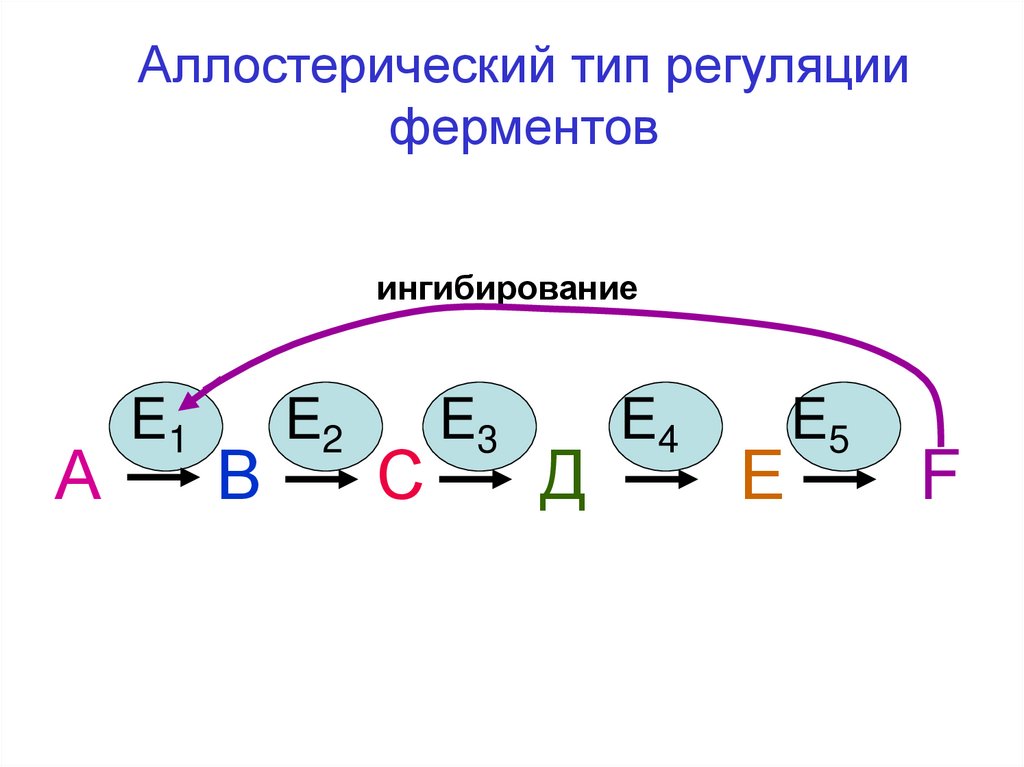
Аллостерический тип регуляцииферментов
ингибирование
А
E1
В
E2
С
E3
Д
E4
Е
E5
F
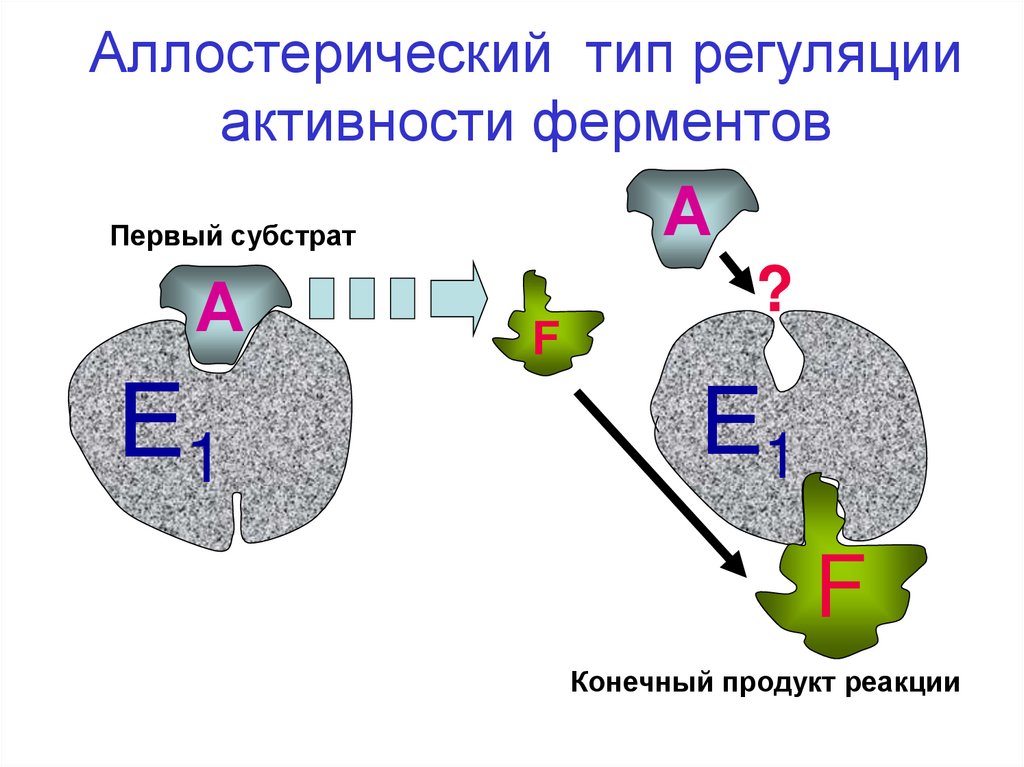
44.
Аллостерический тип регуляцииактивности ферментов
А
Первый субстрат
А
Е1
F
?
Е1
F
Конечный продукт реакции
45.
Роль аллостерических ферментов вметаболизме клетки
1. Регуляция скорости синтеза веществ;
2. В случае накопления энергии (АТФ), обмен
веществ идет по пути запасания резервных
питательных веществ;
3. Для координации процессов синтеза и
распада веществ (регуляторы – АТФ и
АДФ;
4. Для координации параллельно
протекающих путей превращений
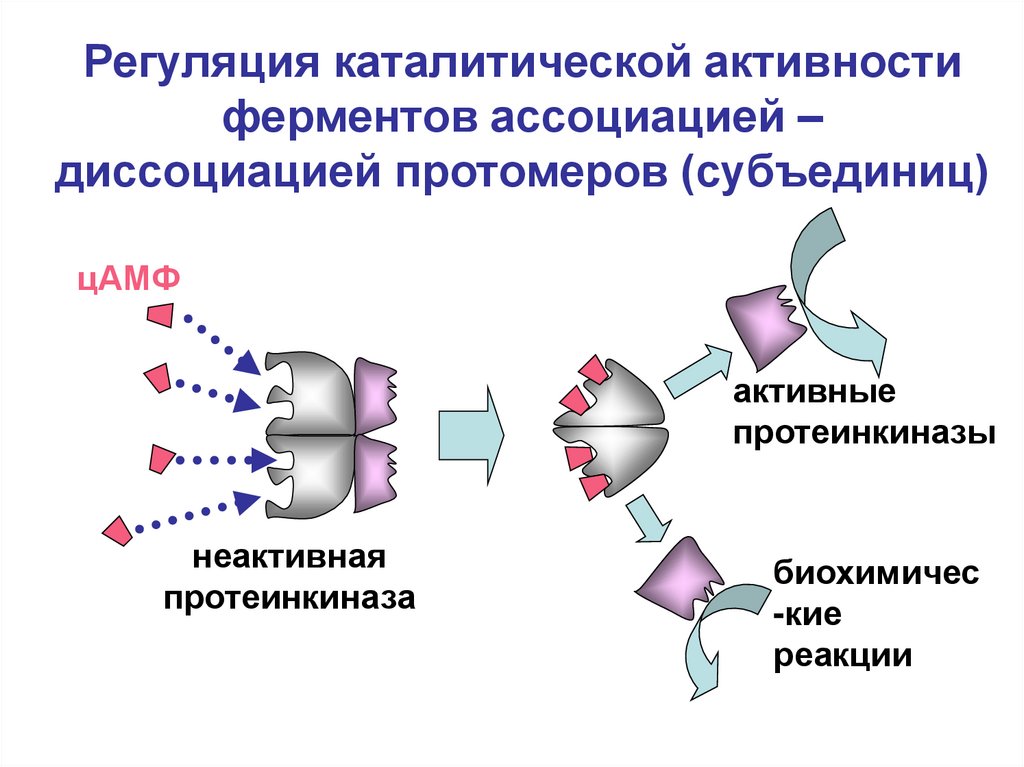
46.
Регуляция каталитической активностиферментов ассоциацией –
диссоциацией протомеров (субъединиц)
цАМФ
активные
протеинкиназы
неактивная
протеинкиназа
биохимичес
-кие
реакции
47.
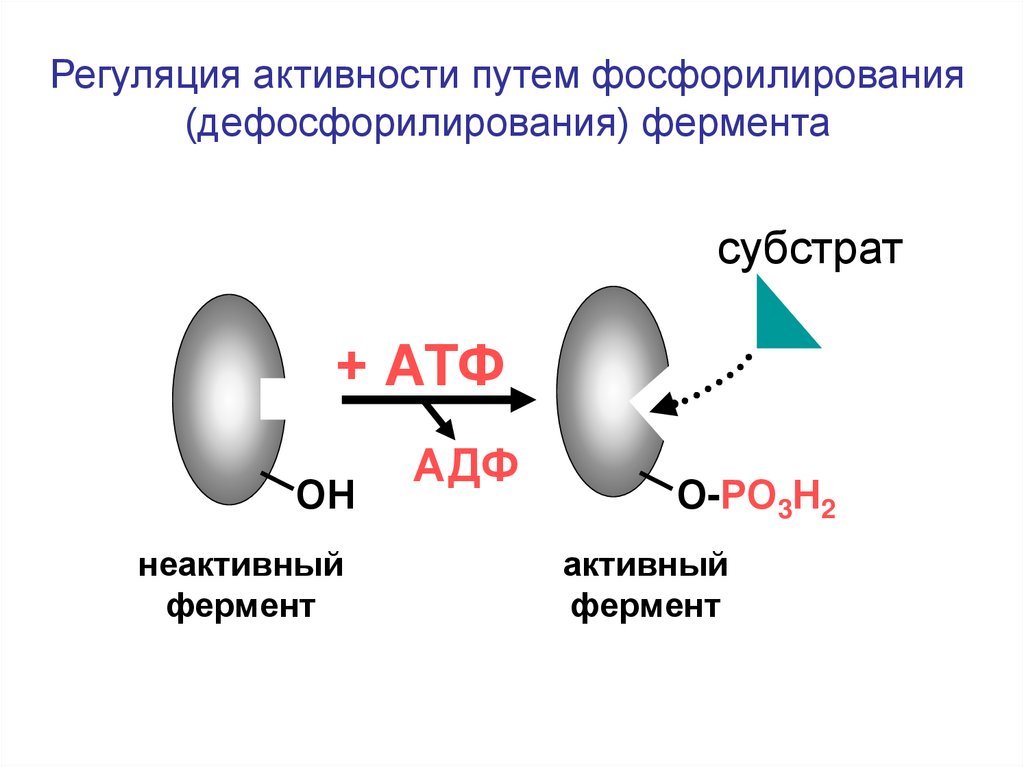
Регуляция активности путем фосфорилирования(дефосфорилирования) фермента
субстрат
+ АТФ
ОН
неактивный
фермент
АДФ
О-РО3Н2
активный
фермент
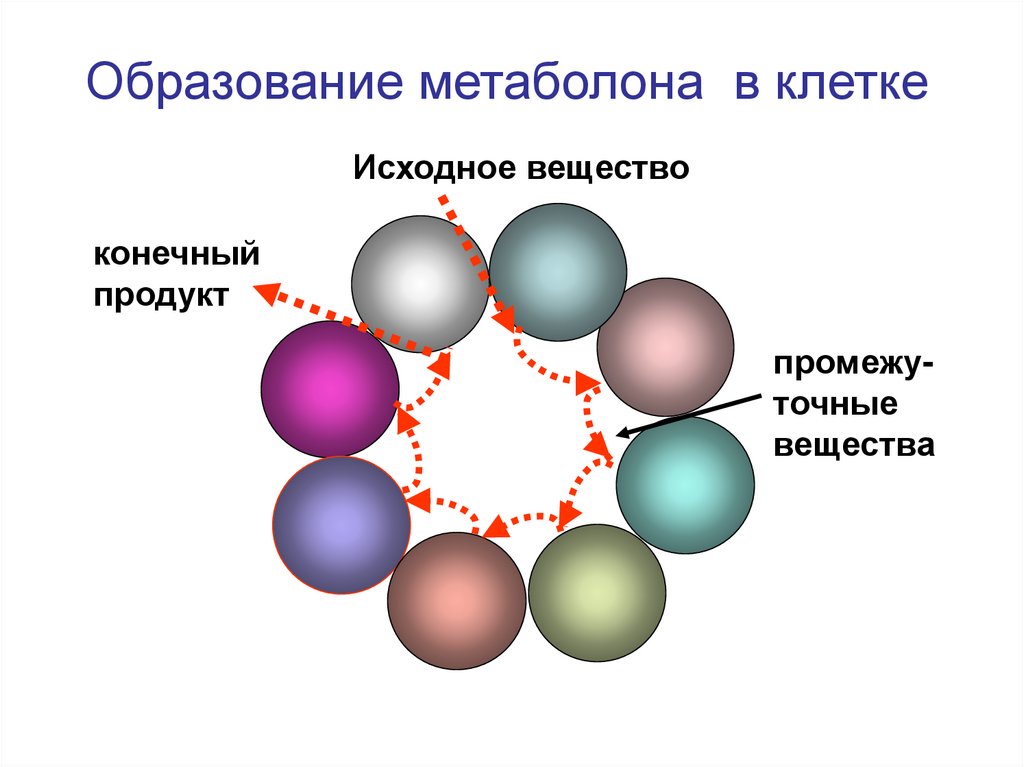
48.
Образование метаболона в клеткеИсходное вещество
конечный
продукт
промежуточные
вещества
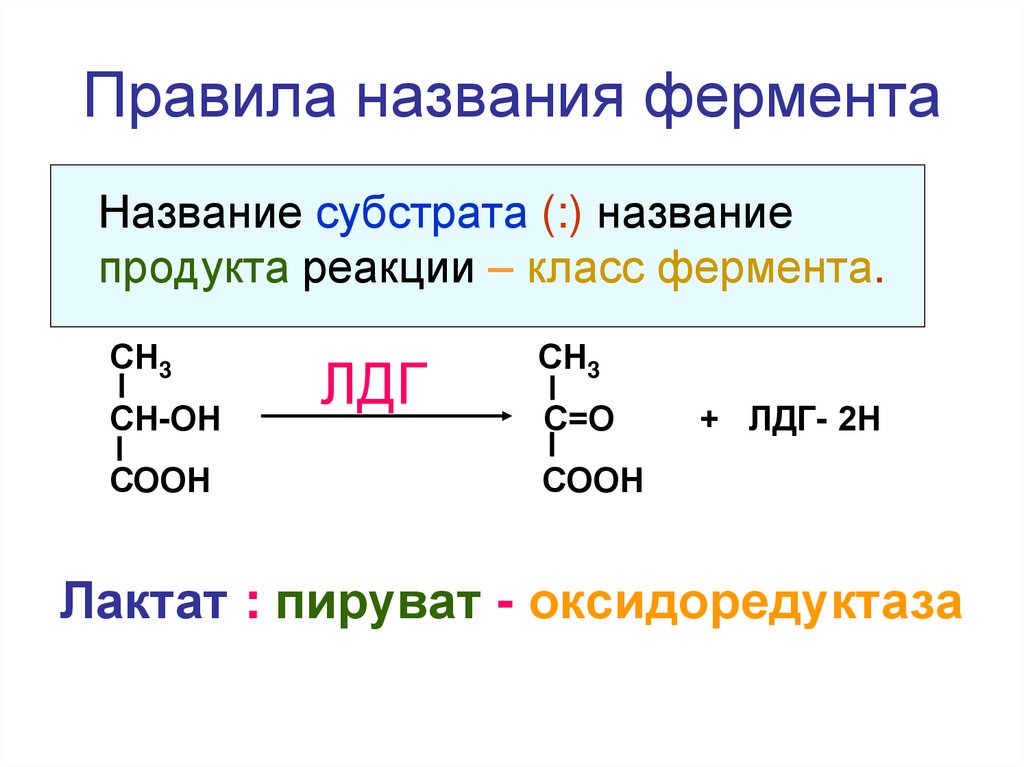
49. Правила названия фермента
Название субстрата (:) названиепродукта реакции – класс фермента.
СН3
СН-ОН
СООН
ЛДГ
СН3
С=О
+ ЛДГ- 2Н
СООН
Лактат : пируват - оксидоредуктаза
50. Классификация ферментов
ОксидоредуктазыТрансферазы
Гидролазы
Лиазы
Изомеразы
Лигазы
51. 1. Оксидоредуктазы
Катализируют окислительновосстановительные реакции1. Окисление спиртовых групп;
2. Окисление альдегидов;
3. Окисление кетонов (одновременно с
декарбоксилированием);
4. Дегидрирование углеродных цепочек;
5. Окислительное дезаминирование.
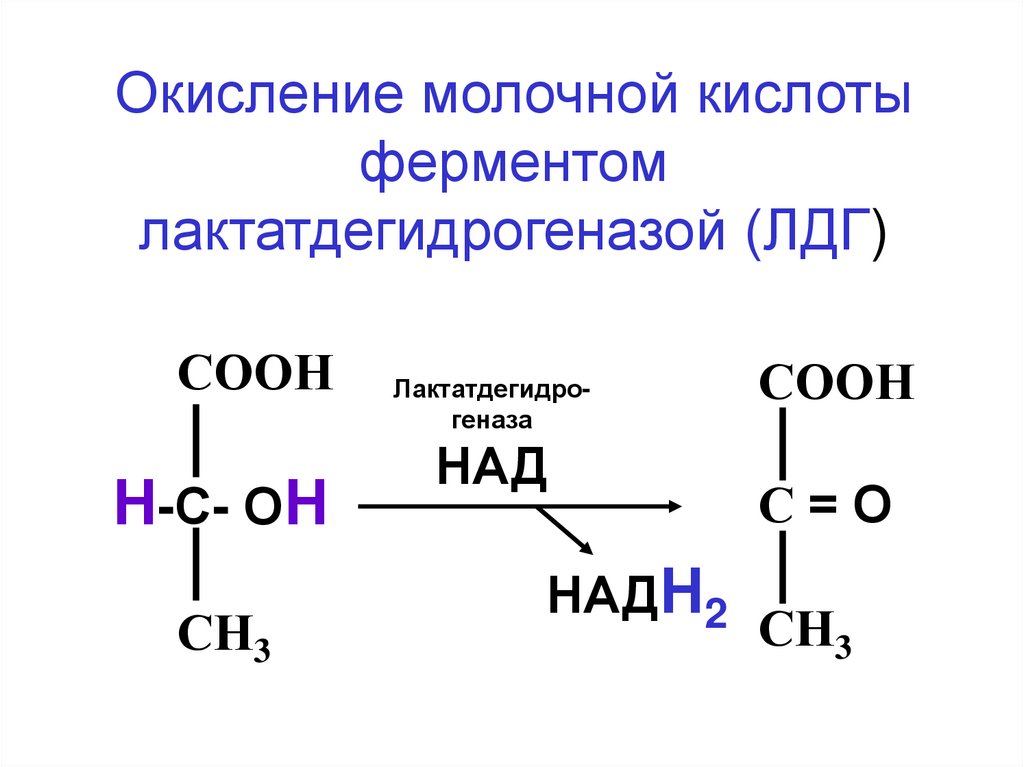
52.
Окисление молочной кислотыферментом
лактатдегидрогеназой (ЛДГ)
СООН
Н-С- ОН
СН3
Лактатдегидрогеназа
НАД
НАДН2
СООН
С=О
СН3
53.
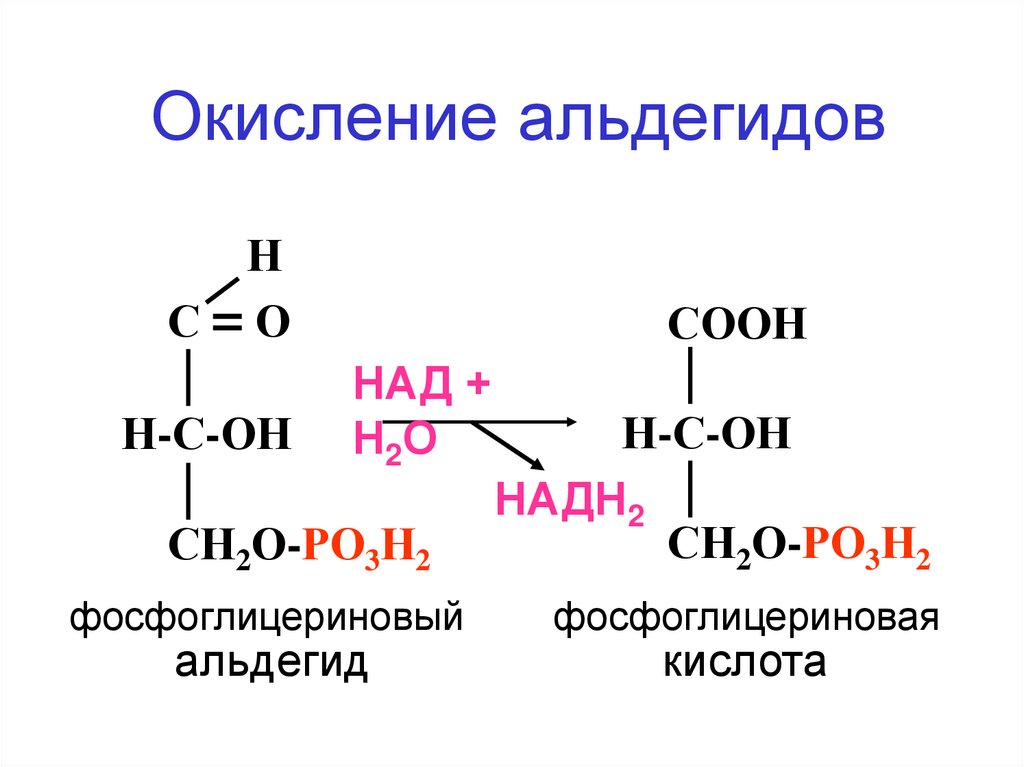
Окисление альдегидовН
С=О
Н-С-ОН
СООН
НАД +
Н 2О
СН2О-РО3Н2
фосфоглицериновый
альдегид
Н-С-ОН
НАДН2
СН2О-РО3Н2
фосфоглицериновая
кислота
54.
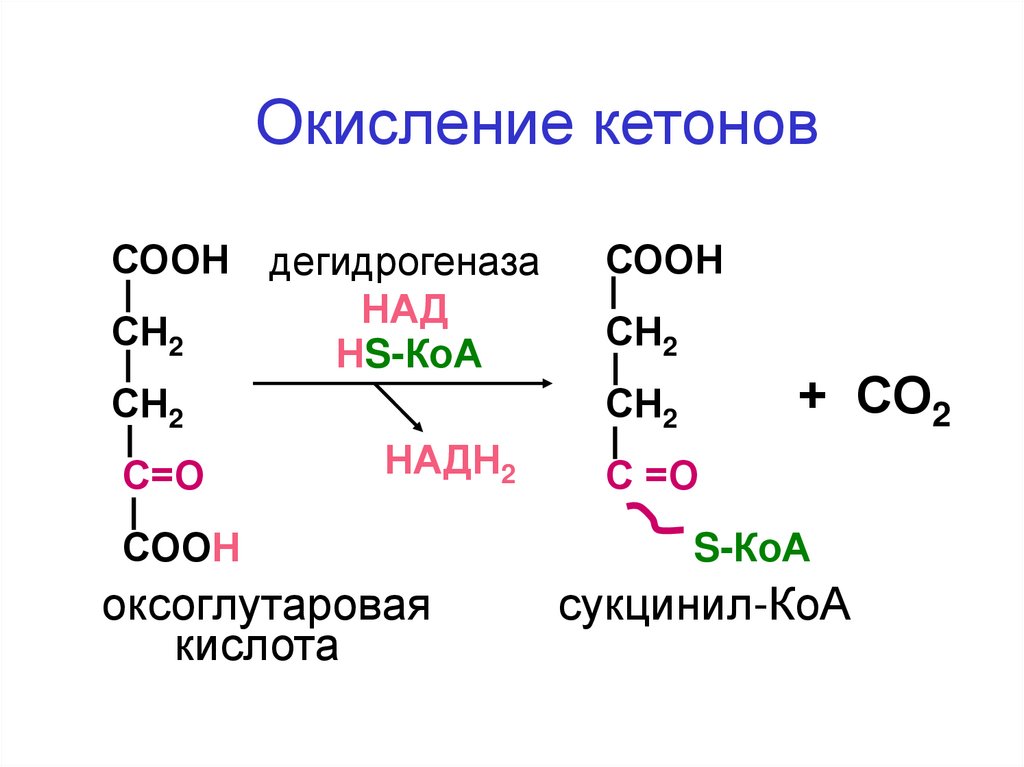
Окисление кетоновСООН дегидрогеназа
НАД
СН2
НS-КоА
СН2
НАДН2
С=О
СООН
оксоглутаровая
кислота
СООН
СН2
+ СО2
СН2
С =О
S-КоА
сукцинил-КоА
55.
Окисление углеродной цепочкиСООН
СН2
дегидрогеназа
ФАД
СООН
СН
+ ФАДН2
СН2
СН
СООН
СООН
янтарная к-та
фумаровая к-та
56.
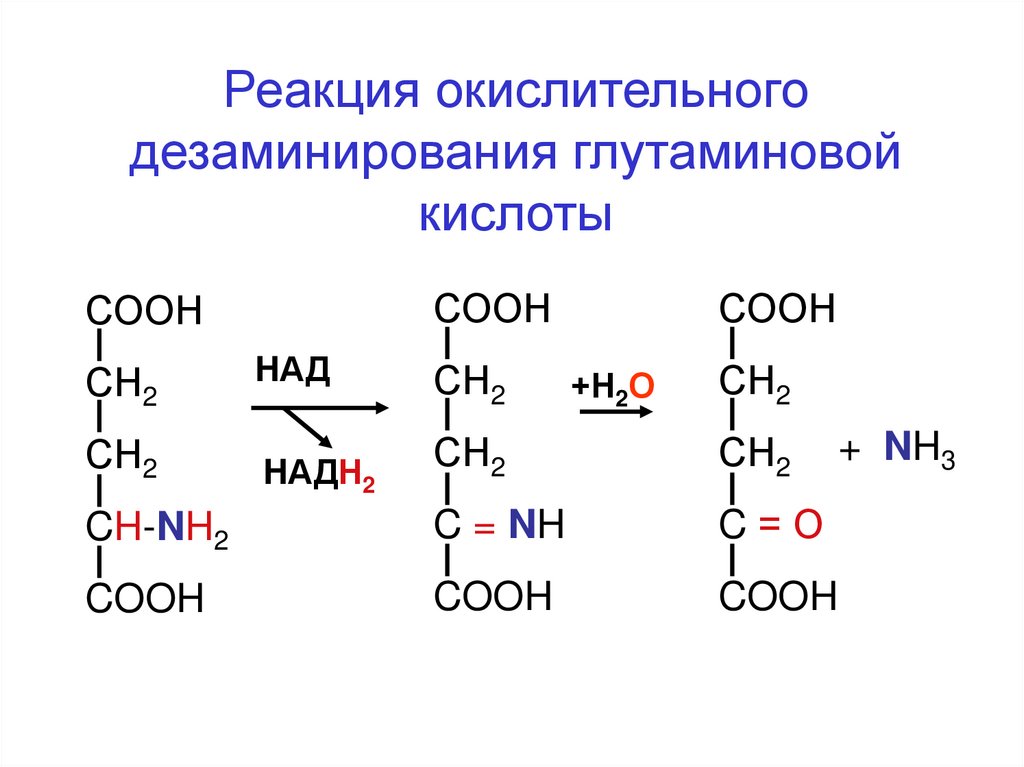
Реакция окислительногодезаминирования глутаминовой
кислоты
СООН
СООН
СН2
HАД
СН2
СООН
+Н2О
СН2
СН2
СН2
CH-NH2
C = NH
C=О
COOH
COOH
COOH
СН2
HАДН2
+ NH3
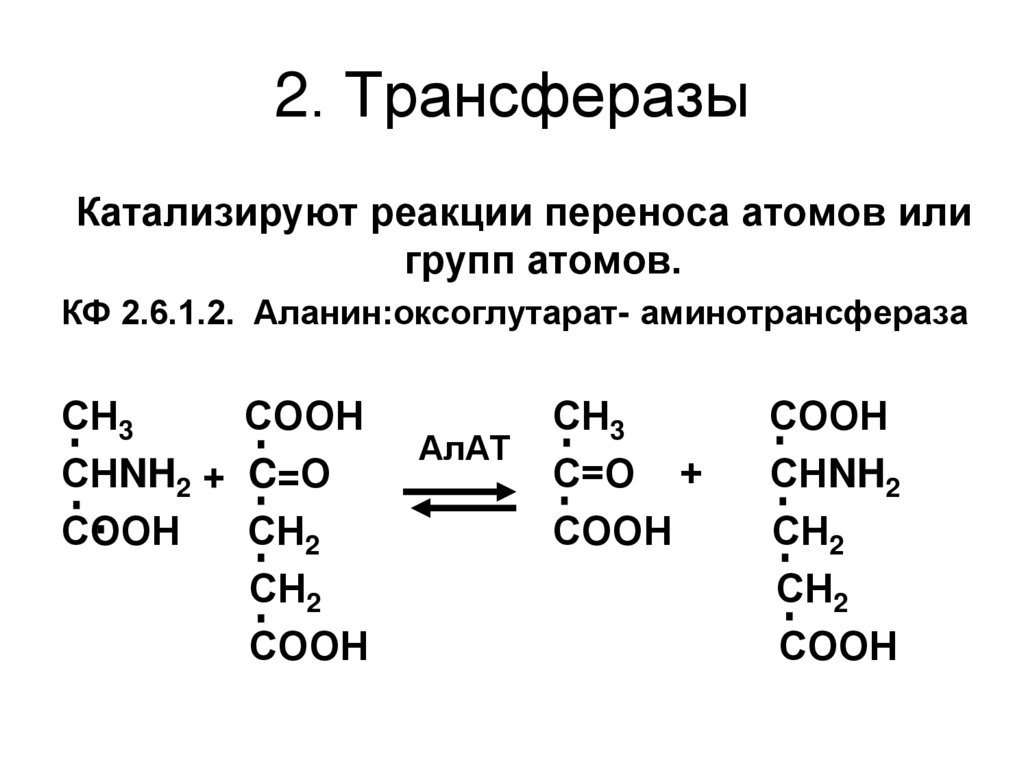
57. 2. Трансферазы
Катализируют реакции переноса атомов илигрупп атомов.
КФ 2.6.1.2. Аланин:оксоглутарат- аминотрансфераза
СН3
СООН
СНNH2 + C=О
СООН
СН2
СН2
СООН
АлАТ
СН3
С=О +
СООН
СООН
СНNH2
СН2
СН2
СООН
58. 3. Гидролазы
Расщепляют ковалентные связи сучастием молекул воды
3.1.1.3 - липаза
3.2.1.1. - альфа-амилаза
3.4.3.2. - дипептидаза
59. 4. Лиазы
Разрывают ковалентныесвязи без участия молекул
воды
4.1.1.1. – пируватдекарбоксилаза
(разрывают связи -С-С-)
4.2.1.1. – карбоангидраза
(разрывают связи -С-О-)
4.3.1.1. – аспартат: аммиак-лиаза
(разрывают связи -С-N-)
60. 5. Изомеразы
Превращают один вид изомера в другой5.2.1.3 ретинен цис: транс-изомераза
(ретиненизомераза)
5.3.1.1. триозофосфат - изомераза
сн2он
н-с=о
с=о
сн2он
сн2оРо3н2
сн2о
РО3Н2
61. 6. Лигазы (синтетазы)
Участвуют в синтезе новых веществ,путем соединения молекул друг с
другом
6.1.1.1. тирозин: т-РНК - лигаза
6.3.1.2. глутамат: аммиак - лигаза
62.
Применение ферментов в медицине.1. Для диагностики заболеваний;
2. Для оценки тяжести протекания болезни;
3. Для контроля качества лечения;
4. В качестве контроля времени выздоровления;
5. Применение ферментов в виде лекарственных
средств;
6. Использование ферментов в аналитической практике
– для измерения концентрации веществ в
биологических жидкостях (кровь, моча и др.)
63.
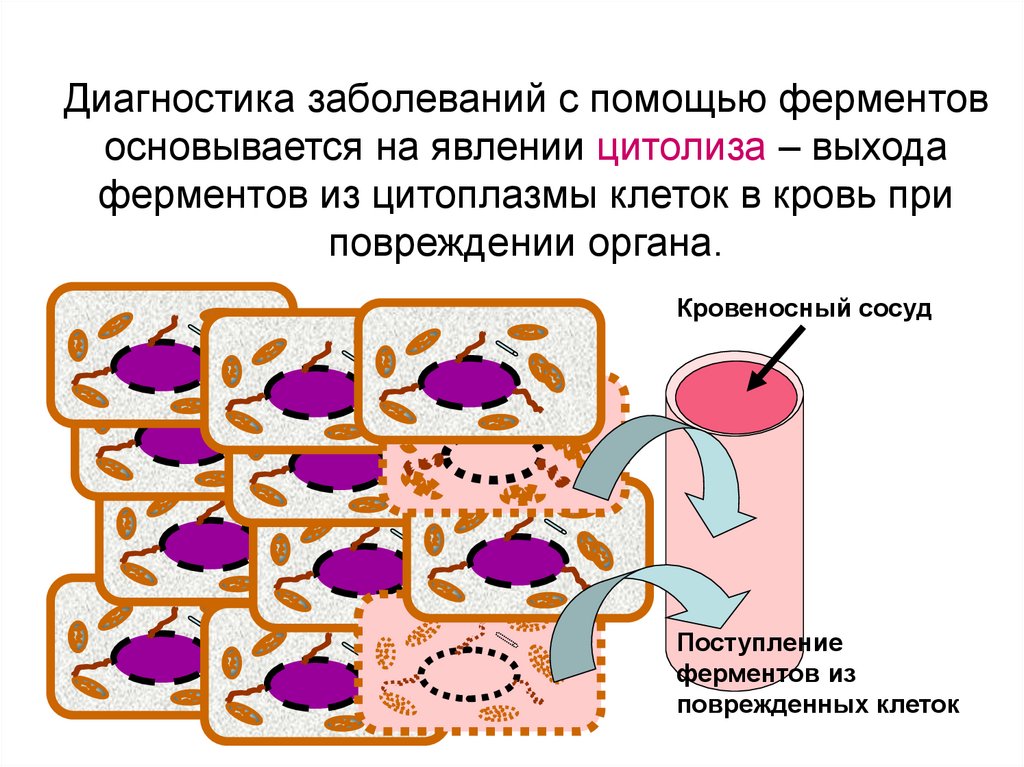
Диагностика заболеваний с помощью ферментовосновывается на явлении цитолиза – выхода
ферментов из цитоплазмы клеток в кровь при
повреждении органа.
Кровеносный сосуд
Поступление
ферментов из
поврежденных клеток
64.
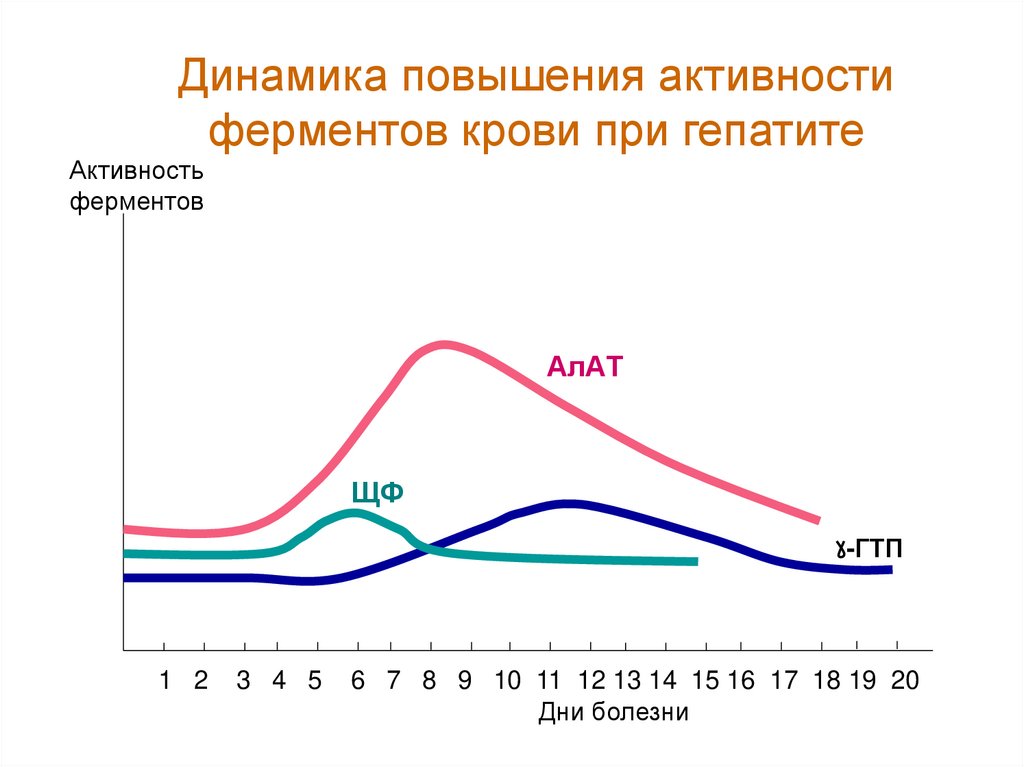
Динамика повышения активностиферментов крови при гепатите
Активность
ферментов
АлАТ
ЩФ
-ГТП
1 2
3 4 5
6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Дни болезни
65.
Применение ферментов в качествелекарственных средств
1. Заместительная терапия (пепсин, ферменты
поджелудочной железы);
2. В хирургической практике для очищения ран
(трипсин, химотрипсин);
3. В качестве противовирусных средств
(рибонуклеаза, дезоксирибонуклеаза);
4. Для растворения тромбов в сосудах
(фибринолизин, стрептолиаза);
5. Для удаления рубцов и спаек (гиалуронидаза,
лидаза);
6. Для лечения рака крови (аспарагиназа)
66.
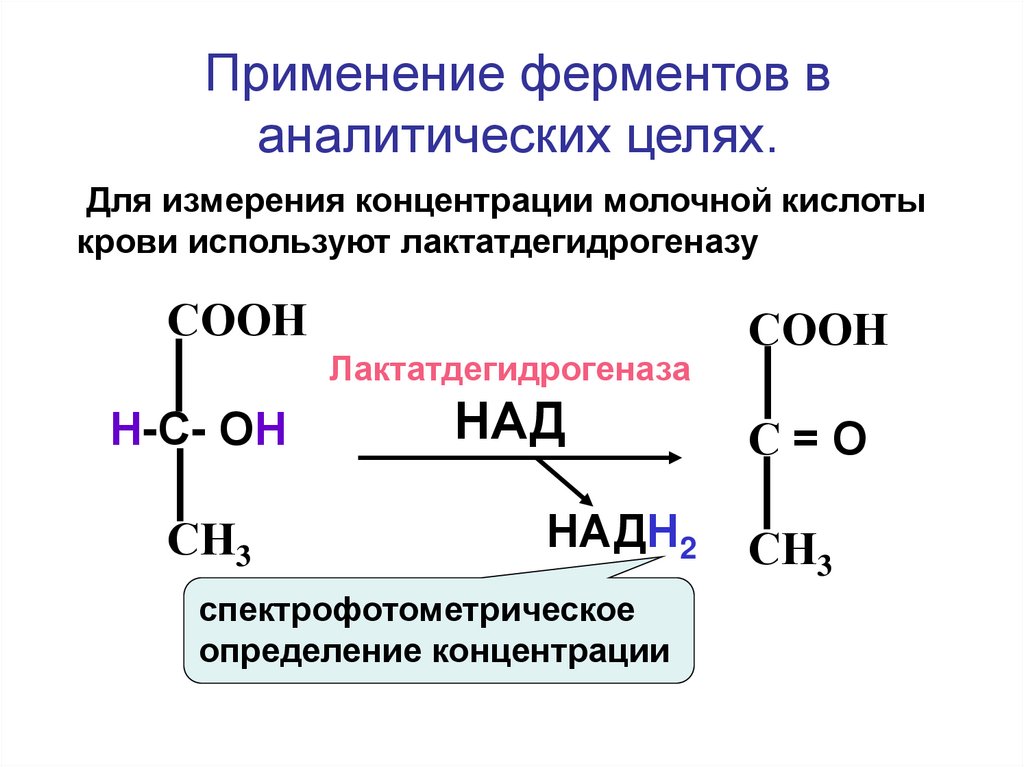
Применение ферментов ваналитических целях.
Для измерения концентрации молочной кислоты
крови используют лактатдегидрогеназу
СООН
Лактатдегидрогеназа
Н-С- ОН
СН3
НАД
НАДН2
спектрофотометрическое
определение концентрации
СООН
С=О
СН3































 biology
biology








