Similar presentations:
Предмет и задачи биохимии. Ферменты. Регуляция активности ферментов. (Лекция 3)
1. Регуляция активности ферментов (регуляция скорости ферментативных реакций)
1. Эффекторы. Типы. Механизмы действия.2.Уровни регуляции активности ферментов;
3.Механизмы регуляции активности регуляторных
ферментов.
4. Изоферменты
2. Влияние эффекторов на активность (скорость реакции) ферментов
• Эффекторы – вещества, которые связываясь смолекулой фермента, ингибируют( ингибиторы) или
усиливают (активаторы) активность фермента.
• Эффекторы:
а. метаболиты, гормоны, образующиеся в организме,
регулируют метаболизм, направляя его в нужное
русло.
б. лекарственные препараты
В. яды.
3. Ингибиторы. Типы.
• По степени прочности связывания с ферментомделят на необратимые и обратимые.
• Обратимые ингибиторы – нековалентно
связываются с ферментами, образуя комплекс
E I , который способен диссоциировать при
определенных условиях. Активность фермента
восстанавливается
EI
E+I
4. Ингибиторы. Типы.
• Необратимые ингибиторы – ковалентносвязываются c ферментом, образуя прочный
комплекс E I , который препятствуют образованию
нормального комплекса ES.
EI – практически не диссоциирует.
Примеры: яды !!( ДФФ- диизопропилфторфосфат) –
нервнопаралитический яд. Ингибируют фермент
ацетилхолинэстеразу, которая участвует в передаче
нервных импульсов от нейрона к нейрону. (На его основе
– синтезированы многие инсектициды)
Лекарственные препараты:
Аспирин – противовоспалительный нестероидный препарат.
Ингибирует фермент циклооксигеназу, который катализирует
образование простагландинов из арахидоновой кислоты.
Ингибированные молекулы фермента разрушаются.
Простагландины – медиаторы воспаления. Их синтез
восстанавливается только после синтеза новых молекул
фермента.
5. Типы обратимых ингибиторов. Конкурентные ингибиторы
• Обратимые ингибиторы делят на конкурентные инеконкурентные.
• К конкурентным ингибиторам (тип ингибирования
конкурентный) относят эффекторы, которые обратимо
ингибируют активность фермента, путем связывания с
активным центром фермента. Ингибитор структурный
аналог субстрата. В результате чего возникает
конкуренция субстрата и ингибитора за активный центр
фермента. Виды взаимодействия молекул в этой
ситуации:
E+S → ES→E+P;
E+I→EI
6. Результат действия конкурентного ингибирования на графике зависимости V от [S]
контрольС ингибитором
Км –повышается; V max – const. При достаточно высокой [S]
субстрат вытесняет ингибитор из активного центра
7. Конкурентные ингибиторы
• Тип ингибирования распространен в организме:• Конкурентными ингибиторами могут быть: промежуточные,
конечные метаболиты, образующиеся в ходе метаболизма
(антиметаболиты).
Примеры:
А.(В метаболизме:)
Глюкоза-6-фосфат
Из гликогена,
глюконеогенеза
Б.(В медицине)
Метиловый спирт
Этанол
фосфатаза
глюкоза + Р
При достаточном уровне глюкозы реакция
замедляется, т.к. глюкоза сходна по
структуре с субстратом и конкурентно
тормозит фосфатазу. Регуляция уровня
сахара.
Ал-дегидрогеназа
формальдегид
Этанол
вытесняет
ацетоальдегид
мет. из
актив.центра
8. Неконкурентные ингибиторы
• Неконкурентные ингибиторы. Тип ингибирования– неконкурентный.
Неконкурентный ингибитор не обладает сходством
структуры с субстратом и связывается с
ферментом вне активного центра (иногда
затрагивается каталитический участок).
Образуется тройной неактивный комплекс:
E+S+ I
ESI
Сродство фермента к субстрата не изменяется, т.е.
Км – не меняется
9. Результат действия неконкурентного ингибитора на графике зависимости [S]
контрольV
с ингибитором
1/2Vмах
1/2Vмах
Км
[S]
Км – не изменяется; Vмах – снижается. При увеличении
концентрации субстрата ингибирование не снижается.
10. Уровни регуляции скорости ферментативных реакций
Для сохранения клеточного гомеостаза в
клетках
скорости ферментативных
реакций в клетке изменяются в зависимости
от условий среды и физиологического
состояния организма (гипоксия, голод,
физические нагрузки, стресс).
Регуляция скорости реакции в клетке
осуществляется на 3-х независимых уровнях:
1. Регуляция количества фермента в клетке;
2. Наличие и концентрация субстрата в клетке;
3. Изменение активности фермента
11. 1. Регуляция количества молекул фермента в клетке
• Количество ферментов определяетсясоотношением скоростей двух процессов –
синтеза, фолдинга белка и распада белка в клетке
(тканевой протеолиз):
синтез
Аминокислоты
фермент (белок)
распад
Синтез и фолдинг регулируются на разных этапах .
Наиболее изучен механизм на уровне транскрипции(индукция – активация; репрессия – угнетение). Регуляция
осуществляется метаболитами, гормонами и др.
Регуляция распада ( протеолиз) менее изучена, но также,
вероятно, на генетическом уровне.
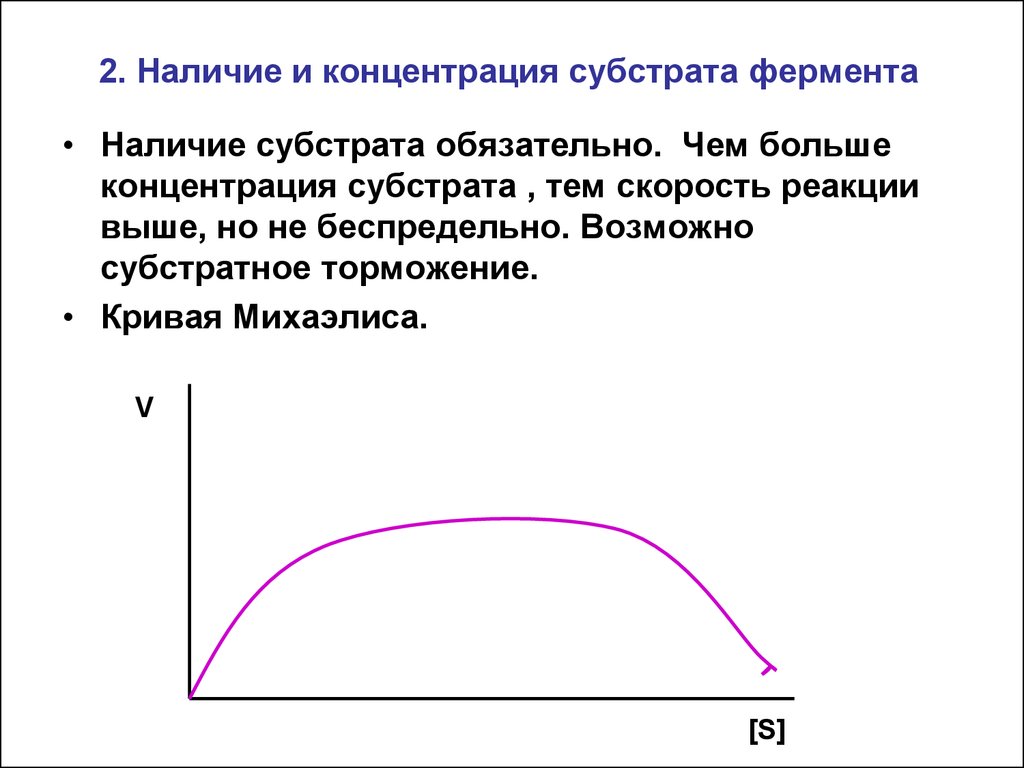
12. 2. Наличие и концентрация субстрата фермента
• Наличие субстрата обязательно. Чем большеконцентрация субстрата , тем скорость реакции
выше, но не беспредельно. Возможно
субстратное торможение.
• Кривая Михаэлиса.
V
[S]
13. 3. Регуляция каталитической активности ключевого (регуляторного) фермента метаболического пути
1.
2.
3.
4.
Высокоэффективный способ регуляции
метаболизма.
Основные механизмы регуляции каталитической
активности регуляторного ферментов:
Аллостерическая регуляция;
Регуляция путем ассоциации/диссоциации
протомеров молекул ферментов;
Регуляция путем фосфорилирования/
дефосфорилирования молекулы фермента;
Регуляция путем частичного протеолиза
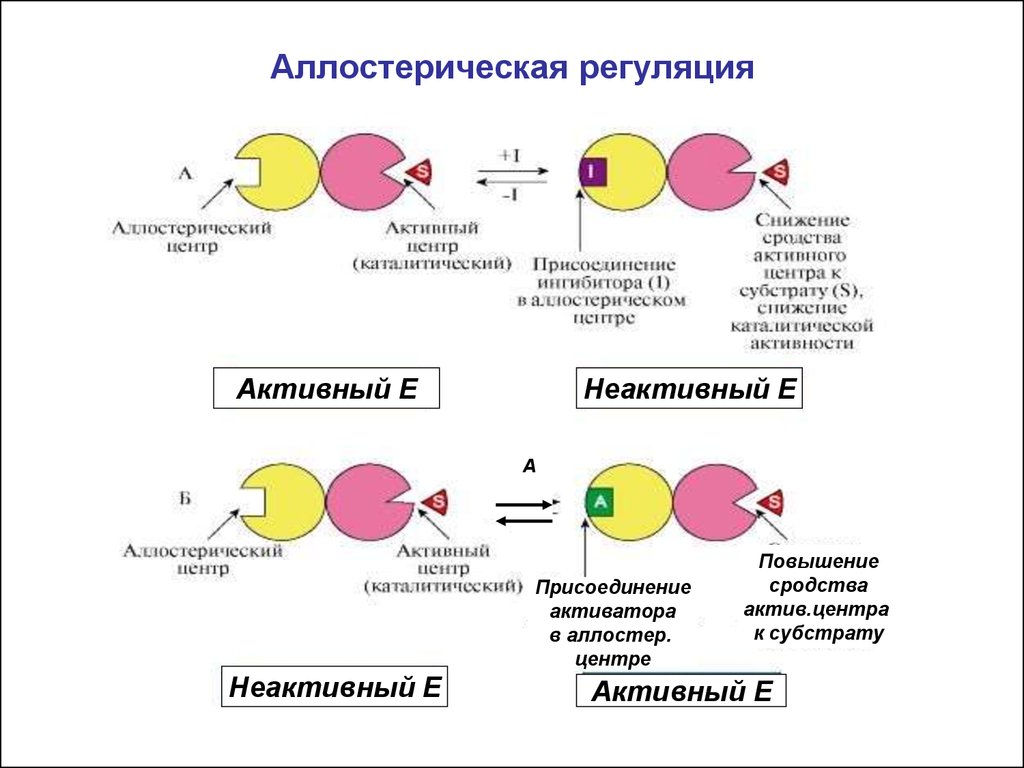
14. Аллостерическая регуляция
• Характерна для олигомерных ферментов(четвертичная структура). В структуре имеются
каталитические протомеры( с активным центром) и
протомеры - регуляторные ( с аллостерич. центром)
• Аллостерические ферменты меняют активность не
только от концентрации субстрата , но и под
действием эффекторов (результат- изменение
конфигурации молекулы и активного центра).
• Аллостерические ферменты- регуляторные ферменты
метаболических путей, катализируют 1-ю
необратимую (самую медленную) реакцию
метаболического пути.
• Активность остальных ферментов этого пути от [S]
• S
P1
P2
P3→
P
E1
E2
E3
E4
15. Аллостерические эффекторы
• Отличаются по химической природе отсубстрата.
• Активаторы и ингибиторы.
• Аллостерические ингибиторы- конечный продукт
метаболического пути. Аллостерическое
ингибирование распространено в регуляции
скорости метаболических путей.
• Аллостерическое ингибирование часто называют
– механизм отрицательной обратной связи
E1
• S
E2
P1
E4
E3
P2
P3
P
16. Аллостерическая регуляция
Активный EНеактивный E
А
Присоединение
активатора
в аллостер.
центре
Неактивный E
Повышение
сродства
актив.центра
к субстрату
Активный E
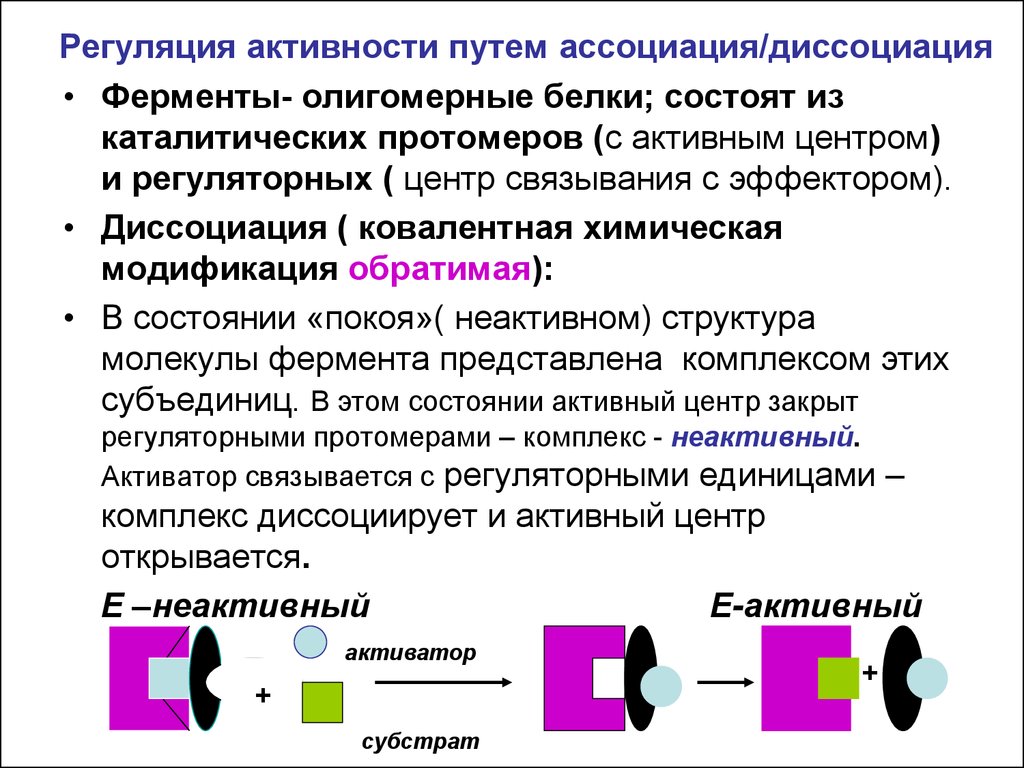
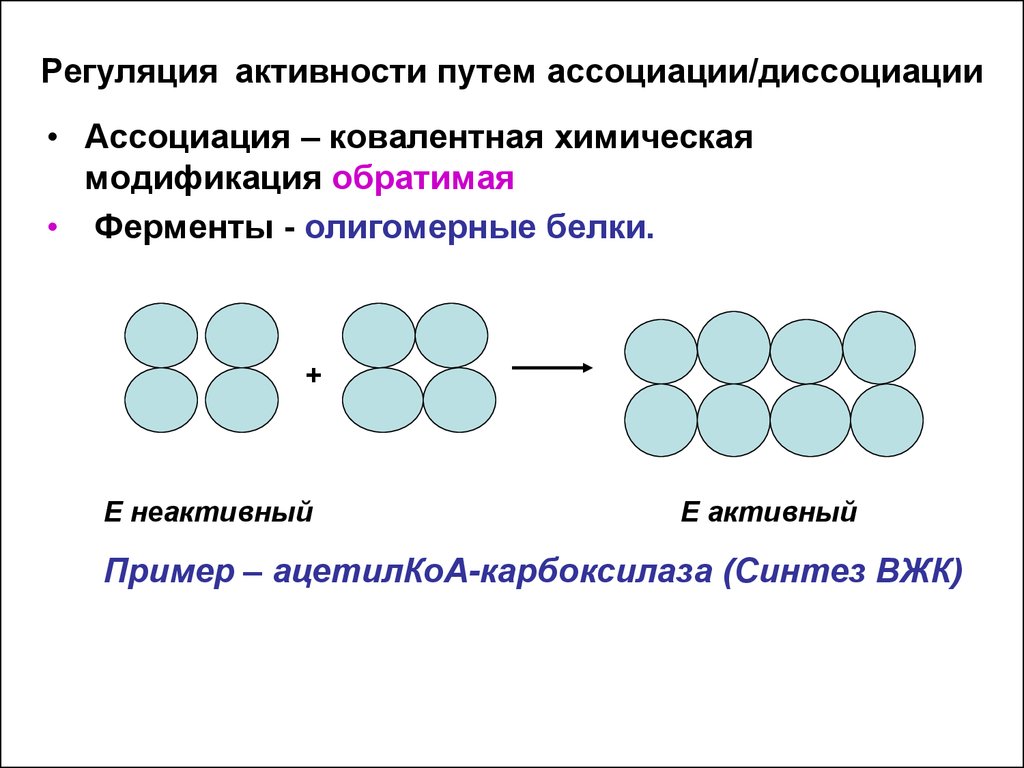
17. Регуляция активности путем ассоциация/диссоциация
• Ферменты- олигомерные белки; состоят изкаталитических протомеров (с активным центром)
и регуляторных ( центр связывания с эффектором).
• Диссоциация ( ковалентная химическая
модификация обратимая):
• В состоянии «покоя»( неактивном) структура
молекулы фермента представлена комплексом этих
субъединиц. В этом состоянии активный центр закрыт
регуляторными протомерами – комплекс - неактивный.
Активатор связывается с регуляторными единицами –
комплекс диссоциирует и активный центр
открывается.
E –неактивный
E-активный
активатор
+
субстрат
+
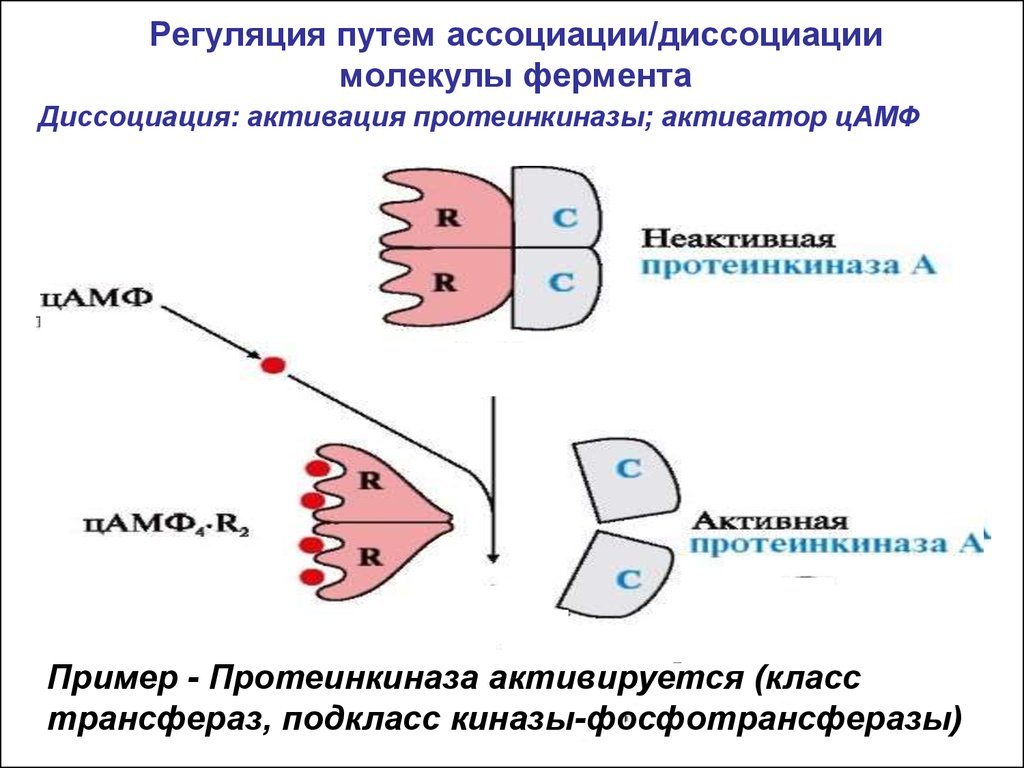
18. Регуляция путем ассоциации/диссоциации молекулы фермента
Диссоциация: активация протеинкиназы; активатор цАМФактиватор
Пример - Протеинкиназа активируется (класс
трансфераз, подкласс киназы-фосфотрансферазы)
19. Регуляция активности путем ассоциации/диссоциации
• Ассоциация – ковалентная химическаямодификация обратимая
• Ферменты - олигомерные белки.
+
E неактивный
E активный
Пример – ацетилКоА-карбоксилаза (Синтез ВЖК)
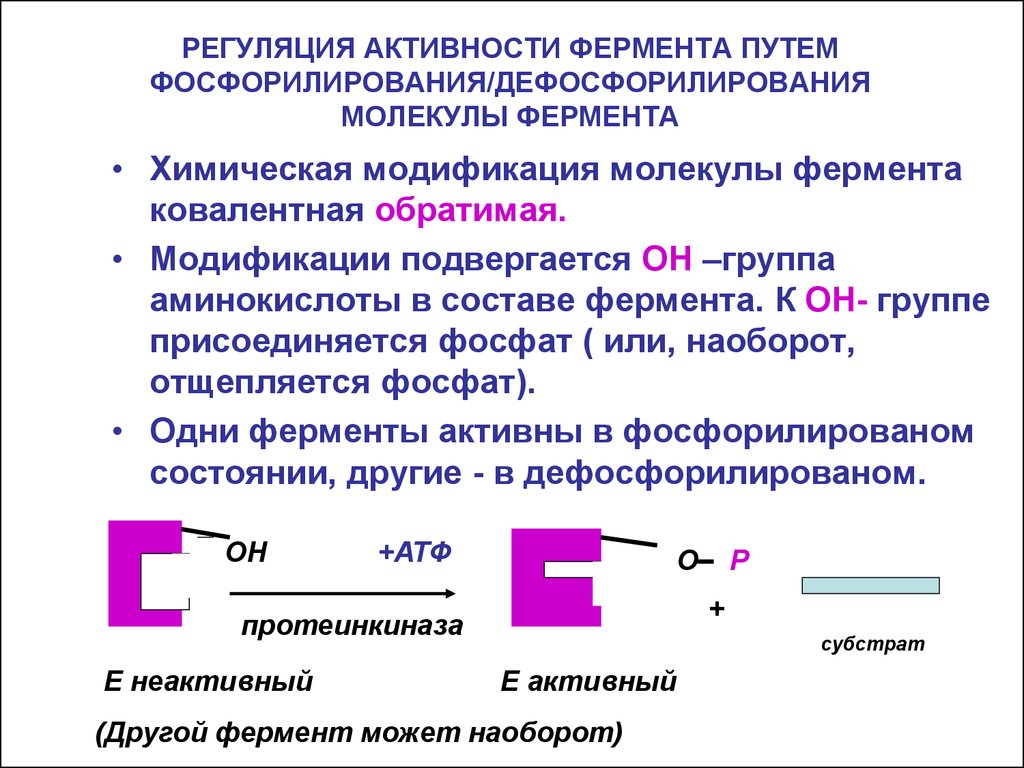
20. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА ПУТЕМ ФОСФОРИЛИРОВАНИЯ/ДЕФОСФОРИЛИРОВАНИЯ МОЛЕКУЛЫ ФЕРМЕНТА
• Химическая модификация молекулы ферментаковалентная обратимая.
• Модификации подвергается ОН –группа
аминокислоты в составе фермента. К ОН- группе
присоединяется фосфат ( или, наоборот,
отщепляется фосфат).
• Одни ферменты активны в фосфорилированом
состоянии, другие - в дефосфорилированом.
ОН
+АТФ
О
+
протеинкиназа
E неактивный
Р
субстрат
E активный
(Другой фермент может наоборот)
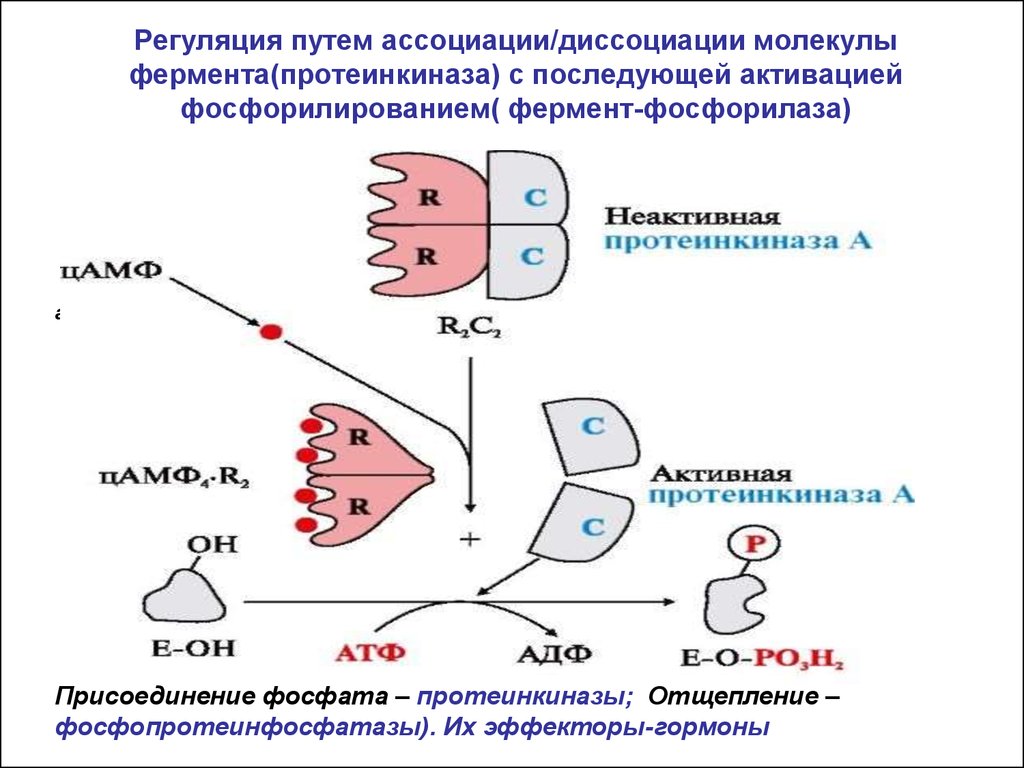
21. Регуляция путем ассоциации/диссоциации молекулы фермента(протеинкиназа) с последующей активацией фосфорилированием( фермент-фосфорилаз
Регуляция путем ассоциации/диссоциации молекулыфермента(протеинкиназа) с последующей активацией
фосфорилированием( фермент-фосфорилаза)
активатор
Присоединение фосфата – протеинкиназы; Отщепление –
фосфопротеинфосфатазы). Их эффекторы-гормоны
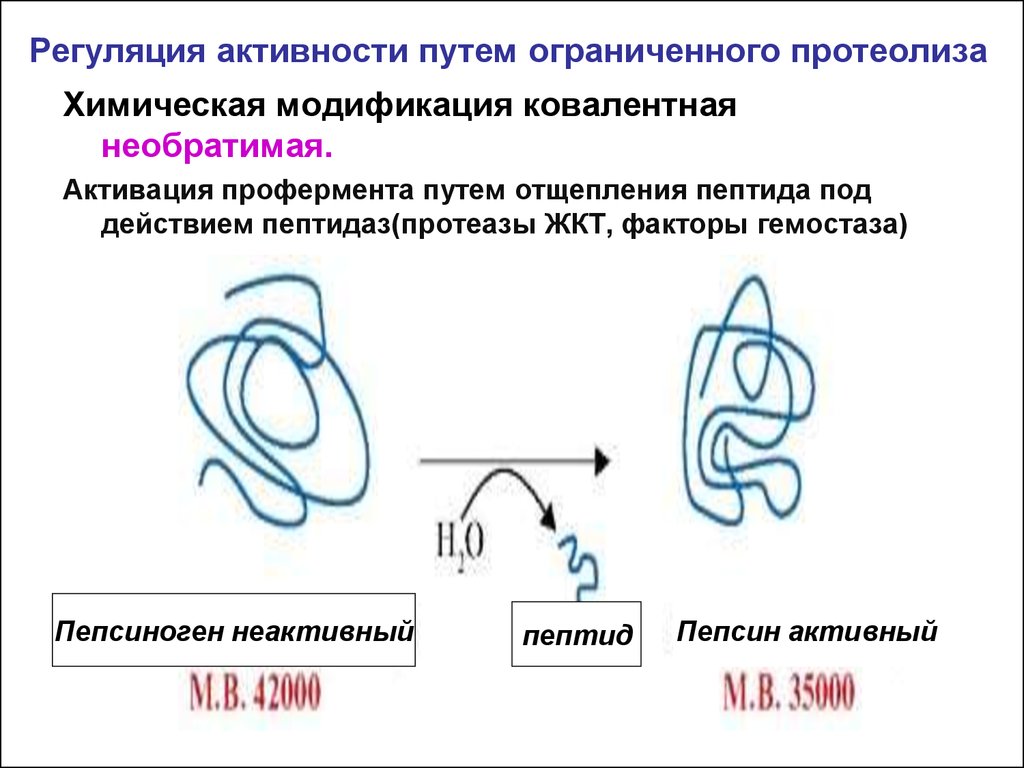
22. Регуляция активности путем ограниченного протеолиза
Химическая модификация ковалентнаянеобратимая.
Активация профермента путем отщепления пептида под
действием пептидаз(протеазы ЖКТ, факторы гемостаза)
Пепсиноген неактивный
пептид
Пепсин активный
23. Изоферменты
• Изоферменты – множественные формыферментов, которые катализируют один тип
реакции в разных тканях, но отличаются по
составу, заряду и иммунологическим свойствам.
• Это олигомерные белки.
• например: лактатдегидрогеназа:
Лактат +НАД
Пировиноградная кислота +НАДН
это тетрамер состоит из двух типов протомеров (субъединиц), Н –
сердце ( heart) и М –мышцы( muscle) – Существует 5 изомеров.
Строго распределены по органам.
ЛДГ1(Н4); ЛДГ2 (Н3М1); ЛДГ3 (Н2М2); ЛДГ4 (Н1М3); ЛДГ5 (М4)
Определяются с помощью электрофореза. Принцип методаразная скорость движения в электрическом поле всвязи с
разным зарядом и ММ.





![Результат действия конкурентного ингибирования на графике зависимости V от [S] Результат действия конкурентного ингибирования на графике зависимости V от [S]](https://cf.ppt-online.org/files/slide/c/CEfpe7HWVP6cig9URKx4XIrGvhsNBzmtQuZwDY/slide-5.jpg)


![Результат действия неконкурентного ингибитора на графике зависимости [S] Результат действия неконкурентного ингибитора на графике зависимости [S]](https://cf.ppt-online.org/files/slide/c/CEfpe7HWVP6cig9URKx4XIrGvhsNBzmtQuZwDY/slide-8.jpg)






 biology
biology chemistry
chemistry








