Similar presentations:
Регуляция активности ферментов
1. Регуляция активности ферментов
РЕГУЛЯЦИЯ АКТИВНОСТИФЕРМЕНТОВ
2.
Регуляция активности ферментов можетосуществляться через действия специальных
веществ, которые называются «эффекторами»
или регуляторами ферментов. Регуляторы
ферментов могут присутствовать как в самом
организме, так и поступать из вне. В
зависимости от влияния на скорость реакции
эффекторы делятся на активаторы и
ингибиторы.
3. Активация ферментов
АКТИВАЦИЯ ФЕРМЕНТОВВыделяют 3 основных способа активирования
ферментов:
1. Аллостерическая активация
2. Постсинтетическая модификация
3. Ограниченный протеолиз
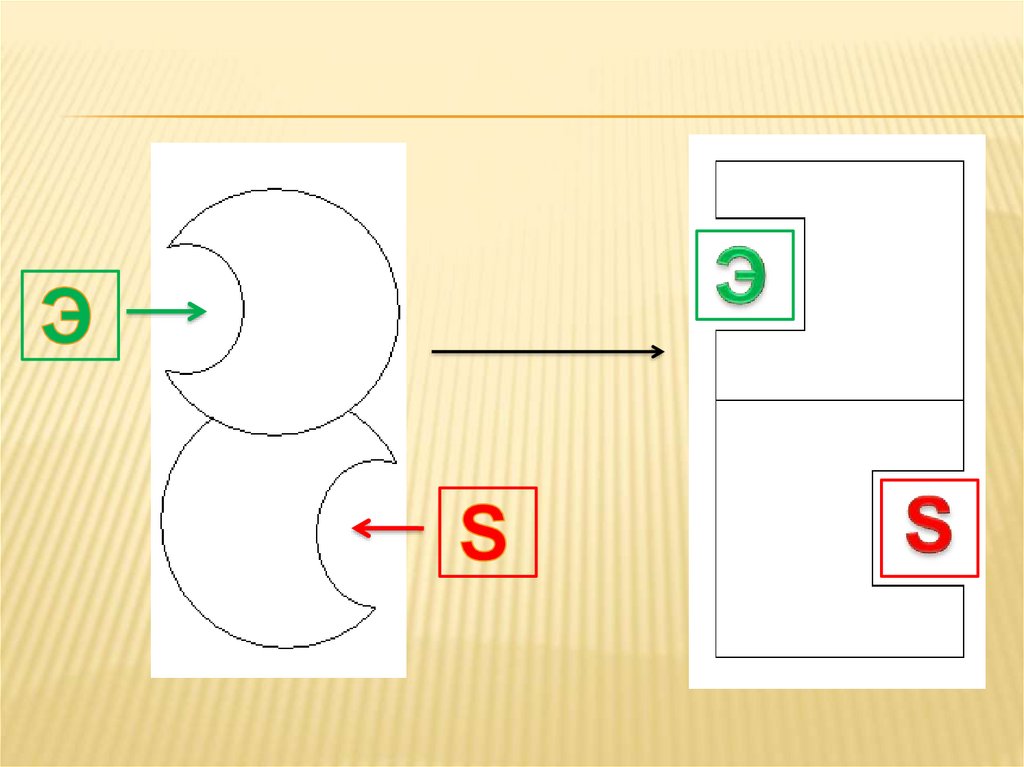
4. Аллостерическая активация
АЛЛОСТЕРИЧЕСКАЯ АКТИВАЦИЯПри данном типе активации эффектор
присоединяется к специальному
регуляторному центру, который называется
аллостерическим.
5.
6.
Аллостерические ферменты построены, какправило, из двух или большего числа
субъединиц. Одна из субъединиц
каталитическая (содержит каталитический
центр), другая – регуляторная (содержит
аллостерический центр).
7.
Присоединение эффектора к регуляторнойсубъединице, приводит к изменению ее
конформации, вследствие чего изменяется
конформация и каталитической субъединицы
(кооперативный эффект), в т.ч. и
каталитического активного центра, в сторону
увеличения его комплиментарности к
субстрату. Таким образом действуют
метаболиты, гормоны, некоторые ионы
металлов и анионы.
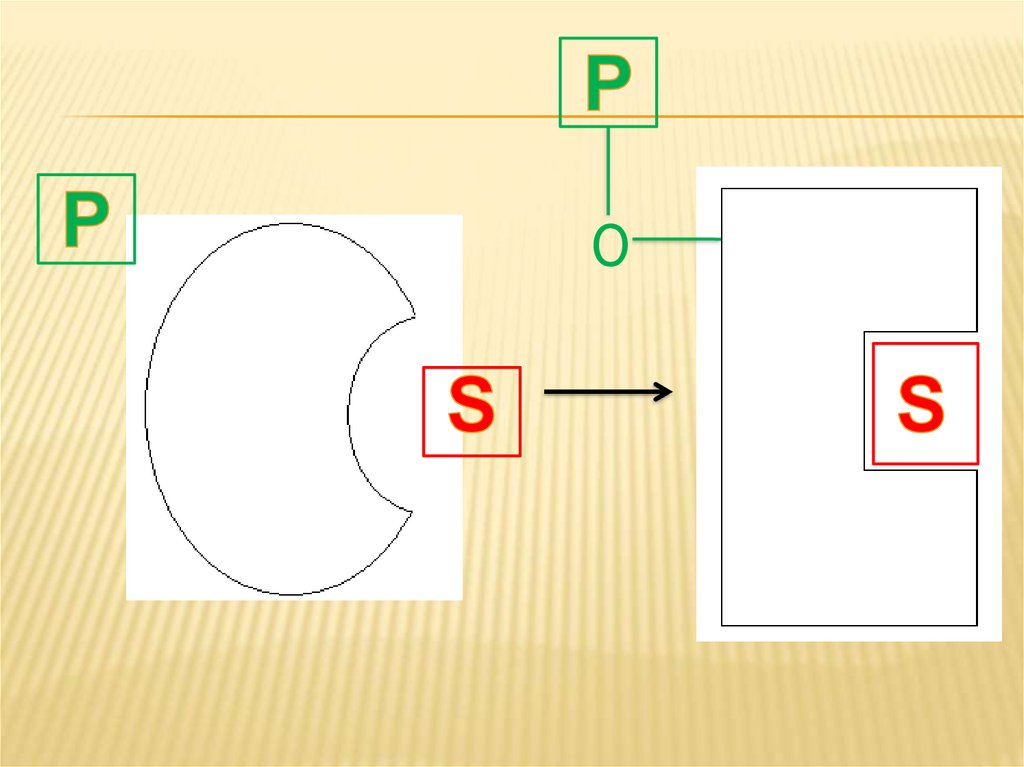
8. Постсинтетическая модификация фермента
ПОСТСИНТЕТИЧЕСКАЯ МОДИФИКАЦИЯФЕРМЕНТА
При данном способе активирования
специальным ферментом, который
называется «протеинкиназа» к белковой
молекуле активируемого фермента
добавляется фосфатная группа.
9.
О10.
Добавление фосфатной группы меняеттретичную структуру фермента и его
активного центра в сторону увеличения его
комплиментарности к субстрату.
11.
Протеинкиназа активирует липазу путемфосфорилирования
Липаза + АТФ протеинкиназа Липаза*OPO3H2 + АДФ
Фосфорилированная липаза может вновь
превращаться в простой белок под действием
фосфопротеинфосфатазы
Липаза * OPO3H2 + H2О фосфопротеинфосфатаза Липаза +
H3PO4
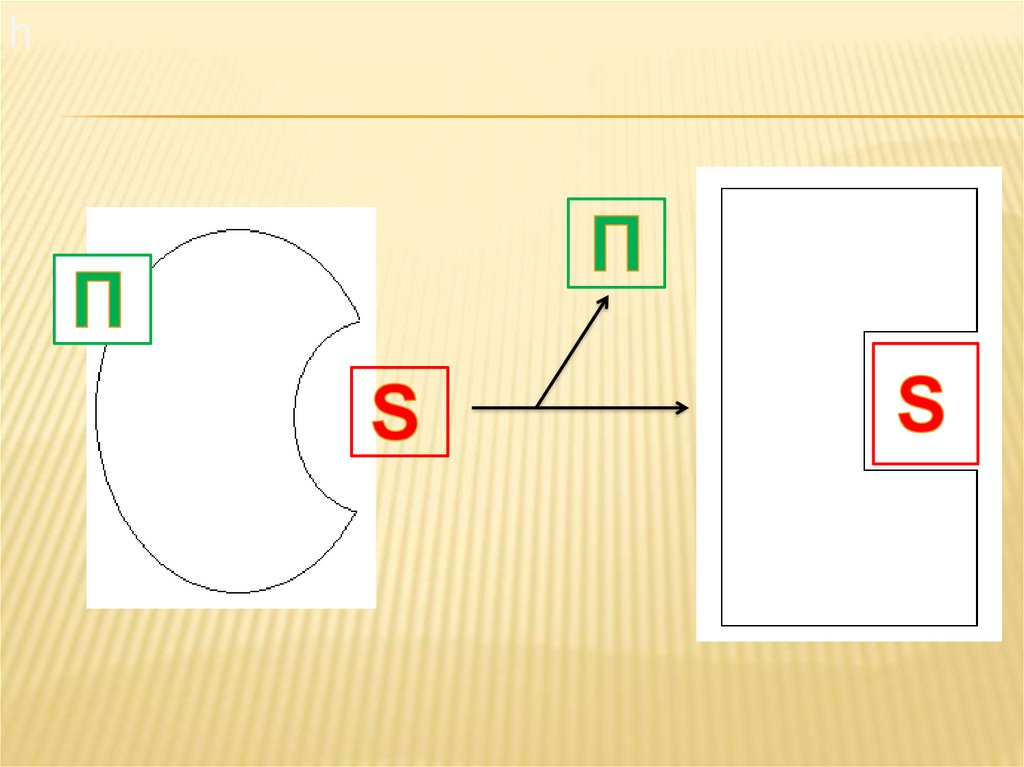
12. Ограниченный протеолиз
ОГРАНИЧЕННЫЙ ПРОТЕОЛИЗМеханизм активации путем ограниченного
протеолиза наиболее характерен для
протеолитических ферментов
(пептидогидралаз). Синтез протеаз в виде
каталитически неактивных
предшественников защищает ткани, в
которых они синтезируются (например, ткань
поджелудочной железы) от
самопереваривания.
13.
Активация ограниченным протеолизомзаключается в отщеплении части
полипептидной цепи профермента
(зимогена), что приводит к изменению
третичной структуры молекулы фермента и
его активного центра в сторону увеличения
комплиментарности к субстрату.
14.
h15.
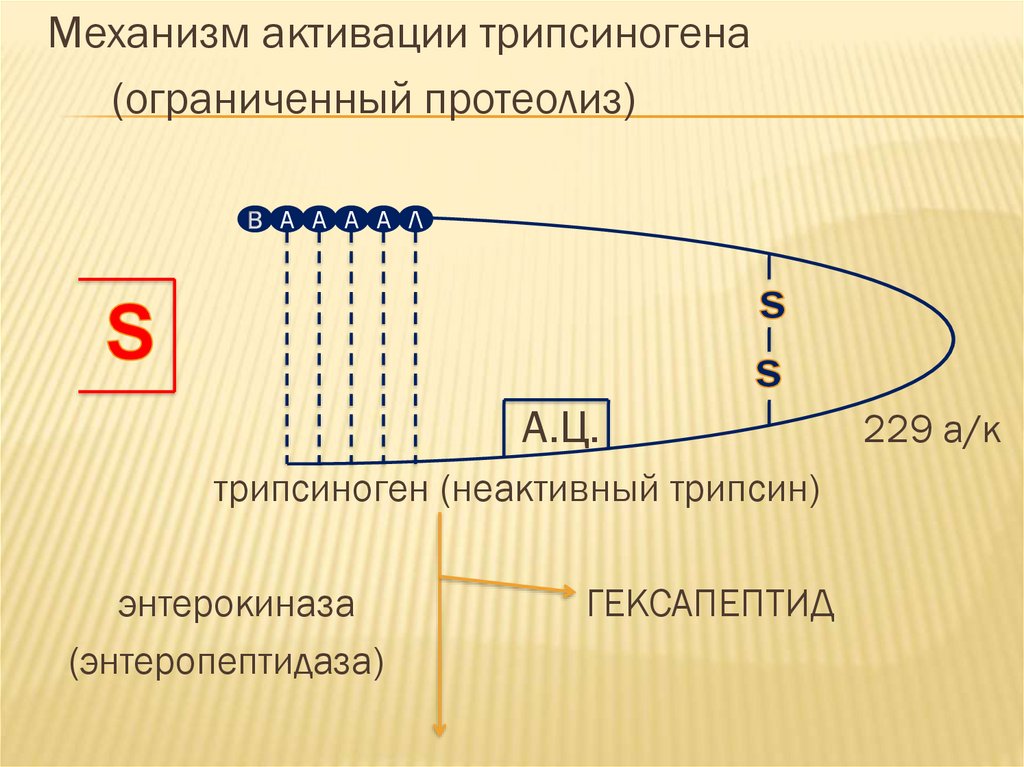
Примером активации путем ограниченногопротеолиза является активация
трипсиногена. Трипсиноген вырабатывается
в клетках поджелудочной железы и является
предшественником протеолитического
фермента трипсина.
16.
Вместе с панкреатическим соком попадет в12-ти перстную кишку и активируется
ферментом, входящим в состав кишечного
сока – энтерокиназой. Механизм активации
представлен на схеме:
17.
Механизм активации трипсиногена(ограниченный протеолиз)
А А А А Л
А.Ц.
трипсиноген (неактивный трипсин)
энтерокиназа
(энтеропептидаза)
ГЕКСАПЕПТИД
229 а/к
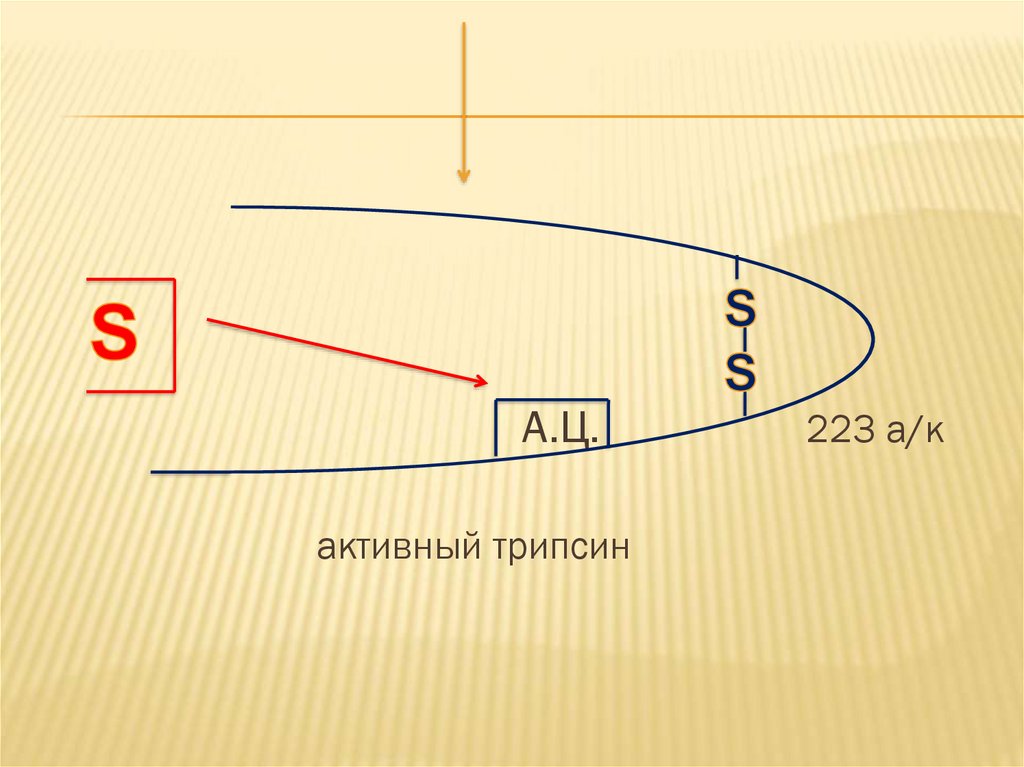
18.
А.Ц.активный трипсин
223 а/к
19.
Активный трипсин уже обладаетспособностью активировать самого себя и
другие ферменты поджелудочной железы.
20. Клинические аспекты
КЛИНИЧЕСКИЕ АСПЕКТЫПри патологии иногда возникает ситуация,
когда происходит активация
протеолитических ферментов не в ЖКТ, а в
самой поджелудочной железе. Данная
ситуация трактуется как острый
некротический панкреатит. В основе терапии
лежит применение препаратов – ингибиторов
трипсина, главным из которых является
трасилол (контрикал).
21. ингибирование
ИНГИБИРОВАНИЕИнгибиторами ферментов называют
вещества, снижающие их активность. По
механизму реализации эффекта различают
следующие виды ингибирования:
22.
Виды ингибирования:I. Конкурентное ингибирование
II. Неконкурентное ингибирование
(а) – обратимое; б) необратимое)
III. Бесконкурентное ингибирование
IV. Субстратное ингибирование
V. Аллостерическое ингибирование
23. Конкурентное ингибирование
КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕПроявляется в борьбе за активный центр
фермента между субстратом и похожим на
него по химическому строению ингибитором,
который занимая место субстрата в активном
центре к дальнейшим превращениям не
способен.
24. Особенности конкурентного ингибирования
ОСОБЕННОСТИ КОНКУРЕНТНОГОИНГИБИРОВАНИЯ
1.
2.
Схожее строение субстрата и конкурентного
ингибитора.
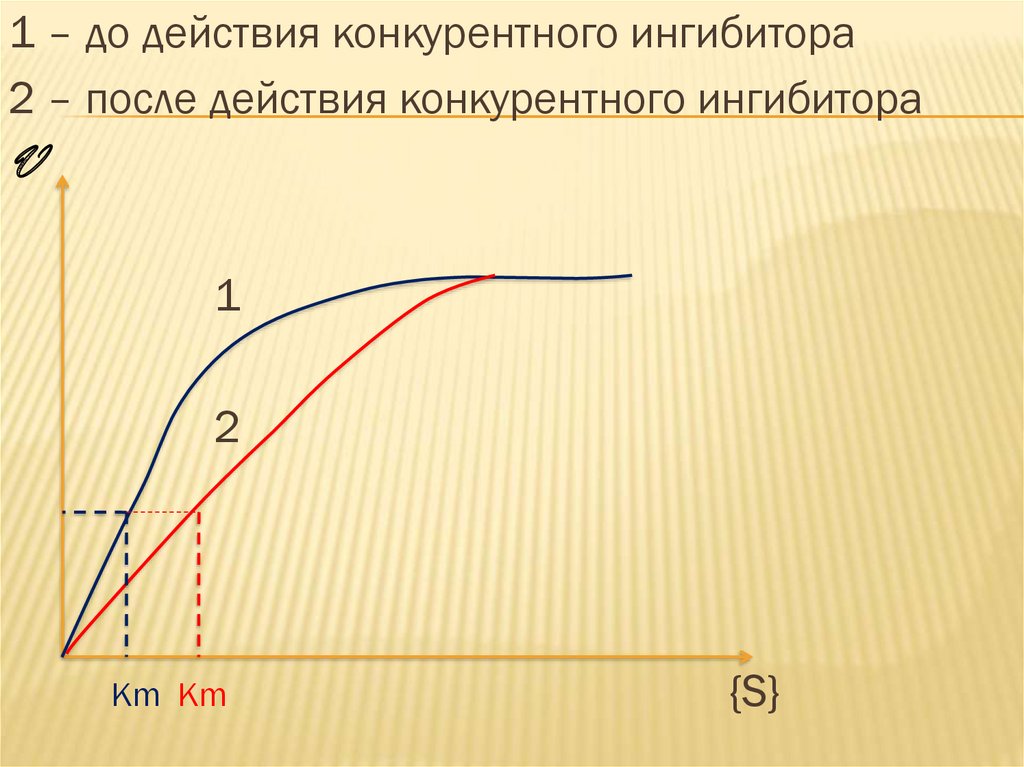
Конкурентное ингибирование всегда
обратимо, поскольку ингибитор может
вытесняться избытком субстрата, т.е.
увеличением константы Михаэлиса.
25.
1 – до действия конкурентного ингибитора2 – после действия конкурентного ингибитора
V
1
2
Km Km
{S}
26.
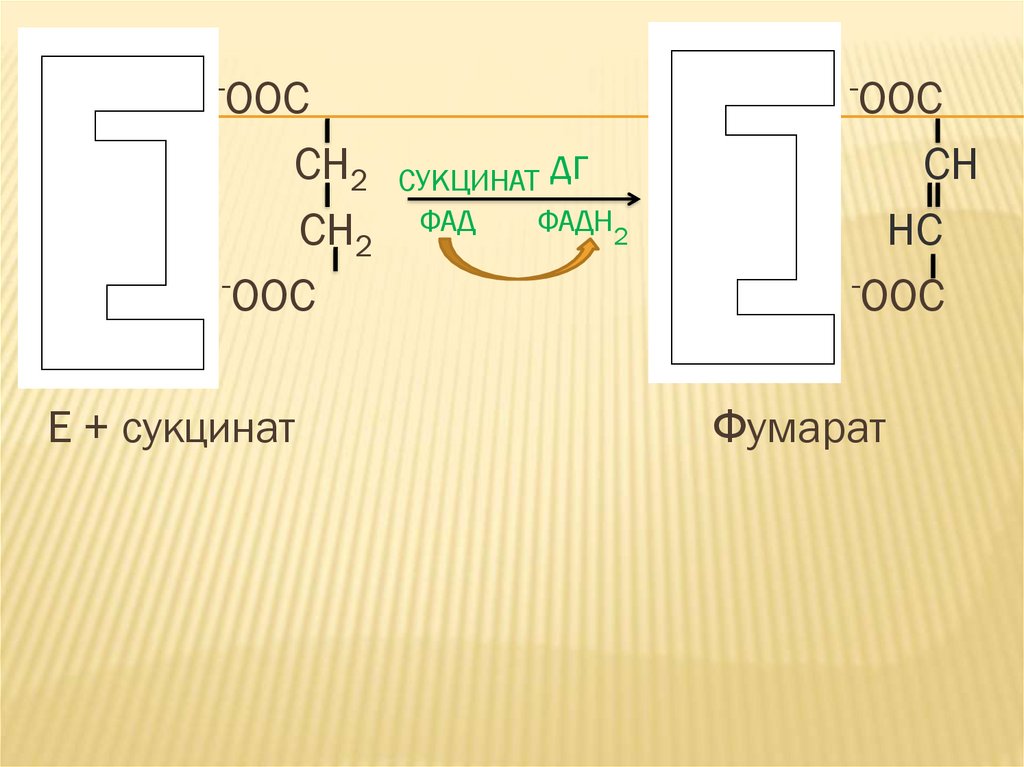
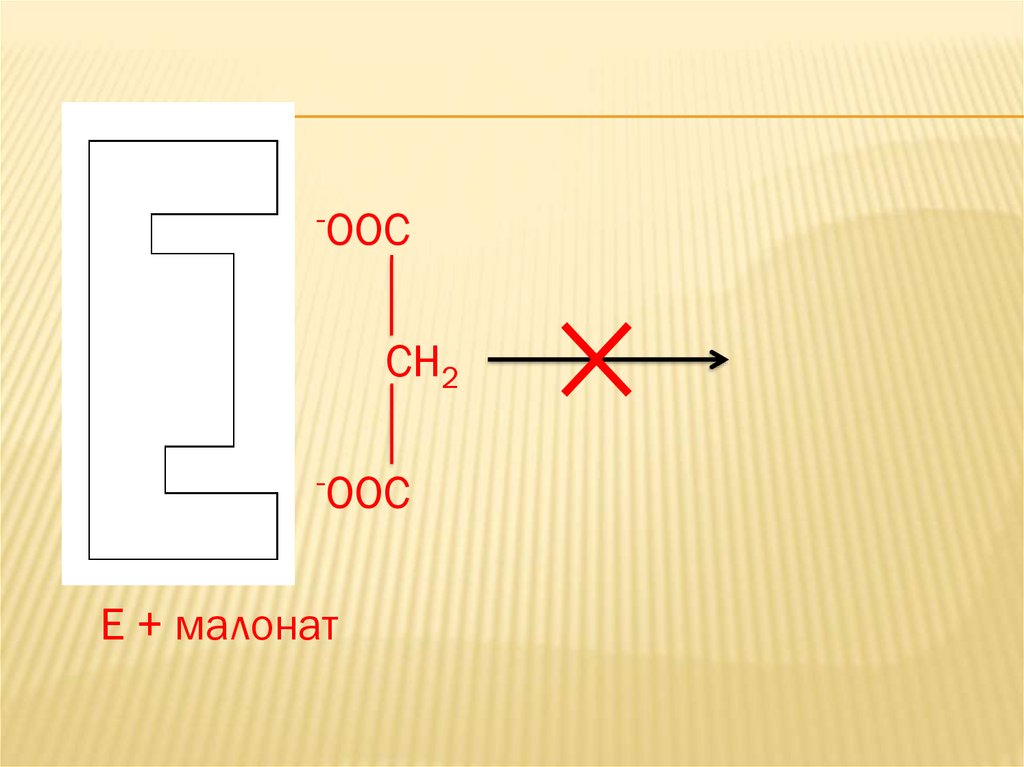
3. Образование тройного комплекса энзим (Е),субстрат (S) и ингибитор (I) невозможно.
Пример: ингибирование
сукцинатдегидрогеназы малоновой кислотой.
27.
-OOCCH2
CH2
-OOC
Е + сукцинат
-OOC
СУКЦИНАТ дг
ФАД
ФАДН2
+
CH
HC
-OOC
Фумарат
28.
-OOCCH2
-OOC
E + малонат
29.
В целом действие конкурентного ингибитораможно представить схемой:
E+I
EI
30. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
При данном виде ингибирования похимическому строению ингибитор и субстрат
не имеют ничего общего, однако, ингибитор
обладает большой степенью сродства к
отдельным функциональным группам
активного центра фермента. В результате
образование ковалентной связи между
ферментом и ингибитором каталитическое
превращение субстрата невозможно.
31.
Иногда неконкурентный ингибиторприсоединяется в другом месте молекулы
энзима инактивируя ее. В зависимости от
прочности связывания ингибирование
выделяют обратимое (диссоциация
комплекса протекает достаточно легко) и
необратимое (когда самопроизвольная
диссоциация комплекса невозможна).
32. Особенности неконкурентного ингибирования
ОСОБЕННОСТИ НЕКОНКУРЕНТНОГОИНГИБИРОВАНИЯ
1.
2.
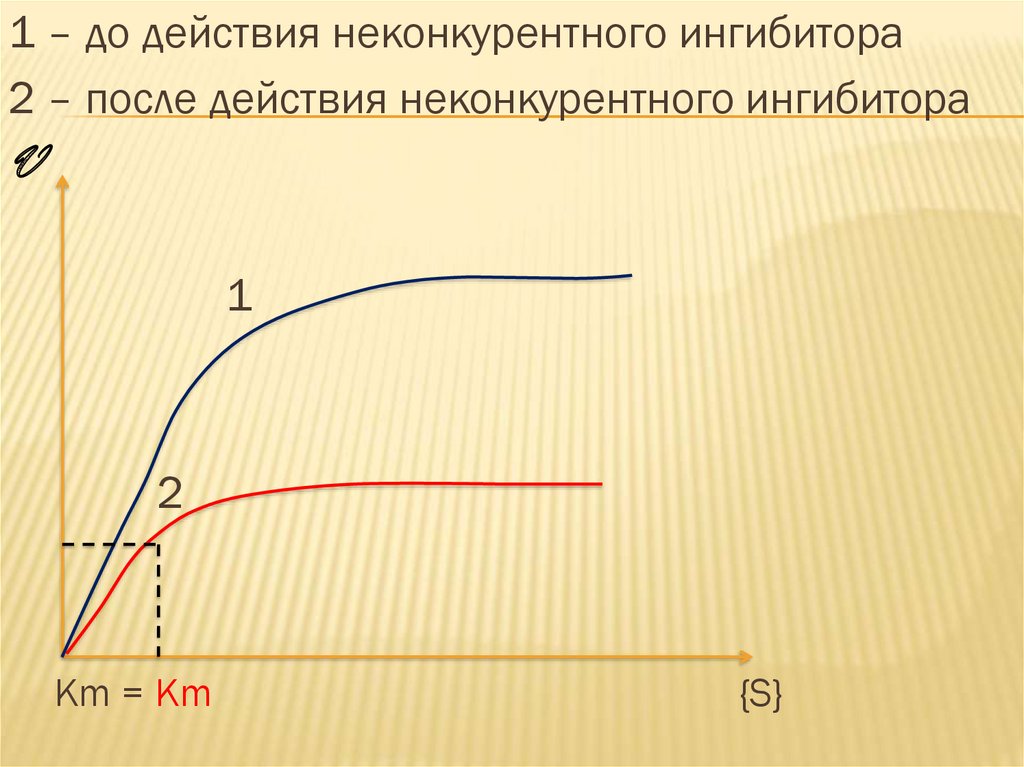
Химическое строение субстрата и
ингибитора не имеет ничего общего.
Неконкурентное ингибирование не
снимается избытком субстрата:
33.
1 – до действия неконкурентного ингибитора2 – после действия неконкурентного ингибитора
V
1
2
Km = Km
{S}
34.
3. Может быть необратимым4. Возможно образование тройного комплекса:
E+S+I
ESI
35.
Необратимое ингибированиерассматривается на примере действия
диизопропилфторфосфата (ДФФ) и
йодацетамида
36.
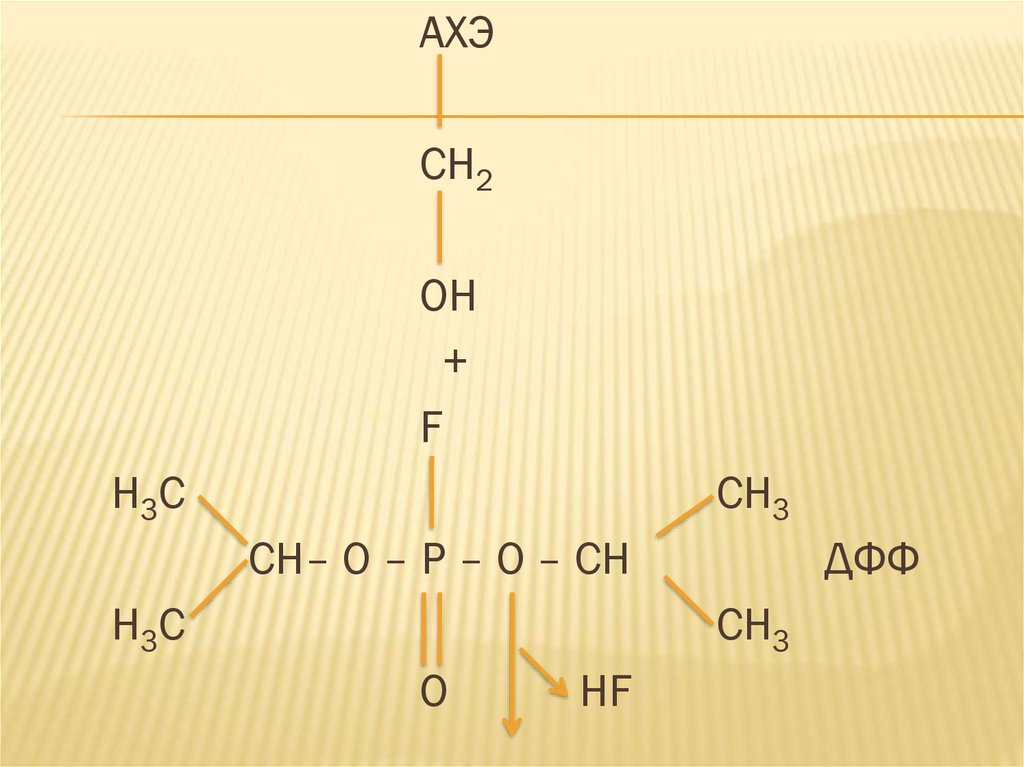
ДФФ относится к группе веществ,объединенных под названием ФОС (ФОВ),
куда входят боевые ОВ, инсектициды,
сильнодействующие лекарственный
препараты. Установлено, что органические
эфиры фосфорной кислоты имеют высокую
степень сродства к аминокислоте серину,
входящего в состав активного центра
фермента и образует с ним прочную
ковалентную связь.
37.
В связи с этим ферменты, имеющие вактивном центре серин, подвергаются
необратимому ингибированию
(ацетилхолинэстераза(АХЭ), химотрипсин).
Биологический эффект ФОС, в первую
очередь, связывают с их действием на АХЭ.
38.
При ингибировании АХЭ ацетилхолиннакапливается в организме, что приводит к
непрерывной передаче нервных импульсов
и, соответственно, непрерывному
сокращению мышечной ткани с развитием
судорог и в дальнейшем паралича.
39.
АХЭCH2
OH
+
F
H3C
CH3
CH– O – P – O – CH
H3C
ДФФ
CH3
О
HF
40.
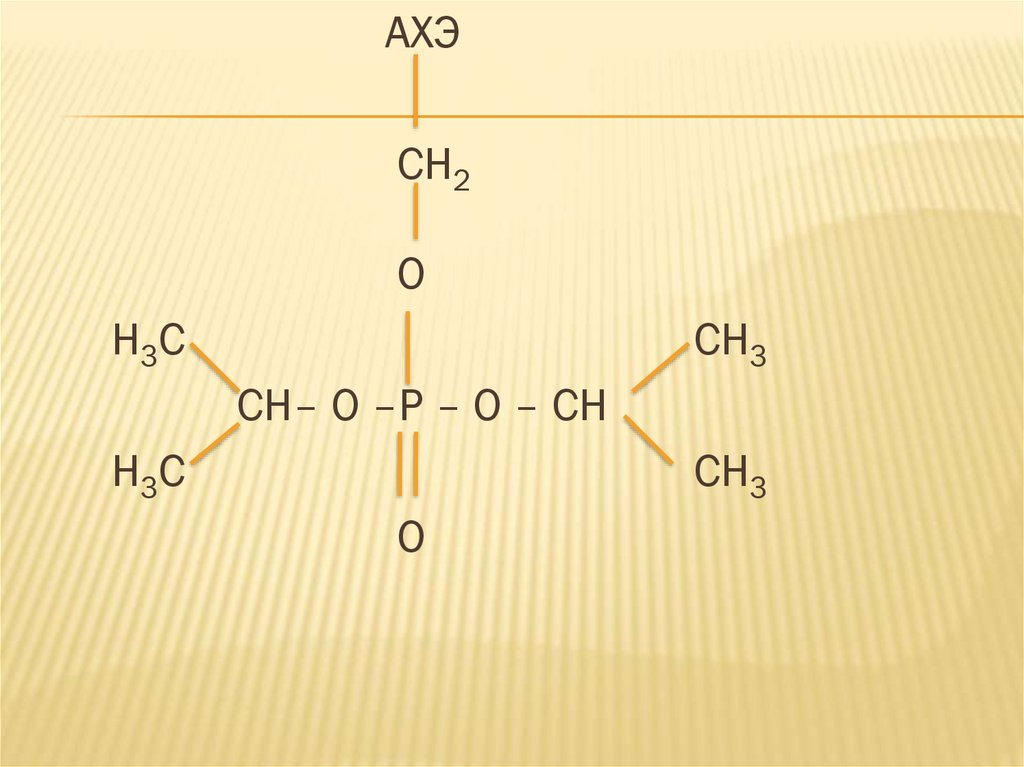
АХЭCH2
О
H3C
CH3
CH– O –P – O – CH
H3C
CH3
О
41.
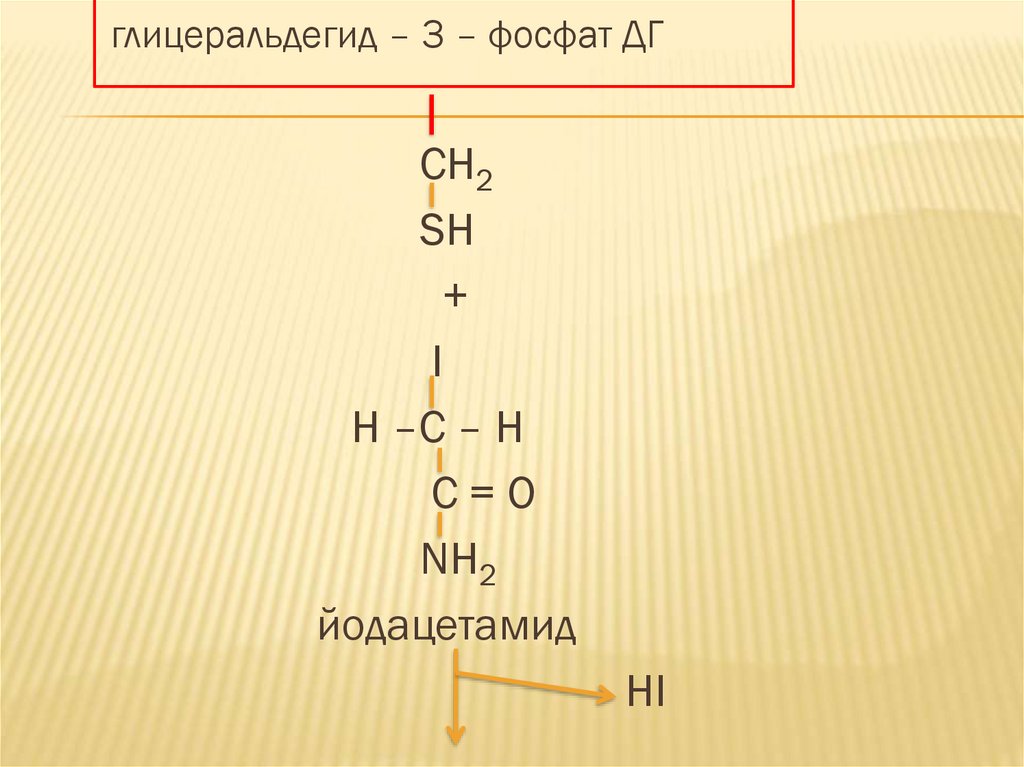
Другой необратимый ингибитор йодацетамидобладает высокой степенью сродства к
ферментам имеющим в активном центре
тиольные группы (например фермент
гликолиза) – глицеральдегид-3фосфатдегидрогеназа.
42.
глицеральдегид – 3 – фосфат ДГCH2
SH
+
I
H –C – H
C=O
NH2
йодацетамид
HI
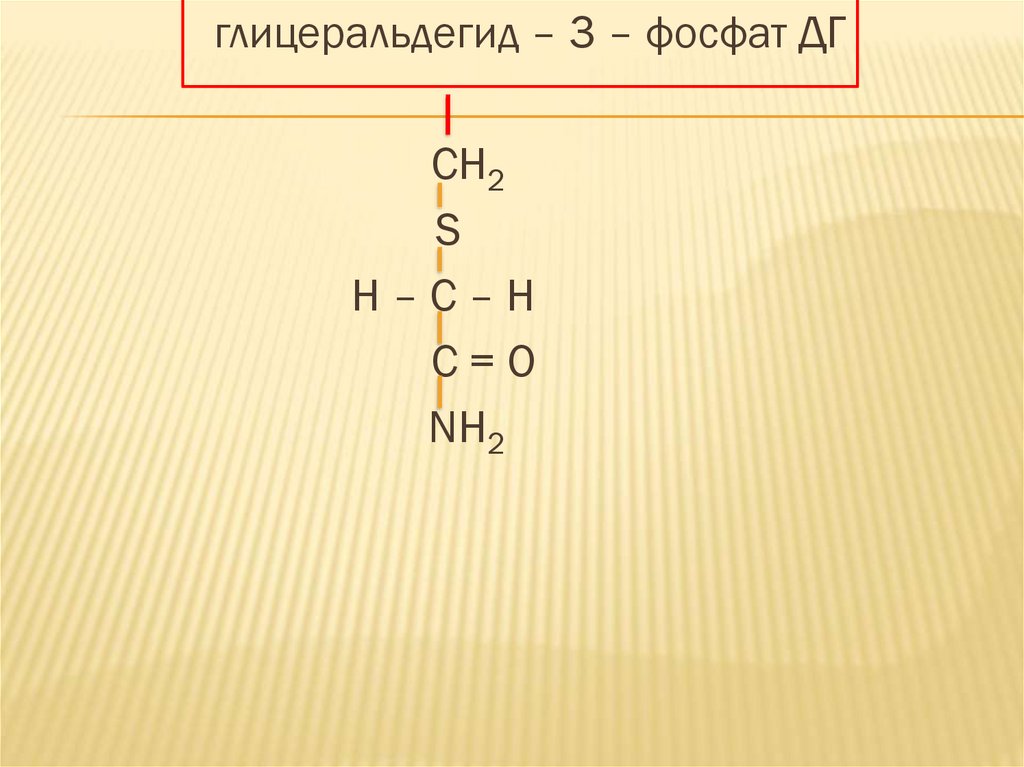
43.
глицеральдегид – 3 – фосфат ДГCH2
S
H–C–H
C=O
NH2
44.
При связывании йодацетамида с SH группойфермента происходит образование прочного
диалкилсульфида в активном центре
фермента и его необратимому
ингибированию, что сопровождается
остановкой гликолиза.
45.
Ионы тяжелых металлов также являютсянеконкурентными ингибиторами
избирательно связываясь с тиольными
группами белков (ртуть, кадмий, свинец,
мышьяк, медь и др.).
46.
Снять действие неконкурентных ингибиторовможно только специальными веществами
которые называются реактиваторы.
Например препарат унитиол связывает и
вытесняет из связи с белками ионы тяжелых
металлов образуя с ними малотоксичные
комплексы.
47. Бесконкурентное ингибирование
БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕМеханизм похож на неконкурентное.
Особенностью данного вида ингибирования
является присоединение ингибитора только к
комплексу фермент-субстрат, с образованием
тройного комплекса ESI, не способного к
дальнейшим превращениям.
Бесконкурентный ингибитор никогда не
присоединяется к ферменту в отсутствии
субстрата. Редкий вид ингибирования.
48. Субстратное ингибирование
СУБСТРАТНОЕ ИНГИБИРОВАНИЕИнгибирование фермента избытком
субстрата. В основе лежит связывание
энзима с двумя и более молекулами
субстрата одновременно. Образовавшийся
комплекс ES2 к дальнейшим превращениям
не способен.
49. Аллостерическое ингибирование
АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕПоследовательность событий при действии
ингибитора аналогична активированию, но
эффект противоположный.
50. Полиферментные системы
ПОЛИФЕРМЕНТНЫЕ СИСТЕМЫРабота большенства ферментов в клетке не
индивидуальна, а связана с формированием
полиферментных систем или конвейеров.
При такой работе ферменты расположены на
близком расстоянии и продукт одного
фермента является субстратом для
следующего. В результате субстрат проходит
небольшое расстояние от одного энзима к
другому, что обеспечивает высокую скорость
последовательных реакций.
51. Виды полиферментных систем
ВИДЫ ПОЛИФЕРМЕНТНЫХ СИСТЕМВ зависимости от организации процесса
выделяют следующие виды полиферментных
систем:
1. Функциональные – ферменты
расположены свободно (пример: гликолиз).
2. Структурно-функциональные – ферменты
фиксированы в единый комплекс (пример:
пируватдегидрогеназный комплекс).
3. Смешанные – присутствуют оба элемента
организации (пример: цикл Кребса).
52. ретроингибирование
РЕТРОИНГИБИРОВАНИЕРетроингибирование – процесс при котором
один из конечных продуктов полиферментной
системы является ингибитором фермента
лежащего в начале цепи реакций.
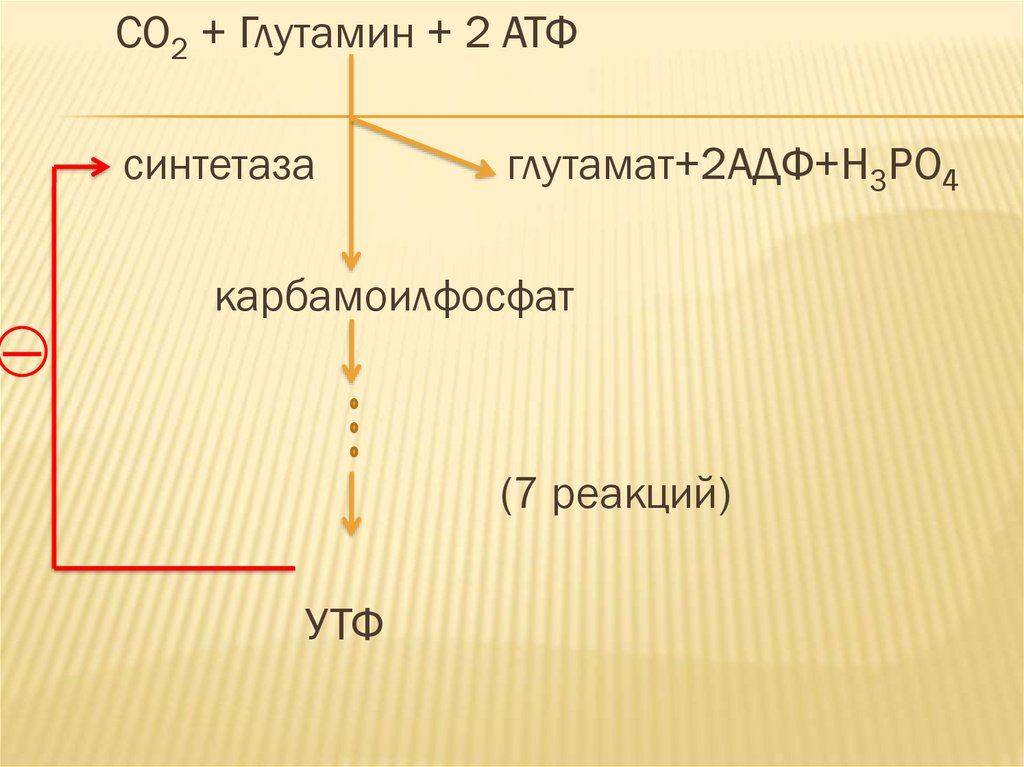
53.
Пример: УТФ в организме образуется в ходе8 реакций. Одновременно УТФ является
аллостерическим ингибитором энзима
лежащего в основе полиферментной системы
карбамоилфосфатсинтетазы II.
54.
CO2 + Глутамин + 2 АТФсинтетаза
глутамат+2АДФ+Н3РО4
карбамоилфосфат
(7 реакций)
УТФ
55.
Ретроингибирование регулирует работуполиферментной системы и предотвращает
избыточное накопление конечного продукта.
56.
Ингибиторы ферментов как лекарственные препаратыПрепарат
Механизм действия и применение
Трасилол (контрикал)
Аналог природного пептида ингибирующего трипсин.
Применение: острый панкреатит и панкреонекроз.
Хронический рецидивирующий панкреатит.
Метотрексат
Близок по строению к фолиевой кислоте и является ее
антагонистом – антиметаболитом. Конкурентный
ингибитор фолатредуктазы. Применение:
противоопухолевый препарат.
5 – Фторурацил
Структурный аналог пиримидина. Конкурентный
ингибитор тимидинсинтетазы. Противоопухолевый
препарат.
Прозерин
Конкурентный ингибитор АХЭ. Средство улучшающее
нервно – мышечную проводимость.
Армин
Относится к группе ФОС. Является необратимым
ингибитором АХЭ. Используется в виде глазных капель,
как средство для снижения внутриглазного давления.
Сульфаниламиды (стрептоцид,
сульфадимизин, сульфален и
др.)
Близки по строению к пара – аминобензойной кислоте.
Захватываются вместо нее микробной клеткой и
ингибируют синтез фолиевой кислоты. Применение:
антибактериальные препараты.
57.
I.II.
III.
IV.
Уровень регуляции б/х процессов через
ферментные системы
Изменение каталитической активности
ферментов вследствие изменения свойств
окружающей их среды – t, pH и др.
Изменение каталитической активности
вследствие воздействия активаторов и
ингибиторов
Изменение интенсивности синтеза молекул
фермента под влиянием метаболитов
Нейрогуморальные влияния на активность
ферментов











































 biology
biology