Similar presentations:
Ферменты. (лекция 2)
1. Лекция №2
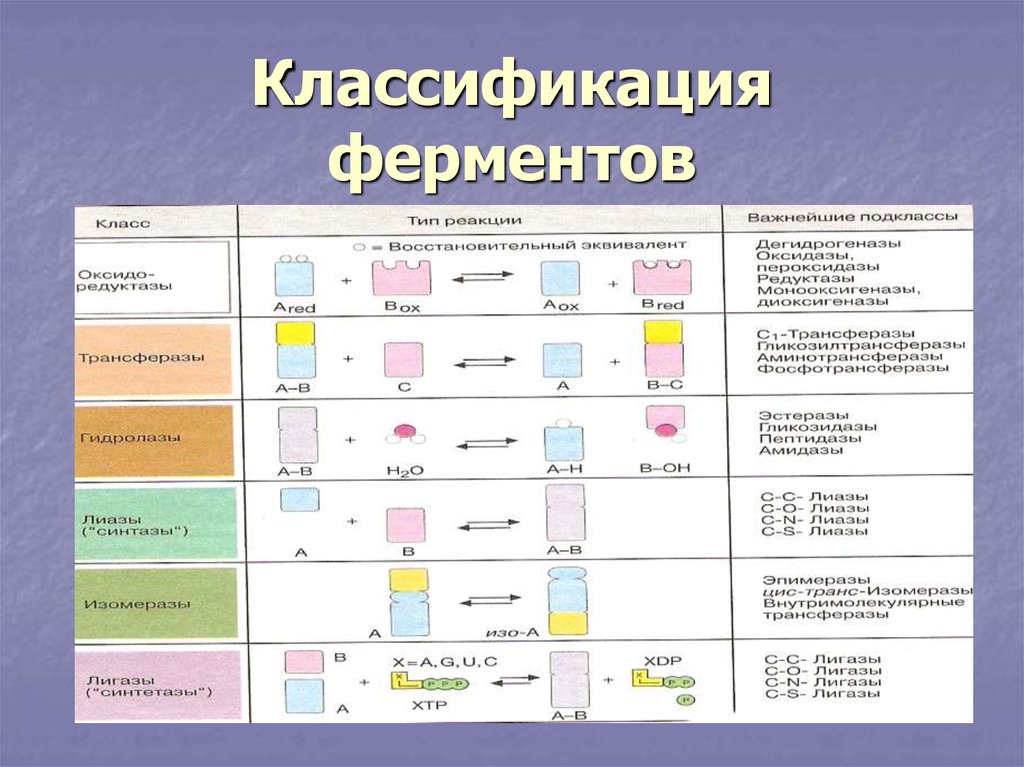
Ферменты2. Классификация ферментов
3.
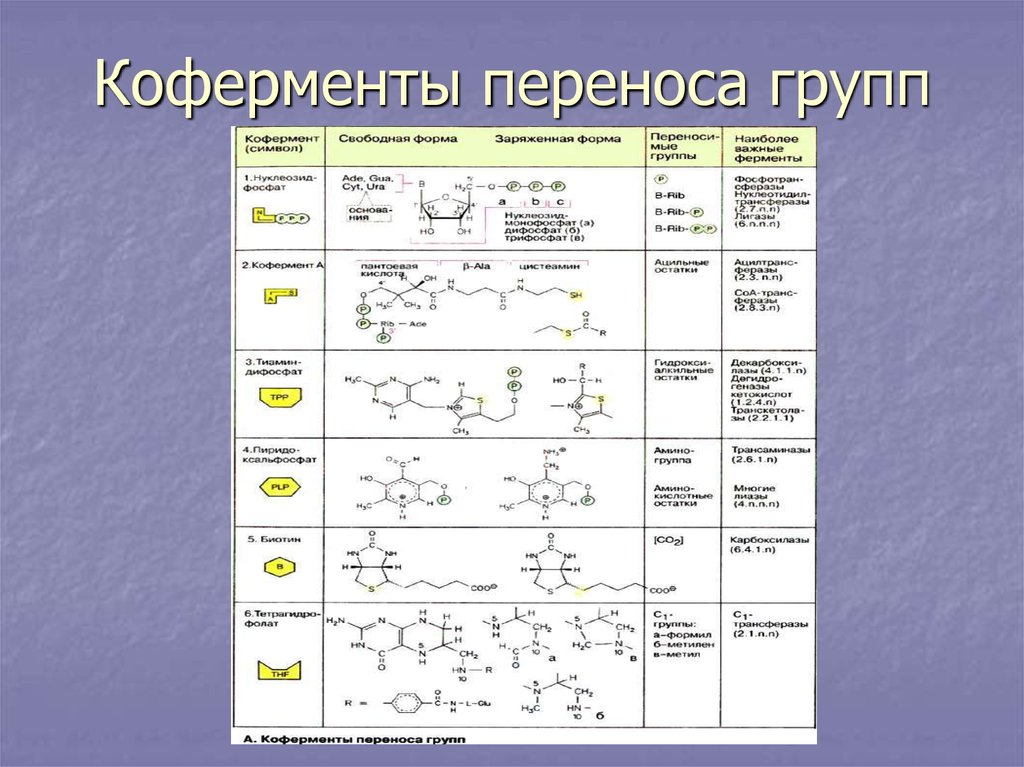
II. Трансферазы.а) п/кл фосфотрансферазы.
Все трансферазы переносят функционольные группы.
Фосфотрансферазы катализируют перенос фосфатной
группы. Коферментом является АТФ. В этой молекуле
остатки фосфорной кислоты связаны между собой
макроэргической связью. Кроме АТФ могут учавствовать
молекулы ЦТФ, ГТФ, УТФ.
б) п/кл аминотрансферазы.
Ферменты отвечают за перенос аминогрупп.
Коферментом является передоксильфосфат, является
производным пиридоксина витамина В6.
в) п/кл ацилтрансферазы.
Переносят остатки органических кислот. Коферментом
является кофермент А, производное пантотеновой
кислоты.
г) п/кл переносящие одноуглеродные группы(СН, СН3).
Коферментом является тетрагидрофолиевая кислота,
производная витамина фолиевая кислота.
4.
III. Гидролазы.Ферменты, катализирующие расщепление веществ с
участием воды. Они не нуждаются в коферментах.
IV. Лиазы.
Ферменты, катализирующие присоединение веществ
по двойным связям.
V. Изомеразы.
Катализируют внутримолекулярные
перегруппировки. Имеют окончание –изомераза или
–мутаза. Могут осуществлять рацимизацию, транс,цисизомеризацию, внутримолекулярный перенос
функциональных групп. Коферментом является
цианкобаламин производное витамина В12.
VI. Лигазы = синтетазы.
Ферменты, осуществляющие энергозависимый
синтез. Поставщиком обычно является
внутриклеточный пирофосфат(АТФ, АДФ).
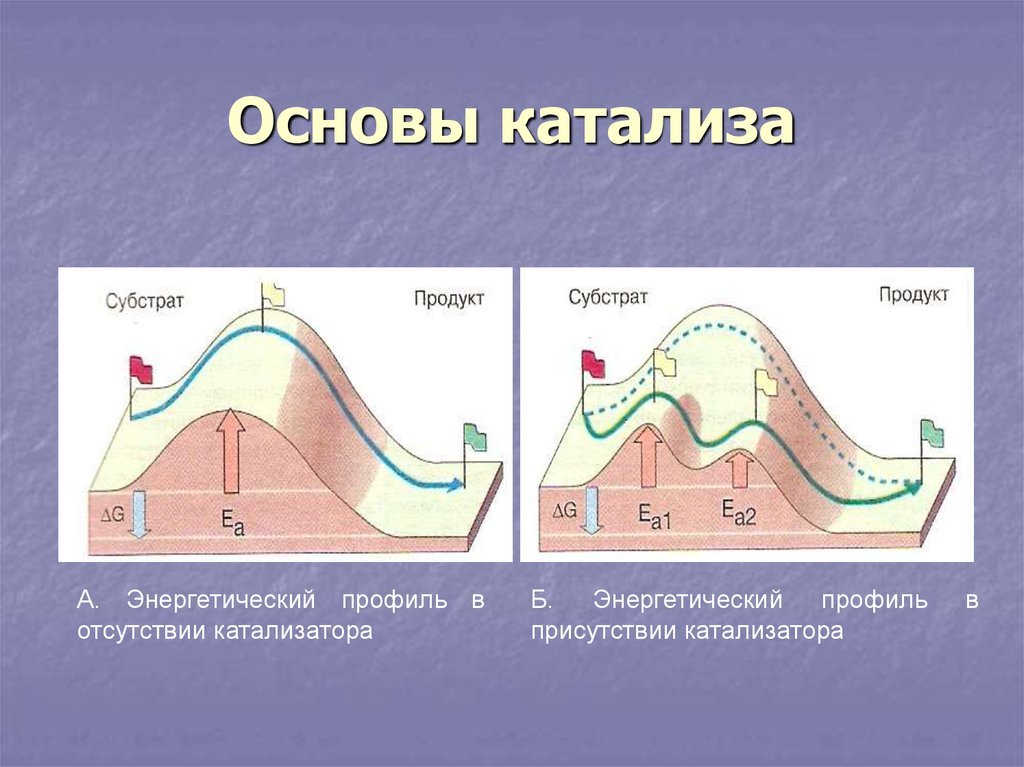
5. Механизм действия ферментов
Биологический ферментативныйкатализ является примером
каталитического процесса и для
него выполняются все законы.
Классические катализаторы
действуют за счет энергии
активации. Энергия активации
энергия, необходимая молекуле
вещества для преодоления
энергетического барьера.
Катализаторы не меняют G они
снижают энергию активации.
Снижение энергии активации
увеличивает количество молекул,
способных преодолеть
энергетический барьер реакции и
происходит это не линейно, не
пропорционально.
6. Основы катализа
А. Энергетический профиль вотсутствии катализатора
Б. Энергетический профиль
присутствии катализатора
в
7. Снижение энергии активации достигается за счет:
1. ориентации субстратов.2. Теория стерического
взаимодействия
(взаимодействие ключ-замок).
Фишер предположил, что
активный центр фермента
пространственно
соответствует молекуле
субстрата. За счет своей
пространственной
специфичности фермент и
субстрат ориентируются
специфично.
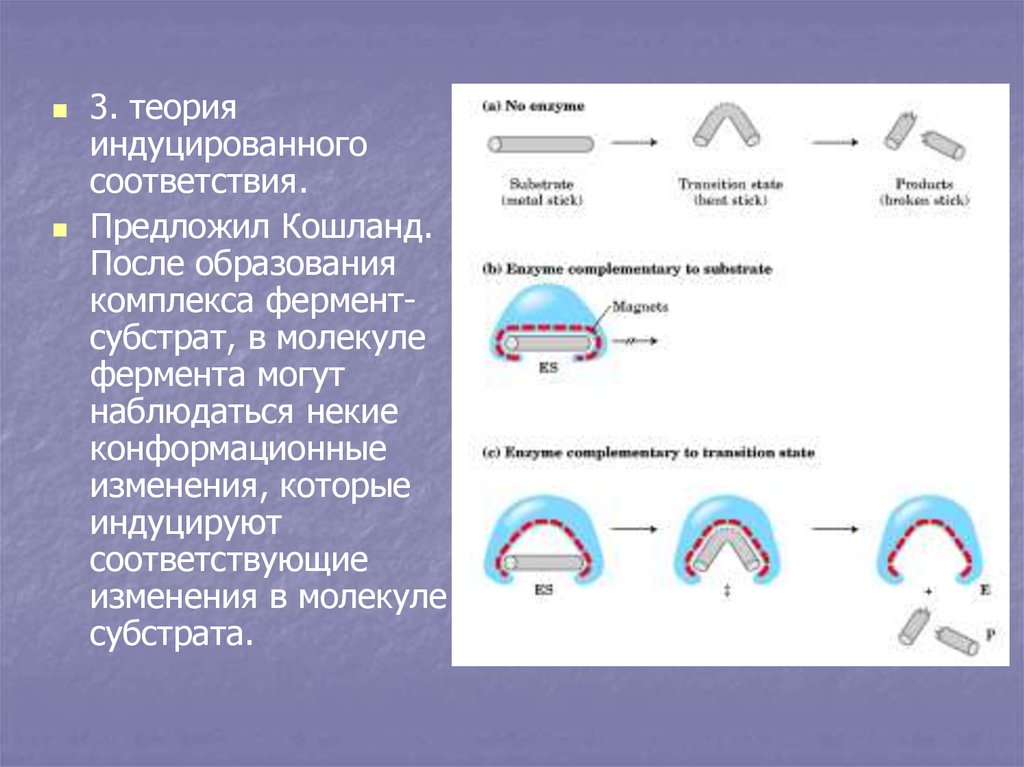
8.
3. теорияиндуцированного
соответствия.
Предложил Кошланд.
После образования
комплекса ферментсубстрат, в молекуле
фермента могут
наблюдаться некие
конформационные
изменения, которые
индуцируют
соответствующие
изменения в молекуле
субстрата.
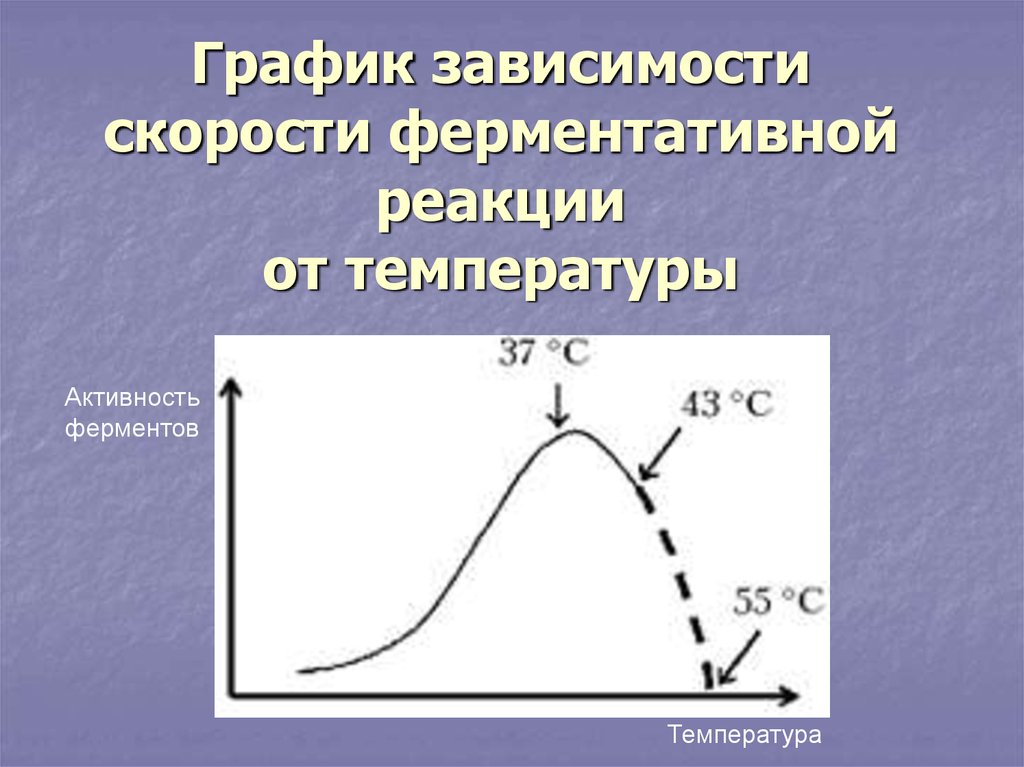
9. График зависимости скорости ферментативной реакции от температуры
Активностьферментов
Температура
10.
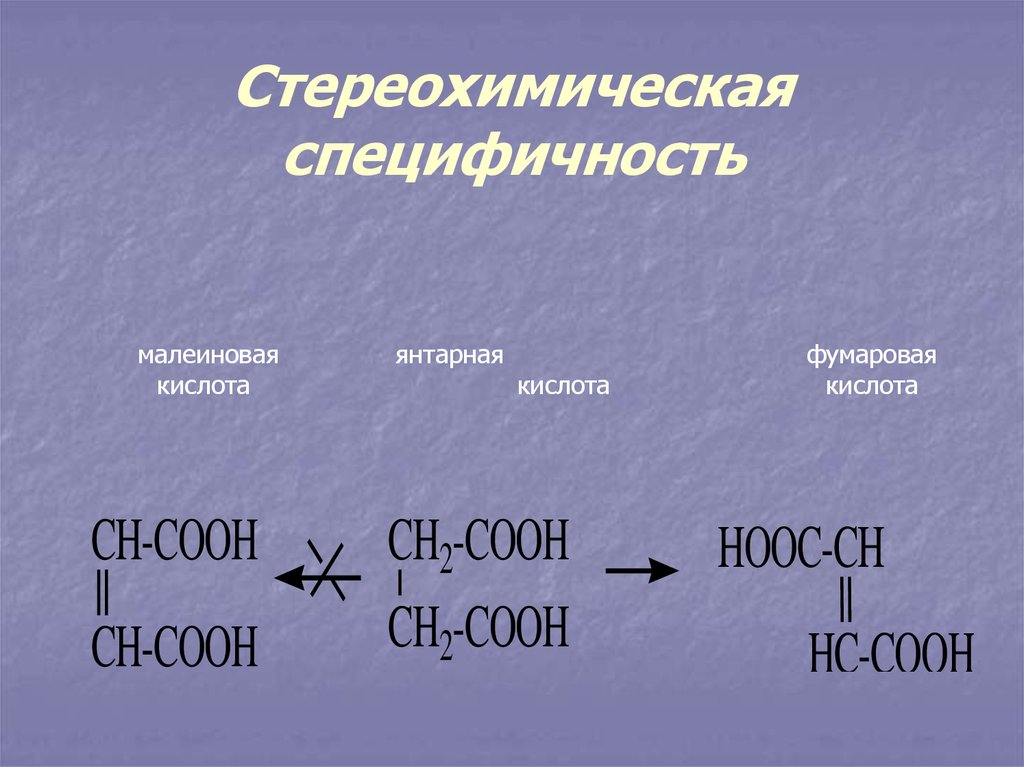
11. Стереохимическая специфичность
малеиноваякислота
CH-COOH
CH-COOH
янтарная
кислота
CH2-COOH
CH2-COOH
фумаровая
кислота
HOOC-CH
HC-COOH
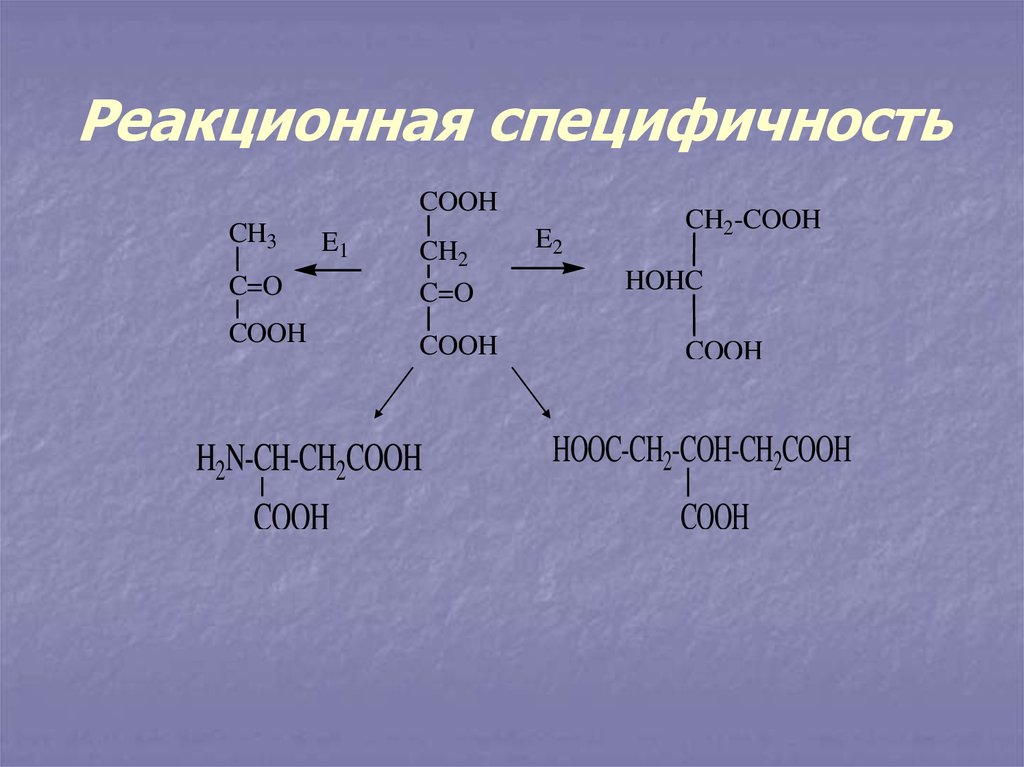
12. Реакционная специфичность
COOHCH3
E1
CH2
C=O
C=O
COOH
COOH
H2N-CH-CH2COOH
COOH
E2
CH2-COOH
HOHC
COOH
HOOC-CH2-COH-CH2COOH
COOH
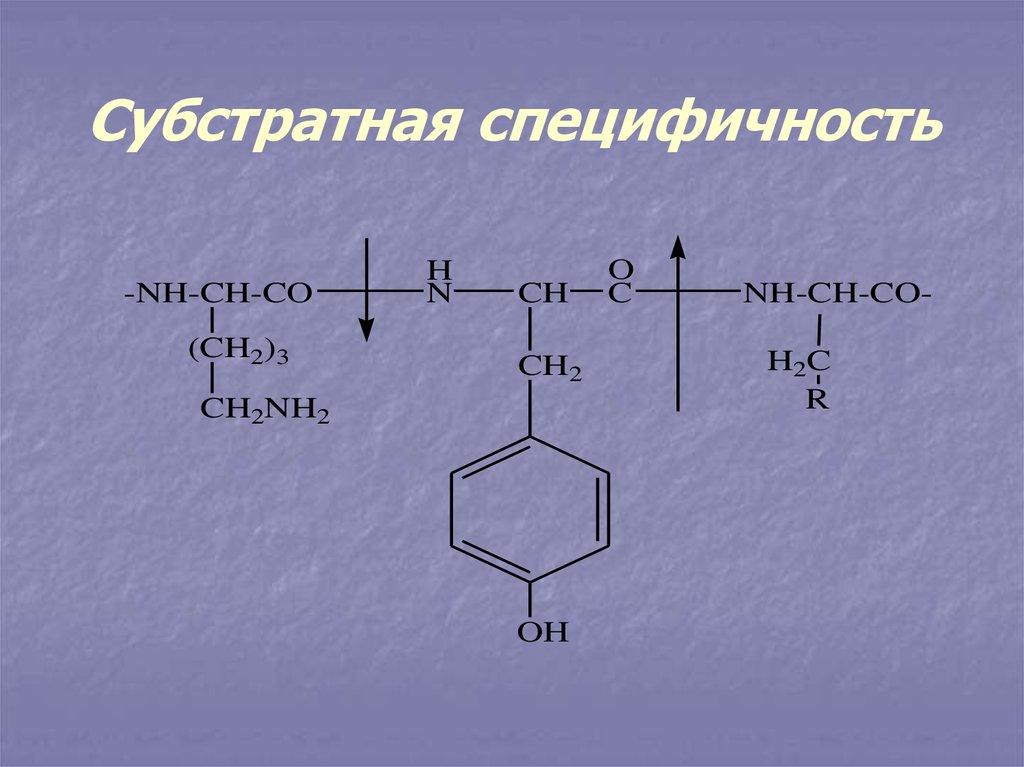
13. Субстратная специфичность
-NH-CH-CO(CH2)3
H
N
CH
CH2
CH2NH2
OH
O
C
NH-CH-COH2C
R
14. Факторы, влияющие на активность фермента
Концентрация субстрата.В 1913г. Михаэлис и Ментен
проедложили уравнение
= max[S]/Km+[S]
15.
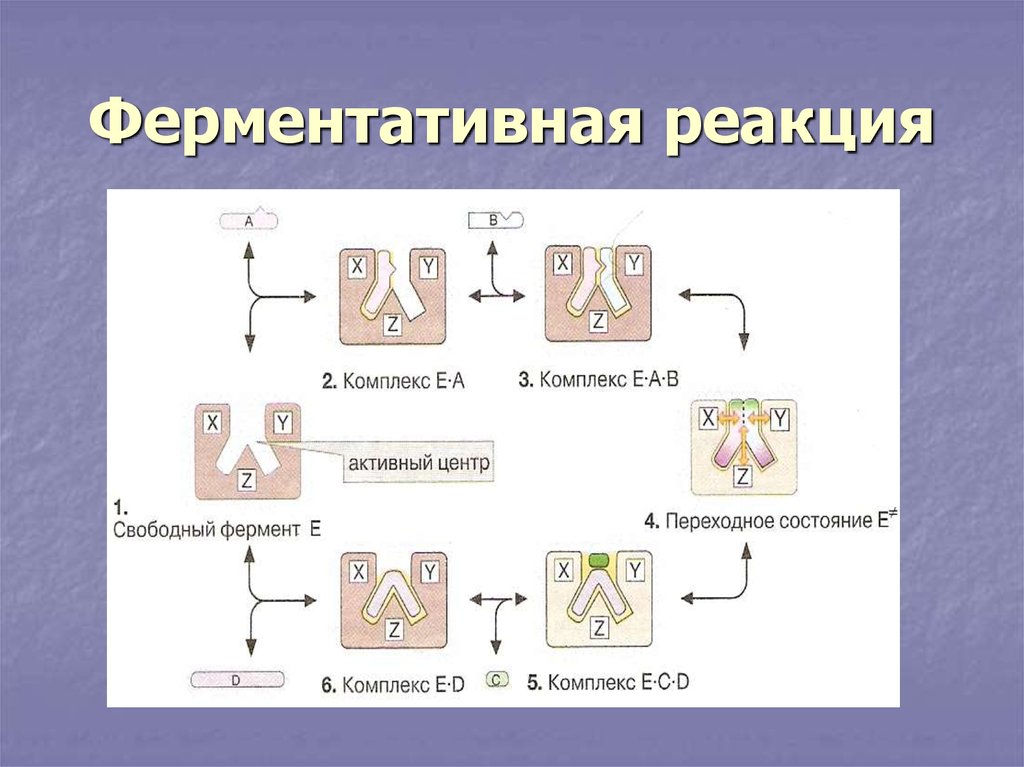
Стадии ферментативного процессаЕ + S ES Е + P
Е - фермент
S - субстрат
ЕS - фермент-субстратный комплекс
Р - продукт
k1
k2
k3
При условии, что: 1. [Еo] 〉〉 [S]
2. [ES]=const
Зависимость скорости реакции описывается
уравнением Михаэлиса-Ментен
16.
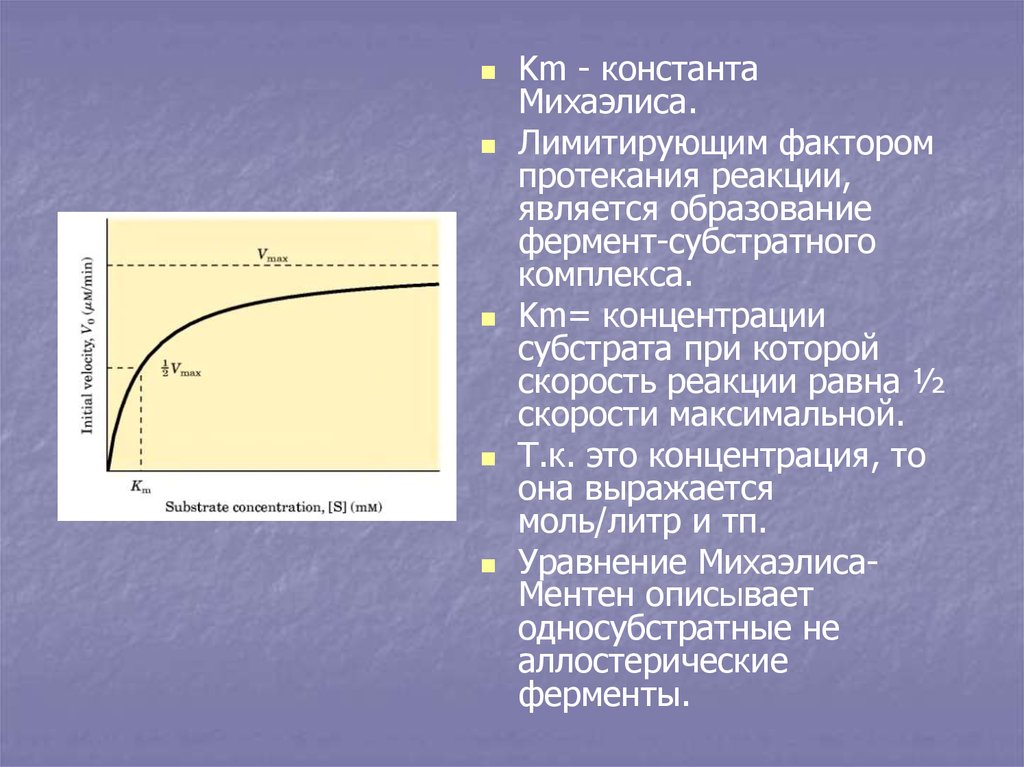
Km - константаМихаэлиса.
Лимитирующим фактором
протекания реакции,
является образование
фермент-субстратного
комплекса.
Km= концентрации
субстрата при которой
скорость реакции равна ½
скорости максимальной.
Т.к. это концентрация, то
она выражается
моль/литр и тп.
Уравнение МихаэлисаМентен описывает
односубстратные не
аллостерические
ферменты.
17. Уравнение Лайнуивера-Берка
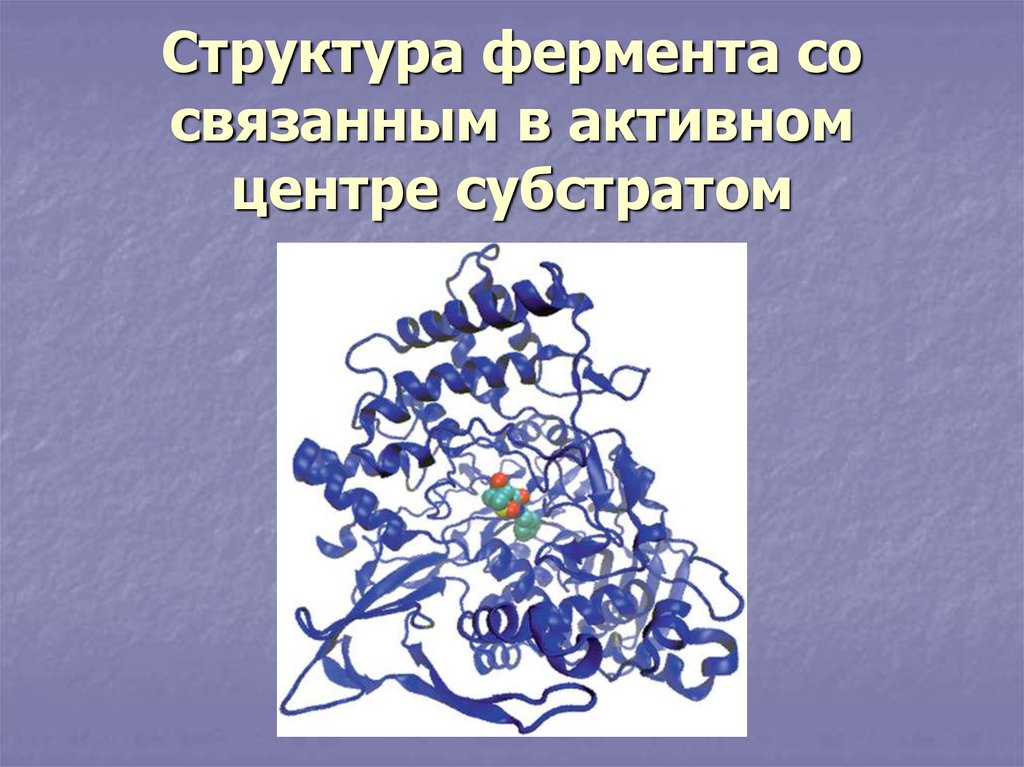
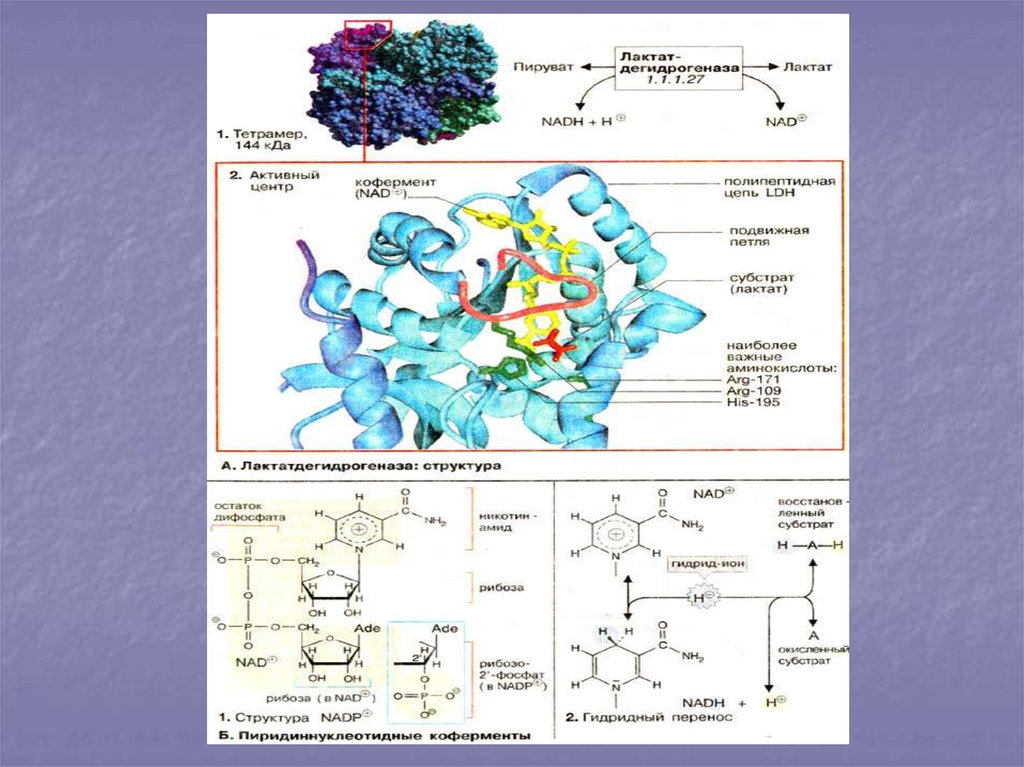
18. Структура фермента со связанным в активном центре субстратом
19. Ферментативная реакция
20. Коферменты переноса групп
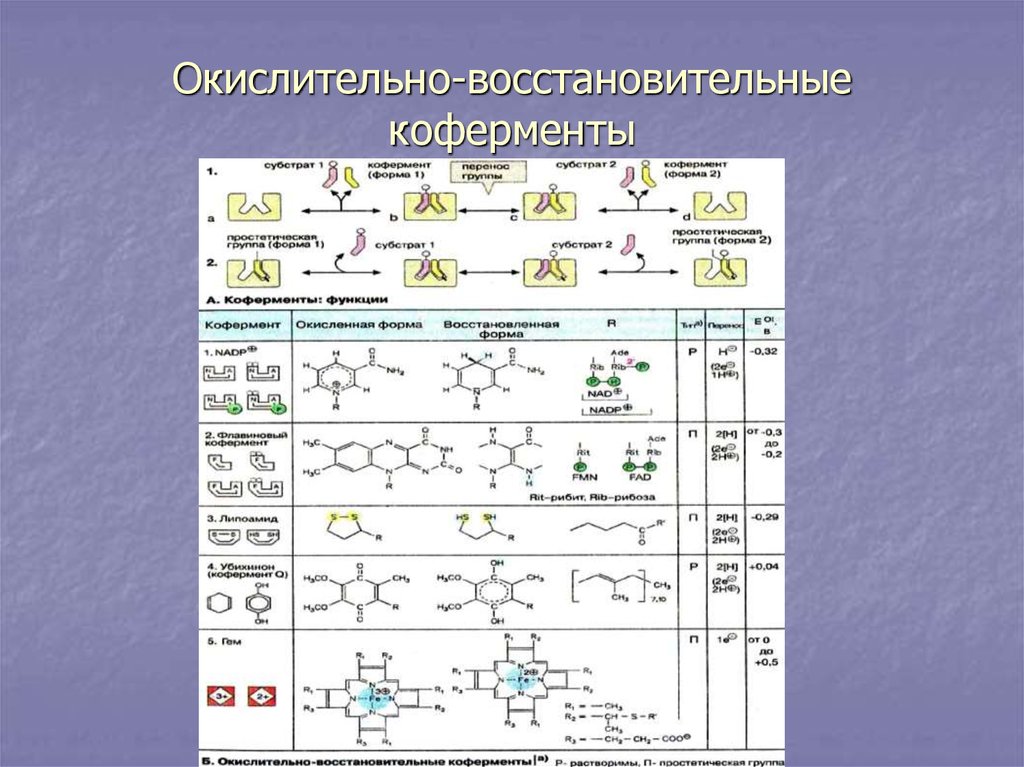
21. Окислительно-восстановительные коферменты
22.
23.
24. IV. Влияние ингибиторов и активаторов.
Модулятор вещество, способное изменятьактивность ферментов.
Активатор вещество, ускоряющее протекание
ферментативных реакций. Механизм действия сходен
с механизмом действия ингибиторов.
Ингибитор вещество, снижающее скорость
ферментативной реакции.
По механизму действия ингибирование бывает
обратимое и необратимое.
Обратимое ингибирование:
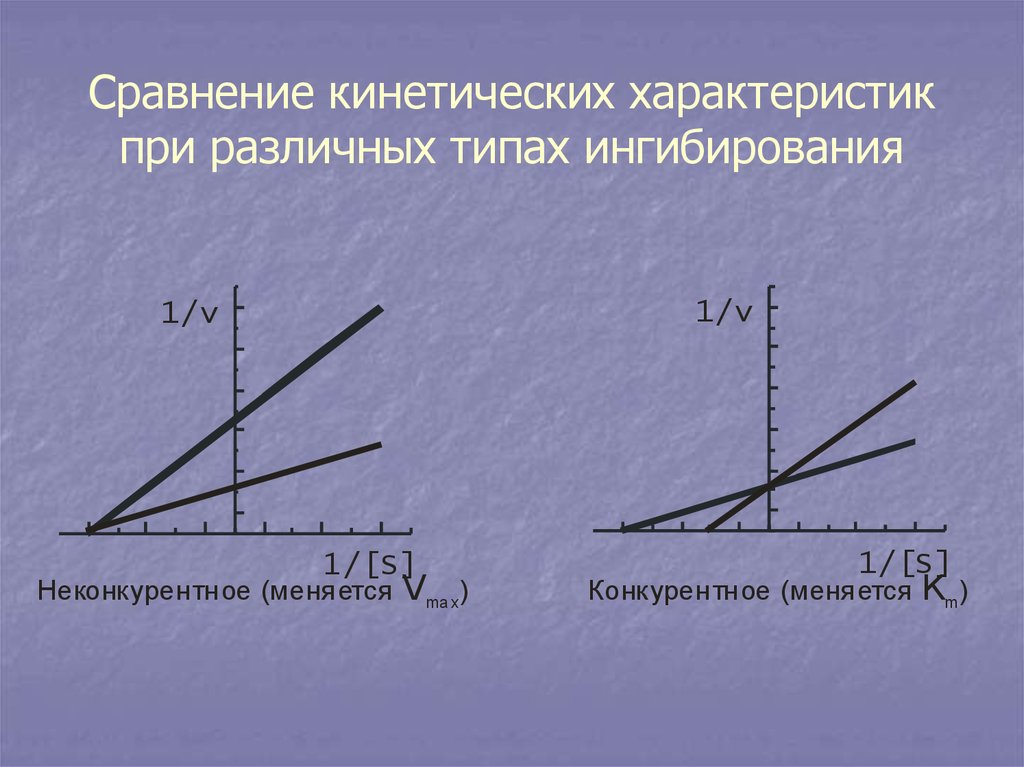
25. Конкурентное ингибирование
Ингибитор по своему строению похож намолекулу субстрата. Ингибитор и субстрат
конкурируют за активный центр.
Конкурентное ингибирование можно снять за
счет избыточного добавления субстрата. При
конкурентном ингибировании max не
меняется. Меняется лишь сродство фермента
к субстрату.
26. Неконкурентное ингибирование
Ингибитор связывается с ферментом не вактивном центре, а на другом участке. При
неконкурентном ингибировании сродство
фермента к субстрату не меняется, а
меняется только максимальная скорость
реакции. Примером являются соли
тяжелых металлов..
27. Сравнение кинетических характеристик при различных типах ингибирования
1/v1/v
1/[S]
Неконкурентное (меняется
Vma x)
1/[S]
Конкурентное (меняется
Km )
28. бесконкурентное ингибирование
При это меняются максимальнаяскорость и сродство к субстрату
бесконкурентное ингибирование
Меняются максимальная скорость и
сродство к субстрату.
29. Аллостерические ферменты.
не подчиняются уравнениюМихаэлиса-Ментен. Это всегда
олигомерные белки, т.е. белки
состоящие из нескольких
субъединиц. Количество их
может варьировать от 2 до 12.
Обязательным условием
является наличие нескольких
конформаций его субъединиц.
Для них характерно наличие как
активных центров, так и
дополнительных центров
связывания с которыми
связываются аллостерические
модуляторы.
30.
При связываниимодулятора с
аллостерическим
центром, меняется
конформация
субъдиниц в которых
этот центр находится.
Насыщение
связываемых
регуляторных единиц
вызывает их
конформацию и как
следствие меняетсы и
конформация
каталитической
субъединицы.
31.
Аллостерическиемодуляторы бывают
положительные и
отрицательные.
Если
аллостерическим
модулятором
является сам
субстрат, то это
гомотропный
фермент, если
другое вещество
гетеротропный
фермент.
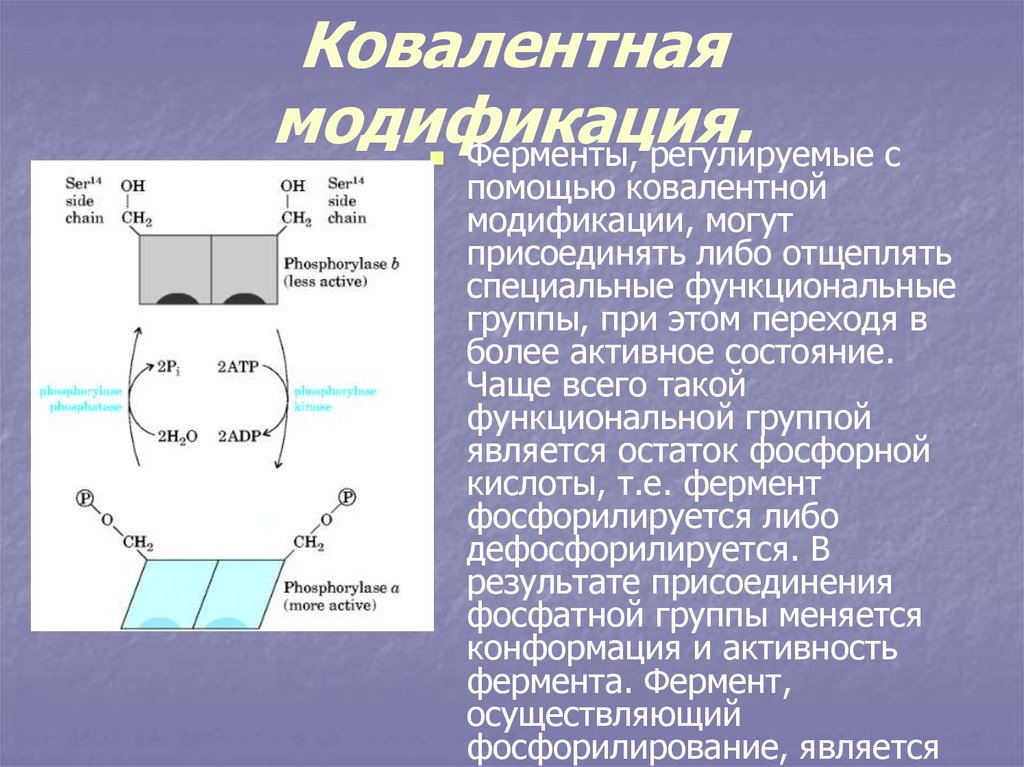
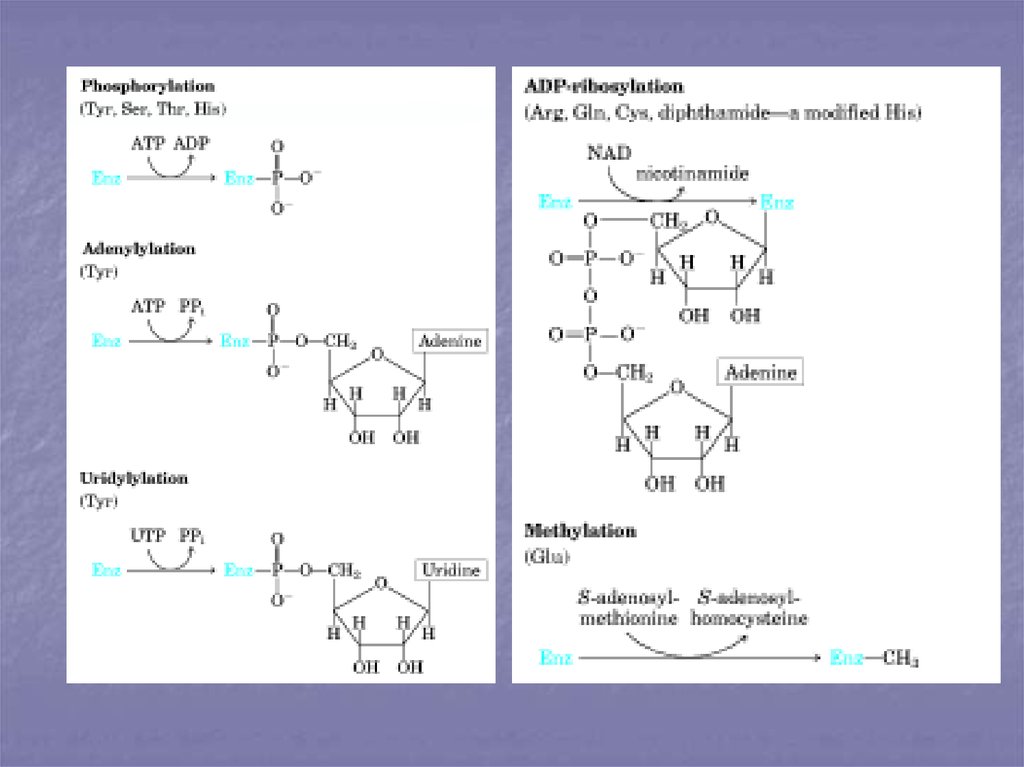
32. Ковалентная модификация.
Ферменты, регулируемые спомощью ковалентной
модификации, могут
присоединять либо отщеплять
специальные функциональные
группы, при этом переходя в
более активное состояние.
Чаще всего такой
функциональной группой
является остаток фосфорной
кислоты, т.е. фермент
фосфорилируется либо
дефосфорилируется. В
результате присоединения
фосфатной группы меняется
конформация и активность
фермента. Фермент,
осуществляющий
фосфорилирование, является
















 biology
biology








