Similar presentations:
Иммунопатология
1.
ИммунопатолгияАйвазян Лилия
Людвиковна
2.
Общие представленияИммунитет – способность многоклеточных
организмов поддерживать постоянство
внутренней среды (гомеостаз) на
макромолекулярном уровне; эту
способность в организме реализует
специальная система клеток, называемая
иммунной.
3.
Основные функции ИС:• Инактивация, разрушение и элиминцаия
экзогенных макрмолекул и патогенных
микробов
• Уничтожение эндогенных макромолекул ,
постоянно образующихся в самом организме,
старых, дефектных и трансформированных
(опухолевых) клеток (иммунный надзор за
собственными клетками)
• Регуляция разнообразных функций организма
посредством образования антител к белкампереносчикам, гормонам, рецепторам и
другим сигнальным молекулам, а так же путем
продукции цитокинов, обладающих системных
действием
4.
антигеныЭто вещества, которые распознаются
специфическими антителами и Тлимфоцитами и вызывают иммунный ответ.
Иммуногенность – это способность антигена
вызывает иммунный ответ
Антигенность – это способность антигена
связываться с антителом.
5.
Формы иммунитета• Врожденный (неспецифический)
• Приобретенный (специфический) высокоспецифичен
6.
Специфичность и памятьОсновные свойства специфического или
приобретенного иммунного ответа; на
повторный контакт с тем же самым
антигеном иммунная система реагирует
более эффективно, быстрее и больше
образуется антител
7.
Иммунный ответРеакция клеток иммунной системы
( с участием Т- и В-лимфоцитов),
развивающаяся при контакте с «чужими»
или измененными «своими» антигенами и
клетками, их несущими.
8.
Органы иммунной системы• Центральные:
-красный костный мозг. Все клетки иммунной системы
происходят из стволовых клеток костного мозга ,которые
дифференцируются в лимфоциты, гранулоциты ,моноциты,
эритроциты и мегакариоциты, здесь происходит раннее,
антигеннезависимое созревание и дифференцировка Влимфоцитов
-тимус. В тимусе происходит дифференцировка костномозговых
клеток-предшественниц Т-лимфоцитов и превращение их в
зрелые Т-лимфоциты
• Периферические:
эти органы связаны между собой кровеносными и
лимфатическими сосудами
-диффузные скопления лимфоидной ткани, ассоциированные со
слизистыми оболочками желудочно-кишечного, дыхательного,
мочеполового трактов и кожи
-лимфоузлы
-селезенки
9.
Клетки иммунной системы• Фагоциты. Делятся на две группы:
- Циркулирующие: нейтрофилы и моноциты
- Тканевые: макрофаги соединительной
ткани, купферовские клетки, дендритные
клетки селезенки, лимфоузлов и кожи ,
интерстициальные макрофаги легких ,
клеток микроглии и другие
10.
Клетки иммунной системы• Натуральные (естественные) киллеры способны
уничтожить разные опухолевые клетки , вирусинфицированные клетки и некоторые нормальные
клетки без предварительного контакта с ними.
• Находятся в крови и лимфоидной ткани,
экспрессируют некоторые антигены Т-лимфоцитов и
макрофагов, АГ ( CD16).
• Описано два основных механизма, опосредующих
цитотоксическую активность НК:
-непосредственное уничтожение опухолевых клеток
после фиксации НК и антигенным детерминантом
опухолевых клеток через соответствующие
рецепторы на поверхности НК
-антитело-зависимая клеточная цитотоксичность
11.
Т-лифоцитыПоверхностные антигены обозначены в
номенклатуре дифференцировочных
антигенов (или маркеров) CD (cluster of
differentiation – кластер дифференцировки).
Для всех Т-лимфоцитов характерно CD-3
CD -4 присутствуют на поврехности Тлимфоцитов ,выполняющих регуляторные
функции (Т-хелперов)
CD-8 экспрессируются на цитотоксических Тлимфоцитах (Т-киллерах)
12.
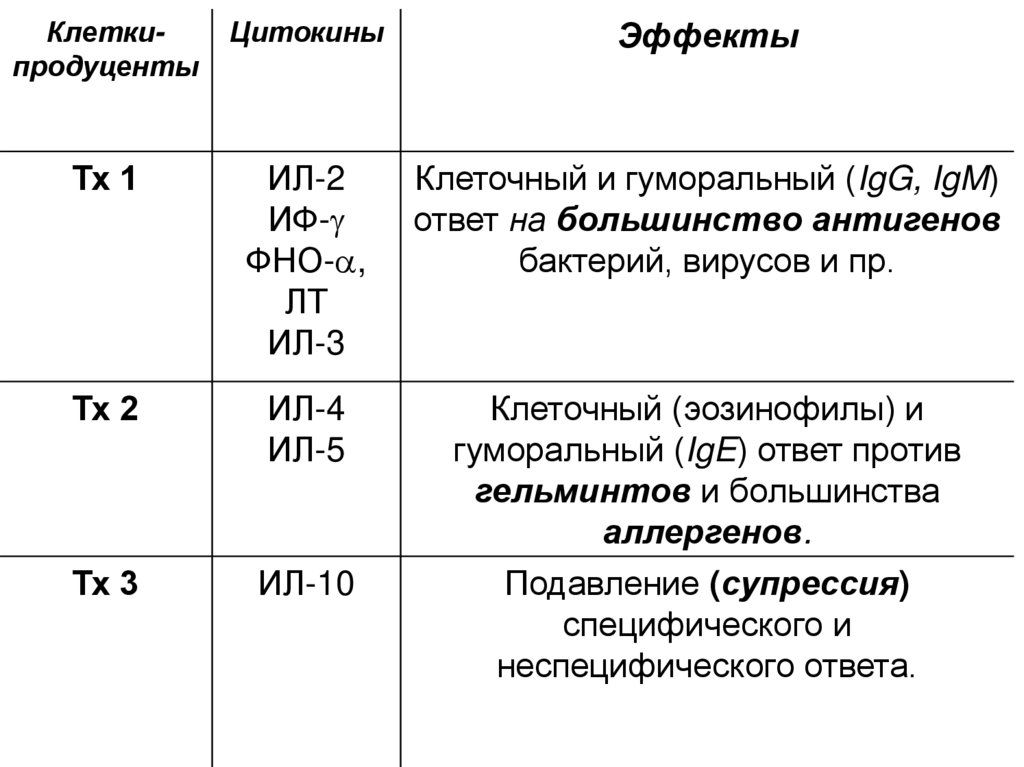
КлеткипродуцентыЦитокины
Эффекты
Тх 1
ИЛ-2
ИФ-g
ФНО-a,
ЛТ
ИЛ-3
Клеточный и гуморальный (IgG, IgM)
ответ на большинство антигенов
бактерий, вирусов и пр.
Тх 2
ИЛ-4
ИЛ-5
Клеточный (эозинофилы) и
гуморальный (IgE) ответ против
гельминтов и большинства
аллергенов.
Тх 3
ИЛ-10
Подавление (супрессия)
специфического и
неспецифического ответа.
13.
14.
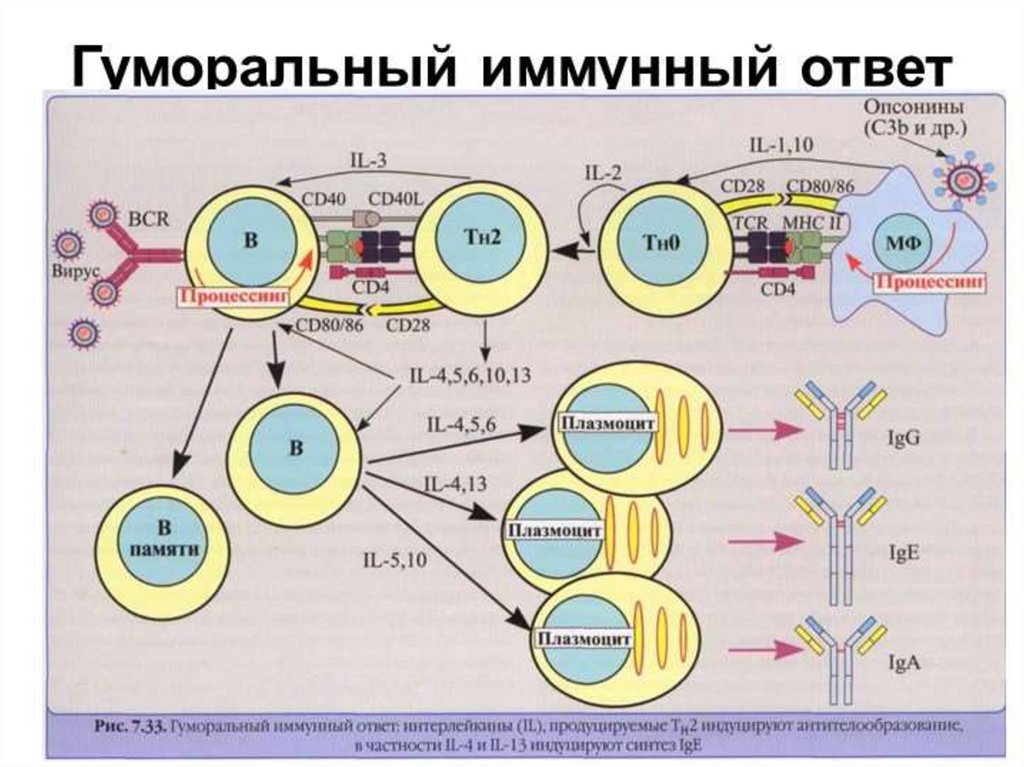
В-лимфоцитыНаходятся в крови и лимфоидных органах: в
лимфоидных фолликулах, в лимфоузлах и в
белой пульпе селезенки.
Характерные маркеры В-лимфоцитов- CD19 и
CD20.
Контакт с АГ ведет к пролиферации Влимфоцитов и дифференцировки их в
антителообразующие (плазматические)
клетки (АОК) и в В-клетки памяти.
15.
Понятие о первичном и вторичном иммунномответе
АГ + рц под влиянием цитокинов,
вырабатываемых
моноцитами,
макрофагами
и
Т-лимфоцитами,
происходит
активация
В-лимфоцитов,
которые
начинают
делиться
и
дифференцироваться в плазматические
клетки.
Часть
активированных
Влимфоцитов превращаются в клетки
памяти,
которые обеспечивают более
быстрый и эффективный иммунный ответ
при повторном контакте с АГ.
16.
Понятие о первичном и вторичном иммунномответе
Стадии первичного иммунного ответа:
1. Занимает 3-4 сут, АТ к соответствующему
АГ в сыворотке отсутствуют
2. Появляются IgМ и спустя 10-14 сут после
контакта с АГ-IgG
3. Уровень АТ остается постоянным
4. Обычно растягивается на месяцы и
характеризуется постепенным снижением
уровня АТ
17.
Вторичный иммунный ответРазвивается при повторном контакте с АГ. АТ,
главным образом IgG ,появляются быстрее
и в более высоком титре ,чем при
первичном иммунном ответе. Следует
также отметить, что IgG распадаются
медленнее, чем IgM.
18.
Классы иммуноглобулиновгуморальный или опосредованный иммунный
ответ, который приводит к
образованию АТ: JgM, IgG, IgA, IgE, IgD
• JgM первым вырабатывается при первичном
иммунном ответе
• IgG как при первичном, так и при вторичном
иммунном ответе
• IgA основной иммуноглобулин слизистых,
содержится также в крови
• IgD присутствует в сыворотке в очень низкой
концентрации ,на поверхности В-лимфоцитов
выполняют функции антигенраспознающих
рецепторов.
• IgE возрастает при аллергических реакциях
19.
Функции отдельных участков молекулы иммуноглобулинаFab-фрагмент представлен N-концевым
участком тяжелой цепи и легкой цепью
молекулы иммуноглобулина, каждая цепь
Fab-фрагмента содержит одну
вариабельную и одну константную область.
Специфичность антител определяется
аминокислотной последовательностью
вариабельных областей.
20.
Функции отдельных участков молекулыиммуноглобулина
Fc-фрагмент представляет собой C-концевые
участки тяжелых цепей и состоит только из
константных областей. От строения Fcфрагмента зависит способность
иммуноглобулина проникать через плаценту,
связывать комплемент и присоединяться к
разным типам клеток — макрофагам,
тромбоцитам, тучным клеткам. Кроме того, от
строения этого фрагмента зависит скорость
синтеза и распада молекулы
иммуноглобулина. В распознавании антигена
Fc-фрагмент участия не принимает.
21.
Клеточный иммунитетКлеточный иммунитет опосредован
цитотоксическими T-лимфоцитами и Tхелперами. Цитотоксические T-лимфоциты
непосредственно контактируют с
чужеродными клетками и разрушают их, а
T-хелперы вырабатывают биологически
активные вещества — цитокины,
активирующие макрофаги.
22.
Антигены гистосовместимостиВ небольшом сегменте 6-й хромосоме у
млекопитающих находятся гены, играющие
важную роль в регуляции иммунного ответа гены главного комплекса гистосовместимости МНС (Major Histocompatibility Complex).
Название этих генов связано с тем, что
первоначально была описана способность
генов вызывать отторжение трансплантата при
пересадке органов. У человека данная группа
генов обозначается как НLA (Human Leucocyte
Antigens - антигны лейкоцитов человека).
23.
Комплекс МНСвключает три класса генов - МНС-I, II и III,
отличающиеся огромным полиморфизмом.
В регуляции иммунного ответа важную
роль играют гены МНС-I и MHC-II, по
системе HLA соответственно HLA-A, -B, -C и
HLA-D. Эти гены кодируют поверхностные
молекулы, также называемые
антигенами гистосовместивмости
24.
МНС-I• Антигены или молекулы белков МНС-I
присутствуют на мембране всех ядерных клеток
организма и на тромбоцитах. При превращении
клетки в опухолевую или при попадании в клетку
вируса, опухолевые или вирусные антигены
выставляются на поверхности мембраны и
образуют комплекс с молекулами МНС-I.
• Т-киллер для активации должен получить двойной
сигнал: его Т-клеточный рецептор соединяется со
специфическим антигеном, а рецептор CD8 – с
молекулой МНС-I клетки-мишени. Только такое
двойное распознавание приведет к активации Ткиллера и лизису клетки-мишени
25.
МНС-IIАнтигены или молекулы МНС-II экспрессируются на
поверхности антиген-презентирующих клеток
(дендритных клеток, В-лимфоцитов и макрофагов).
Связывание этих молекул с представляемым
антигеном абсолютно необходимо для активации
CD4+ Т-хелперов. Т-хелпер должен получить
двойной сигнал: его Т-клеточный рецептор
соединяется со специфическим антигеном, а
рецептор CD4 – с молекулой МНС-II. Только двойное
распознавание приведет к активации Т-хелпера и
выделению цитокинов, то есть к запуску иммунного
ответа.
Среди генов МНС-II находятся гены регуляции
иммунного ответа, от которых зависит его
интенсивность.
26.
МНС-IIIГены МНС-III кодируют белки системы
комплемента, участвующие в образовании
С3-конвертаз.
27.
Неспецифические (врожденные)эффекторные механизмы иммунитета
Гуморальные
1. Активация системы комплемента.
2. Синтез интерферонов.
Система комплемента может самостоятельно
распознавать и уничтожать многие
внеклеточные бактерии и привлекать к их
уничтожению фагоциты, активируя их.
28.
Неспецифические (врожденные)эффекторные механизмы иммунитета
• 1. Фагоцитоз макрофагами и
нейтрофилами
• 2. Цитотоксичность, зависимая от НKклеток.
НK-клетки способны распознавать и
убивать опухолевые клетки. Уничтожение
происходит за счет образования
межклеточных каналов (образованные
белками-перфоринами), через которые НKклетки вводят в клетку-мишень ФНО и
ферменты. ФНО является сигналом,
запускающим программу самоуничтожения
клетки-мишени - апоптоз
29.
Филогенетически древние неспецифические(врожденные) эффекторные механизмы
иммунитета способны бороться со многими
вирусами, бактериями и опухолевыми клетками.
Однако данные механизмы не меняют свою
эффективность после предварительного
ознакомления с антигенами, то есть не
обладают свойством памяти. Именно данное
свойство, а также чрезвычайно высокая
специфичность и эффективность выгодно
отличают описываемые ниже приобретенные
(специфические) механизмы иммунитета
30.
Специфические (приобретенные) эффекторныемеханизмы
1.Активация системы комплемента по классическому
пути антителами (IgM и IgG), связавшимися с
поверхностными антигенами бактерий (комплексом
антиген-антитело). Результаты активации системы
комплемента изложены выше.
2. Опсонизация антителами клеток, вирусов и
растворимых антигенов приводит к стимуляция
фагоцитоза бактерий.
3. Антитело-зависимая клеточная цитотоксичность
(АЗКЦ). Осуществляется НК, макрофагами, нейтрофилами,
имеющими на своей поверхности рецепторы к Fcфрагментам антител IgG, и эозинофилами, имеющими
рецепторы к Fc-фрагментам IgE. Указанные эффекторные
клетки связываются через эти рецепторы с антителами,
фиксированными к поверхностным антигенам клетокмишеней, и уничтожают клетки-мишени, “меченые”
антителами. Именно таким путем, например, эозинофилы
повреждают клетки гельминтов. Механизмы уничтожения
у НК, фагоцитов и эозинофилов разные.
4. Связывание и нейтрализация вирусов и токсинов
бактерий антителами с последующим фагоцитозом
образующихся иммунных комплексов фагоцитами.
31.
Антитела являются своеобразной меткой,которой специфические гуморальные
механизмы метят подлежащие
уничтожению клетки. Причем само это
уничтожение производится путем
активации системы комплемента и
фагоцитоза, которые являются
врожденными и неспецифическими.
32.
Иммунологическая толерантность• Иммунологической толерантностью
называют своеобразную специфическую
ареактивность иммунной системы в
отношении определенного антигена,
которую индуцирует предшествующий
контакт с антигеном. Иными словами,
иммунологическая толерантность означает
способность организма не давать
иммунный ответ против специфического
антигена.
33.
Механизмы толерантности• Клональная делеция в процессе созревания Т
и/или В-клеток ,имеющие рецепторы к
собственным белкам-антигенам ,погибают
путем апоптоза после распознавания этих
антигенов
• Клональная анергия – такое состояние
аутореактивных лимфоцитов ,при котором они
сохраняют жизнеспособность, но не могут
быть активированы аутоантигенами
• Супрессия Т-лимфоцитами Тх3 способные
инактивировать Тх1, Тх2 и В-лимфоциты, за
счет секреции трансформирующего фактора
роста и ИЛ-10
34.
Иммунопатолгия- патологическое нарушенияиммунной системы.
Виды иммунопатолгий:
• Иммунодефицитные состояния
• Аллергические реакции (реакции
гиперчуствительности)
• Аутоаллергические (аутоиммунные)
реакции
35.
ИммцнодефицитыСостояния, характеризующиеся снижением
иммунологической реактивности в результате
наследственного или приобретенного дефекта
эффекторных механизмов иммунитета.
Характерные проявления иммунодефицитов:
• Инфекционные: рецидивирующие, трудно
поддающиеся лечению антибиотиками
инфекции ,вызываемые гноеродной флорой;
аутоинфекции
• Опухолевые – вследствие нарушения функции
«иммунный надзор»
• Патологические изменения в лабораторных
иммунологических тестах
36.
Первичные иммунодефицитыВ большинстве случаев являются
наследственными заболеваниями, с
нарушениями эффекторного механизма
иммунитета:
• Дефекты фагоцитоза – дефект адгезии
лейкоцитов к эндотелию,
• Нарушение хемотаксиса
• Нарушение прилипания лейкоцитов к
бактериям
• Нарушение кислород-зависимых
бактрицидных механизмов
• Дефекты белков системы комплимента
• Специфические иммуннодефициты
37.
Первичные иммунодефициты38.
Вторичные иммунодефицитыЯвляются синдромом, который осложняет
течение основного заболевания, имеются
сочетанные поражения и неспецифических,
и специфических эффекторных механизмов
иммунитета.
39.
Этиологические факторы вторичныхиммунодефицитов:
• ВИЧ-инфекция – повреждение Т-лимфоцитов хелперов
• Нарушения обмена веществ, обусловленные
недостатком в организме белка и веществ,
необходимых для его синтеза
• Действие ионизирующей радиации и лекарственных
веществ, которые вызывают торможение размножение
быстроделящихся лимфоидных клеток и угнетать их
продукцию или цитокинов
• Тяжелые и длительные стрессы- нарушение функции
НК-клеток
• Генирализованные поражения красного костного мозга
• Состояние после спленэктомии
• Старение
40.
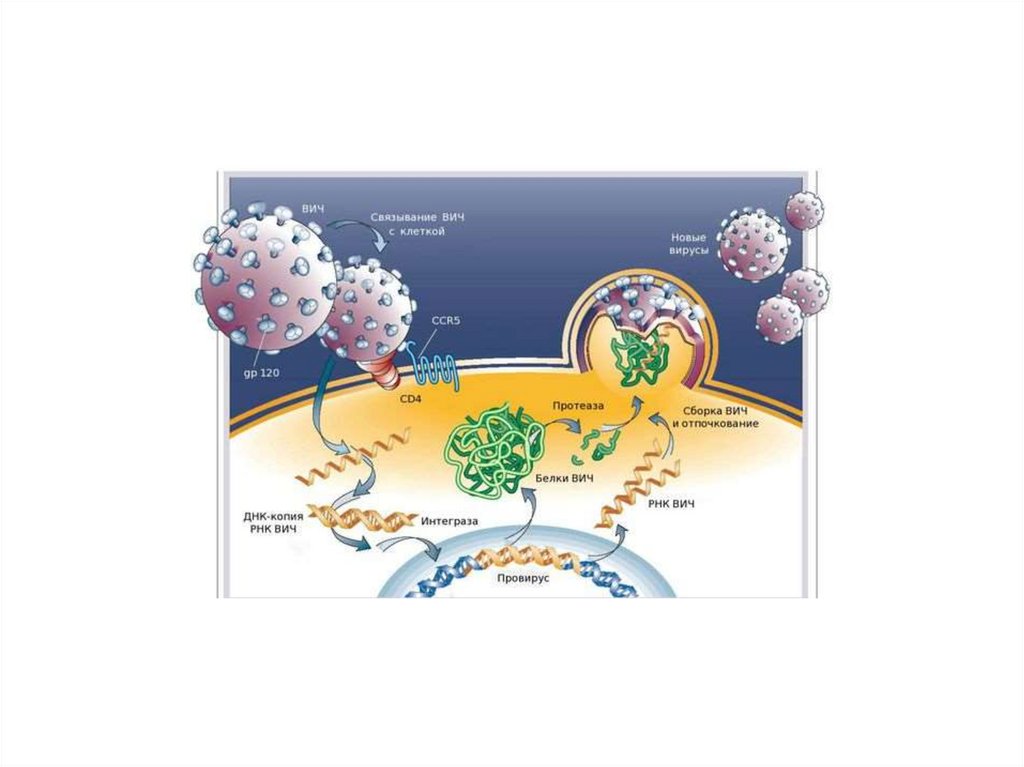
СПИДВызывается вирусом иммунодефицита (ВИЧ) ,
который представляет собой РНКсодержащий ретровирус.
Поверхностный гликопротеин ВИЧ (gp120)
имеет высокое сходство к рецептору CD4 .
Это объясняет избирательное поражение
вирусов Т-хелперов, а также других клеток,
особенно макрофагов. Соединяясь с
рецептором , вирус внедряется в клетки.
41.
СПИДКлючевые события в развитии СПИДа:
• Поражение вирусом CD4 Т-хелперов,
приводящее к гибели этих клеток (Т-хелпер
выполняет основную регулирующую роль в
запуске реакция клеточного и
гуморального специфического иммунитет)
• Инфицирование вирусом CD4 моноцитов и
макрофагов не вызывает их гибель, но
служат важнейшим резервуаром для ВИЧ и
переносят вирус в различные органы
42.
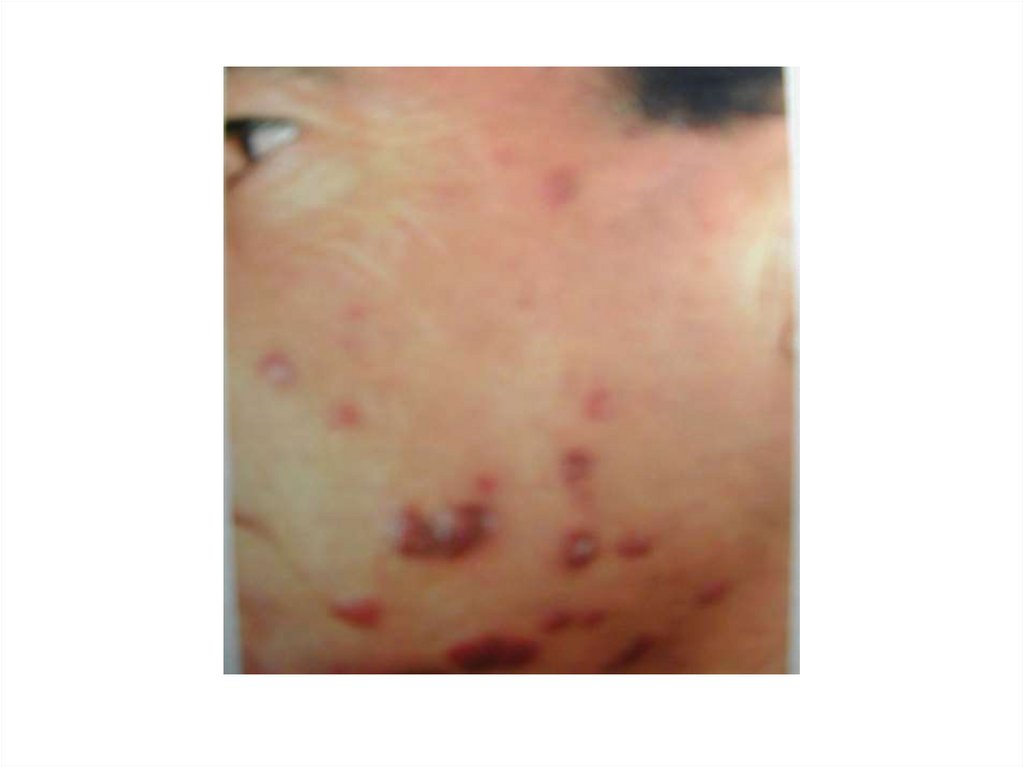
43.
Для больных СПИДом характерно:• Снижение резистентности к условнопатогенным возбудителям
оппортунистических инфекций: хронические
диареи, кандидоз слизистых оболочек,
пневмоцистные пневмонии
• Повторные инфекции, вызываемые
гноеродными бактериями
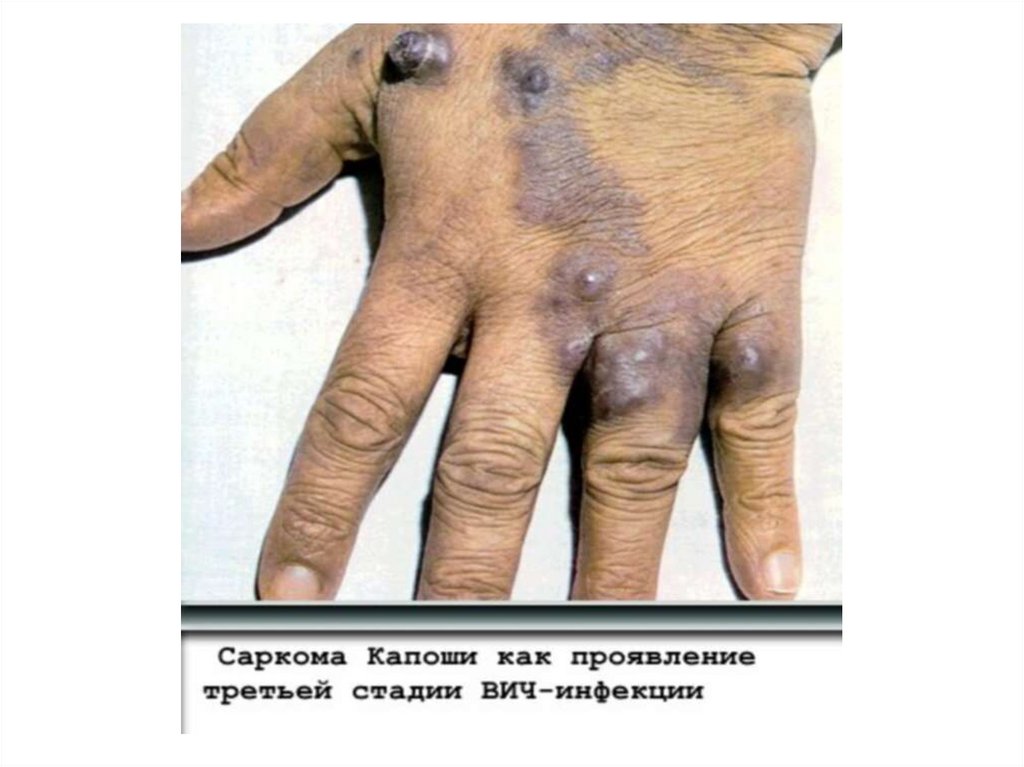
• Угнетение противоопухолевого иммунитета:
саркома Капоши, злокачественные лимфомы
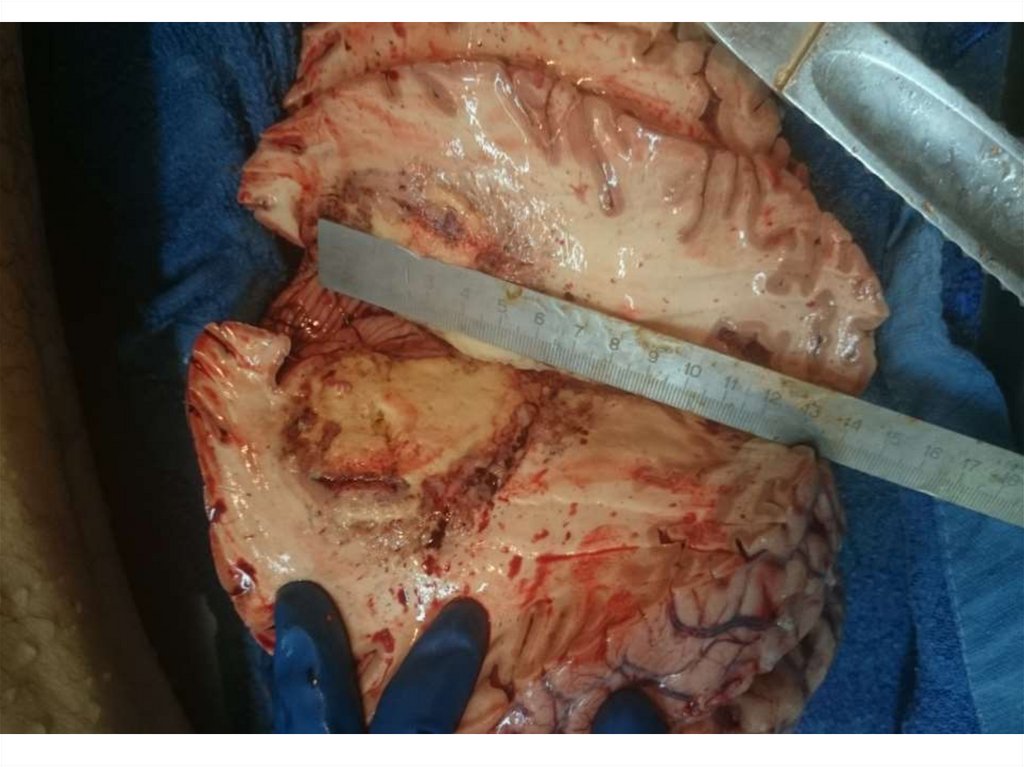
• Поражения ЦНС в результате как прямого
повреждающего действия ВИЧ на головной
мозг, так и оппортунистическими
криптококковой и токсоплазменной
инфекциями
44.
45.
46.
47.
48.
49.
Аутоиммуные (аутоаллергические)заболевания
Обусловленные аутоантителами (антителами к
собственным антигенам) и цитотоксическими
Т-лимфоцитами, имеющих рецепторы против
собственных антигенов.
Механизмы повреждения тканей (вторичная
альтерация) различны:
- цитотоксические реакции II типа и клеточные
реакции IV тип – органоспецифические
аутоиммунные заболевания;
- -диффузное отложение иммунных комплексов
III тип при органонеспицифеских
аутоиммунных заболеваний
50.
Механизмы запуска аутоиммунных процессов• Повреждение гистогематических барьеров
• Изменение собственных АГ
• Попадание в организм бактериальных АГ,
имеющих детерминанты, пространственно
похожие на определенные антигенные
детерминанты тканей организма человека
• Реактиация анергичных клонов – нарушение
иммунологической толерантности
• Снятие супрессии (снижение активности Тсупрессоров, контролирующих
аутореактивные Т-хелперы и В-лимфоциты,
приводит к развитию аутоиммунных
заболеваний












































 medicine
medicine








