Similar presentations:
Пептиды и белки
1.
ПЕПТИДЫ И БЕЛКИСпирали встречаются во многих областях: в архитектуре, в макромолекулах
белков, нуклеиновых кислот и даже в полисахаридах (Loretto Chapel, Santa Fe,
NM/© Sarbo )
2.
ОБЩИЕ СВЕДЕНИЯ О БЕЛКАХУ каждого вида организмов имеются тысячи
различных белков, а число самих видов,
вероятно, составляет около 10 миллионов.
Можно ли всего из 20 аминокислот построить,
скажем, 1011 (или более) различных
последовательностей?
Дипептид – 2 изомера
Трипептид (из трех аминокислот – А, В и С) – 3!
=1·2·3=6 изомеров (ABC, АСВ, ВАС, ВСА, CAB и
СВА)
2
3.
ОБЩИЕ СВЕДЕНИЯ О БЕЛКАХТетрапептид - 4! = 4·3·2·1=24 различные
последовательности
Полипептида из 20 различных
аминокислот – 20!≈2·1018 изомеров (Mr ≈2600).
Белок с Mr ≈34000, состоящий из 12
аминокислот в равных соотношениях, имеет
10300 возможных последовательностей.
3
4.
ОБЩИЕ СВЕДЕНИЯ О БЕЛКАХGarrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851s.
4
5. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ
H2NCH
COOH + HNH
R1
CH
R2
O
H2N
COOH + HNH
CH
R1
C
CH
R2
COOH + ... HNH
R3
O
NH
CH
C
CH
COOH
Rn
O
NH
CH
R3
C
... NH
CH
COOH
Rn
5
6. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851s.6
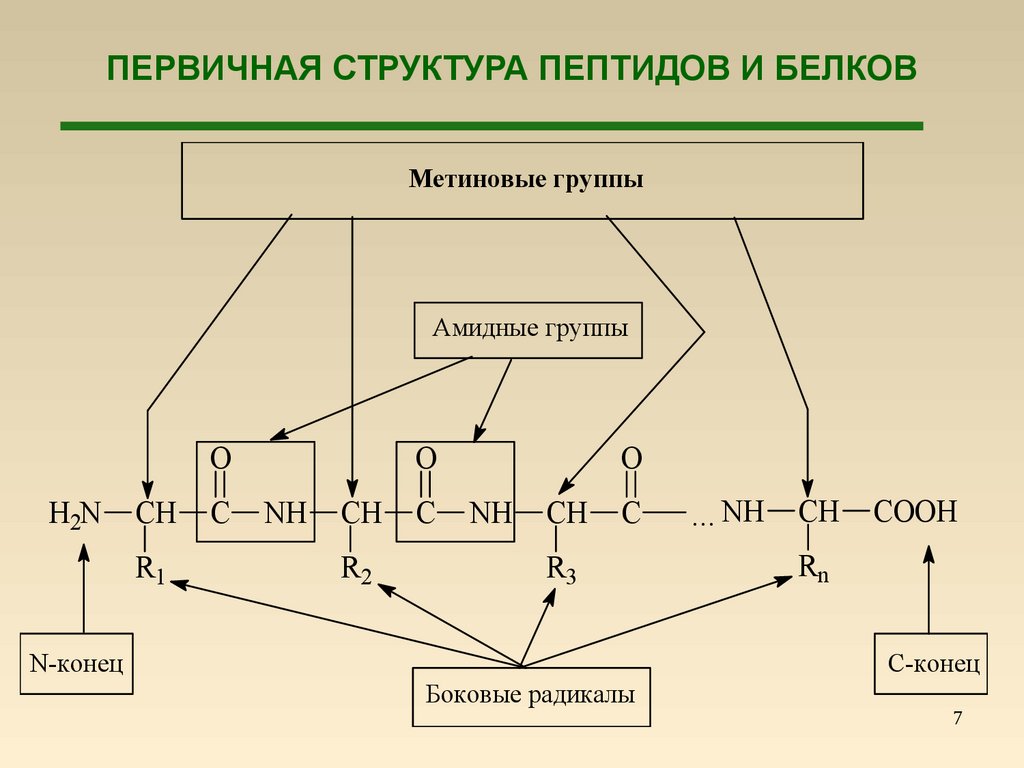
7. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ
Метиновые группыАмидные группы
O
H2N
CH
R1
C
O
NH
CH
R2
C
O
NH
CH
C
R3
N-конец
... NH
CH
COOH
Rn
С-конец
Боковые радикалы
7
8. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Состав и аминокислотная последовательность)
Молекулярные характеристики некоторых белковБелок
Мол. масса
Число остатков
Число цепей
Инсулин (бычий)
5 733
51
2
Рибонуклеаза
(из поджелудочной железы быка)
13 683
124
1
Лизоцим (из яичного белка)
13 930
129
1
Миоглобин (из миокарда лошади)
16 890
153
1
Химотрипсин
(из поджелудочной железы быка)
22 600
241
3
Гемоглобин
(человека)
64 500
574
4
Сывороточный альбумин (человека)
68 500
~550
1
Гексокиназа (из дрожжей)
102 000
~800
2
γ-Глобулин (лошади)
149 900
~1250
4
Глутаматдегидрогенеза
(из печени быка)
1 000 000
~8300
~40
8
9. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Выделение и очистка белков)
ДиализМембрана, окружающая раствор
белка, свободно пропускает воду
и низкомолекулярные
соединения, такие, как NaCl или
глюкоза, но не пропускает
большие молекулы в частности
молекулы белка. Малые
молекулы диффундируют из
диализного мешочка во внешний
сосуд, так как в процессе
диффузии молекулы стремятся
перейти в зону с более низкой
концентрацией. Заменяя
несколько раз водную фазу во
внешнем сосуде на
дистиллированную воду, можно
снизить концентрацию
низкомолекулярных соединений
в растворе белка до сколь угодно
малой величины.
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851s.
9
10. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Выделение и очистка белков)
Гель-фильтрацияРазделение белков в
соответствии с размерами их
молекул методом гельфильтрации. Раствор,
содержащий смесь белков,
пропускают через колонку,
заполненную очень мелкими
пористыми гранулами
гидрофильного полимера:
широко используют для этой
цели производные декстрана.
Молекулы малых белков
проникают внутрь гранул, тогда
как более крупные молекулы не
могут туда проникнуть.
Молекулярную массу белка
можно определить путем
сравнения скорости его
прохождения через колонку со
скоростями прохождения других
белков с известными
молекулярными массами.
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851s. 10
11. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Выделение и очистка белков)
Гель-электрофорезGarrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
11
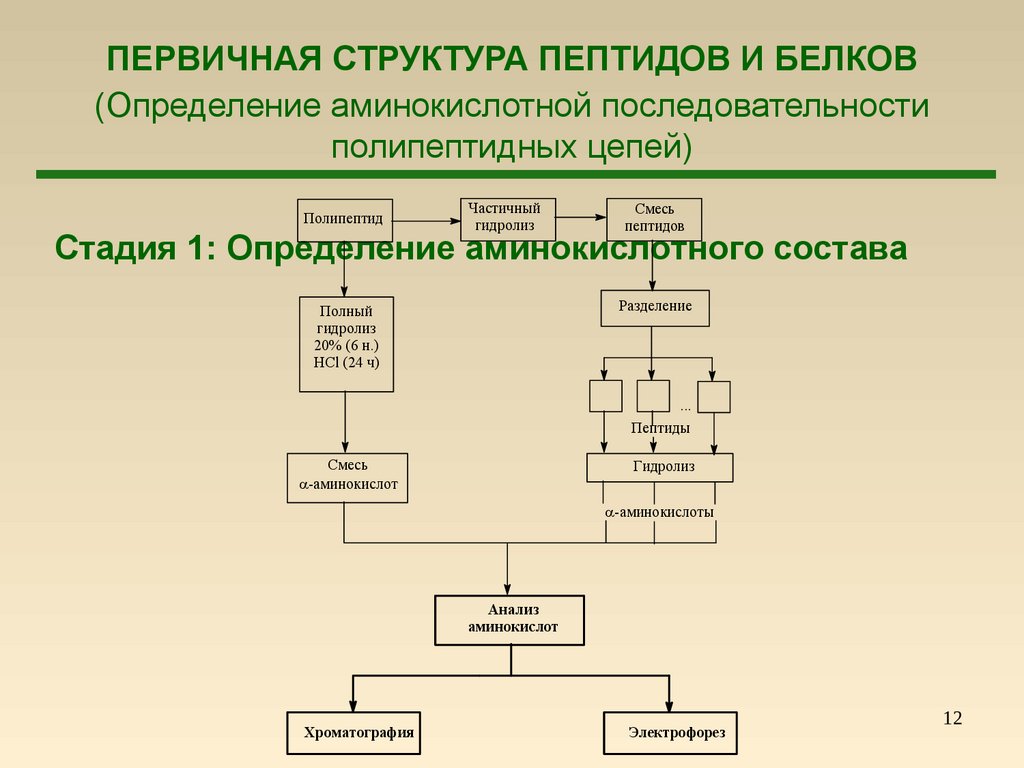
12. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
ПолипептидЧастичный
гидролиз
Смесь
пептидов
Стадия 1: Определение аминокислотного состава
Разделение
Полный
гидролиз
20% (6 н.)
HCl (24 ч)
...
Пептиды
Смесь
-аминокислот
Гидролиз
-аминокислоты
Анализ
аминокислот
Хроматография
Электрофорез
12
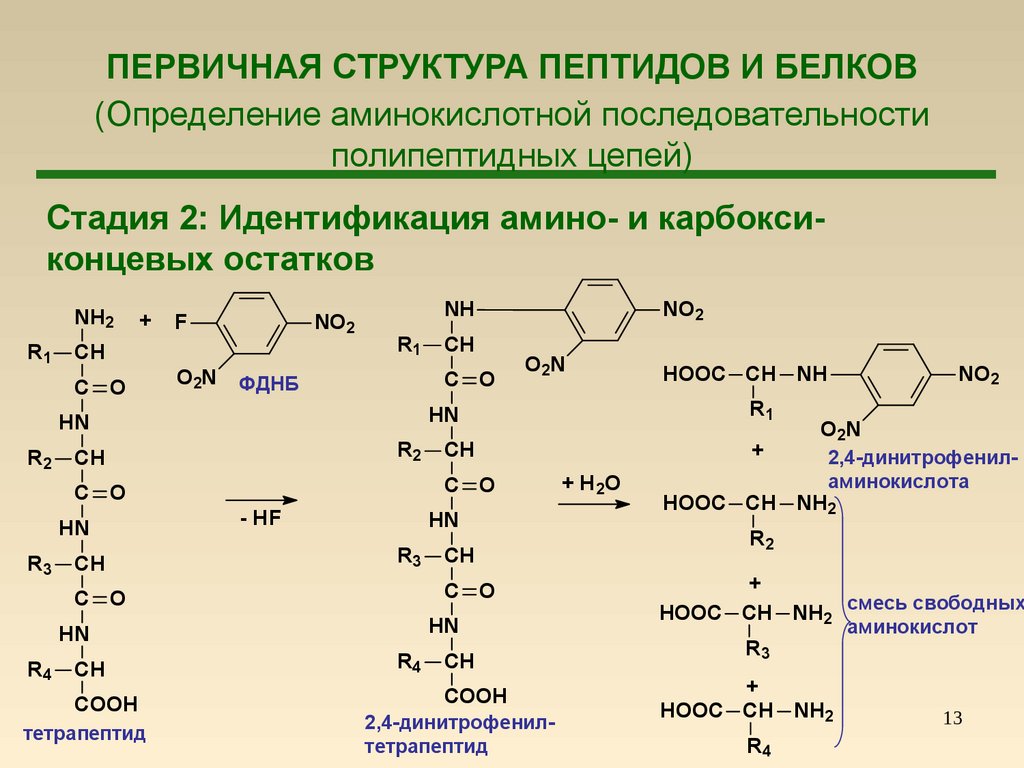
13. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 2: Идентификация амино- и карбоксиконцевых остатковNH2
R1
+
F
NO2
CH
C O
O2N
R1
R2
CH
- HF
HN
R3
C O
C O
HN
HN
R4
CH
COOH
тетрапептид
CH
R4
CH
COOH
2,4-динитрофенилтетрапептид
+
+ H 2O
NO2
HOOC CH NH
R1
CH
C O
C O
R3
O2N
HN
CH
HN
CH
C O
ФДНБ
HN
R2
NO2
NH
O2N
2,4-динитрофениламинокислота
HOOC CH NH2
R2
+
HOOC CH NH2 смесь свободных
R3
+
HOOC CH NH2
R4
аминокислот
13
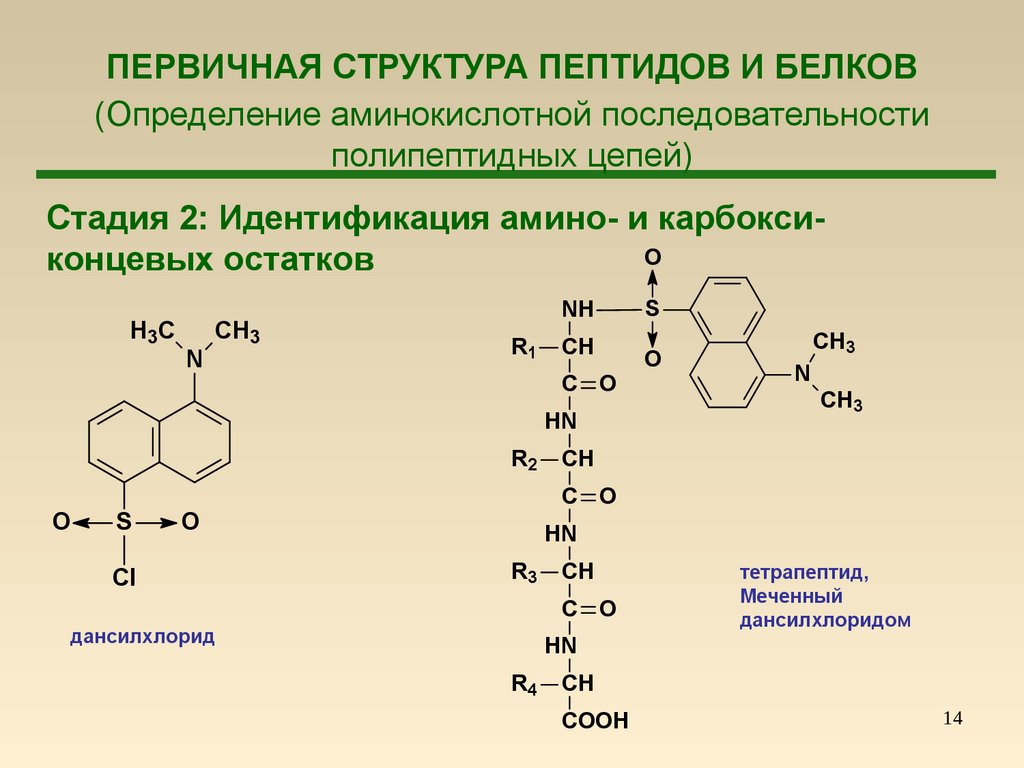
14. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 2: Идентификация амино- и карбоксиOконцевых остатков
H 3C
N
CH3
NH
R1
CH
C O
HN
R2
O
S
O
CH3
N
CH3
CH
C O
O
Cl
S
HN
R3
CH
C O
дансилхлорид
тетрапептид,
Меченный
дансилхлоридом
HN
R4
CH
COOH
14
15. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 3: Расщепление полипептидной цепи нафрагменты
Специфичность, свойственная четырем важным методам фрагментации
полипептидных цепей
Обработка
Точки расщепления (остатки, которым принадлежит
карбонильная группа расщепляемой пептидной связи)
Трипсин
Лизин
Аргинин
Химотрипсин
Фенилаланин
Триптофан
Тирозин
Пепсин
Фенилаланин
Триптофан
Тирозин
Некоторые другие остатки
Бромциан
Метионин
15
16. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
1617. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 3: Расщепление полипептидной цепи на фрагментыАктивный центр химотрипсина
17
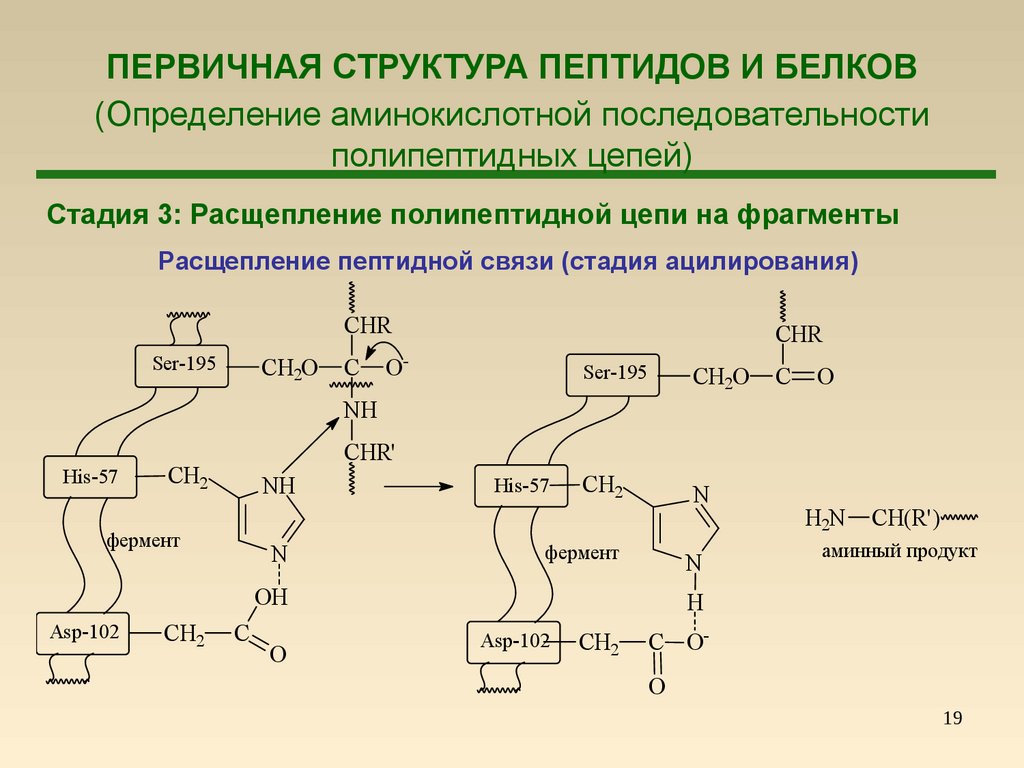
18. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
1819. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 3: Расщепление полипептидной цепи на фрагментыРасщепление пептидной связи (стадия ацилирования)
CHR
Ser-195
CH2O
C
CHR
O-
Ser-195
CH2O
CH2
N
C
O
NH
His-57
CHR'
CH2
NH
фермент
N
His-57
фермент
N
OH
Asp-102
CH2
C
O
H2N
CH(R')
аминный продукт
H
Asp-102
CH2
C OO
19
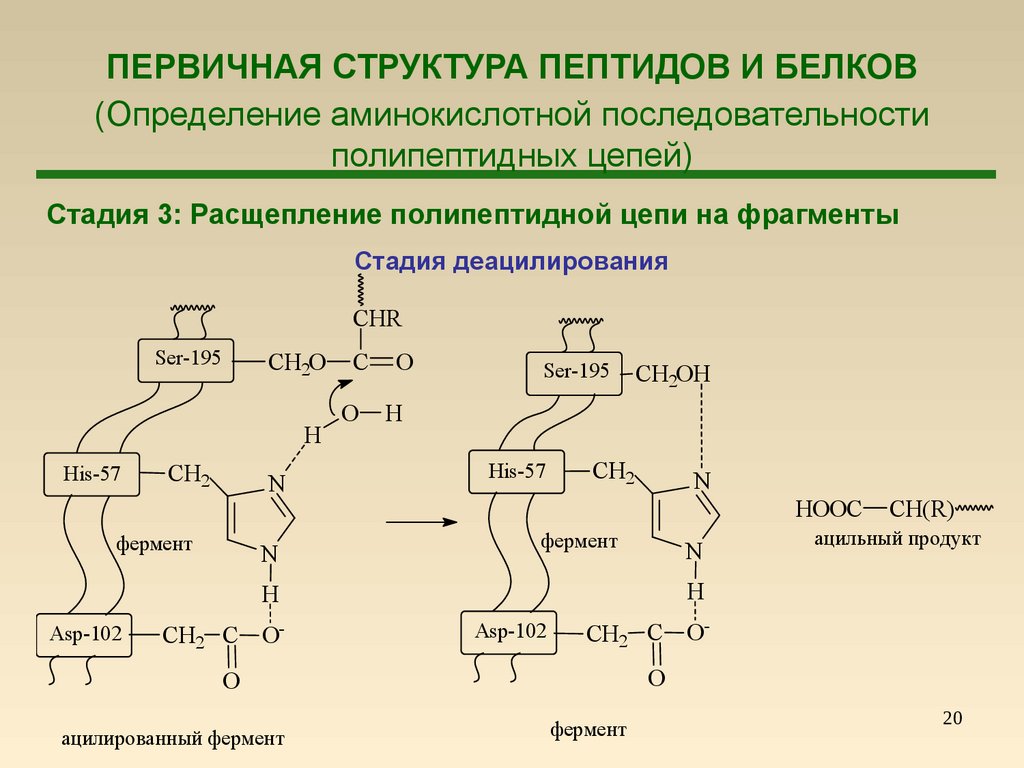
20. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 3: Расщепление полипептидной цепи на фрагментыСтадия деацилирования
CHR
Ser-195
CH2O
H
His-57
CH2
N
фермент
N
C
O
O
H
Ser-195
His-57
CH2OH
CH2
N
HOOC
фермент
N
CH2 C O-
Asp-102
CH2 C OO
O
ацилированный фермент
ацильный продукт
H
H
Asp-102
CH(R)
фермент
20
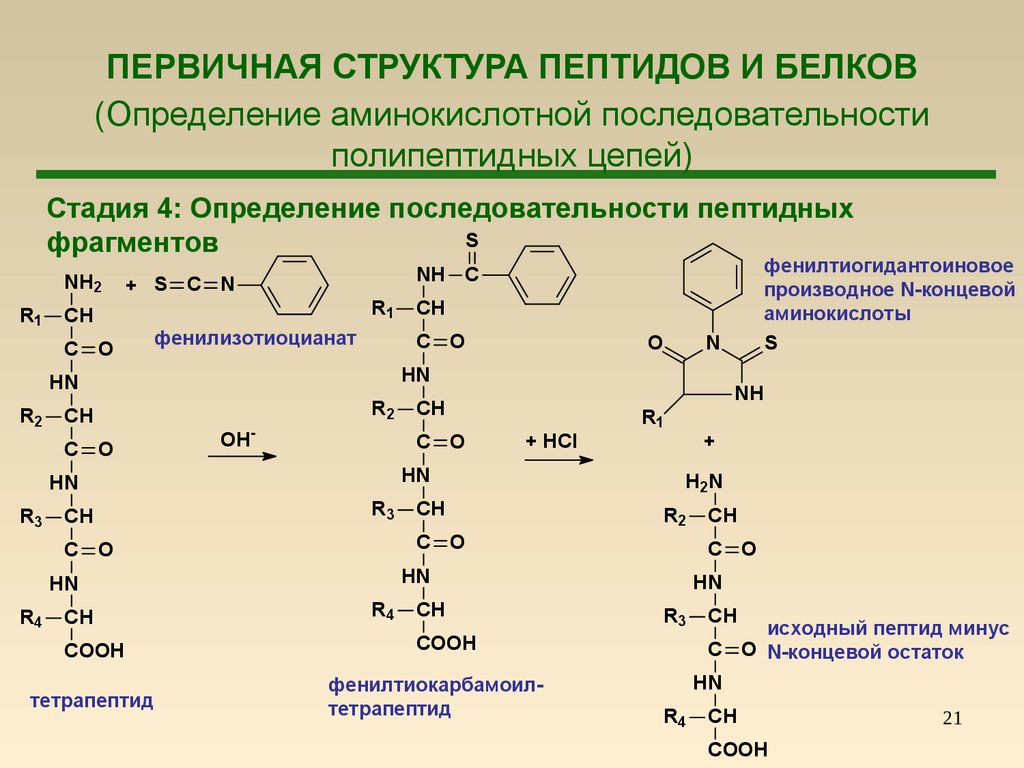
21. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 4: Определение последовательности пептидныхS
фрагментов
NH2
R1
+ S C N
R1
CH
C O
фенилизотиоцианат
R2
OH
-
CH
R3
CH
R1
+
H 2N
R2
C O
R4
CH
COOH
COOH
тетрапептид
фенилтиокарбамоилтетрапептид
CH
C O
HN
HN
CH
+ HCl
HN
C O
R4
N
NH
CH
C O
HN
R3
O
HN
CH
C O
CH
C O
HN
R2
фенилтиогидантоиновое
производное N-концевой
аминокислоты
S
NH C
HN
R3
CH
исходный пептид минус
C O N-концевой остаток
HN
R4
CH
COOH
21
22. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 4: Определение последовательности пептидныхфрагментов
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
22
23. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 5: Расщепление исходной полипептидной цепи еще однимспособом
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
23
24. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Стадия 6: Установление порядка расположения пептидныхфрагментов по перекрывающимся участкам
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
24
25. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
2526. ПЕРВИЧНАЯ СТРУКТУРА ПЕПТИДОВ И БЕЛКОВ (Определение аминокислотной последовательности полипептидных цепей)
Аминокислотная последовательность, т.е.порядок чередования -аминокислотных
остатков, составляет первичную структуру
пептидов и белков.
26
27.
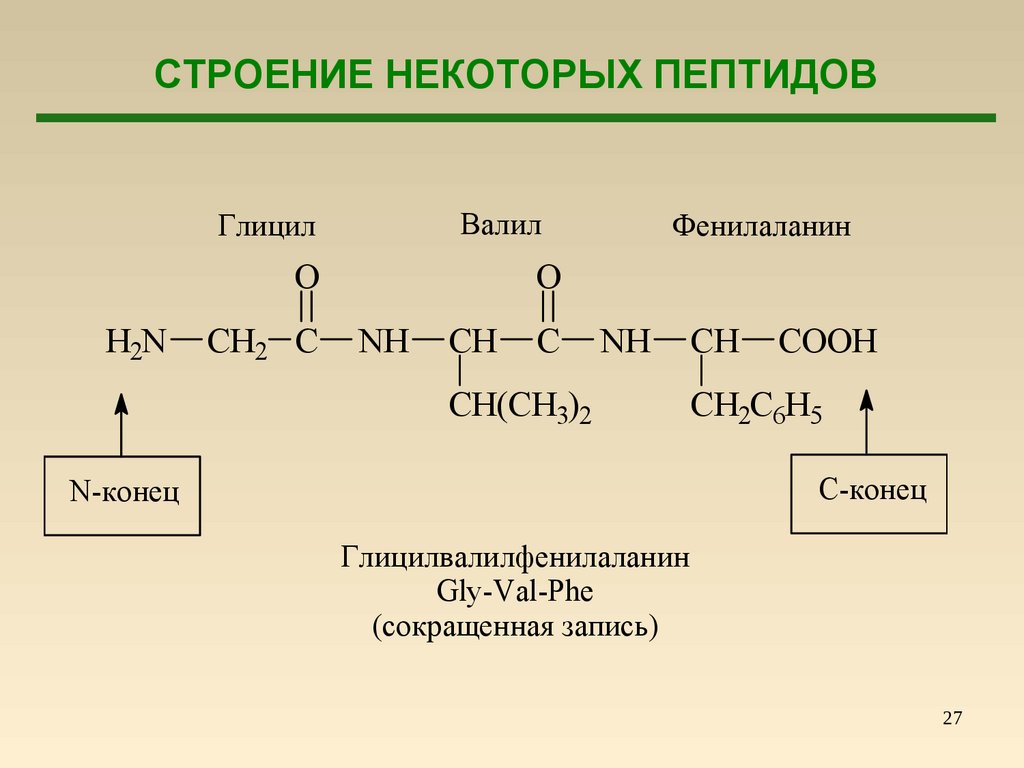
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВH2N
Глицил
Валил
O
O
CH2 C
NH
CH
C
Фенилаланин
NH
CH(CH3)2
CH
COOH
CH2C6H5
С-конец
N-конец
Глицилвалилфенилаланин
Gly-Val-Phe
(сокращенная запись)
27
28.
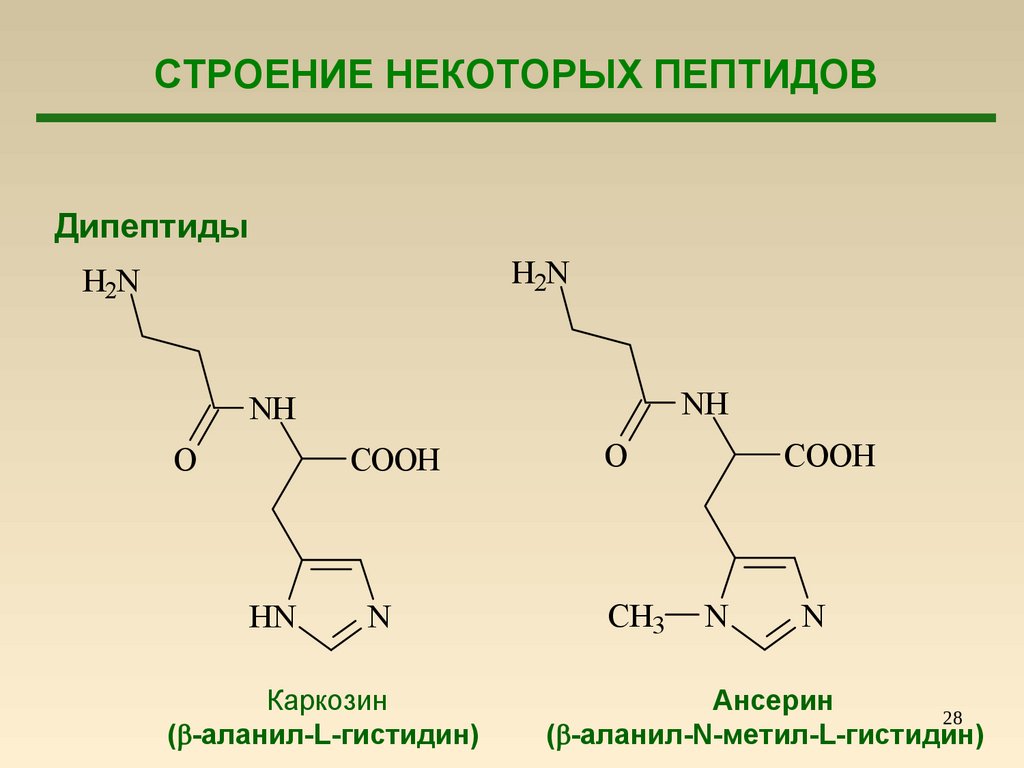
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВДипептиды
H2N
H2N
NH
NH
O
HN
COOH
O
N
CH3
Каркозин
( -аланил-L-гистидин)
COOH
N
N
Ансерин
28
( -аланил-N-метил-L-гистидин)
29.
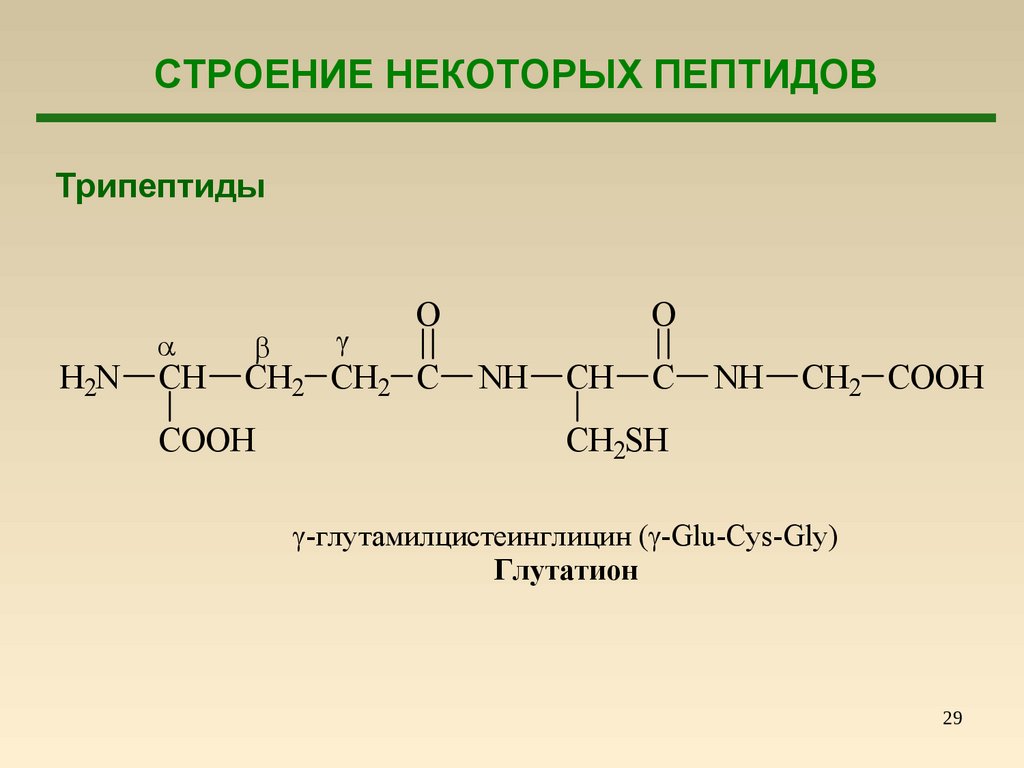
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВТрипептиды
H2N
CH
O
CH2 CH2 C
COOH
O
NH
CH
C
NH
CH2 COOH
CH2SH
-глутамилцистеинглицин ( -Glu-Cys-Gly)
Глутатион
29
30.
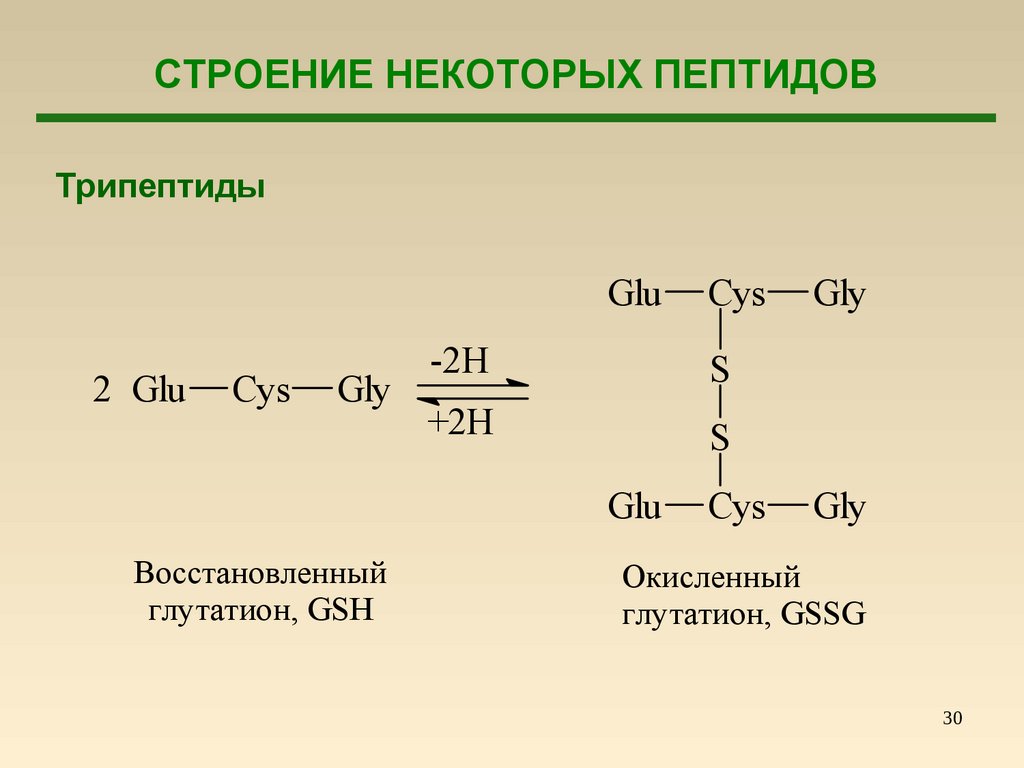
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВТрипептиды
Glu
2 Glu
Cys
Gly
-2H
S
+2H
S
Glu
Восстановленный
глутатион, GSH
Cys
Cys
Gly
Gly
Окисленный
глутатион, GSSG
30
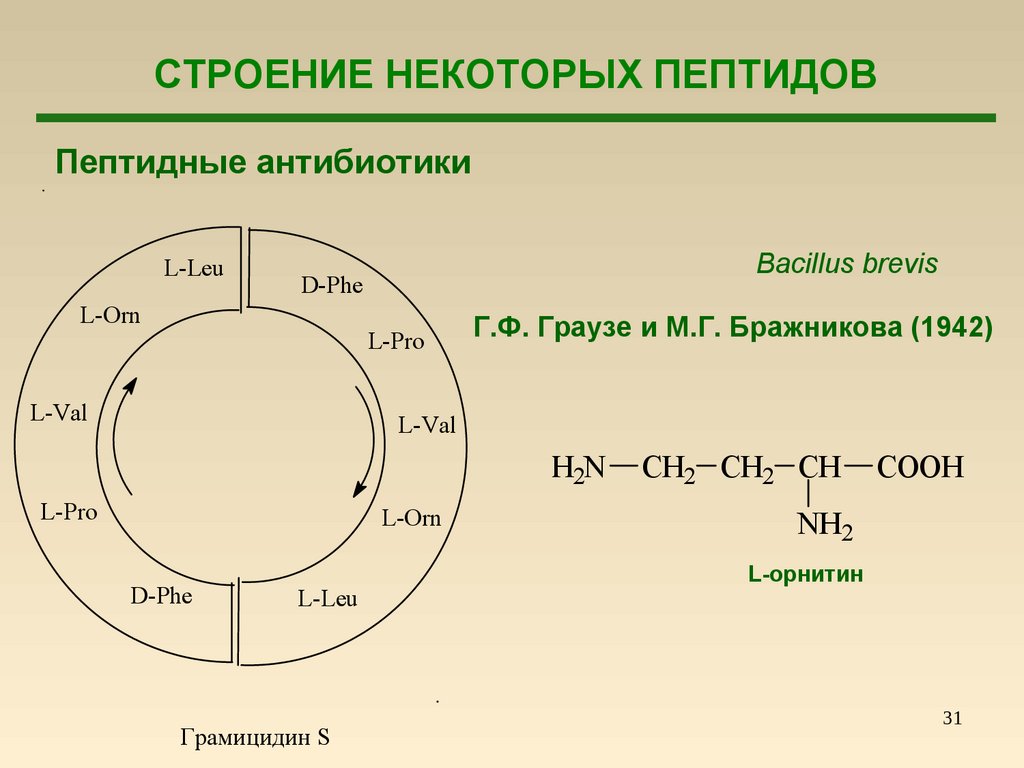
31.
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВПептидные антибиотики
L-Leu
Bacillus brevis
D-Phe
L-Orn
L-Pro
L-Val
Г.Ф. Граузе и М.Г. Бражникова (1942)
L-Val
H2N
L-Pro
L-Orn
D-Phe
L-Leu
Грамицидин S
CH2 CH2 CH
COOH
NH2
L-орнитин
31
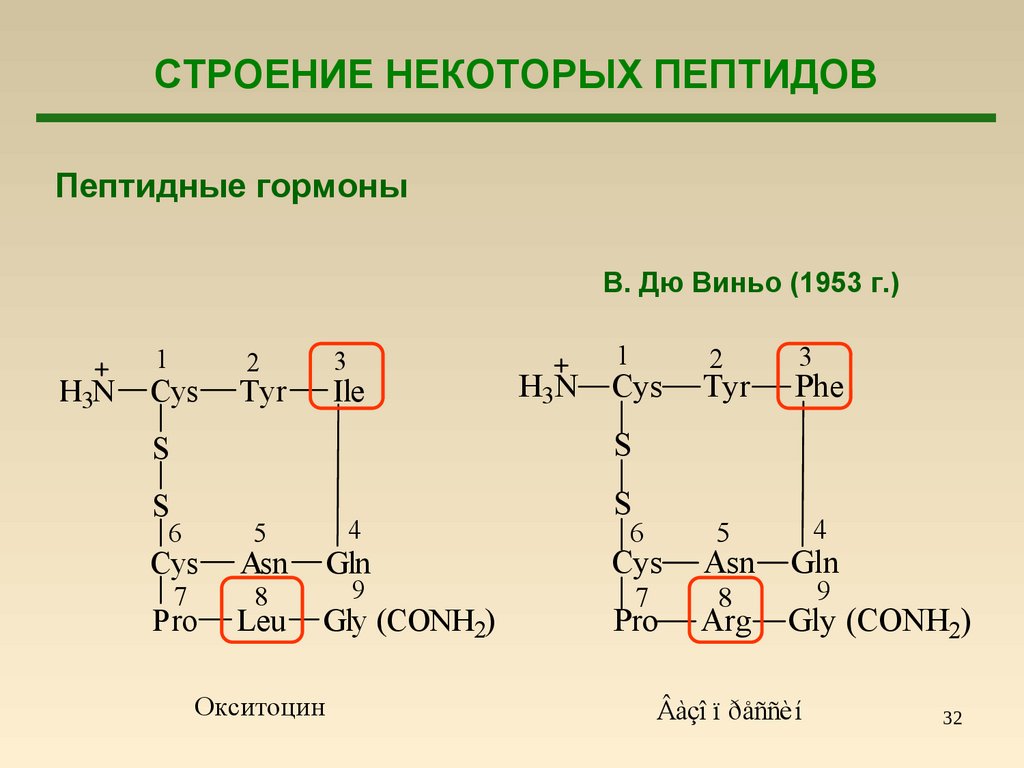
32.
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВПептидные гормоны
В. Дю Виньо (1953 г.)
H3N
1
Cys
3
2
Tyr
Ile
H3N
1
Cys
S
S
S
S
6
Cys
Asn
7
8
Pro
4
5
Leu
Gln
9
Gly (CONH2)
Окситоцин
6
2
Tyr
Phe
5
4
Cys
Asn
7
8
Pro
3
Arg
Gln
9
Gly (CONH2)
Âàçî ï ðåññèí
32
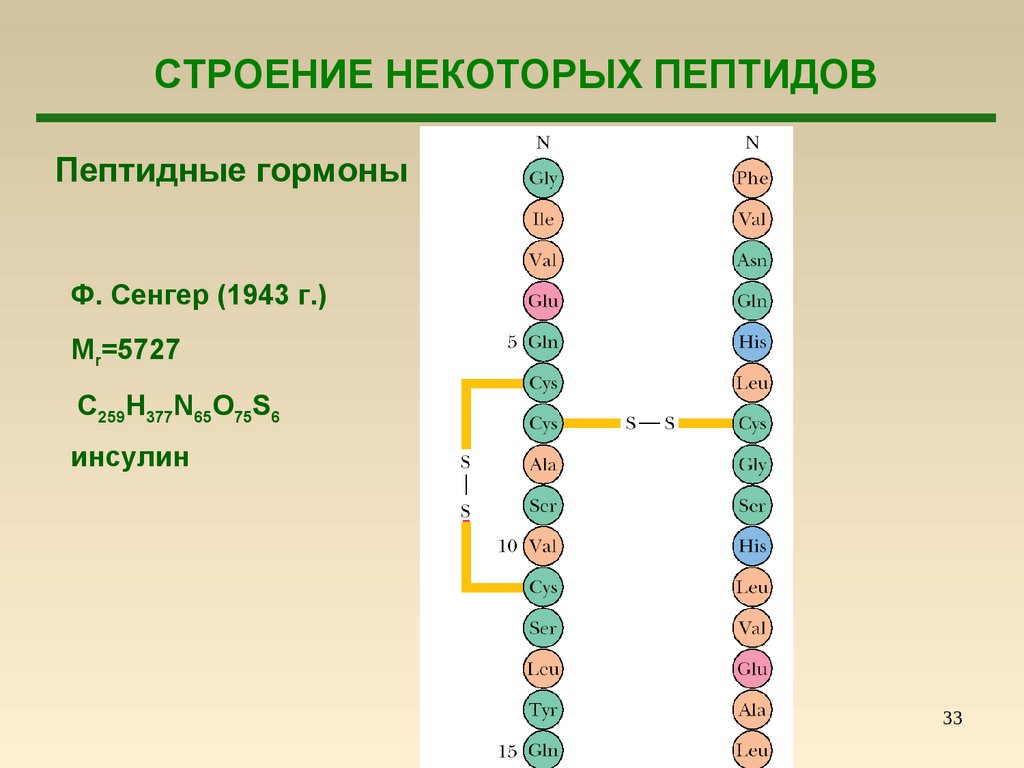
33.
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВПептидные гормоны
Ф. Сенгер (1943 г.)
Mr=5727
С259Н377N65O75S6
инсулин
33
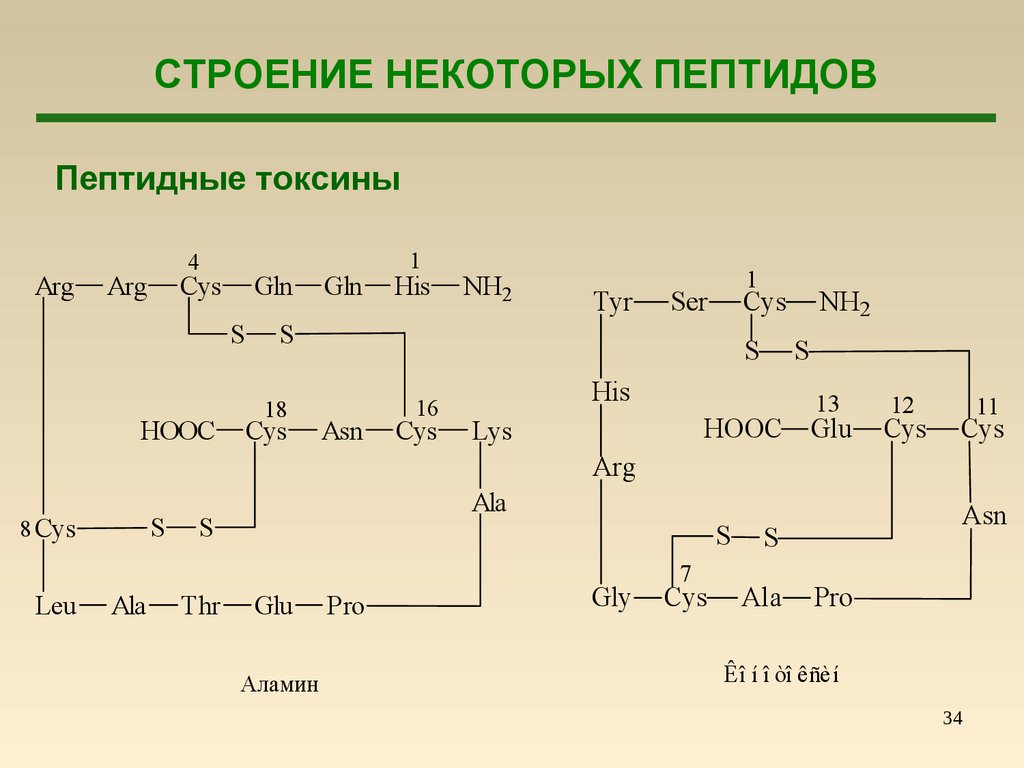
34.
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВПептидные токсины
Arg
4
Arg
Cys
Gln
S
HOOC
Gln
1
His
NH2
Tyr
1
Ser
Cys
S
18
Cys
S
Asn
16
Cys
S
His
HOOC
Lys
NH2
13
Glu
12
Cys
11
Cys
Arg
S
8 Cys
Leu
Ala
Ala
S
Thr
S
Glu
Аламин
Pro
Gly
7
Cys
Asn
S
Ala
Pro
Êî í î òî êñèí
34
35.
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВНейропептиды
Tyr
Gly
Gly
Phe
Met
Met-энкефалин
Tyr
Gly
Gly
Phe
Leu
Leu-энкефалин
35
36.
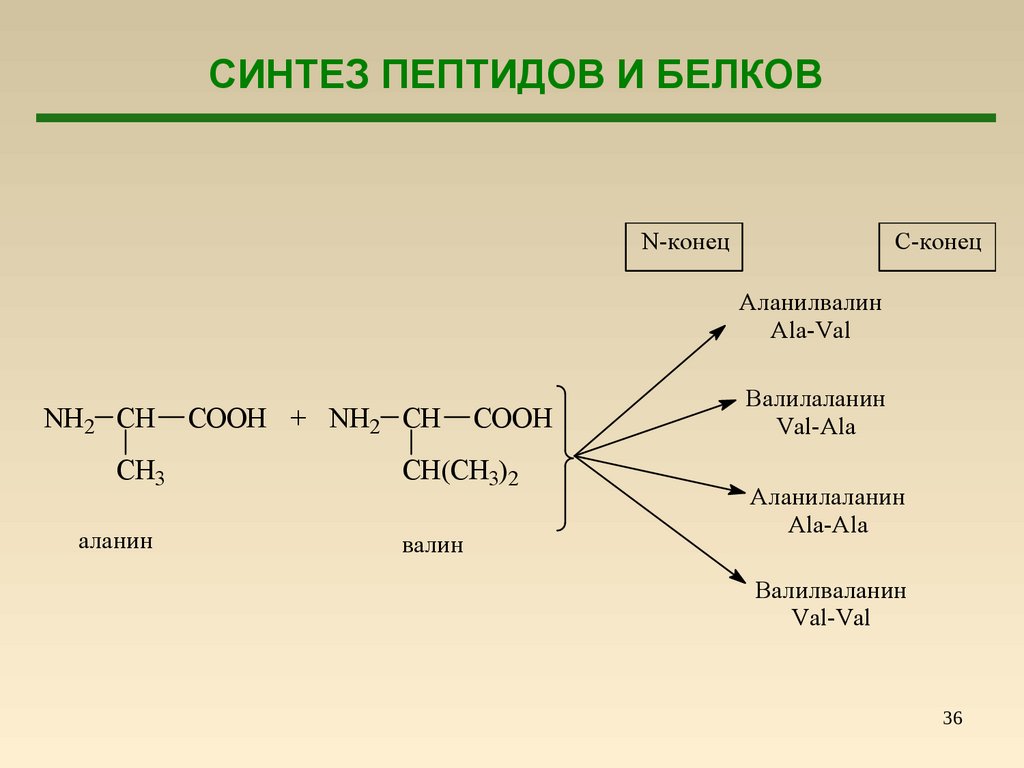
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВN-конец
С-конец
Аланилвалин
Ala-Val
NH2 CH
CH3
аланин
COOH + NH2 CH
COOH
CH(CH3)2
валин
Валилаланин
Val-Ala
Аланилаланин
Ala-Ala
Валилваланин
Val-Val
36
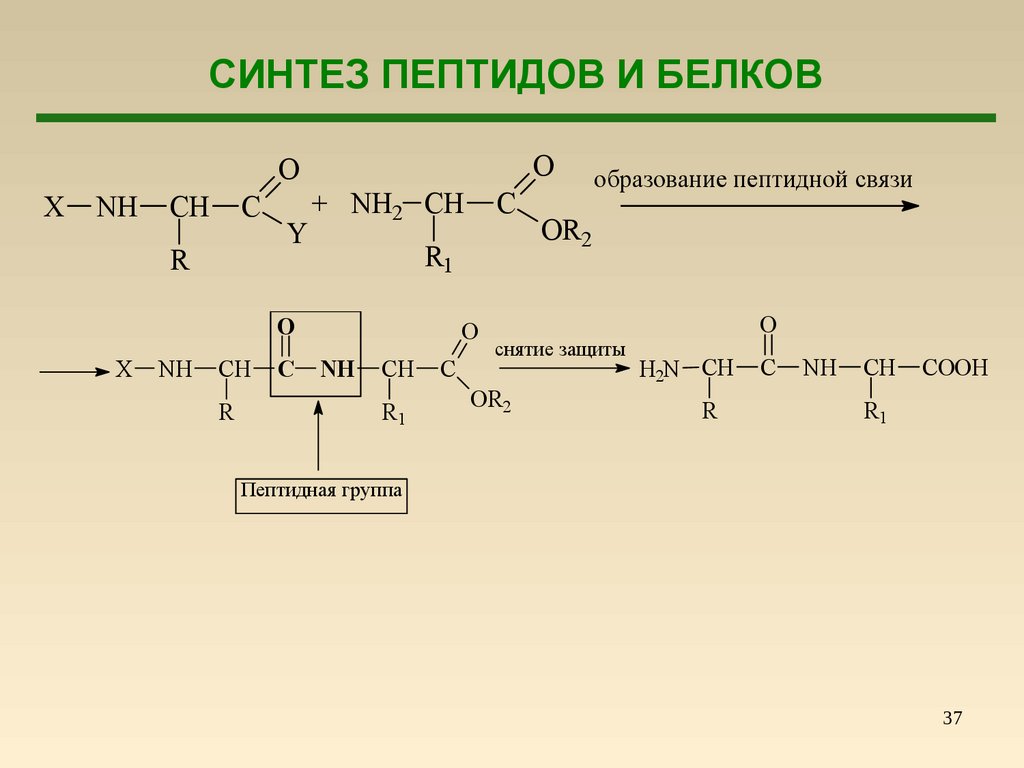
37.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВO
O
X
NH
CH
C
R
Y
+ NH2 CH
R1
O
X
NH
CH
R
C
C
O
NH
CH
R1
C
образование пептидной связи
OR2
снятие защиты
OR2
O
H2N CH
R
C
NH
CH
COOH
R1
Пептидная группа
37
38.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВСинтез дипептида аланилвалина
1-ый компонент – Аланин
Защита NH2-группы:
NH2 CH
COOH + C6H5CH2O
CH3
-аланин
C
Cl -HCl C6H5CH2O
O
карбобензоксихлорид
C
O
NH
CH
COOH
CH3
карбобензоксигруппа
38
39.
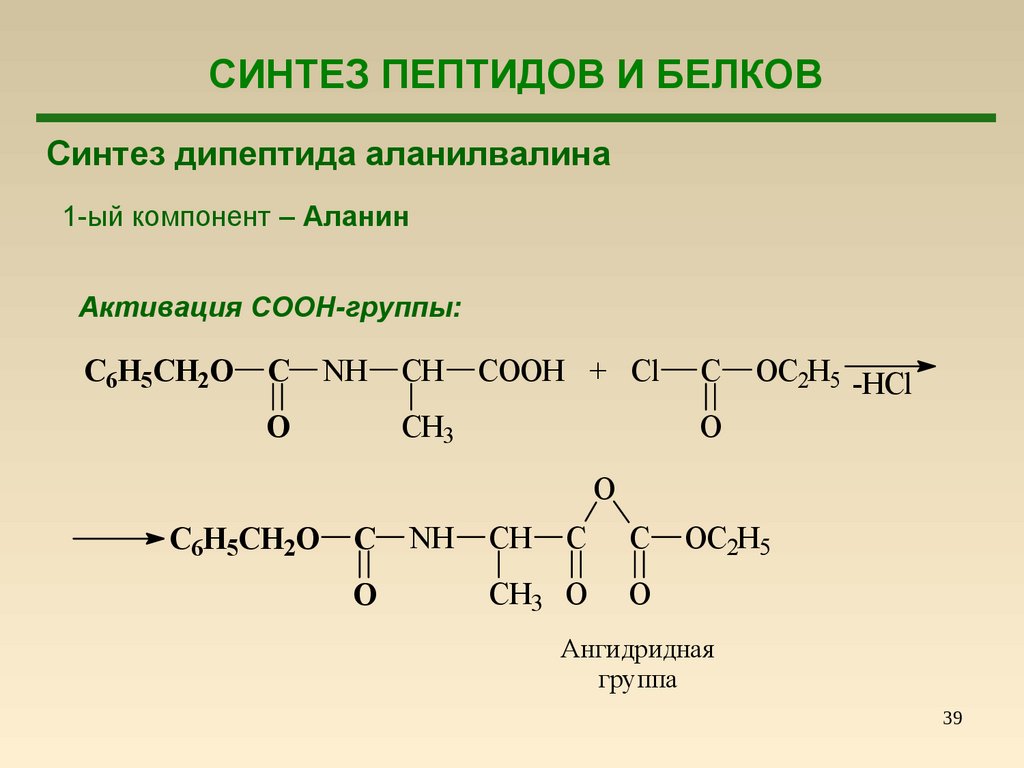
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВСинтез дипептида аланилвалина
1-ый компонент – Аланин
Активация COOH-группы:
C6H5CH2O
C
NH
CH
COOH + Cl
CH3
O
C
OC2H5 -HCl
O
O
C6H5CH2O
C
O
NH
CH
C
C
CH3 O
O
OC2H5
Ангидридная
группа
39
40.
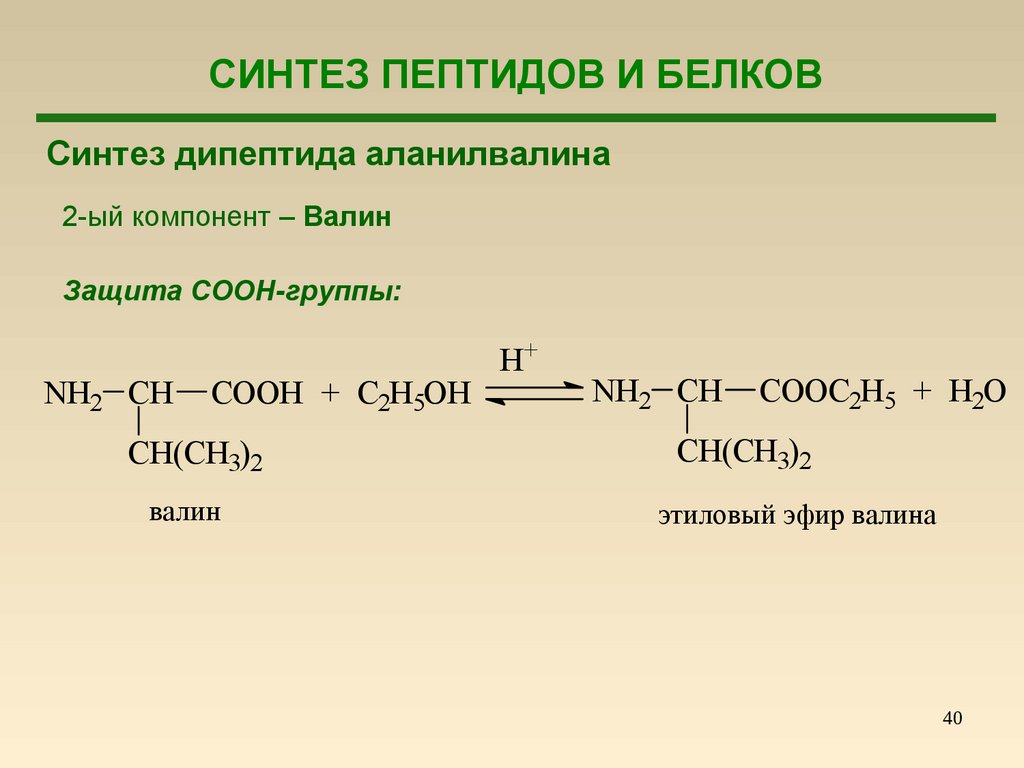
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВСинтез дипептида аланилвалина
2-ый компонент – Валин
Защита COOH-группы:
NH2 CH
COOH + C2H5OH
CH(CH3)2
валин
H+
NH2 CH
COOC2H5 + H2O
CH(CH3)2
этиловый эфир валина
40
41.
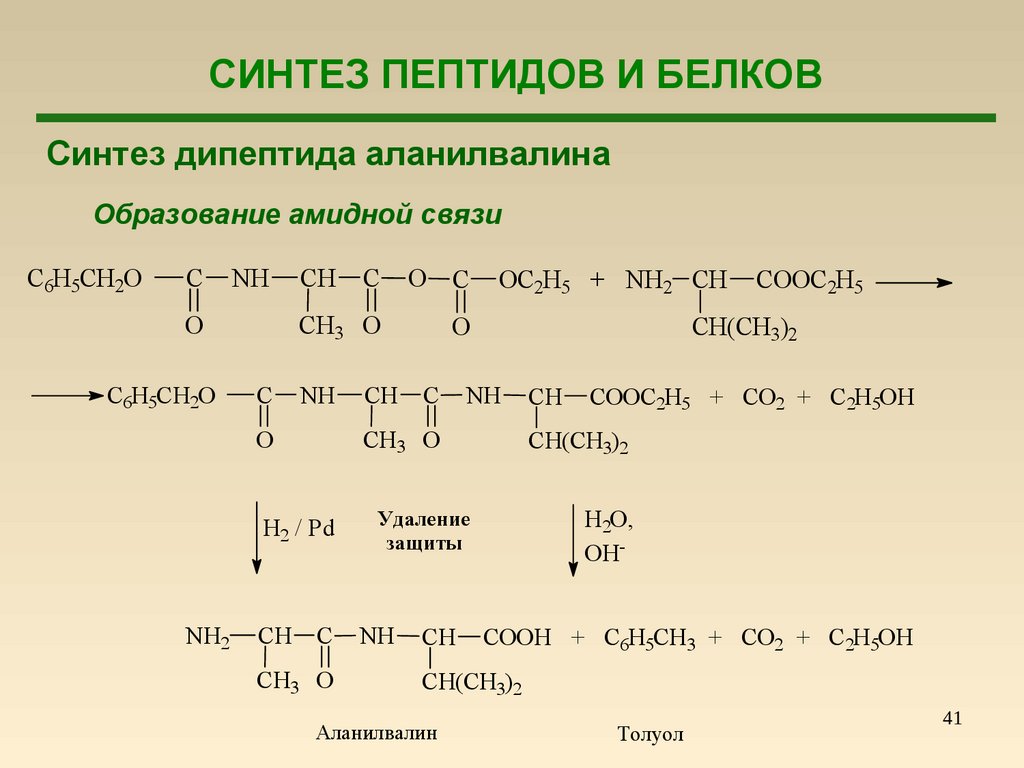
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВСинтез дипептида аланилвалина
Образование амидной связи
C6H5CH2O
C
NH
O
C6H5CH2O
NH2
C
CH
C
O C
CH3 O
O
NH
CH
C
CH3 O
H2 / Pd
Удаление
защиты
C
CH3 O
NH
CH
COOC2H5
CH(CH3)2
NH
O
CH
OC2H5 + NH2 CH
CH
COOC2H5 + CO2 + C2H5OH
CH(CH3)2
H2O,
OHCOOH + C6H5CH3 + CO2 + C2H5OH
CH(CH3)2
Аланилвалин
Толуол
41
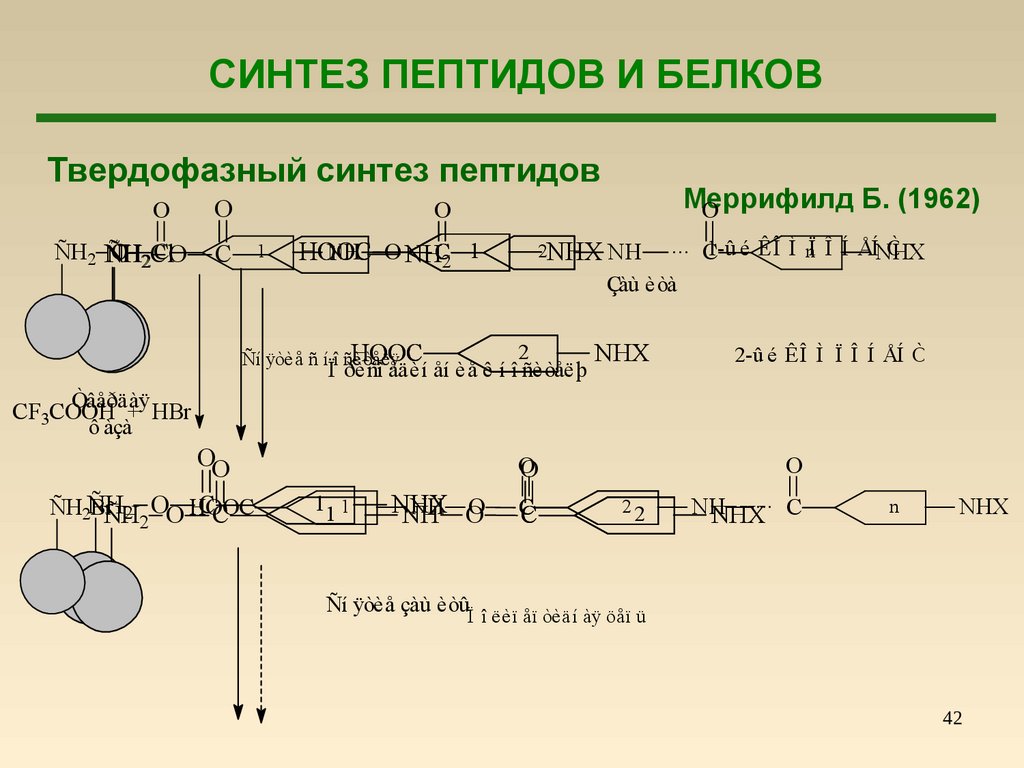
42.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВТвердофазный синтез пептидов
O
ÑH2 ÑH
O 2Cl
CO
O
Меррифилд
Б. (1962)
O
O
C
1
2NHX NH
NH
O NHC2 1
HOOC
1
... C1-û é ÊÎ Ì nÏ Î Í ÅÍNHX
Ò
Çàù èòà
2
NHX
Ï ðèñî åäèí åí èå ê í î ñèòåëþ
HOOC
Ñí ÿòèå ñ í î ñèòåëÿ
2-û é ÊÎ Ì Ï Î Í ÅÍ Ò
Òâåðäàÿ
CF3COOH + HBr
ô àçà
OO
CC
ÑH2ÑH
BrÑH
2 OO HOOC
2
O
O
11 1
NHX
NH O
O
NH
C
C
O
22
...
NH
NHX C
n
NHX
Ñí ÿòèå çàù èòû
Ï î ëèï åï òèäí àÿ öåï ü
42
43.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВТвердофазный синтез пептидов
Меррифилд Б. (1962)
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
43
44.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВТвердофазный синтез пептидов
Меррифилд Б. (1962)
Этим методом были синтезированы цепи А и Б инсулина
(1967), апоферритин (1968), рибонуклеаза А (1969).
В синтезе рибонуклеазы были соединены 124
аминокислотных остатка, что потребовало проведения 369
химических реакций и 1131 автоматических операций
(промывки и т. п.) без промежуточного выделения продуктов.
ЖИДКОФАЗНЫЙ СИНТЕЗ
Акад. М.М. Шемякин
44
45.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВApplied Biosystems model 430A peptide synthesizer
45
46.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВBiosearch Peptide Synthesizer (New Brunswick) model 9600
46
47.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВABI model 431a peptide synthesizer, made by applied Biosystems
47
48.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВApplied Biosystems 433A Peptide Synthesizer
48
49.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВApplied Biosystems 433A Peptide Synthesizer
49
50.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВApplied Biosystems 433A Peptide Synthesizer
50
51.
СИНТЕЗ ПЕПТИДОВ И БЕЛКОВApplied Biosystems 433A Peptide Synthesizer
51
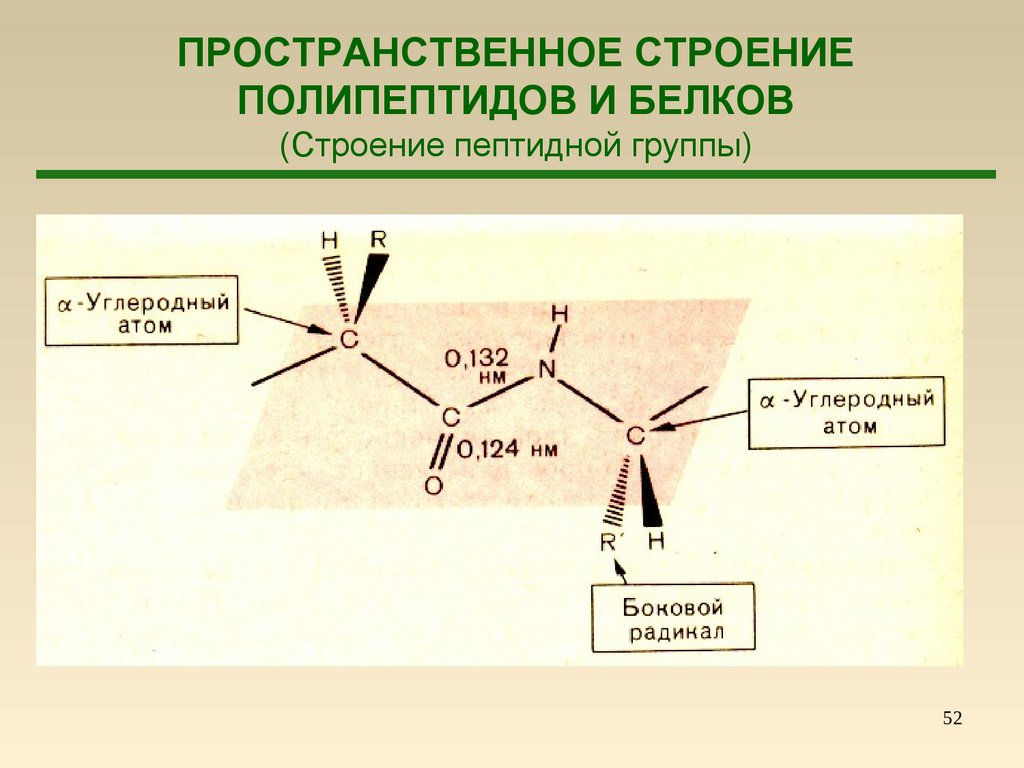
52.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Строение пептидной группы)
52
53.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Строение пептидной группы)
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
53
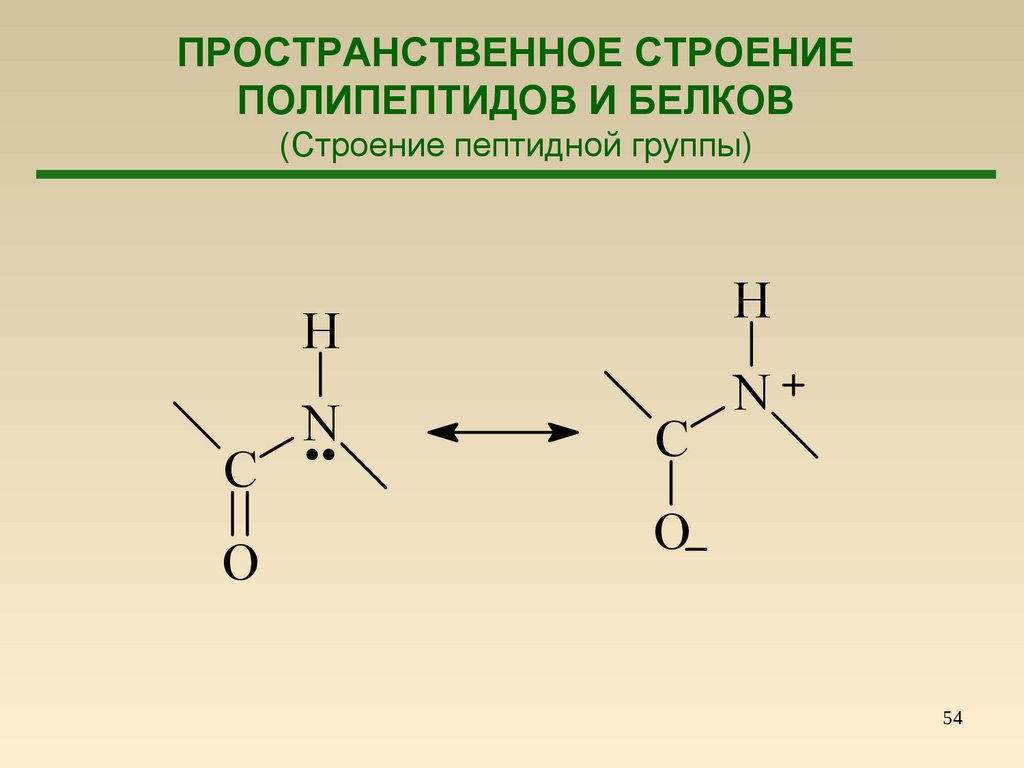
54.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Строение пептидной группы)
H
H
C
O
N
C
N
O
54
55.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Строение пептидной группы)
Garrett R.H., Grisham C.M. Biochemistry. 2ed., 1999. 851 s.
55
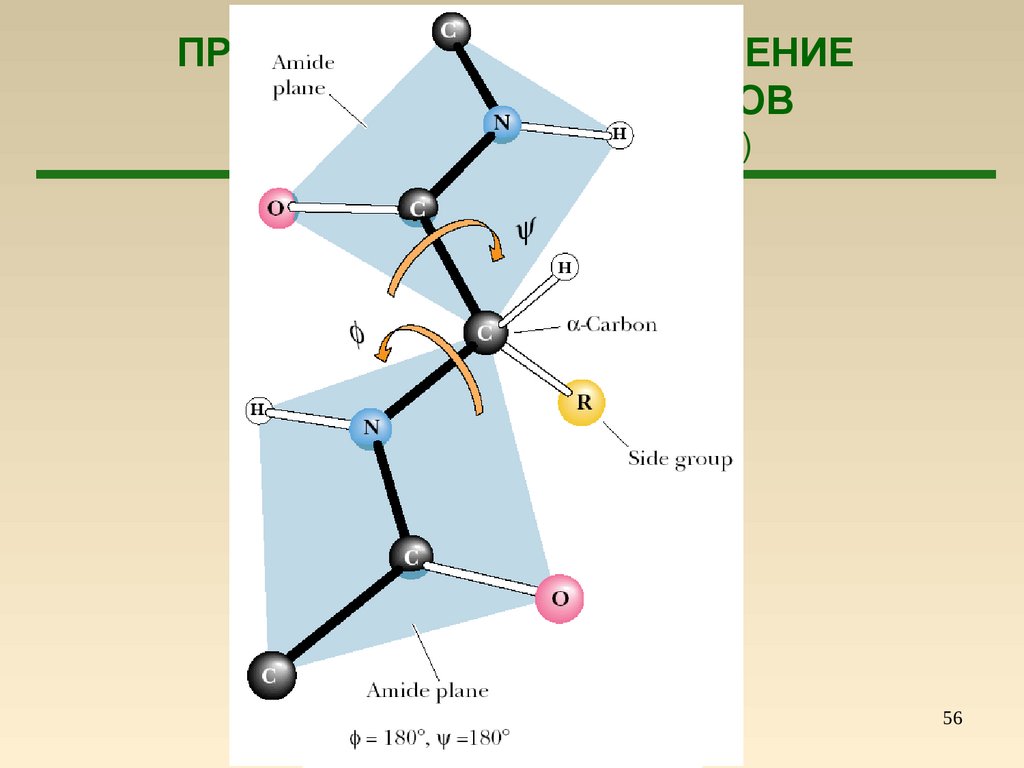
56.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Строение пептидной группы)
56
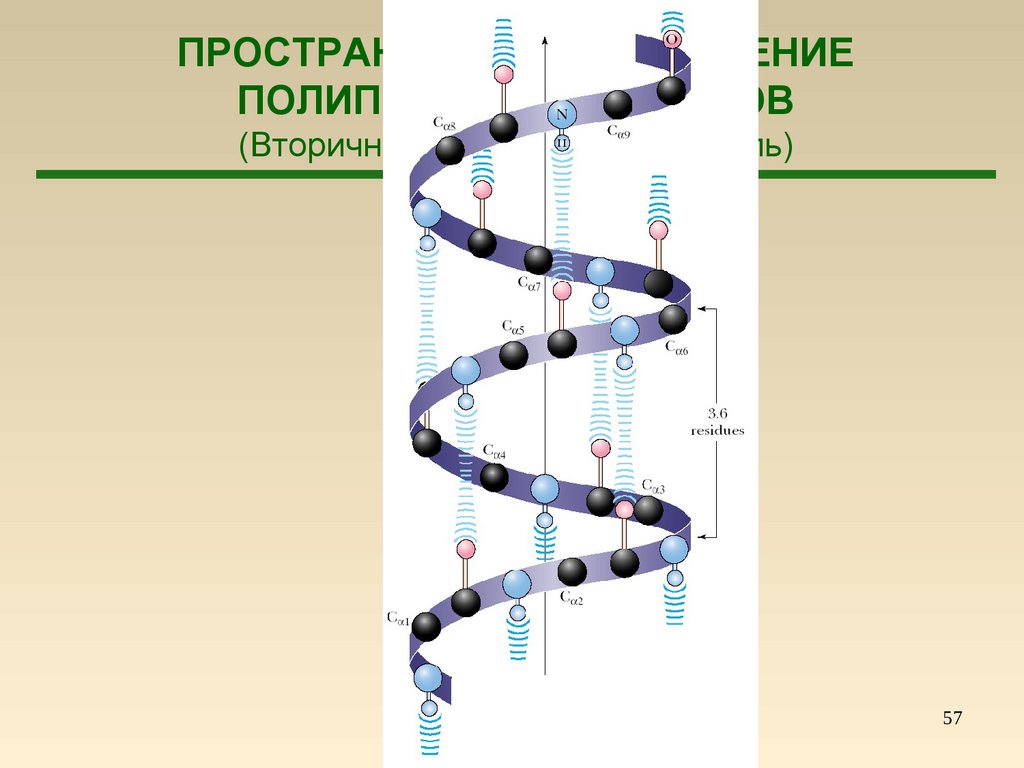
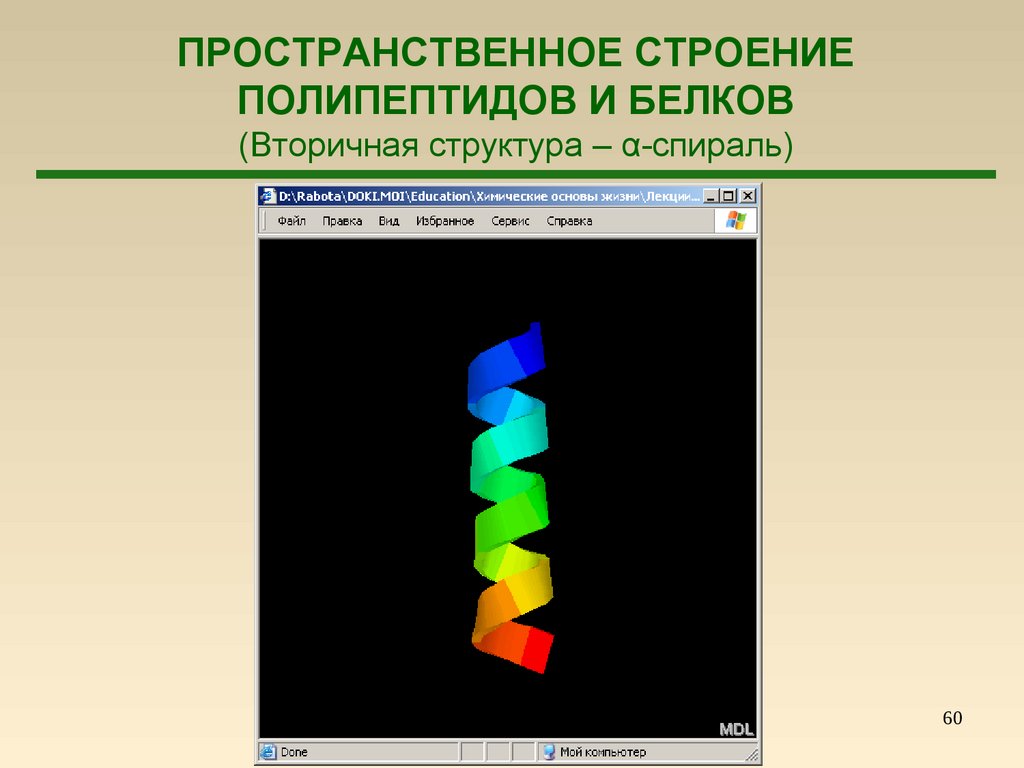
57.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – α-спираль)
57
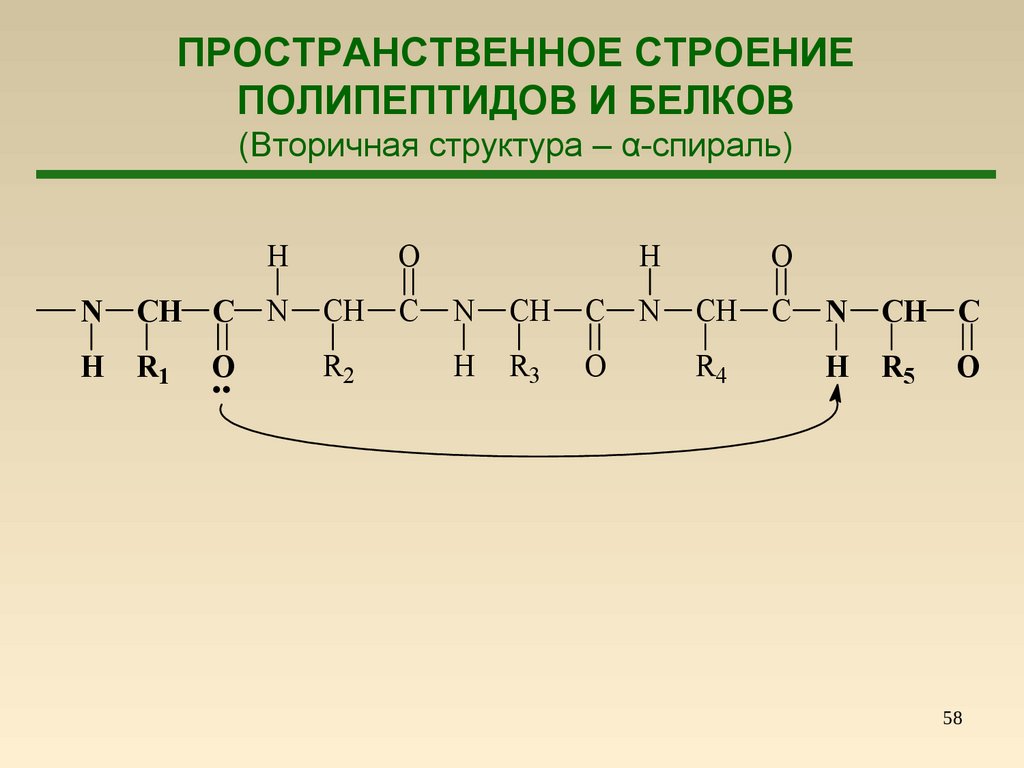
58.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – α-спираль)
H
N
CH C
H
R1
O
N
O
CH
R2
C
H
N
CH
C
H
R3
O
N
O
CH
R4
C
N
CH C
H
R5
O
58
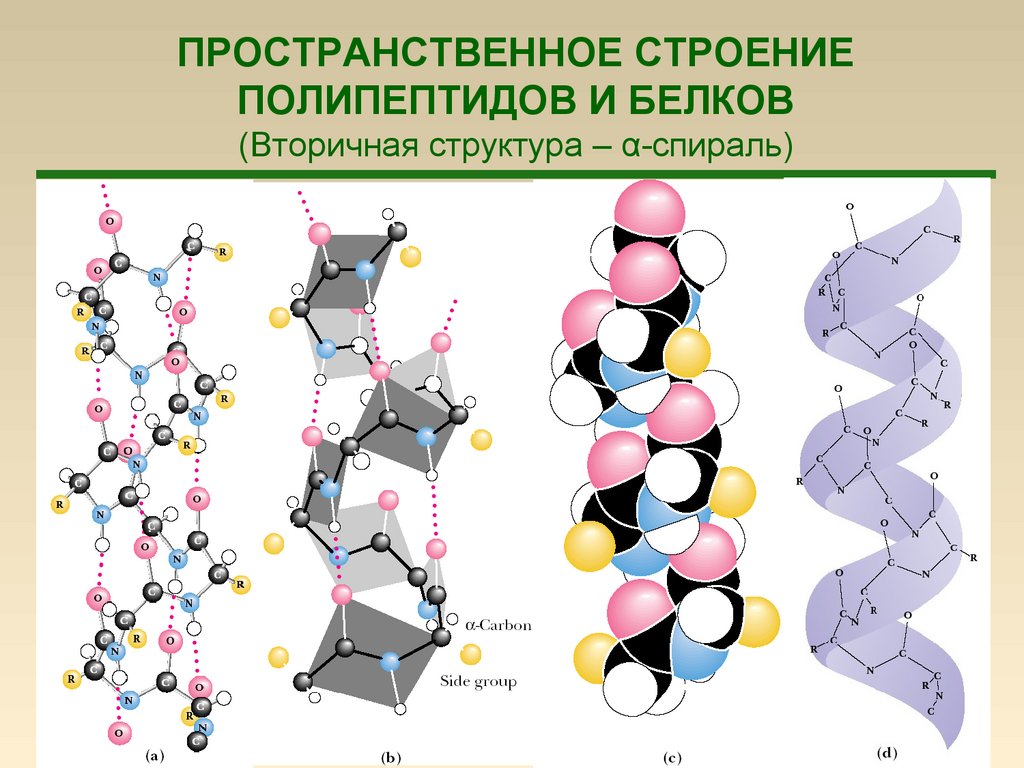
59.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – α-спираль)
59
60.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – α-спираль)
60
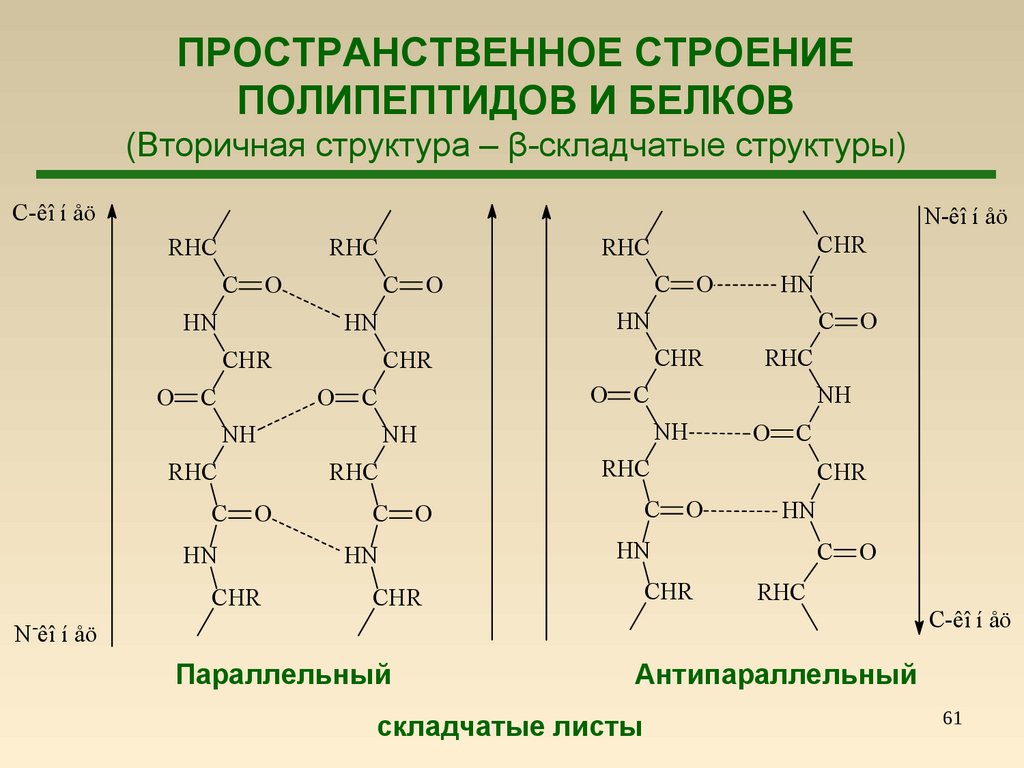
61.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – β-складчатые структуры)
C-êî í åö
N-êî í åö
RHC
RHC
C
O
C
HN
O
C
O
C
RHC
C
O
C
NH
HN
CHR
C
NH
NH
O
C
RHC
C
O
HN
CHR
O
HN
HN
CHR
CHR
O
RHC
C
NH
RHC
O
C
CHR
CHR
O
HN
O
HN
HN
CHR
CHR
RHC
C
O
RHC
C-êî í åö
N-êî í åö
Параллельный
Антипараллельный
складчатые листы
61
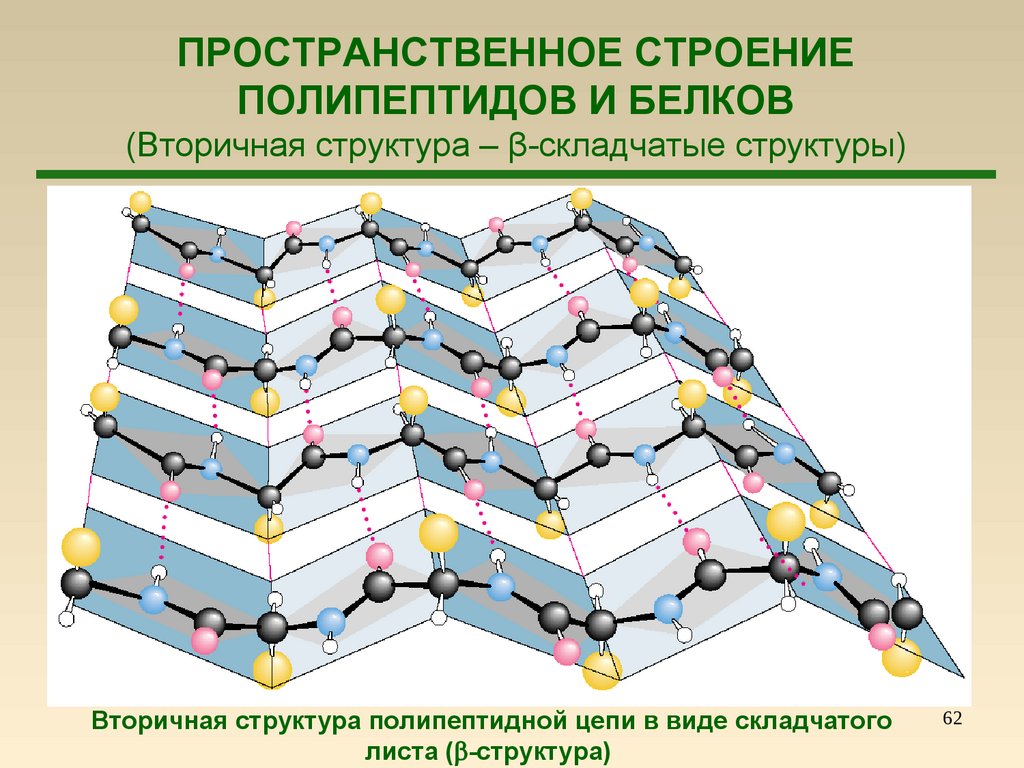
62.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – β-складчатые структуры)
Вторичная структура полипептидной цепи в виде складчатого
листа ( -структура)
62
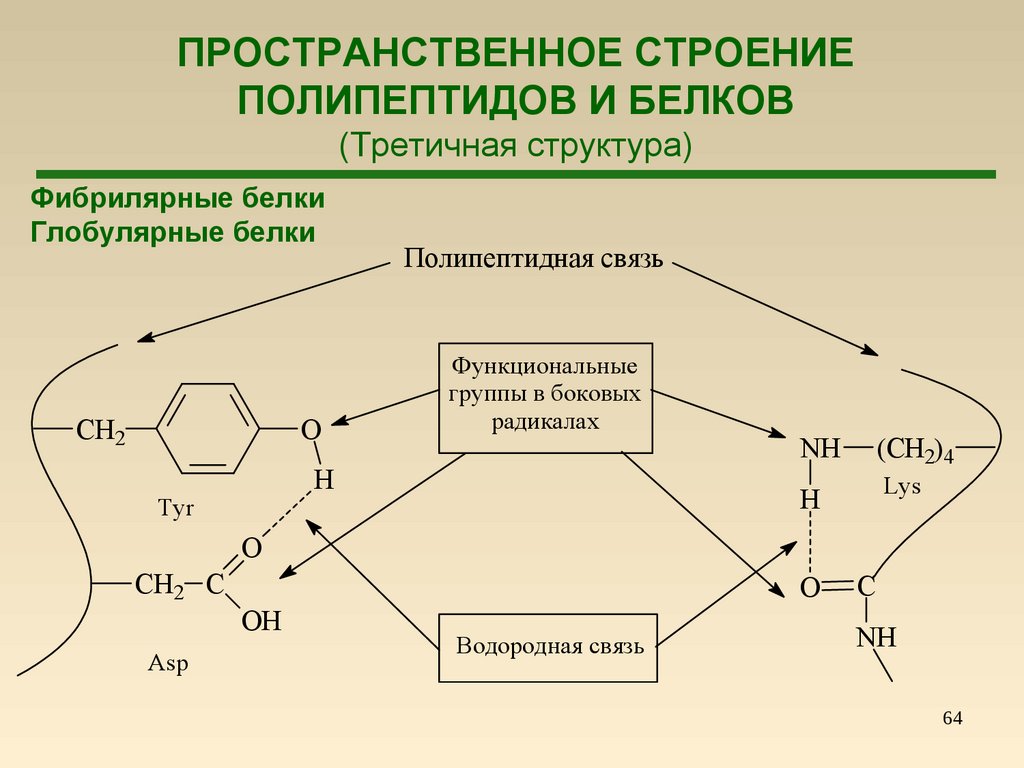
63.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Вторичная структура – β-складчатые структуры)
63
64.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
Фибрилярные белки
Глобулярные белки
CH2
O
Полипептидная связь
Функциональные
группы в боковых
радикалах
H
Tyr
NH
(CH2)4
H
Lys
O
CH2 C
O
OH
Asp
Водородная связь
C
NH
64
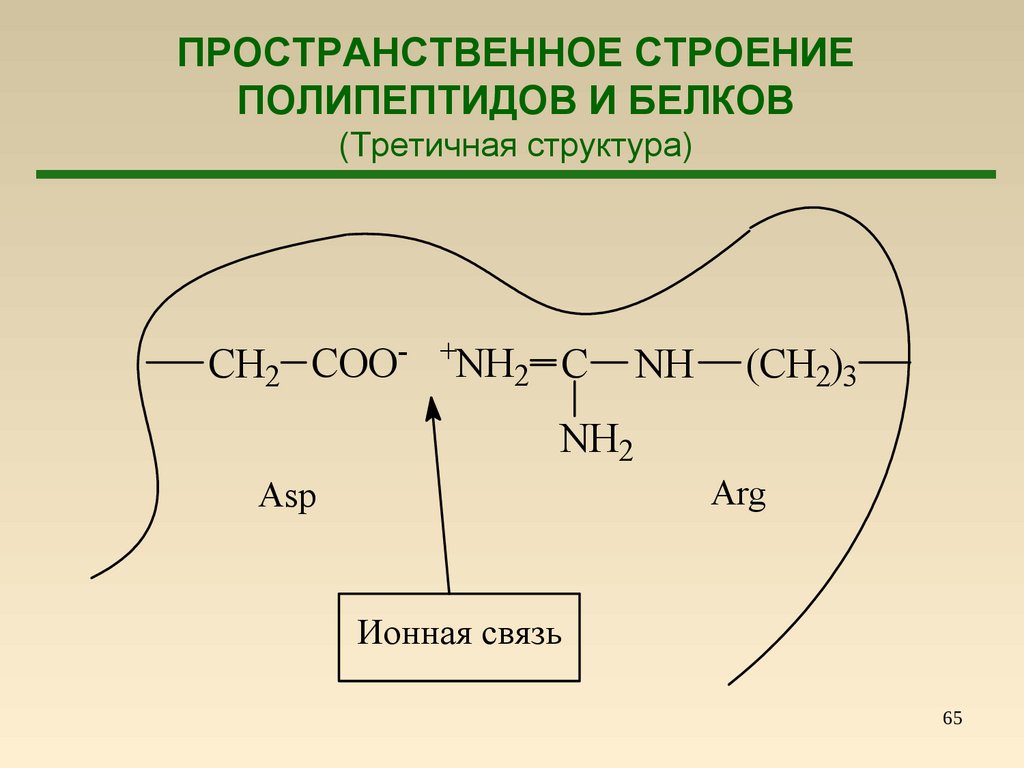
65.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
CH2 COO-
+NH
2
C
NH
(CH2)3
NH2
Arg
Asp
Ионная связь
65
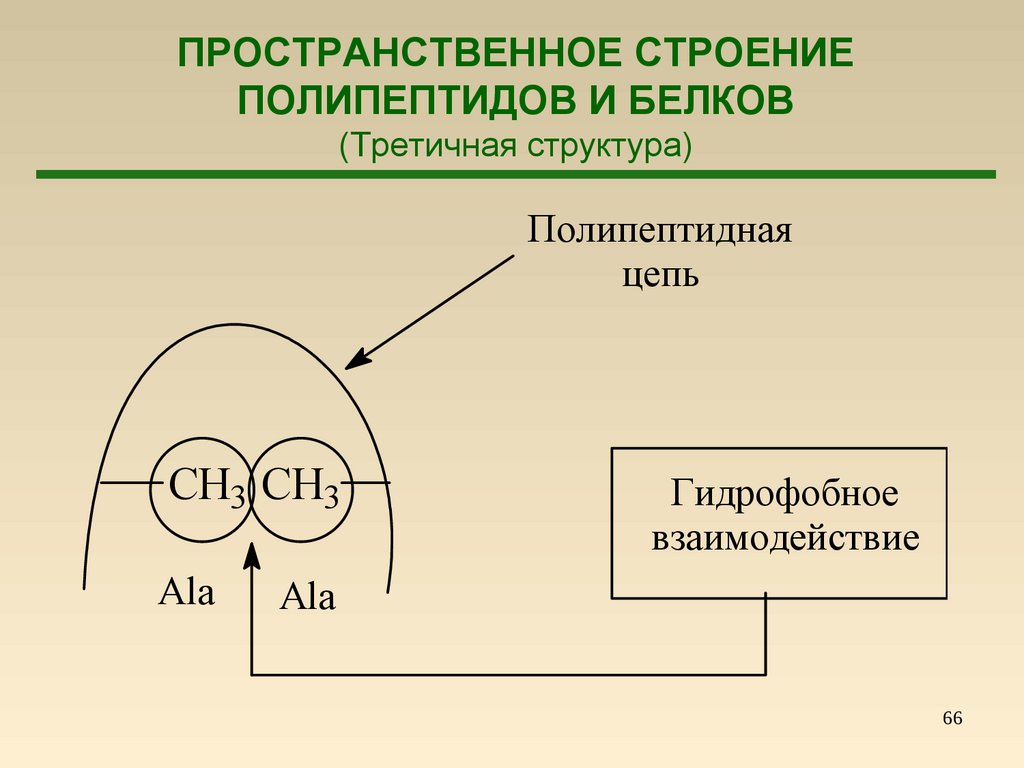
66.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
Полипептидная
цепь
CH3 CH3
Ala
Гидрофобное
взаимодействие
Ala
66
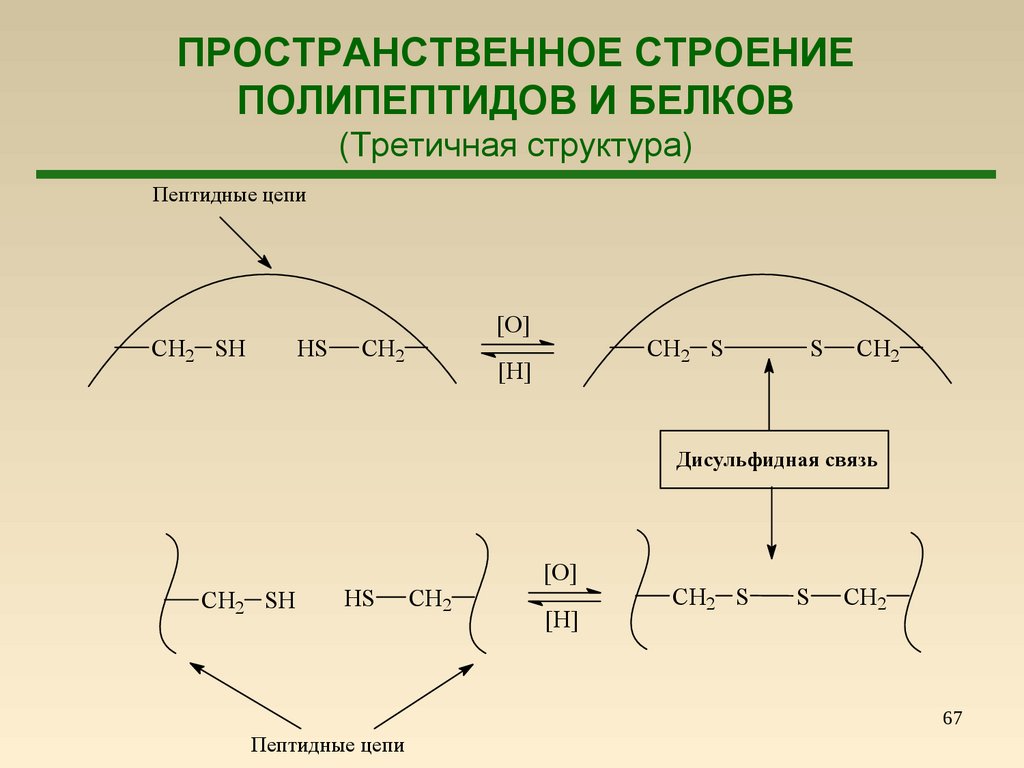
67.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Третичная структура)
Пептидные цепи
CH2 SH
HS
[O]
CH2
CH2 S
[H]
S
CH2
Дисульфидная связь
CH2 SH
HS
CH2
[O]
[H]
CH2 S
S
CH2
67
Пептидные цепи
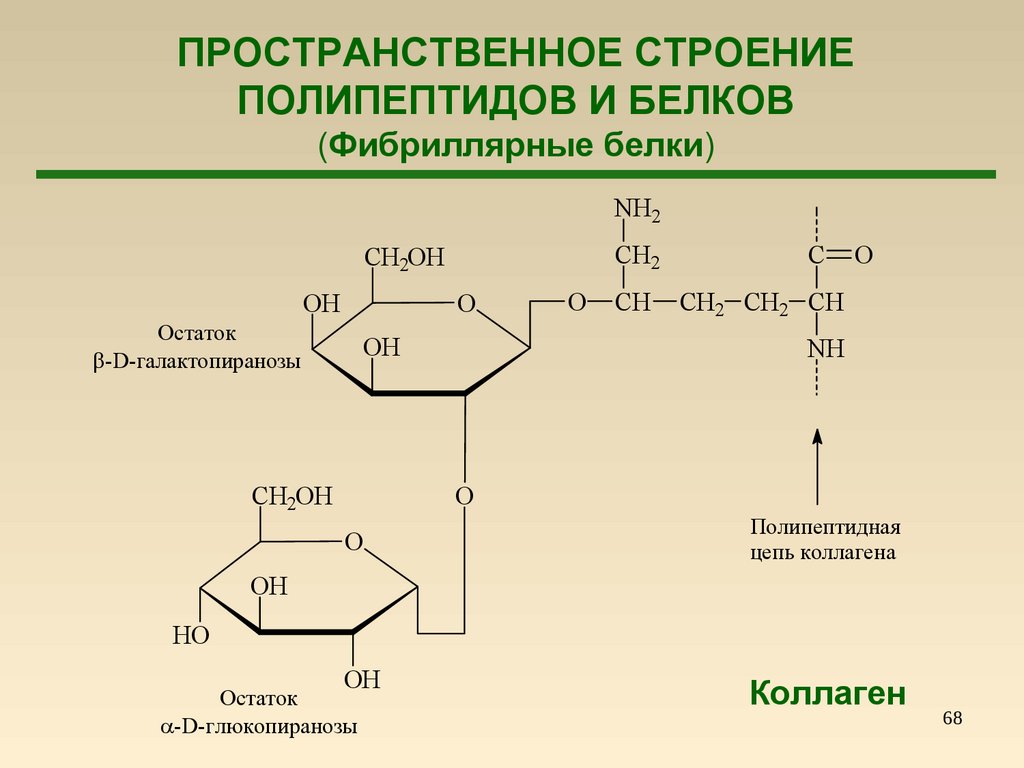
68.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
NH2
CH2
CH2OH
O
OH
Остаток
-D-галактопиранозы
OH
CH2OH
O
CH
C
O
CH2 CH2 CH
NH
O
O
Полипептидная
цепь коллагена
OH
HO
OH
Остаток
-D-глюкопиранозы
Коллаген
68
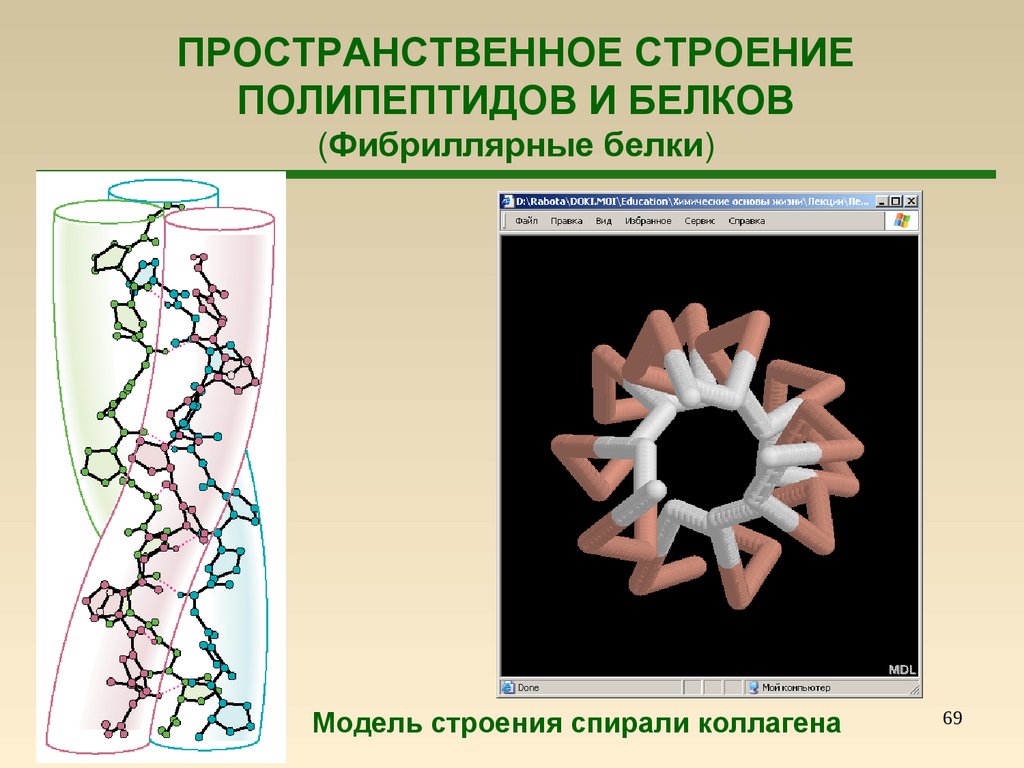
69.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
Модель строения спирали коллагена
69
70.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
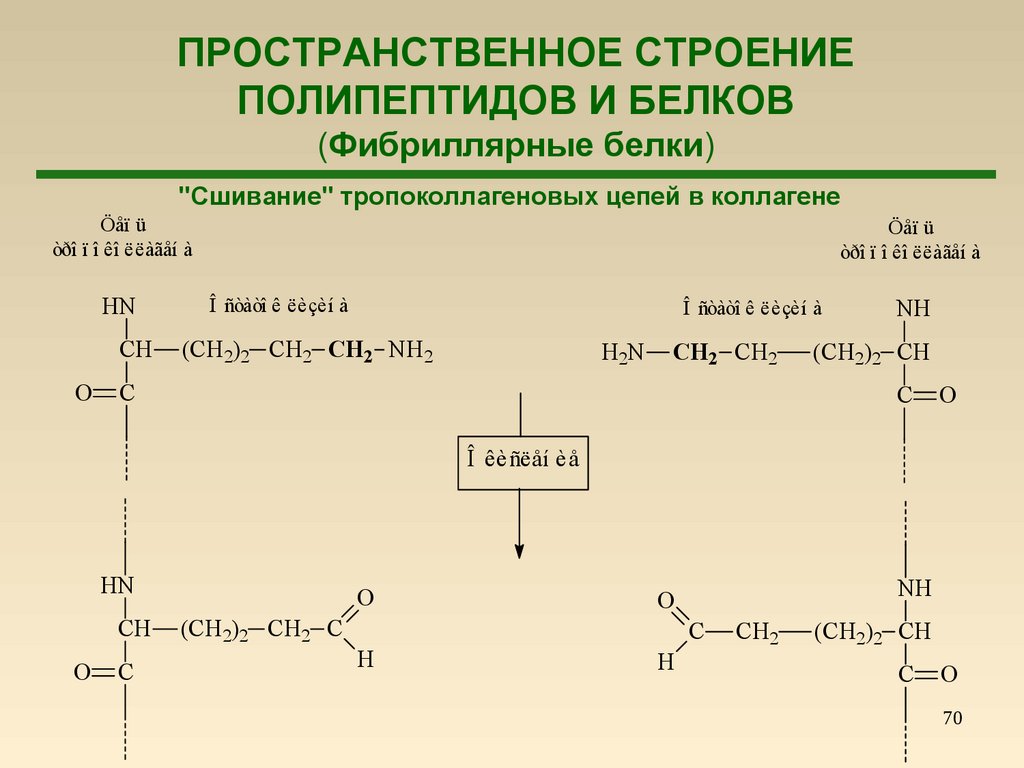
"Сшивание" тропоколлагеновых цепей в коллагене
Öåï ü
òðî ï î êî ëëàãåí à
HN
CH
O
Öåï ü
òðî ï î êî ëëàãåí à
Î ñòàòî ê ëèçèí à
Î ñòàòî ê ëèçèí à
(CH2)2 CH2 CH2 NH2
H2N
CH2 CH2
C
NH
(CH2)2 CH
C
O
Î êèñëåí èå
HN
CH
O
C
O
NH
O
(CH2)2 CH2 C
C
H
H
CH2
(CH2)2 CH
C
O
70
71.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
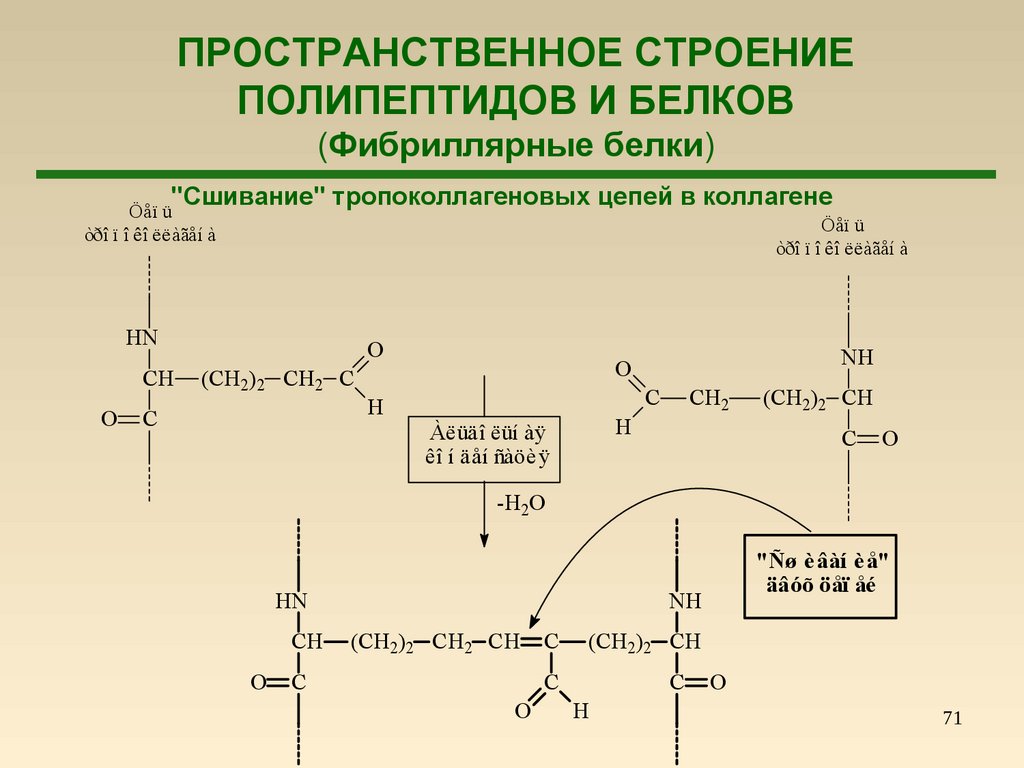
"Сшивание" тропоколлагеновых цепей в коллагене
Öåï ü
òðî ï î êî ëëàãåí à
Öåï ü
òðî ï î êî ëëàãåí à
HN
CH
O
O
(CH2)2 CH2 C
C
H
NH
O
C
CH2
H
Àëüäî ëüí àÿ
êî í äåí ñàöèÿ
(CH2)2 CH
C
O
-H2O
HN
CH
O
"Ñø è âàí è å"
äâóõ öåï åé
NH
(CH2)2 CH2 CH
C
C
(CH2)2 CH
C
O
C
H
O
71
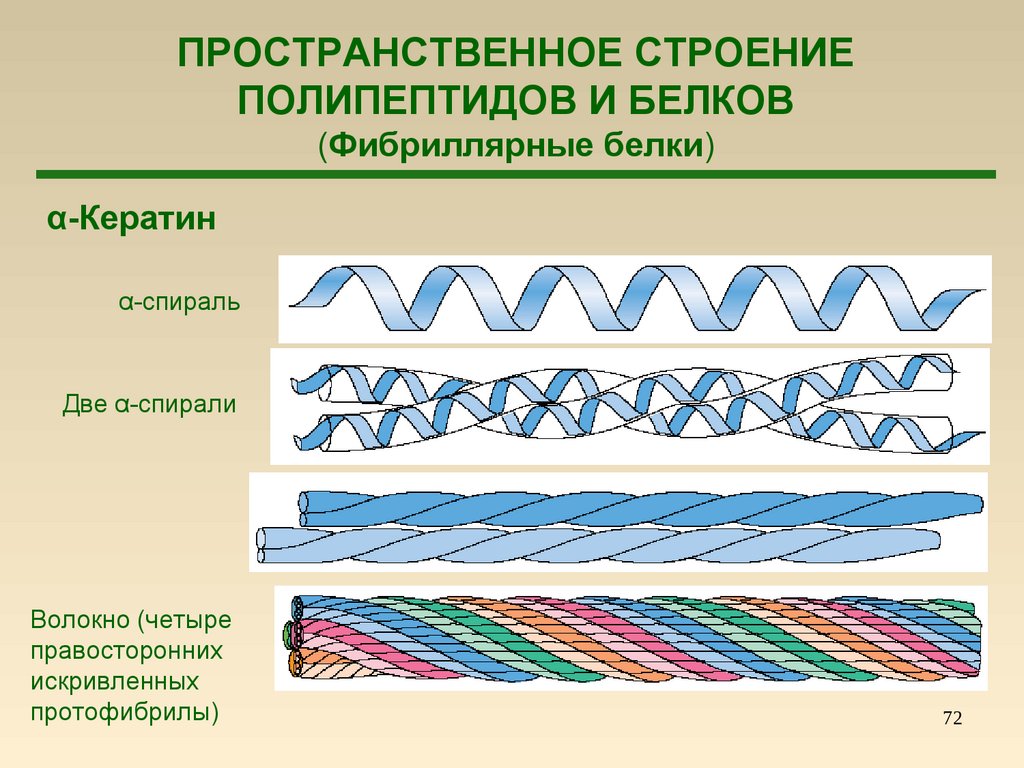
72.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
α-Кератин
α-спираль
Две α-спирали
Волокно (четыре
правосторонних
искривленных
протофибрилы)
72
73.
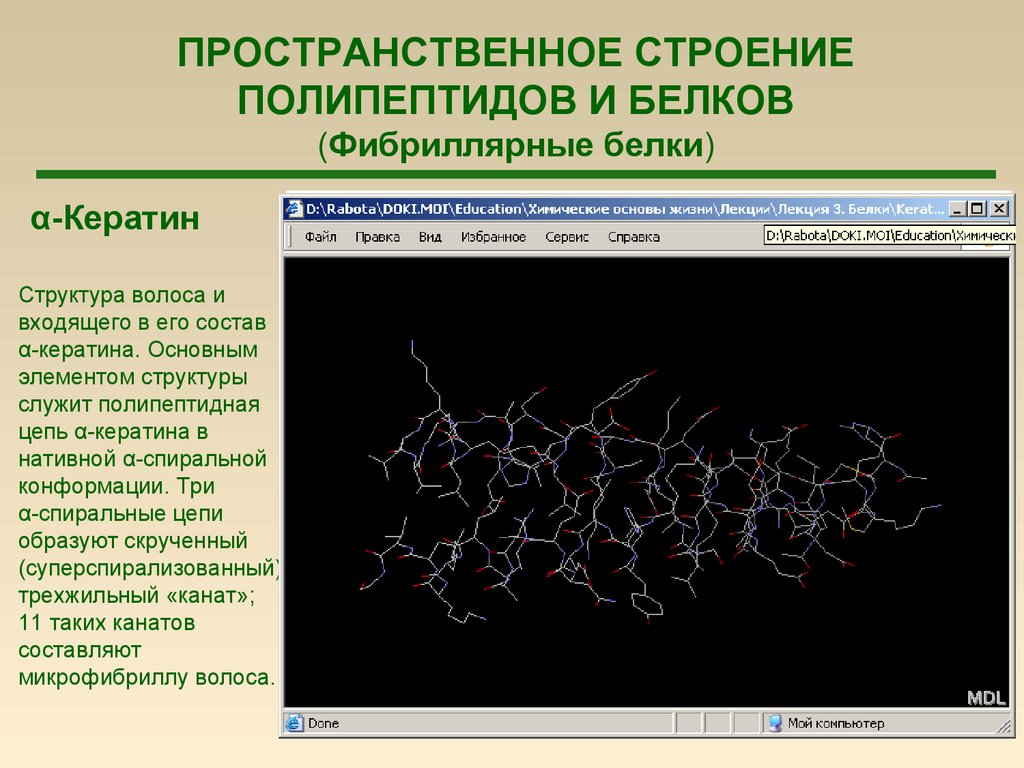
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
α-Кератин
Структура волоса и
входящего в его состав
α-кератина. Основным
элементом структуры
служит полипептидная
цепь α-кератина в
нативной α-спиральной
конформации. Три
α-спиральные цепи
образуют скрученный
(суперспирализованный)
трехжильный «канат»;
11 таких канатов
составляют
микрофибриллу волоса.
73
74.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
β-Кератин
фиброин
β-Конформация
полипептидных цепей в βкератинах.
А. Три цепи, образующие
складчатый слой (вид сверху);
показано расположение
поперечных водородных
связей между соседними
цепями. R-группы выделены
красным цветом.
Б. Та же структура (вид
сбоку): показано
расположение R-групп,
выступающих по обе стороны
складчатого слоя.
74
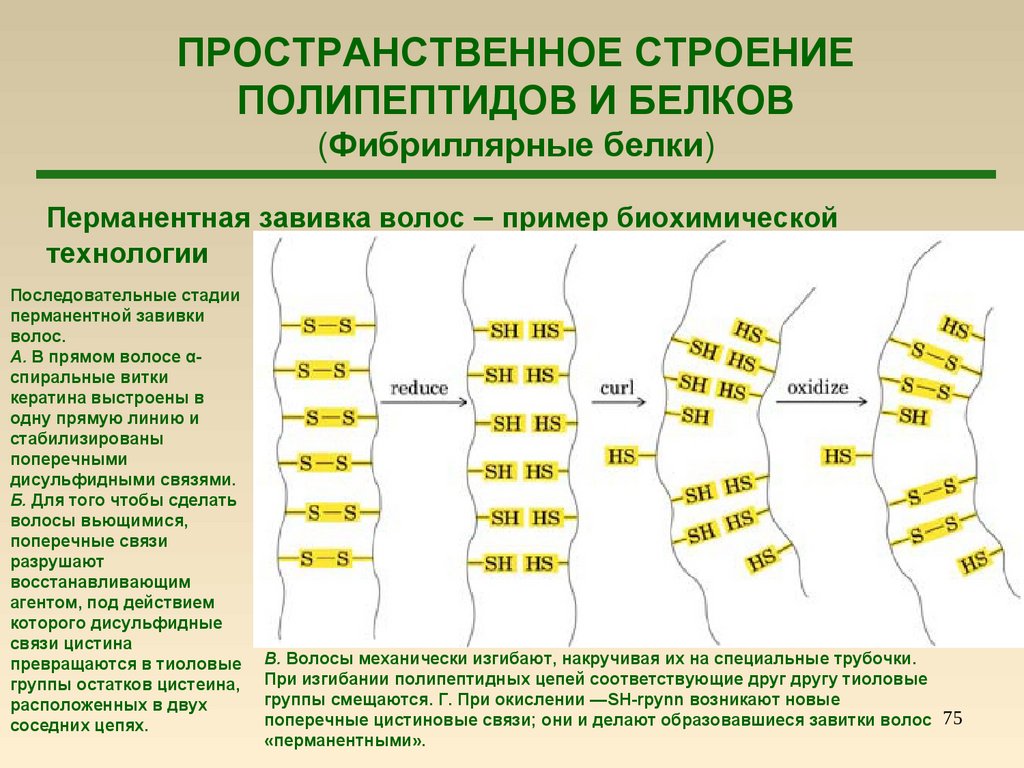
75.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Фибриллярные белки)
Перманентная завивка волос – пример биохимической
технологии
Последовательные стадии
перманентной завивки
волос.
А. В прямом волосе αспиральные витки
кератина выстроены в
одну прямую линию и
стабилизированы
поперечными
дисульфидными связями.
Б. Для того чтобы сделать
волосы вьющимися,
поперечные связи
разрушают
восстанавливающим
агентом, под действием
которого дисульфидные
связи цистина
превращаются в тиоловые
группы остатков цистеина,
расположенных в двух
соседних цепях.
В. Волосы механически изгибают, накручивая их на специальные трубочки.
При изгибании полипептидных цепей соответствующие друг другу тиоловые
группы смещаются. Г. При окислении —SH-rpynn возникают новые
поперечные цистиновые связи; они и делают образовавшиеся завитки волос 75
«перманентными».
76.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Глобулярные белки)
76
77.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Глобулярные белки)
Лизоцим
1965 г.
129 аминокислотных
остатков
Mr = 14 600
77
78.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Денатурация и ренатурация)
78
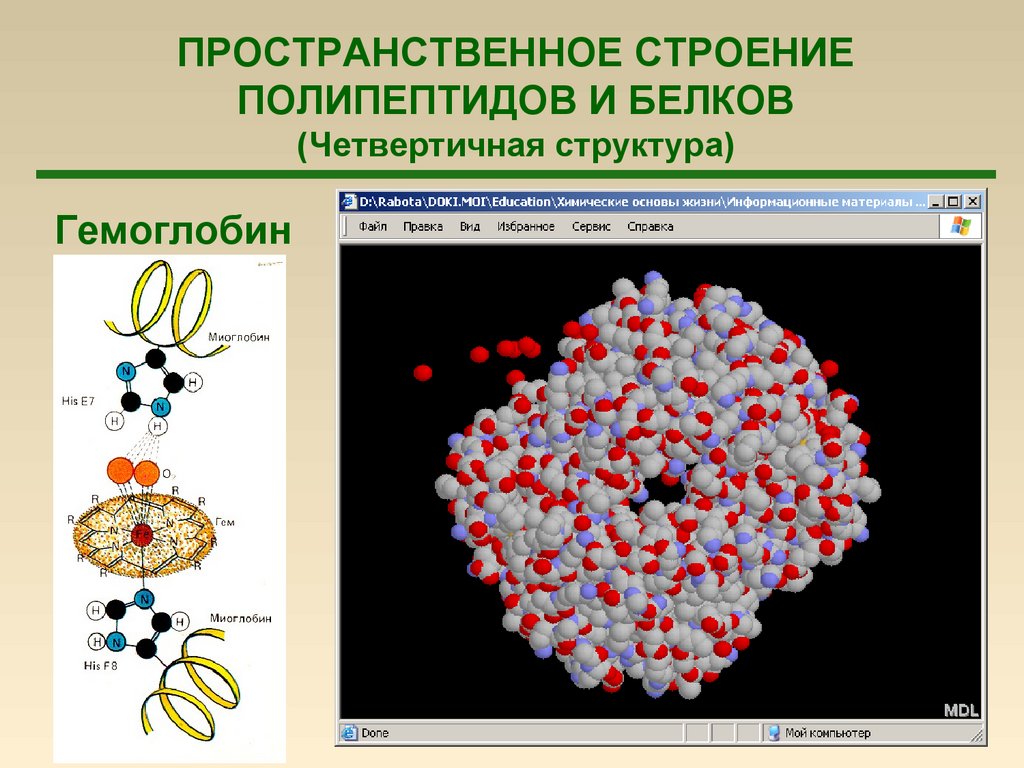
79.
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕПОЛИПЕПТИДОВ И БЕЛКОВ
(Четвертичная структура)
Гемоглобин
79




































 chemistry
chemistry








