Similar presentations:
Первичная структура белков и пептидов
1. Первичная структура белков и пептидов
ПЕРВИЧНАЯ СТРУКТУРАБЕЛКОВ И ПЕПТИДОВ
Структурная организация белков и пептидов. N- и
С- концевой анализ. Первичная структура белков и
пептидов. Методы установления первичной
структуры пептидов и белков.
Белки. Классификация и свойства белков.
2. Аминокислотный состав и аминокислотная последовательность
АМИНОКИСЛОТНЫЙ СОСТАВ ИАМИНОКИСЛОТНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
Первичная структура белков и
пептидов. Лекция
Понятие о различных уровнях структурной организации
пептидов и белков ввел Кай Линдстрем-Ланг, датский
химик. Он предложил описывать строение пептидов и
белков, пользуясь понятиями первичной, вторичной и
третичной структуры.
При единообразно построенной полиамидной цепи
специфичность пептидов и белков определяется двумя
важнейшими характеристиками: аминокислотным
составом и аминокислотной последовательностью.
Аминокислотный состав пептидов и белков - это
природа и количественное соотношение входящих в них
аминокислот
28.11.2018
2
3. Определение аминокислотного состава
28.11.2018АМИНОКИСЛОТНОГО СОСТАВА
3
Первичная структура белков и пептидов.
Лекция
ОПРЕДЕЛЕНИЕ
4.
Rn H2O
n
HCl
n NH2 CH COOH
R
Полностью разрушается Trp и частично Ser, Thr, Cys, а Gln и Asn
превращаются в Glu и Asp соответственно.
Пептидные связи, образованные аминокислотными остатками с
разветвленной боковой цепью (Val, Ile, Leu), из-за стерических
препятствий гидролизуются частично. Особенно стабильны связи
Val-Val, Ile-Ile, Val-Ile, Ile-Val и т.п.
Asn и Asp определяют как Asn + Asp
Gln и Glu определяют как Gln + Glu
Trp - разрушается /гидролиз 4 N СН3-SО3Н/
Cys = ½ Cystin или CM-Cys
Первичная структура белков и
пептидов. Лекция
NH CH CO
28.11.2018
Анализ аминокислотного состава включает полный кислотный
гидролиз исследуемого белка или пептида с помощью 5,7н HCl и
количественное определение всех аминокислот в гидролизате.
Гидролиз образца проводится в запаянных ампулах в вакууме при
110 0С в течение 24 часов.
4
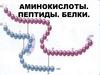
5. Определение АК состава
ОПРЕДЕЛЕНИЕ АК СОСТАВА28.11.2018
Первичная структура белков и
пептидов. Лекция
Для определения аминокислотного состава белка проводится
параллельный гидролиз в течение 24, 48, 72 и 96 часов, и все
пробы далее количественно анализируются. Для Val, Leu и Ile
берутся максимальные значения, а для Ser и Thr полученные
значения экстраполируются к нулевому времени.
5
6.
Количественное определение аминокислот вгидролизате белка или пептида проводится с помощью
аминокислотного анализатора - прибора,
разработанного в 1958 году С.Муром и У.Стенном.
Смесь аминокислот разделяется методом жидкостной
хроматографии на колонке, заполненной твердым
носителем. Колонка промывается буферными
растворами с последовательным повышением их рН и
молярности. Время удерживания каждой аминокислоты
строго определенно и зависит от степени ее ионизации.
Постколоночная модификация:
- нингидрин (570 нм, 440 нм для пролина и оксипролина)
- флуорескамин
- о-фталевый альдегид (ОФА), кроме пролина и вторичных
аминов
Идентификация – ионообменная ВЭЖХ
Предколоночная модификация:
- образование фенилтиокарбамильных (ФТК) производных
используется для количественного определения
аминокислот в гидролизате белка в PICO-TAGанализаторе (Waters).
Идентификация - ВЭЖХ на обращенной фазе
28.11.2018
Первичная структура белков и
пептидов. Лекция
6
7.
NH2 CH CO NHCH2
CH3
CO NH
CH
CH2
CO NH
CH
COOH
CH2
OH
Методы определения первичной структуры:
Метод Эдмана (Эдмана-Грэя)/секвенаторы
при помощи пептидаз
а) с N-концевых остатков при помощи аминопептидаз
(хроматографическая идентификация и кинетика накопления
соответствующих АК)
б) с С-концов при помощи карбоксипептидаз .
метод «перекрывающихся блоков»
масс-спектрометрический метод
вывод АК последовательности белка на основе нуклеотидной
последовательности кодирующего его гена.
Первичная структура белков и
пептидов. Лекция
COOH
CH
28.11.2018
Аминокислотная последовательность - это порядок чередования
аминокислотных остатков в молекуле пептида или белка.
Аминокислотная последовательность составляет первичную
структуру пептида или белка.
7
8. Критерии чистоты белковых препаратов
КРИТЕРИИ ЧИСТОТЫ БЕЛКОВЫХ ПРЕПАРАТОВОпределение первичной структуры белка требует
предварительного проведения ряда операций. Белок должен быть
тщательно очищен, чистота материала должна быть подтверждена как
минимум двумя независимыми методами.
Первичная структура белков и
пептидов. Лекция
аналитическое ультрацентрифугирование;
электрофорез в нативных или денатурирующих
условиях;
иммунохимические методы;
определение N- и С- концевых аминокислотных
остатков
28.11.2018
8
9. Определение N- и С- концевого аминокислотного остатка
28.11.2018КОНЦЕВОГО
АМИНОКИСЛОТНОГО ОСТАТКА
9
Первичная структура белков и пептидов.
Лекция
ОПРЕДЕЛЕНИЕ N- И С-
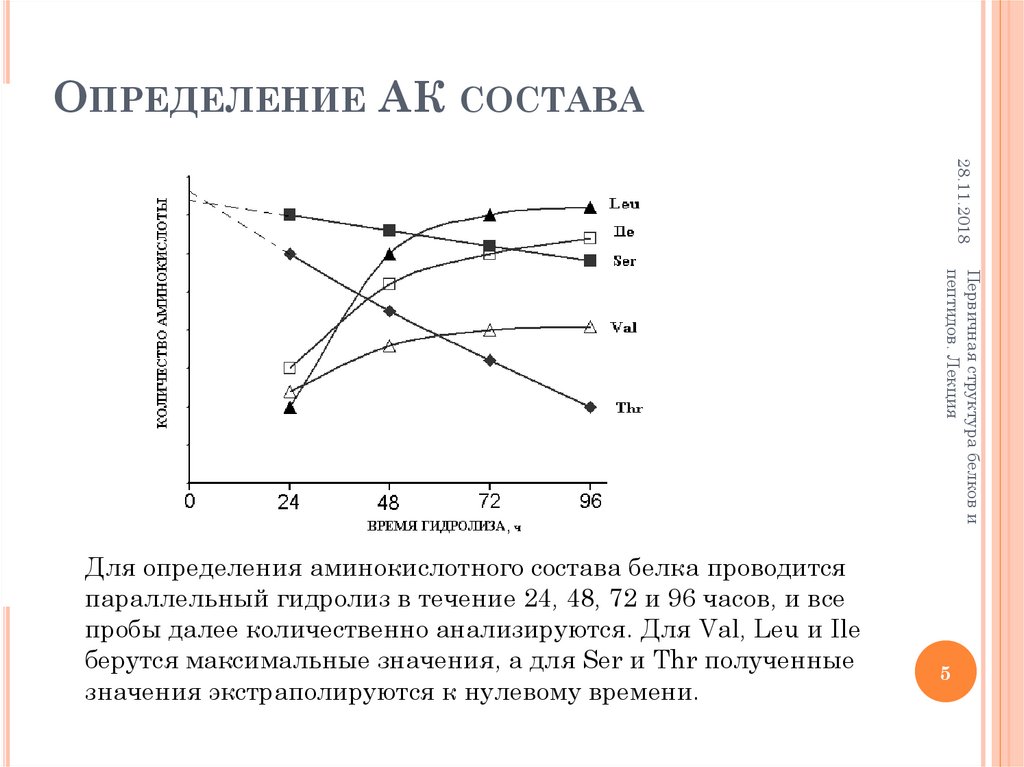
10. Определение N-концевой аминокислоты. Метод Сэнгера
ОПРЕДЕЛЕНИЕ N-КОНЦЕВОЙ АМИНОКИСЛОТЫ.МЕТОД СЭНГЕРА
R1
O2N
R2
R3
- HF
HCl
NH CH CO NH CH CO NH CH CO
NO2
O2N
NO2
R1
NH CH COOH
NO2
R1
R2
H2O
R3
NH2 CH COOH
R2
NH2 CH COOH
R3
Первичная структура белков и
пептидов. Лекция
NH2 CH CO NH CH CO NH CH CO
NO2
28.11.2018
F
10
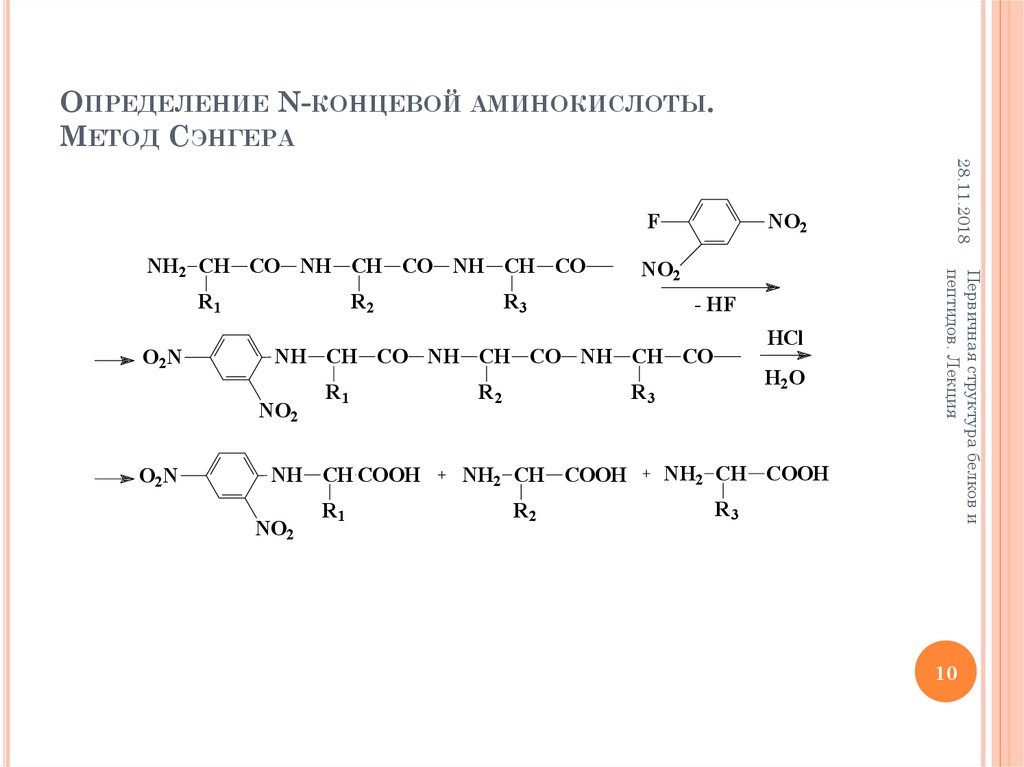
11. Определение N-концевой аминокислоты. Метод Грэя-Хартли
ОПРЕДЕЛЕНИЕ N-КОНЦЕВОЙ АМИНОКИСЛОТЫ.МЕТОД ГРЭЯ-ХАРТЛИ
N CH3
CH3
R2
SO2Cl
R3
- HCl
N CH3
HCl
SO2 NH CH CO NH CH CO NH CH CO
R1
CH3
R2
H2O
R3
N CH3
SO2NH CH COOH
R1
NH2 CH COOH
R2
Первичная структура белков и
пептидов. Лекция
NH2 CH CO NH CH CO NH CH CO
R1
28.11.2018
CH3
NH2 CH COOH
R3
11
12. Высокоэффективная двумерная тонкослойная хроматография
ВЫСОКОЭФФЕКТИВНАЯДВУМЕРНАЯ ТОНКОСЛОЙНАЯ
ХРОМАТОГРАФИЯ
28.11.2018
Первичная структура белков и
пептидов. Лекция
В условиях жесткого кислотного гидролиза полностью
разрушаются ДНС-триптофан и происходит дезаминирование
остатков дикарбоновых кислот, которые превращаются соответственно
в ДНС-апарагиновую и ДНС-глутаминовую аминокислоту. Степень 12
разрушения ДНС-пролина, ДНС-серина и ДНС-треонина возрастает
по мере увеличения времени гидролиза.
13. Определение С-концевой аминокислоты
ОПРЕДЕЛЕНИЕ С-КОНЦЕВОЙ АМИНОКИСЛОТЫ28.11.2018
Гидразинолиз
Rn-2
.....
Rn-1
NH2 CH CO NHNH2
Rn-2
Rn
NH2 CH CO NHNH2
Rn-1
0
100 C
NH2 CH COOH
Rn
Первичная структура белков и
пептидов. Лекция
. . . . .NH CH CO NH CH CO NH CH COOH (n-1) NH2NH2
Метод предложен Акабори в 1952 г. Белок нагревают с
гидразином (безводным) в запаянной ампуле при 100 - 120 0С в
течение 8 - 10 часов. При этом происходит расщепление белка гидразинолиз, в результате чего все аминокислоты, кроме С-концевой,
образуют гидразиды. Обработкой бензальдегидом гидразиды
аминокислот переводят в нерастворимые производные, которые
удаляют фильтрованием. Свободные С-концевые аминокислоты
13
определяют хроматографически
14. Определение С-концевой аминокислоты с помощью карбоксипептидаз (энзиматический гидролиз)
ОПРЕДЕЛЕНИЕ С-КОНЦЕВОЙ АМИНОКИСЛОТЫ СПОМОЩЬЮ КАРБОКСИПЕПТИДАЗ
(ЭНЗИМАТИЧЕСКИЙ
ГИДРОЛИЗ)
Rn-2
Rn-1
Rn
Rn-1
NH2 CH COOH
Rn
Карбоксипептидаза А - отщепляет аминокислоты с
ароматической и длинной алифатической боковой цепью:
Phe, Tyr, Trp, Leu, Ile, Met,Val.
Карбоксипептидаза В - отщепляет основные аминокислоты
- Lys, Arg, орнитин и не отщепляет С-концевой Pro.
Первичная структура белков и
пептидов. Лекция
. . . . .NH CH CO NH CH COOH
Rn-2
карбоксипептидаза
28.11.2018
. . . . .NH CH CO NH CH CO NH CH COOH
Карбоксипептидаза С (Р) - соединяет в себе специфичность
карбоксипептидаз А и В и в то же время может отщеплять
С-концевой Pro.
Карбоксипептидаза Y - отщепляет практически все
аминокислоты, включая Pro.
14
15. Определение аминокислотной последовательности
28.11.2018АМИНОКИСЛОТНОЙ
ПОСЛЕДОВАТЕЛЬНОСТИ
15
Первичная структура белков и пептидов.
Лекция
ОПРЕДЕЛЕНИЕ
16. Определение аминокислотной (N-концевой)последовательности белков с помощью метода Эдмана
ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ (NКОНЦЕВОЙ)ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКОВ СПОМОЩЬЮ МЕТОДА ЭДМАНА
Первичная структура белков и
пептидов. Лекция
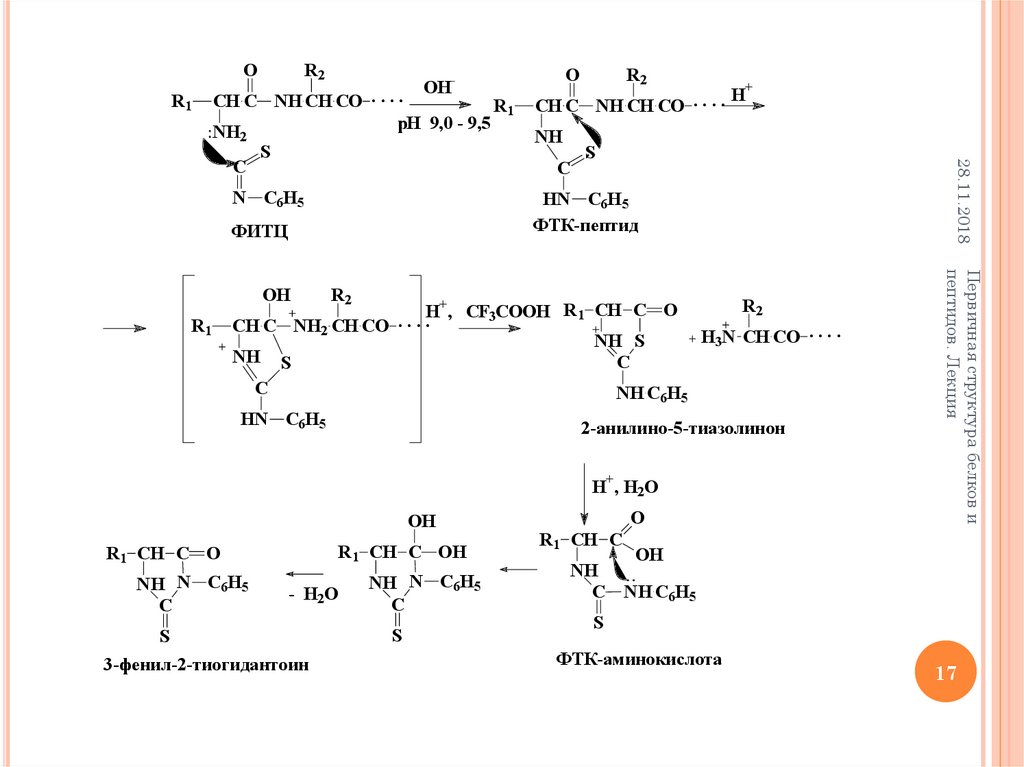
Каждый цикл деградации включает три стадии:
28.11.2018
Основным методом определения аминокислотной
последовательности является метод деградации полипептидной
цепи белка с помощью фенилизотиоцианата (ФИТЦ),
разработанный П. Эдманом в 1950-1956г.г.
Метод Эдмана позволяет последовательно отщеплять N-концевые
аминокислотные остатки в виде фенилтиогидантоинов (ФТГ)
аминокислот.
I. Конденсация, образование фенилтиокарбамил пептида (ФТК-пептид);
II. Циклизация, отщепление N-концевого остатка аминокислоты и его
циклизация в 2-анилино-5-тиазолинон;
III. Изомеризация, 2-анилино-5-тиазолинон N-концевого остатка
аминокислоты изомеризуется в фенилтиогидантоин, который в
дальнейшем идентифицируется (265-270 нм).
16
17.
OR1
R2
OH-
CH C NH CH CO . . . .
R1
pH
9,0
9,5
NH
2
NH
R2
R2
H+, CF3COOH R1 CH C O
.
.
.
.
CH C NH2 CH CO
H3N CH CO . . . .
NH S
NH S
C
C
NH C6H5
HN C6H5
2-анилино-5-тиазолинон
H+, H2O
OH
R1 CH C OH
R1 CH C O
NH N C6H5
C
- H2O
S
3-фенил-2-тиогидантоин
NH N C6H5
C
S
O
Первичная структура белков и
пептидов. Лекция
OH
S
HN C6H5
ФТК-пептид
ФИТЦ
R1
H+
CH C NH CH CO . . . .
C
N C6H5
R2
28.11.2018
C
S
O
R1 CH C
OH
NH
C NH C6H5
S
ФТК-аминокислота
17
18. Метод Эдмана-Грея
МЕТОД ЭДМАНА-ГРЕЯПервичная структура белков и
пептидов. Лекция
В 1972 г. В.Греем было предложено использовать метод
Эдмана в сочетании с реакцией дансилирования (ДНСЭдман).
После каждого цикла отщепления по Эдману отбирается
небольшая проба образца (аликвота) и анализируется Nконцевой остаток укороченного пептида с помощью
реакции дансилирования.
Этот подход выгодно отличается от «прямого» Эдмана, так
как при этом отсутствует стадия промывки (экстракции),
удаляющая избыток реагентов и побочных продуктов,
образовавшихся в процессе реакции конденсации, что
позволяет исключить возможные потери пептидов
(особенно неполярных) за счет их растворения в
органическом растворителе.
Постепенное уменьшение количества анализируемого
материала (в результате отбора аликвот) компенсируется
более высокой чувствительностью определения
флуоресцирующих производных аминокислот.
28.11.2018
18
19. Автоматическое секвенирование
АВТОМАТИЧЕСКОЕ СЕКВЕНИРОВАНИЕ28.11.2018
Иммобилизация белка по лизину:
R1
NH2 S
C N C6H4 N C
S
NH2
CH CO
. . . . NH CH CO. . . .
CH2 4
S
стекло
NH2
R1
S
NH C NH C6H4 NH C NH CH CO. . . . NH CH CO . . . .
S
стекло
S
NH C NH C6H4 NH C
CH2 4
NH
После кислотной обработки N-концевая АК отщепляется и
остается связанной со стеклом. Далее проводят секвенирование с
последующим отщеплением АК, остатки лизина «пропускаются».
N-концевые секвенаторы – до 40 АК остатков (15 циклов в сутки)
Первичная структура белков и
пептидов. Лекция
стекло
19
20. Определения С-концевой последовательности белков с помощью карбоксипептидаз
ОПРЕДЕЛЕНИЯ С-КОНЦЕВОЙ ПОСЛЕДОВАТЕЛЬНОСТИБЕЛКОВ С ПОМОЩЬЮ КАРБОКСИПЕПТИДАЗ
Отщепление аминокислот альдолазы
мышцы кролика карбоксипсптидазой А
Первичная структура белков и
пептидов. Лекция
Изучая кинетику
отщепления аминокислот
карбоксипептидазами,
можно получить
информацию о
последовательности
расположения их на Сконцевом участке
молекулы белка или
пептида. Скорость
появления
освобождающихся
аминокислот во времени
позволяет сделать вывод
о С-концевой
последовательности
белка.
28.11.2018
20
Ser-Leu-Phe-Ile-Ser-Asn-His-Ala-Tyr-OH
21.
Первичная структура белков ипептидов. Лекция
С-концевые секвенаторы – до 40 АК остатков
28.11.2018
При работе с карбоксипептидазами необходимо учитывать
следующие основные проблемы:
1) многие препараты ферментов А и В содержат эндонуклеазы (трипсин,
химотрипсин), которые следует инактивировать добавлением
диизопропилфторфосфата(DIPF);
2) следует учитывать различие в скоростях отщепления отдельных
аминокислот, зависящее как от природы боковой цепи у отщепляемого
остатка, так и от природы аминокислоты расположенной в соседнем
положении. Отщепление С-концевой аминокислоты значительно
ускоряется, если перед ней находится остаток с ароматической или
алифатической боковой цепью. Напротив, если в соседнем положении
находится глицин, пролин, глутаминовая кислота, то скорость гидролиза
снижается;
3) возникают осложнения и в случае, когда в С-концевой
последовательности стоят подряд несколько остатков одной и той же
аминокислоты.
Поэтому при использовании карбоксипептидаз надежно удается вывести
последовательность не более чем трех-пяти аминокислотных остатков,
расположенных в белке в С-концевом положении.
21
22. Определение АК последовательности методом «перекрывающихся блоков»
ОПРЕДЕЛЕНИЕ АК ПОСЛЕДОВАТЕЛЬНОСТИМЕТОДОМ «ПЕРЕКРЫВАЮЩИХСЯ БЛОКОВ»
CN
CH2CH2SCH3
NH CH
CONH CH CO
R
CH2 CH2
O
NH CH
C
NH CH CO
R
Первичная структура белков и
пептидов. Лекция
Определение АК состава, N- и С-концевых АК (при необходимости)
Восстановление дисульфидных связей с защитой сульфгидрильной
группы
3.
Анализ АК состава, выбор реагентов для расщепления:
- эндопептидазы:
Трипсин: Lys – X, Arg – X, кроме X=Pro
Химотрипсин: после ароматических АК
Пепсин между гидрофобными АК
Глутаминовая протеаза: Glu - X
- химическое расщепление:
Частичный гидролиз (10% уксусная к-та): лабильны связи, образованные
Asp и Pro
Расщепление BrCN по остаткам метионина:
28.11.2018
1.
2.
-
BrCN
H2O
+
H
CH2CH2SCH3 Br
NH CH CONH CH CO
R
CH2 CH2
O
NH CH
C
O
NH2 CH CO
R
CH3SCN
22
23.
Первичная структура белков ипептидов. Лекция
G-W-V-R /A- F-V-K /C-E-C-D триптические пептиды
G-W /V-R-A-F /V-K-C-E-C-D химотриптические пептиды
28.11.2018
4.
Селективное расщепление пептидных связей -1
4.1.
Разделение смеси, выделение индивидуальных пептидов
4.2.
Анализ этих пептидов: определение АК состава, N- и Сконцевых АК (при необходимости)
4.3.
Секвенирование пептидов (любым методом) + сиквенс
N –концевой последовательности
5. Селективное расщепление пептидных связей -2 (выделение,
анализ, секвенирование)
6. Установление полной АК последовательности (по
перекрыванию фрагментов пептидов)
Бромциановые пептиды:
Триптические пептиды:
Asn-Phe-Arg-Ser-Glu-Val
Туг-Asn-Lys-Val-Ile-Gly-Ser-Met(Ser)
Ala-Val-Met(Ser)
Ala-Val-Met-Туг-Asn-Lys
Ser-Glu-Val
Val-Ile-Gly-Ser-Met-Asn-Phe-Arg
23
Ala-Val-Met-Tyr-Asn-Lys-Val-Ile-Gly-Ser-Met-Asn-Phe-Arg-Ser-Glu-Val
24. определении аминокислотной последовательности пептидов масс-спектрометрическим методом
ОПРЕДЕЛЕНИИ АМИНОКИСЛОТНОЙПОСЛЕДОВАТЕЛЬНОСТИ ПЕПТИДОВ МАСССПЕКТРОМЕТРИЧЕСКИМ МЕТОДОМ
28.11.2018
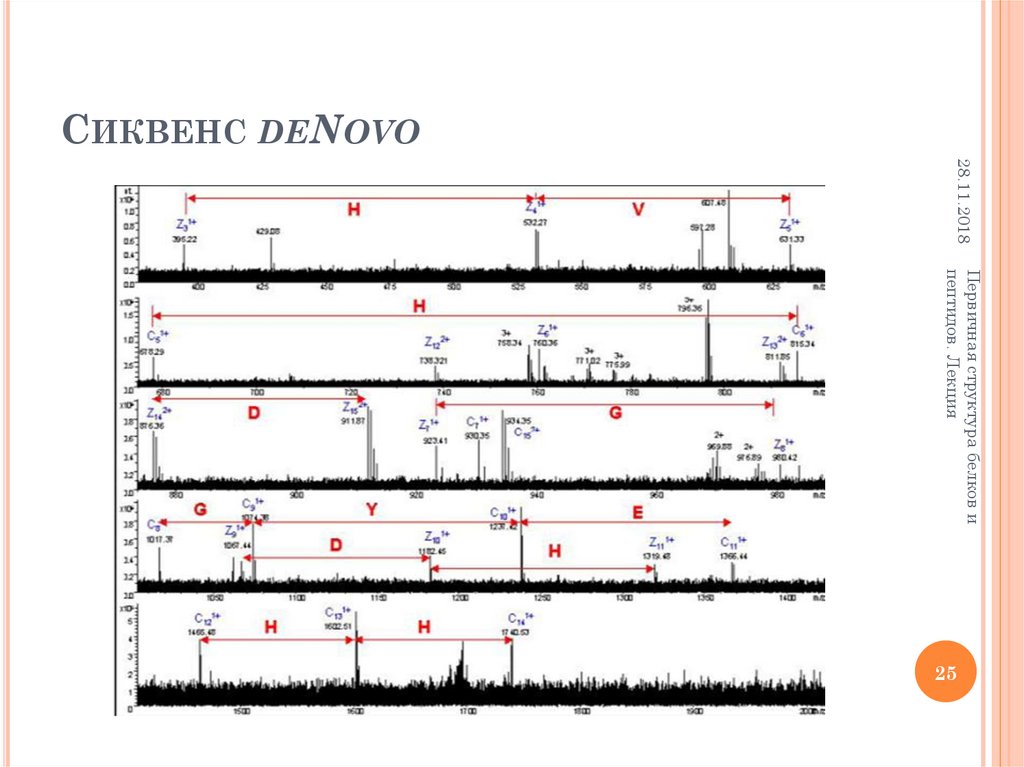
Используется способность ионизированных молекул пептидов
распадаться по так называемому аминокислотному типу
фрагментации, заключающемуся в разрыве СО—NH или CH—СО
связей.
Первичная структура белков и
пептидов. Лекция
o Идентификация в масс-спектре пиков, соответствующих фрагментам
А1...Аn или а1...аn, дает информацию о строении пептида.
24
25. Сиквенс deNovo
СИКВЕНС DENOVO28.11.2018
Первичная структура белков и
пептидов. Лекция
25
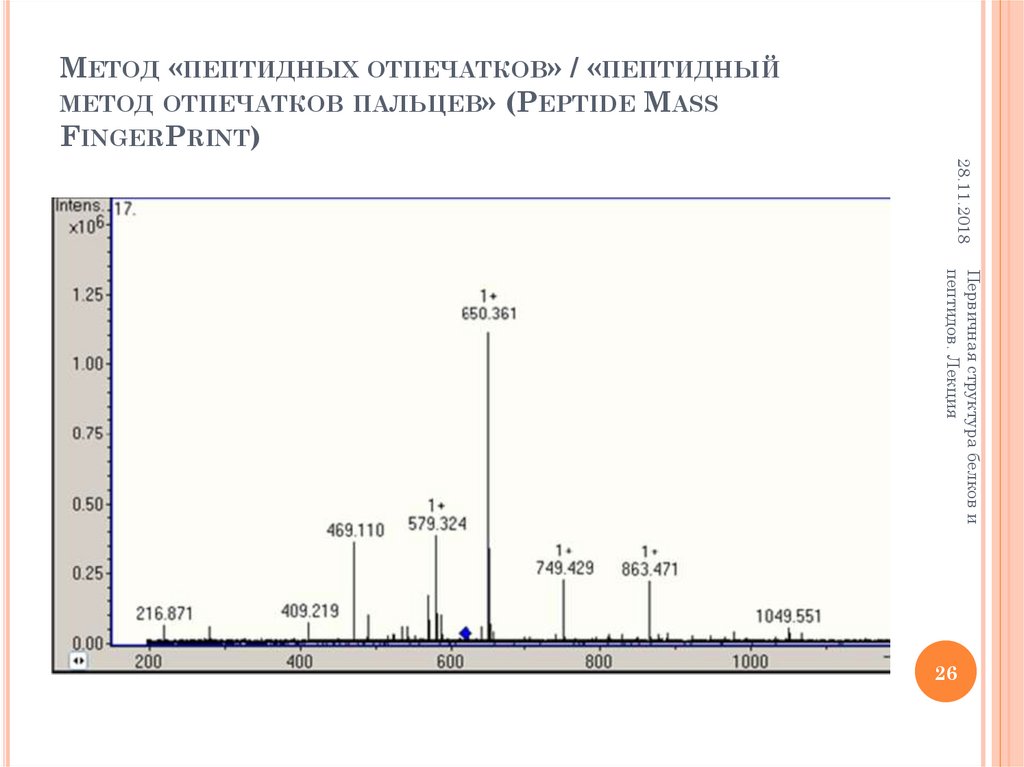
26. Метод «пептидных отпечатков» / «пептидный метод отпечатков пальцев» (Peptide Mass FingerPrint)
МЕТОД «ПЕПТИДНЫХ ОТПЕЧАТКОВ» / «ПЕПТИДНЫЙМЕТОД ОТПЕЧАТКОВ ПАЛЬЦЕВ» (PEPTIDE MASS
FINGERPRINT)
28.11.2018
Первичная структура белков и
пептидов. Лекция
26
27. Установление АК последовательности белка на основе нуклеотидной последовательности кодирующего его гена
УСТАНОВЛЕНИЕ АК ПОСЛЕДОВАТЕЛЬНОСТИБЕЛКА НА
ОСНОВЕ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ
КОДИРУЮЩЕГО ЕГО ГЕНА
Развитие методов анализа последовательности ДНК сделало возможным на
основе генетического кода выводить соответствующие аминокислотные
последовательности, исходя из установленных нуклеотидных:
5’- ATG GCA TCC GGA CCA ACG TAA -3’
Белок:
N- Met Ala
Ser Gly Pro Thr Stop -C
При реализации такого подхода следует, однако, иметь в виду целый ряд
ограничений и возможные источники ошибок:
Во-первых, выведенная из нуклеотидной аминокислотная последовательность
может не соответствовать реальной, вследствие процессинга, который часто
происходит как на уровне информационной РНК, так и при превращении
белка-предшественника в конечный белок.
Во-вторых, лишь одна ошибка в определении последовательности ДНК
(пропуск или вставка) приводит к выведению совершенно неправильной
аминокислотной последовательности белка.
Таким образом, установление первичной структуры ДНК не всегда может
заменить непосредственное исследование аминокислотной последовательности
кодируемого ею белка. В то же время параллельное изучение первичных
структур белка и ДНК чрезвычайно эффективно. Установление нуклеотидной
последовательности дает возможность расположить изученные пептидные
фрагменты в непрерывную полипептидную цепь, позволяя решать, таким
образом, наиболее сложную задачу структурного анализа белка. С другой
стороны, данные по аминокислотной последовательности пептидов упрощают и
уточняют анализ нуклеотидной последовательности.
Первичная структура белков и
пептидов. Лекция
ДНК:
28.11.2018
27
28. Белки
28.11.201828
Определение белков. Классификация и
свойства белков.
Первичная структура белков и пептидов.
Лекция
БЕЛКИ
29.
Белки – это полипептиды, способные самопроизвольноформировать и сохранять определенную пространственную
структуру
РНК-аза
Диализ
Потеря активности
Восстановление активности
Пространственное строение предопределяется первичной
структурой белка
Функция белка предопределяется его пространственной
структурой
Белок может функционировать, т. е. выступать в качестве
фермента, структурного или транспортного белка, регулятора,
токсина, ингибитора только потому, что он обладает вполне
определенным пространственным строением.
Первичная структура белков и
пептидов. Лекция
Денатурация
28.11.2018
Ренактивация РНК-азы:
29
30. классификация белков
КЛАССИФИКАЦИЯ БЕЛКОВГлобулины (в воде не
растворяются, но растворимы в
разбавленных растворах солей.
К глобулинам принадлежат
глобулины крови и мышечный
белок миозин)
Глутелины (растворяются только
в разбавленных растворах
щелочей. Встречаются в
растениях)
Склеропротеины
(нерастворимые белки. К
склеропротеинам относятся
кератины, белок кожи и
соединительных тканей
коллаген, белок натурального
шелка фиброин)
o Нуклеопротеиды (составные
части клеточных ядер.
Нуклеопротеиды являются
важнейшей составной частью
вирусов — возбудителей многих
болезней)
o Фосфопротеиды (вителлин—
белок, содержащийся в яичном
желтке, белок молока казеин)
o Хромопротеиды (содержат
молекулу окрашенного
вещества, обычно типа порфина.
Гемоглобин — переносчик
кислорода, окрашивающий
красные кровяные тельца)
o Гликопротеиды (входят в состав
хрящей, рогов, слюны)
o Металлопротеиды (некоторые
ферменты)
Первичная структура белков и
пептидов. Лекция
Альбумины (хорошо
растворяются в воде.
Содержатся в молоке, яичном
белке и крови)
Протеиды (сложные
белки)
28.11.2018
Протеины (простые
белки)
30
31. классификация белков
КЛАССИФИКАЦИЯ БЕЛКОВв молекулах которых
полипептидные цепи плотно
свёрнуты в компактные
шарообразные структуры
(глобулы)
белки, имеющие вытянутую
нитевидную структуру, в
которой соотношение
продольной и поперечной
осей более 1:10
Трехмерная структура молекулы
гемоглобина — глобулярного
белка
Коллаген - главный опорный
белок
Первичная структура белков и
пептидов. Лекция
Фибриллярные белки -
28.11.2018
Глобулярные белки́ — белки,
32. классификация белков
КЛАССИФИКАЦИЯ БЕЛКОВМембранные белки – это белки, которые
Периферические мембранные белки являются монотопическими
белками. Они либо связаны слабыми связями с липидной мембраной,
либо ассоциируют с интегральными белками за счёт гидрофобных,
электростатических или других нековалентных сил. Они диссоциируют от
мембраны при обработке соответствующим водным раствором (например,
с низким или высоким pH, с высокой концентрацией соли или под
действием хаотропного агента). Эта диссоциация не требует разрушения
мембраны.
Первичная структура белков и
пептидов. Лекция
Интегральные мембранные белки прочно встроены в мембрану и
могут быть извлечены из липидного окружения только с помощью
детергентов или неполярных растворителей. По отношению к липидному
бислою интегральные белки могут быть трансмембранными
политопическими или интегральными монотопическими.
28.11.2018
встроены в клеточную мембрану или мембрану клеточной органеллы или
ассоциированы с таковой.
32


























 chemistry
chemistry