Similar presentations:
Пептиды и белки
1.
Ставропольский государственный медицинскийуниверситет
Кафедра общей и биологической химии
Пептиды и белки
1
2.
План лекции• Пептидная связь
• Уровни организации белковой молекулы
• Химические и физические свойства белков
• Методы анализа белков
• Функции белков
• Антимикробные пептиды
2
3.
ПростыеПротеины
•Альбумины
•Глобулины
•Гистоны
•Протамины
•Проламины
Белки
Сложные
Протеиды
•Фосфопротеины
(казеин молока)
•Нуклеопротеиды
•Хромопротеиды
•Гликопротеиды
•Склеропротеины
(кератин, коллагены,
эластин, фиброин)
3
4.
Простые белки:1) Альбумины
2) Глобулины
З) Гистоны
4) Склеропротеины
5.
Сложные белки :1. Нуклеопротеины
2.
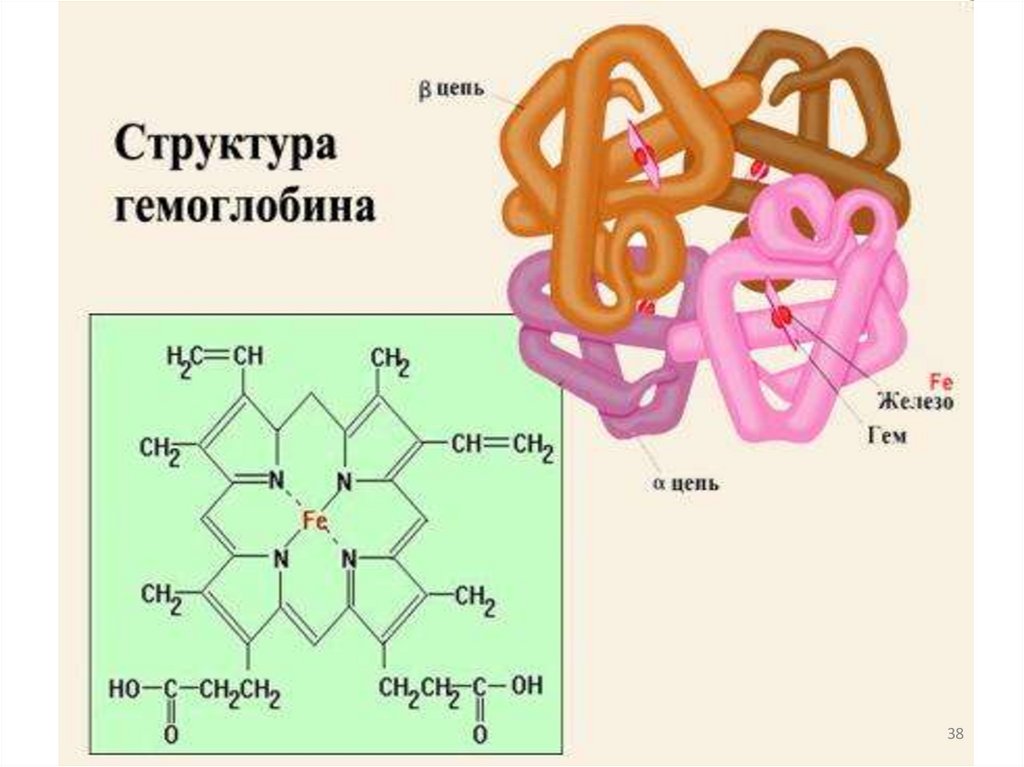
Гемопротеины
3. Металлопротеины
4. Липопротеины
5. Фосфопротеины
6. Глюкопротеины
6.
Состав белков16%
2%
Углерод
Водород
53%
23%
6%
Кислород
Азот
Сера
6
7.
Плазма крови содержит ≈ 300 белков. Ихконцентрация определяется тремя основными
факторами: скоростью синтеза, скоростью
метаболизма и объемом жидкости, в котором
распределены белки.
7
8.
Нормальное содержание белков в плазме крови – 65-85 г/л(у новорожденных – 50-60 г/л, уровня взрослых достигает к
трем годам).
Методом высаливания нейтральными солями из плазмы
крови выделяют три группы белков:
альбумины – 40-50 г/л
глобулины – 20-30 г/л
фибриноген – 2–4 г/л.
Плазма крови, лишенная фибриногена, называется сывороткой.
8
9.
В организме взрослого человекапроисходит постоянное обновление белков
крови – за сутки разрушается и вновь
синтезируется
около 17 г альбумина и
5 г глобулинов.
9
10.
Почти все белки плазмы, за исключением альбумина,являются гликопротеинами,
количество углеводов в их составе варьируется от 1%
до 40% (кислый гликопротеин).
Олигосахариды присоединяются к белкам, образуя
гликозидные связи с гидроксильной группой серина
или треонина, или взаимодействуя с карбоксильной
группой аспарагина.
10
11.
ОБРАЗОВАНИЕ ПЕПТИДНОЙСВЯЗИ
11
12.
OH2 N-CH-C
R
O
+ H2 N-CH-C
OH
O
+ H2 N-CH-C
OH
R'
R''
OH
пептидная связь
N-конец
O
O
C-конец
H2 N-CH-C-NH-CH-C-NH-CH-COOH
R
R'
R"
трипептид
13
13.
OO
H2 N-CH-C NH-CH2 -C
CH3
Ала
Гли
O
NH-CH-C OH
CH2 -C6 H5
Фен
аланил глицил фенилаланин
14
14.
15.
16.
Замена одного аминокислотного остатка надругой может привести к патологии.
Например,
в белковой цепи гемоглобина замена
Глутаминовой кислоты на Валин
приводит к тяжелому заболеванию –
серповидноклеточной анемии
17
17.
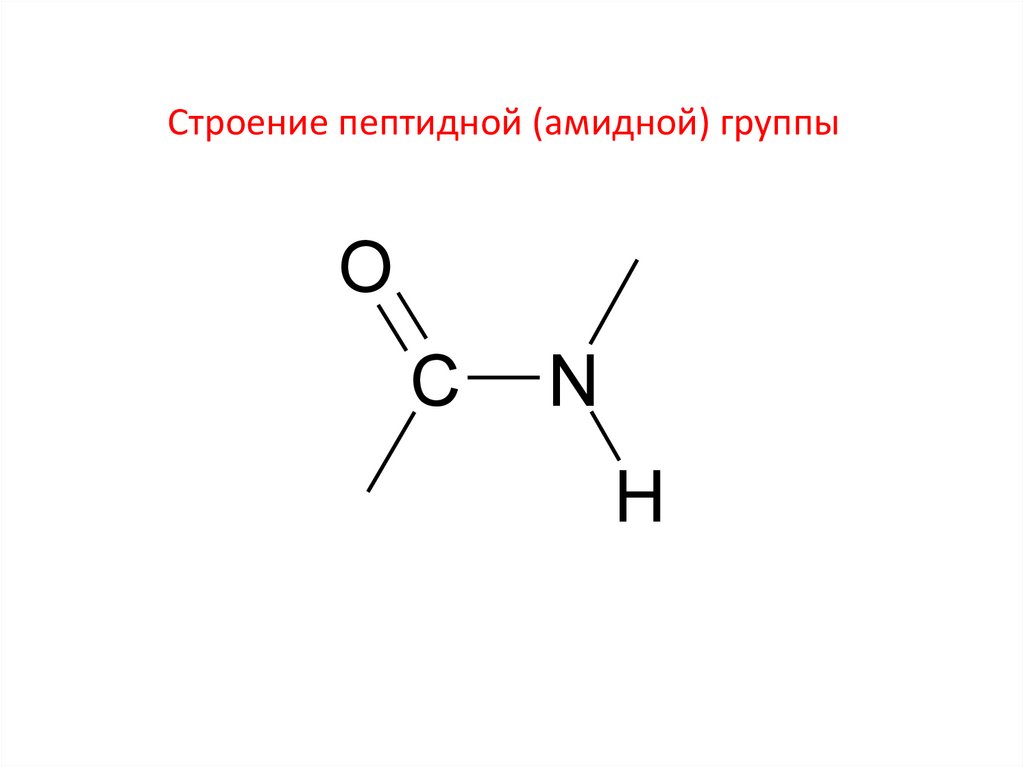
Строение пептидной (амидной) группыO
C
N
H
18.
19.
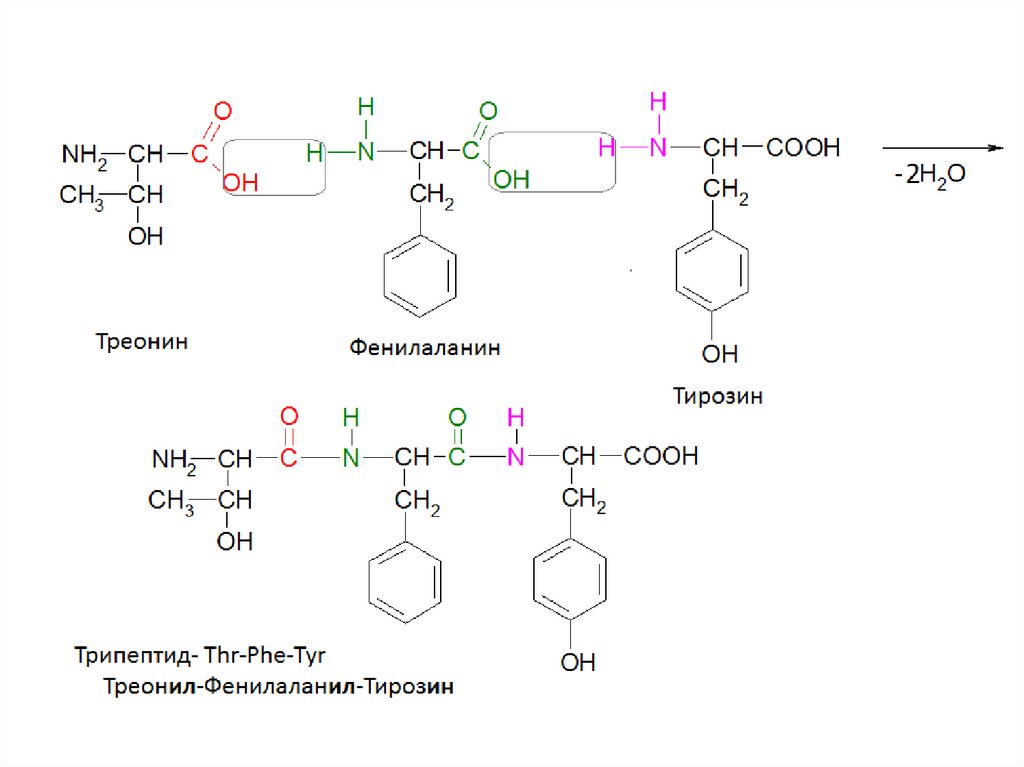
Изоэлектрическая точка пептидов и белковПептид: Тре-Фен-Тир.
Содержит одну COOH и одну NH2
ИЭТ будет равна 5-6 (pI≈7).
Пептид: Гли-Лиз-Тир.
Содержит одну COOH и две NH2
ИЭТ будет равна 8-11 (pI>7).
Пептид: Глу-Ала-Цис.
Содержит две COOH и одну NH2
ИЭТ будет равна 3 (pI<7).
20.
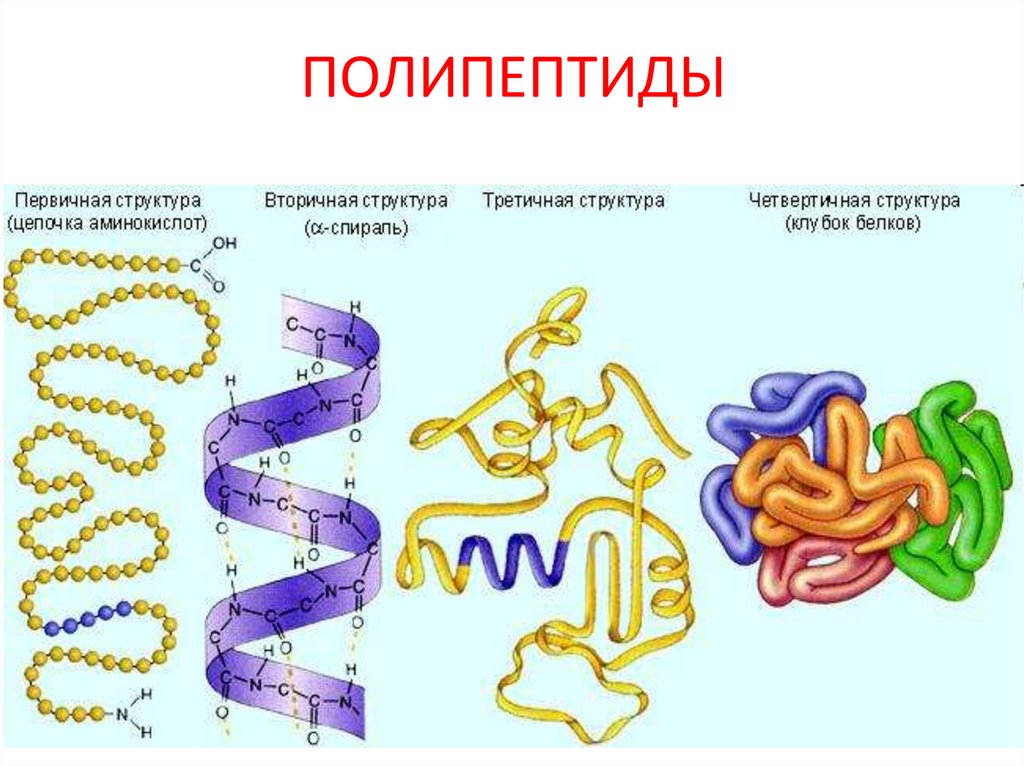
ПОЛИПЕПТИДЫ21
21.
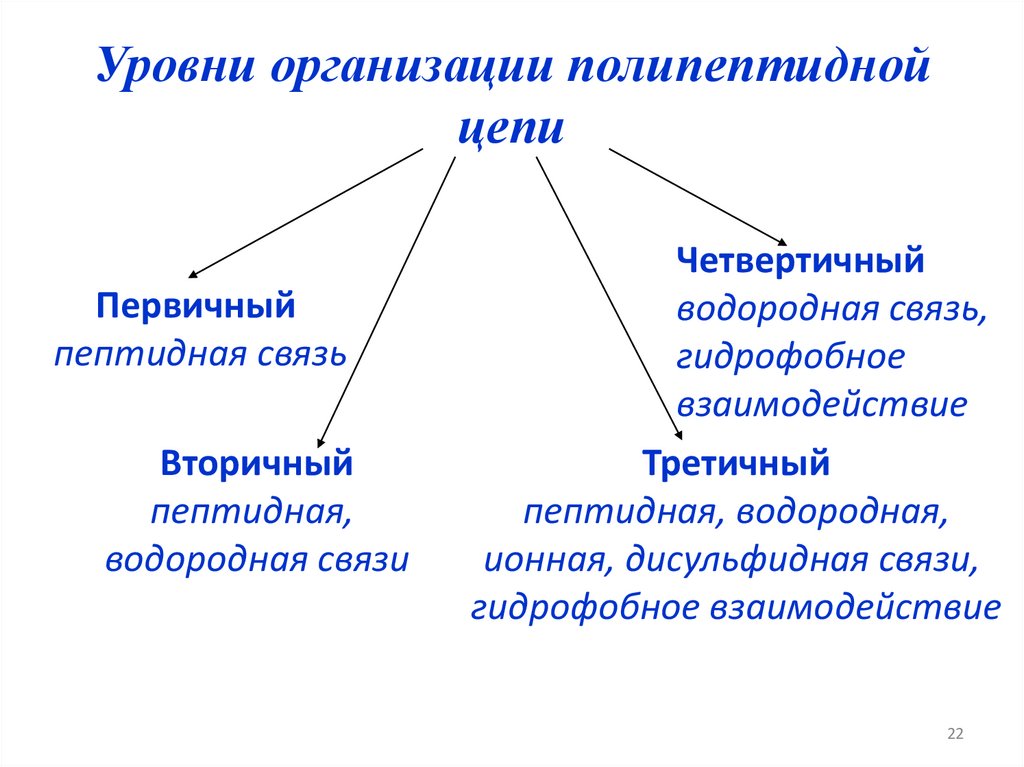
Уровни организации полипептиднойцепи
Первичный
пептидная связь
Вторичный
пептидная,
водородная связи
Четвертичный
водородная связь,
гидрофобное
взаимодействие
Третичный
пептидная, водородная,
ионная, дисульфидная связи,
гидрофобное взаимодействие
22
22.
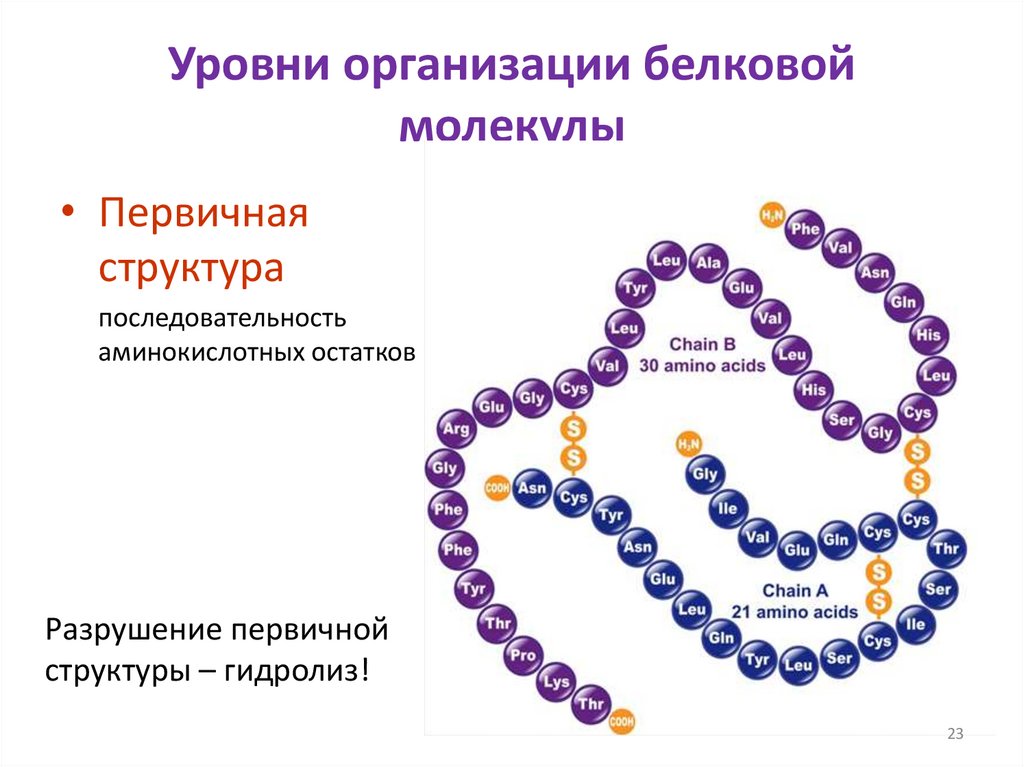
Уровни организации белковоймолекулы
• Первичная
структура
последовательность
аминокислотных остатков
Разрушение первичной
структуры – гидролиз!
Первичная структура
инсулина человека
(http://www.interactive-biology.com)
23
23.
2424.
Вторичная структура белка• упорядочивание за счет водородных связей
Альфа спирали
Лайнус Карл Полинг
(1901-1994)
Нобелевская премия по химии 1954 г.
25
25.
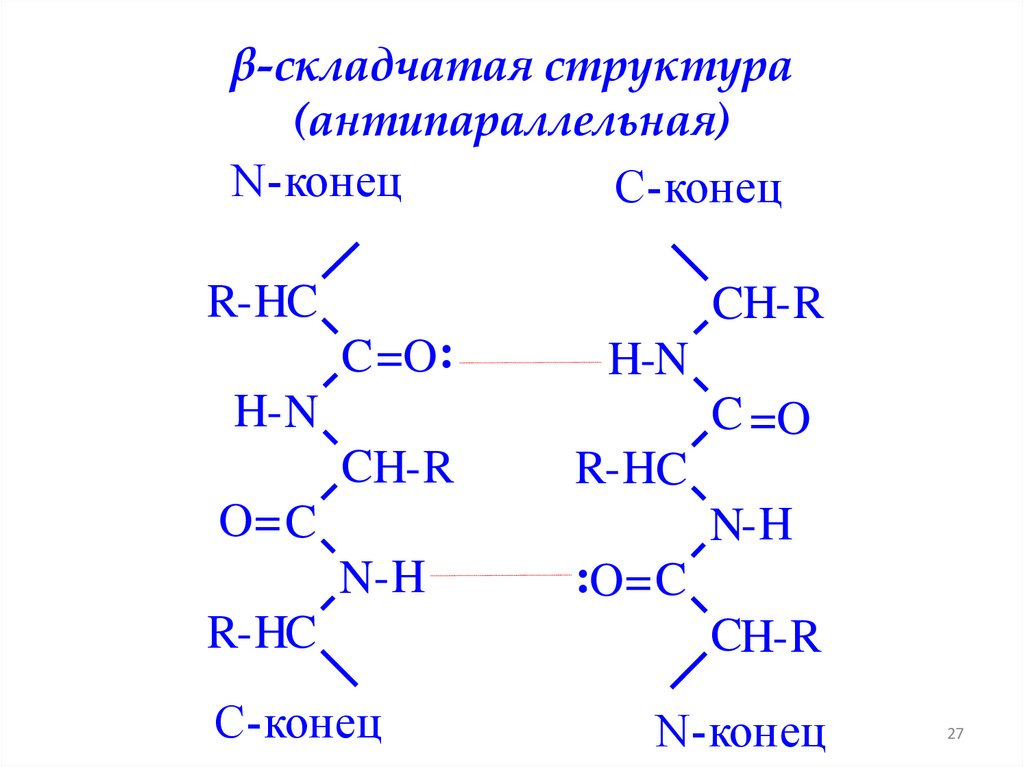
β-складчатая структура(параллельная)
N-конец
N-конец
R-HC
C =O:
H- N
R-HC
C =O
H- N
CH-R
O= C
C H-R
:O= C
N-H
R-HC
C-конец
N -H
R-HC
C-конец
26
26.
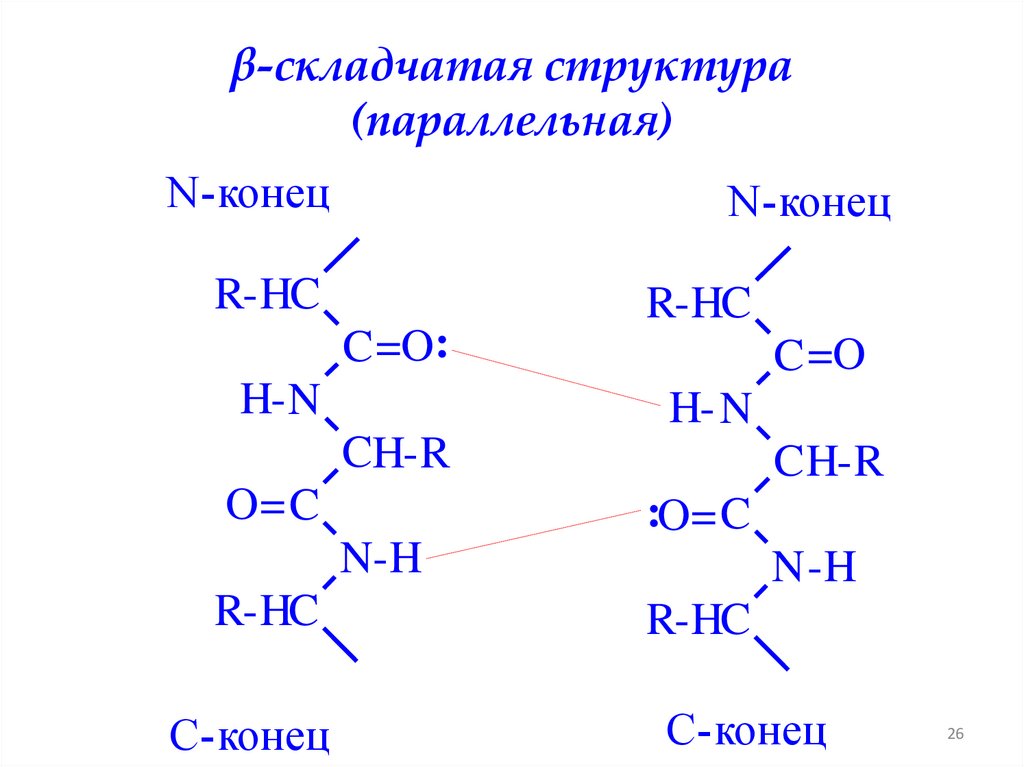
β-складчатая структура(антипараллельная)
N-конец
C-конец
R-HC
CH-R
C =O:
H-N
H- N
C =O
CH-R
R-HC
O= C
N-H
N-H
R-HC
C-конец
:O= C
CH-R
N-конец
27
27.
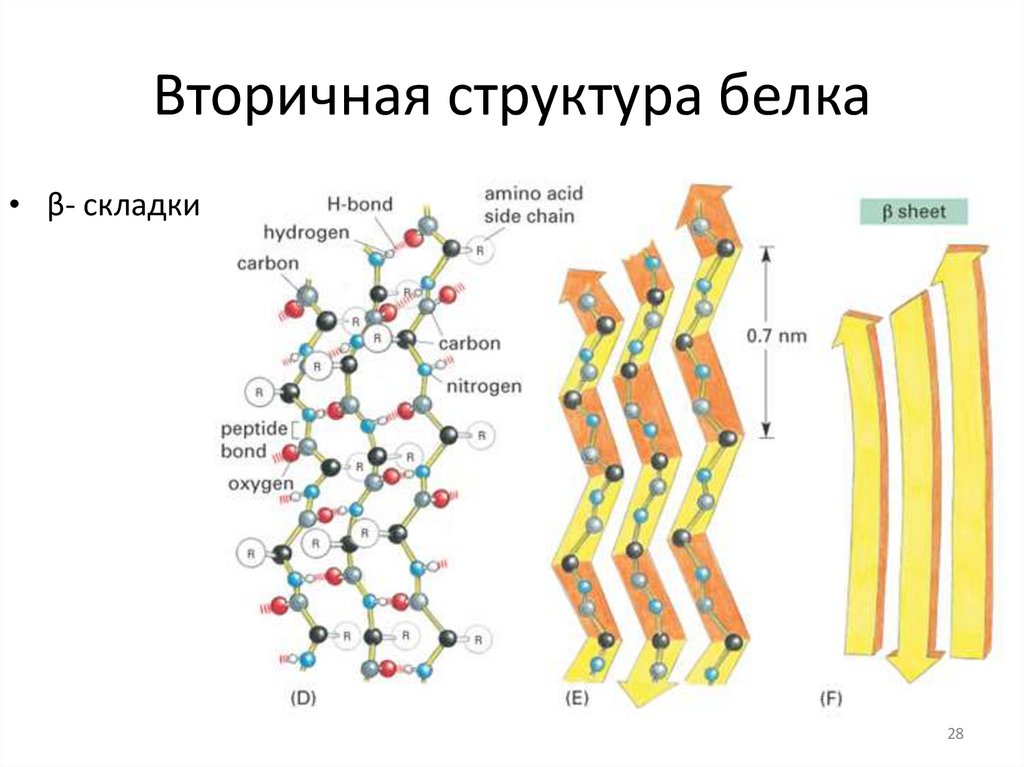
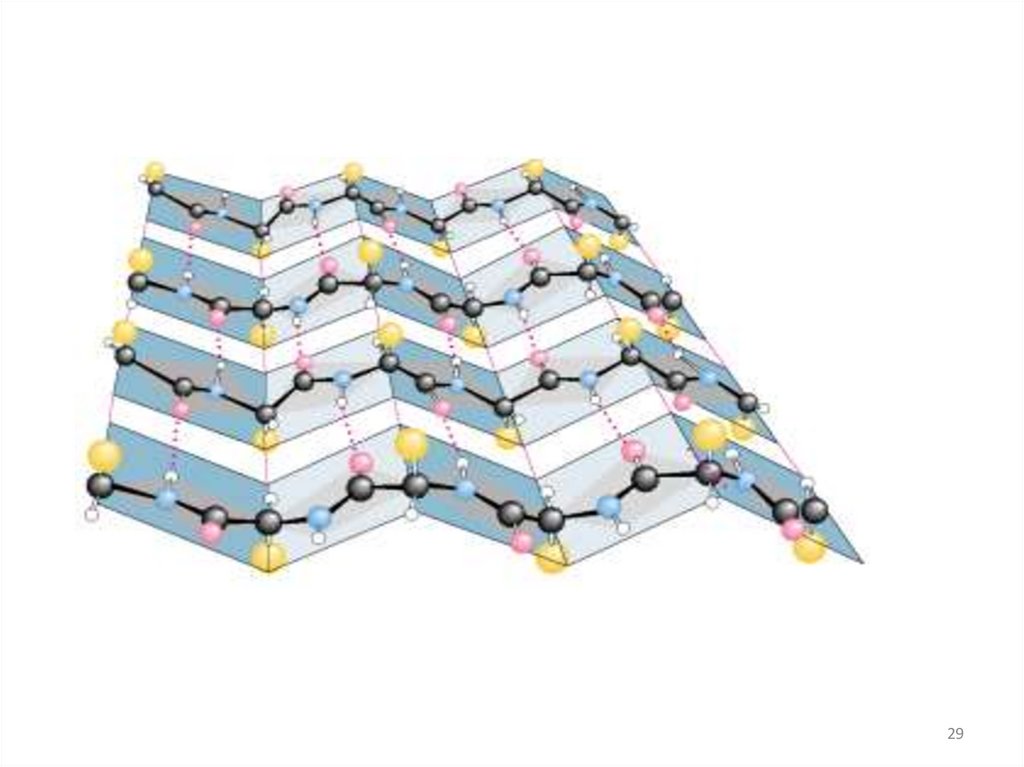
Вторичная структура белка• β- складки
28
28.
2929.
Прионы• Инфекционные белки.
• PrPC нормальный
мембранный белок
нервных клеток
• PrPSc «патологическая»
конформация.
PrPC
PrPSc
α-спирали переходят в β-складки
30
30.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКАПространственное расположение полипептидной цепи, обусловленное
взаимодействием между боковыми группами аминокислотных остатков
гидрофобные
водородные
ковалентные
ионные
31
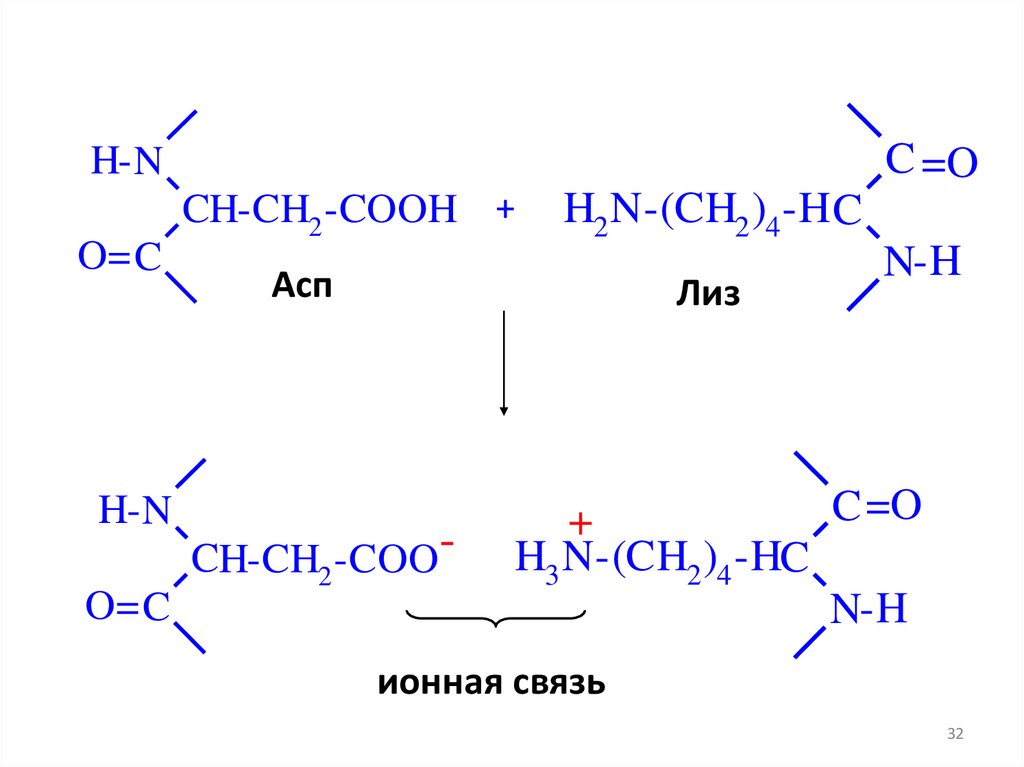
31.
C =OH- N
O= C
H-N
O= C
CH-CH2 -COOH +
H2 N-(CH2 )4 -H C
N-H
Асп
Лиз
CH-CH2 -COO -
C =O
+
H3 N-(CH2 )4 -HC
N-H
ионная связь
32
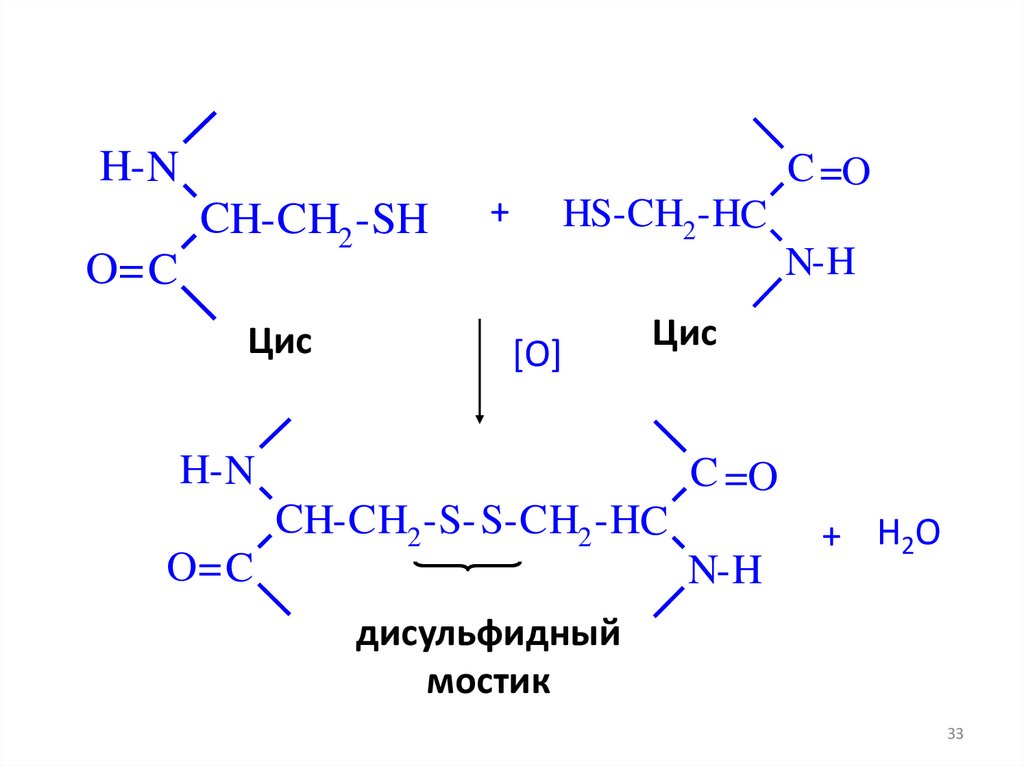
32.
H- NO= C
C =O
CH-CH2 -SH
Цис
+
HS-CH2 -HC
N-H
[O]
Цис
H- N
O= C
C =O
CH-CH2 -S- S-CH2 -HC
N-H
+ H2O
дисульфидный
мостик
33
33.
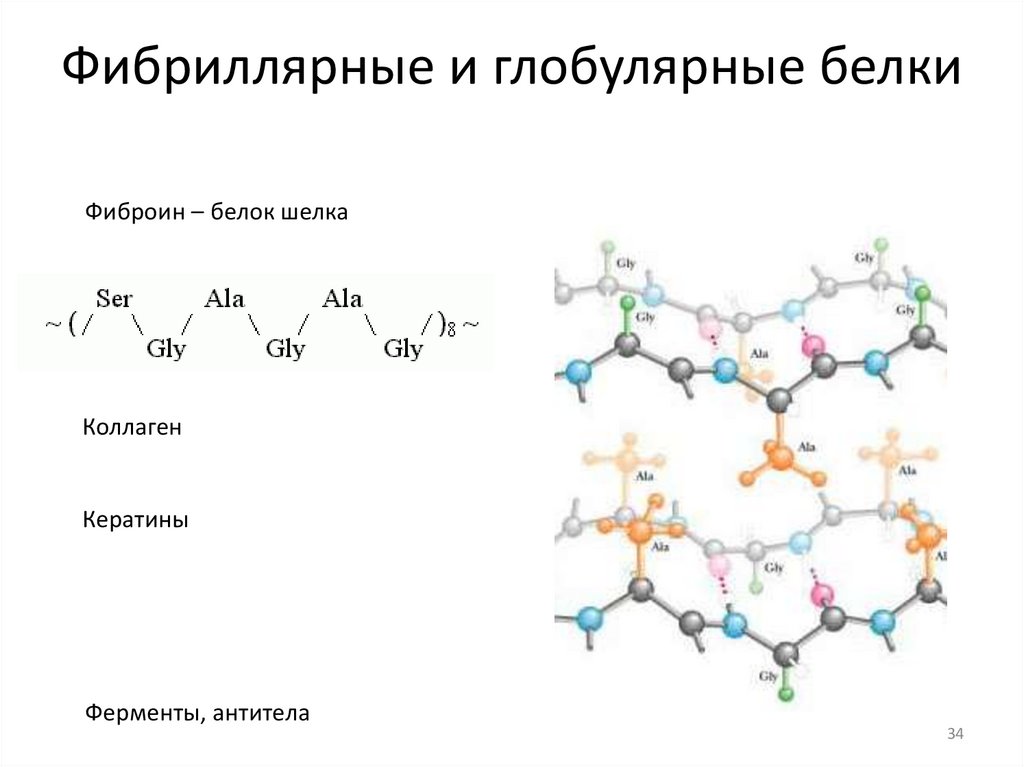
Фибриллярные и глобулярные белкиФиброин – белок шелка
Коллаген
Кератины
Ферменты, антитела
34
34.
Коллаген35
35.
3636.
Четвертичная структура:Для функционирования белков необходимо,
чтобы несколько полимерных цепей были
объединены в единый комплекс или агрегат.
37
37.
3838.
Физические свойства белков• Размер – в среднем 300-500 а/к,
• самый крупный – коннектин 38.138 а/к
• Заряд (изоэлектрическая точка)
Основные белки (гистоны, протамины, pI=11)
Кислые белки (пепсин, pI=1)
39
39.
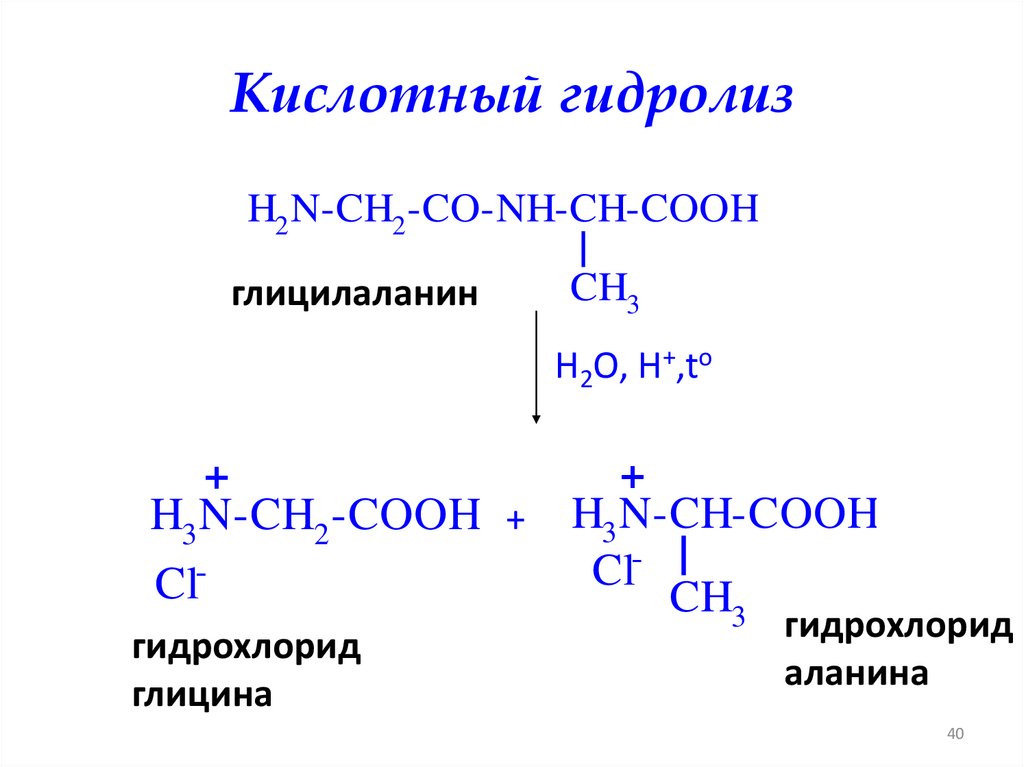
Кислотный гидролизH2 N-CH2 -CO-NH-CH-COOH
глицилаланин
CH3
H2O, H+,to
+
+
H3 N-CH2 -COOH + H3 N-CH-COOH
Cl
Cl
CH3
гидрохлорид
глицина
гидрохлорид
аланина
40
40.
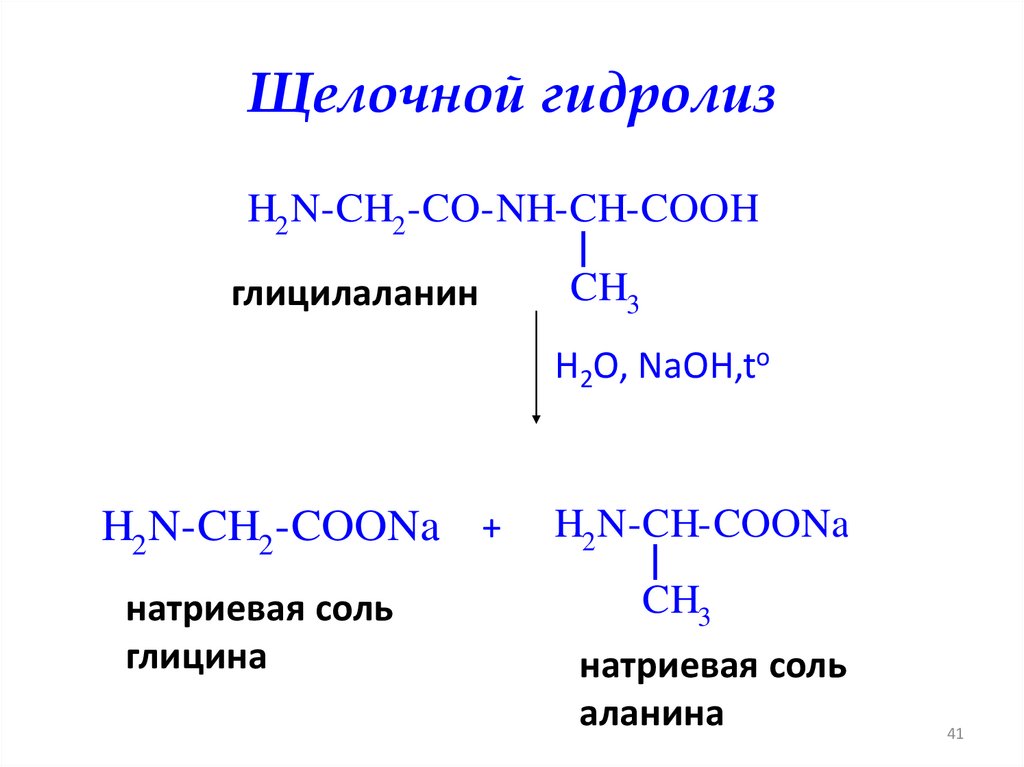
Щелочной гидролизH2 N-CH2 -CO-NH-CH-COOH
глицилаланин
CH3
H2O, NaOH,to
H2 N-CH2 -COONa +
натриевая соль
глицина
H2 N-CH-COONa
CH3
натриевая соль
аланина
41
41.
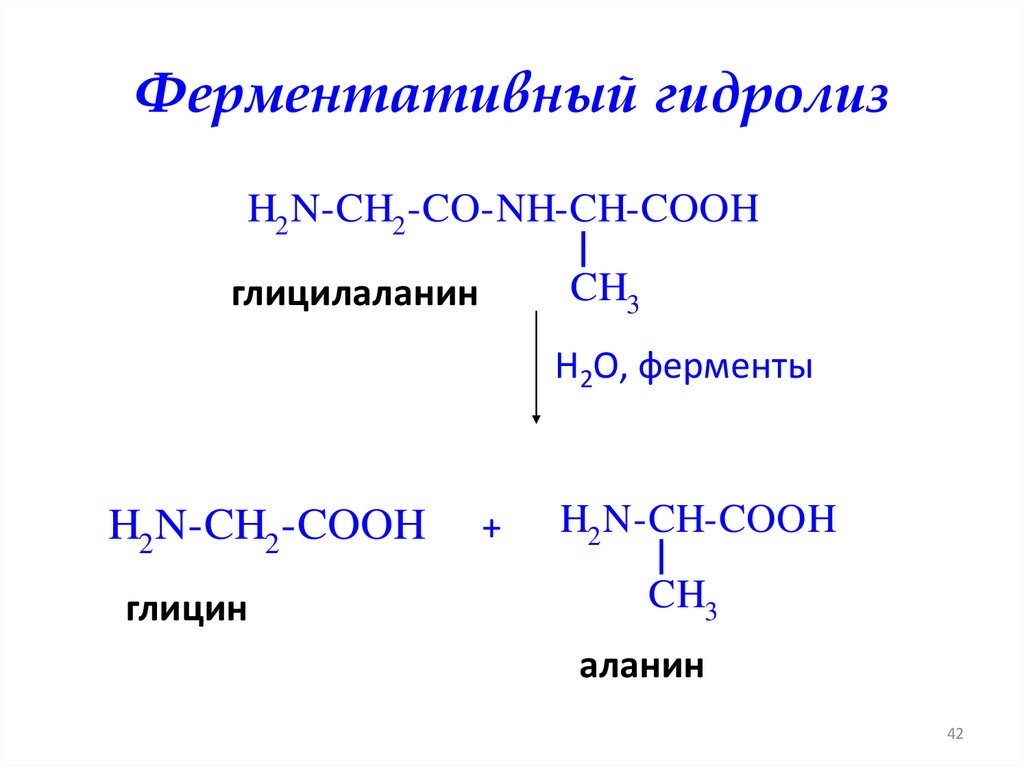
Ферментативный гидролизH2 N-CH2 -CO-NH-CH-COOH
CH3
глицилаланин
H2O, ферменты
H2 N-CH2 -COOH
глицин
+
H2 N-CH-COOH
CH3
аланин
42
42.
Качественная реакция напептидные связи
Биуретовая реакция
Белок + Cu(OH)2
красно-фиолетовое
окрашивание
43
43.
4444.
Методы выделенияи очистки белка
45.
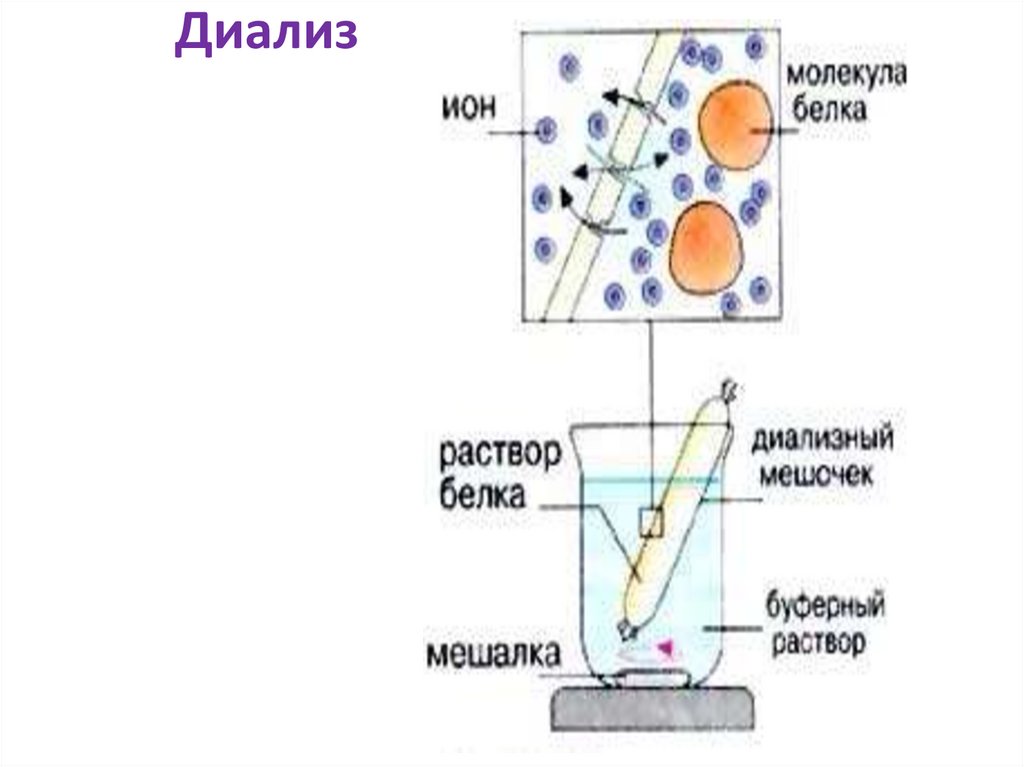
Диализ46.
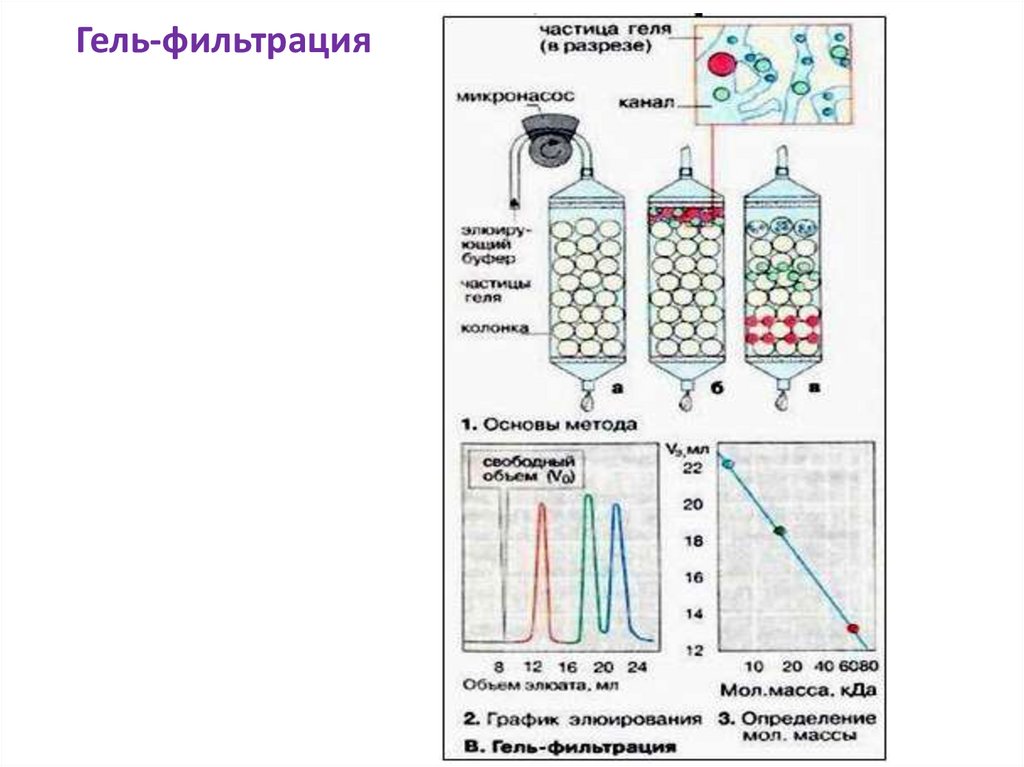
Гель-фильтрация47.
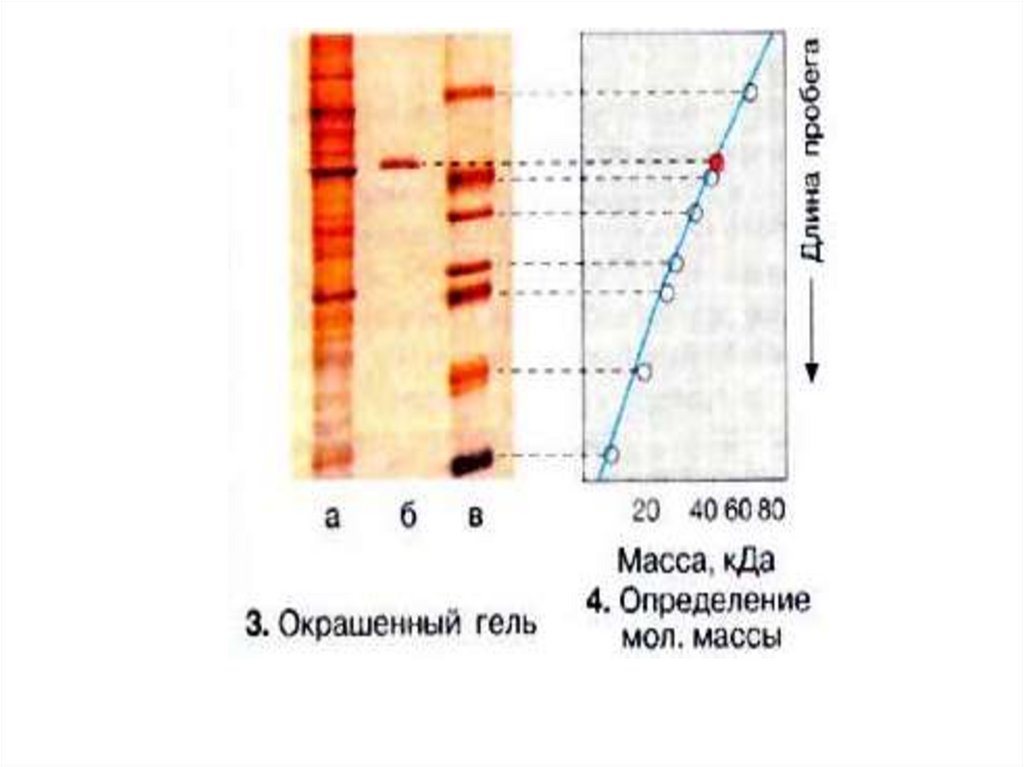
Электрофорез в полиакриламидном геле вприсутствии додецилсульфата натрия
48.
49.
Электрофорезом (на ацетилцеллюлозе или агарозе)выделяют:
альбумины – 55-65 %
α1-глобулины – 2-4 %
α2–глобулины – 4-8 %
β-глобулины – 8-12 % (иногда β1 и β2)
γ-глобулины – 12-18 %.
50
50.
Альбумины – это группа белков плазмы смолекулярной массой около 40 кДа, содержат много
глутаминовой кислоты и поэтому имеют кислые
свойства и высокий отрицательный заряд при
физиологических рН.
51
51.
Глобулины – группа разнообразных белков плазмы смолекулярной массой до 100 кДа, слабокислые или
нейтральные.
52
52.
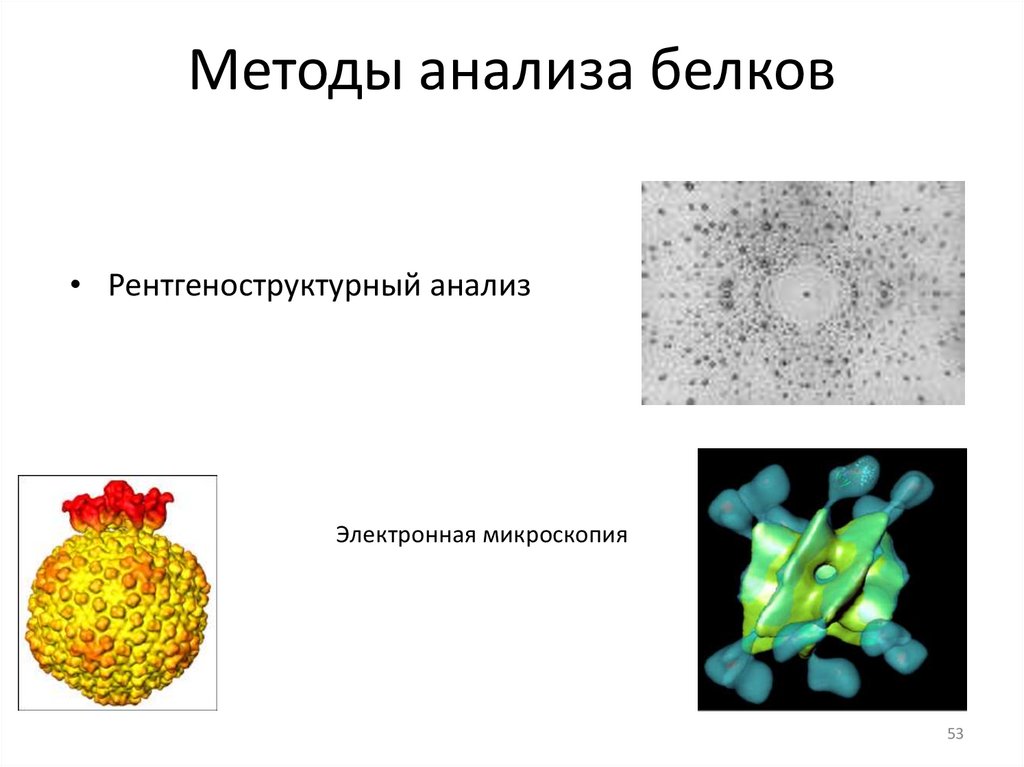
Методы анализа белков• Рентгеноструктурный анализ
Электронная микроскопия
53
53.
Функции белков1. Каталитическая функция
Ферменты – катализаторы биохимических реакций
Более 5000 разных реакций
Очень высокая специфичность!
Модель «ключ-замок»
54
54.
2. Структурная функция белков• Входят в состав всех мембранных и
немембранных органелл клетки
• Коллаген – соединительная ткань
• Кератин – волосы и ногти
• Актин и тубулин - цитоскелет
55
55.
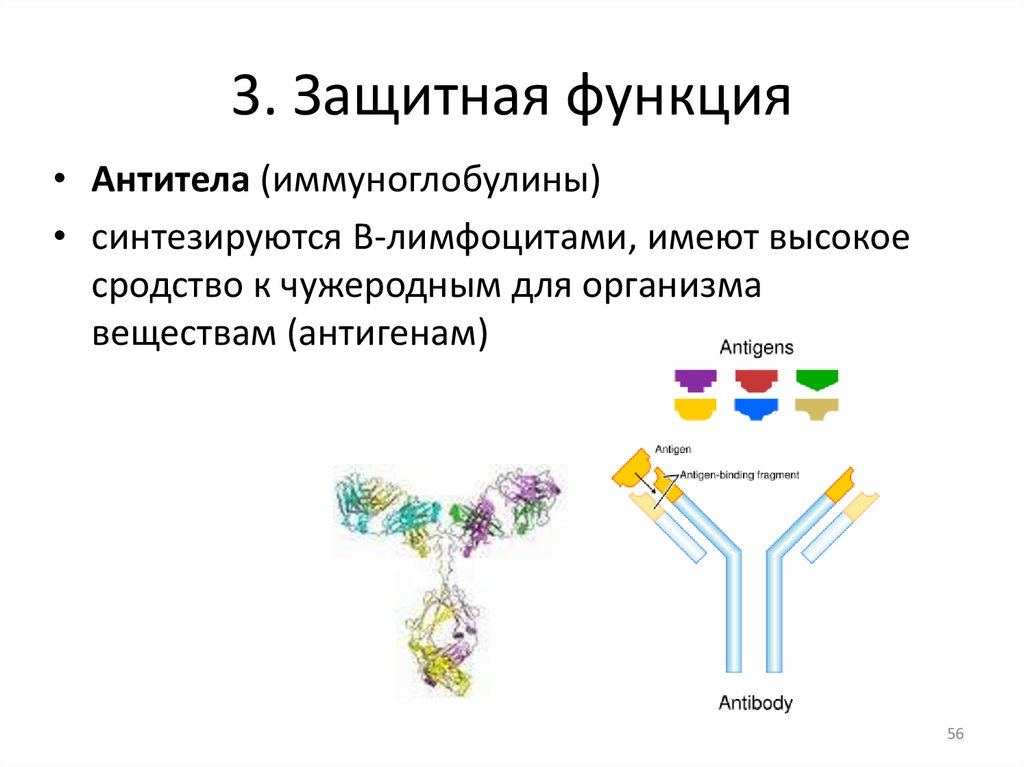
3. Защитная функция• Антитела (иммуноглобулины)
• синтезируются В-лимфоцитами, имеют высокое
сродство к чужеродным для организма
веществам (антигенам)
56
56.
4. Регуляторная функция• Белки – гормоны (инсулин)
• Факторы роста
• Белки - регуляторы активности генов
(активаторы и репрессоры)
57
57.
5. Транспортная функция• Гемоглобин
• Ионные каналы
мембран
58
58.
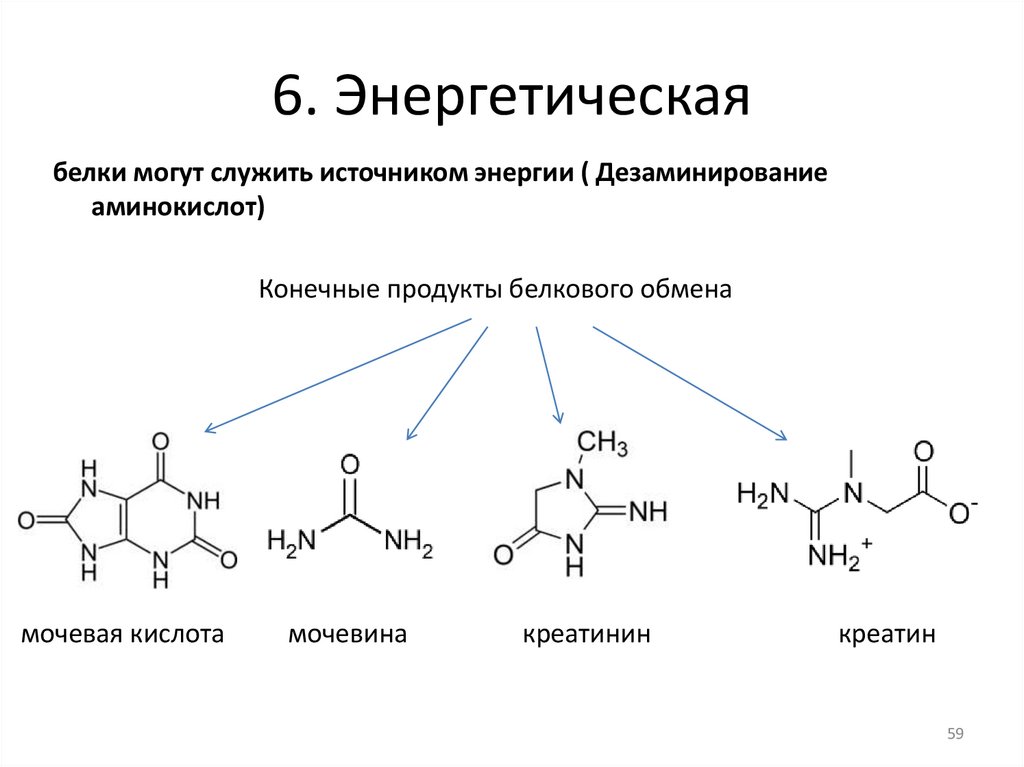
6. Энергетическаябелки могут служить источником энергии ( Дезаминирование
аминокислот)
Конечные продукты белкового обмена
мочевая кислота
мочевина
креатинин
креатин
59
59.
Физиологическая рольбелков плазмы крови:
1. Поддерживают коллоидно-осмотическое
(онкотическое) давление и постоянный объем
циркулирующей крови (ОЦК).
2. Принимают активное участие в свертывании крови.
Ряд белков, в том числе фибриноген, являются
основными компонентами системы свертывания.
60
60.
3. Определяют вязкость крови, которая в 4-5 развыше вязкости воды, что играет важную роль в
поддержании гемодинамических отношений в
кровеносной системе.
4. Принимают участие в поддержании постоянного
рН крови, как одна из важнейших составляющих
буферных систем крови.
61
61.
5. Транспортная функция (альбумин, транстиретин,транскортин, трансферрин) – перенос
многих
веществ в т.ч. лекарственных средств (пенициллин,
салицилаты и др.) к тканям.
6. Играют важную роль в процессах гуморального
иммунитета (особенно иммуноглобулины).
62
62.
7. Поддерживают уровень катионов в крови, образуяс ними недиализируемые комплексы (с белками
связано 40-50% кальция сыворотки, значительная
часть железа, магния, меди и других элементов).
8. Служат резервом аминокислот.
63
63.
Причины гипопротеинемий:недостаточность поступления белков в организм
(при голодании, язвенной болезни, стенозе
привратника, опухолях)
недостаточность переваривания и всасывания
пищевых белков (при диспепсии, дизентерии,
гастроэнтеритах);
нарушение синтеза белков печенью (дефицит
ферментов синтеза белков при наследственных
гипопротеинемиях, гепатиты, циррозы; жировая
дистрофия печени);
хронические заболевания почек с
нефротическим компонентом.
64
64.
Физико-химические свойства пептидов и белков65
65.
Осаждение нативных белков1. ВЫСАЛИВАНИЕ - это осаждение белков
высокими концентрациями нейтральных солей
щелочных и щелочноземельных металлов.
При высаливании сохраняется нативность
белковых молекул. Если осадить белки с помощью
высаливания, а затем уменьшить концентрацию
солей, например, методом диализа, то белок опять
растворится.
66.
2. ПРИМЕНЕНИЕ ВОДООТНИМАЮЩИХ СРЕДСТВ.Такими средствами являются растворители, которые
смешиваются с водой в любых соотношениях. Чаще
всего это ацетон, этиловый спирт.
67.
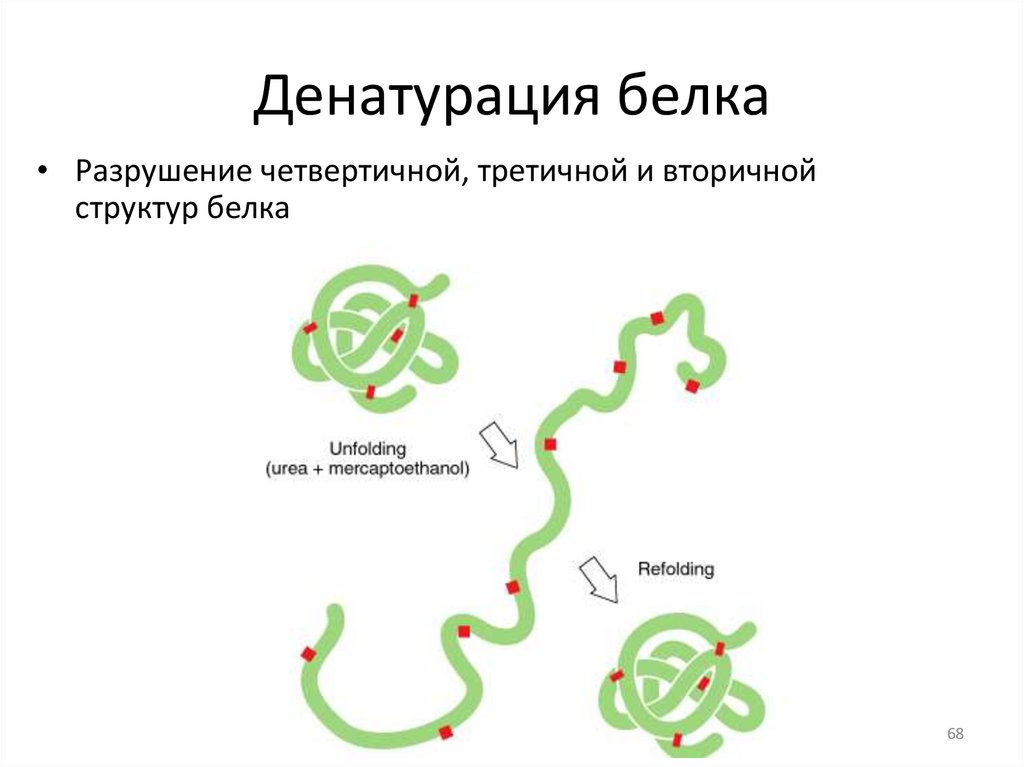
Денатурация белка• Разрушение четвертичной, третичной и вторичной
структур белка
68
68.
ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ БЕЛКОВФизические факторы
Химические факторы
1. Высокие температуры. Для
1. Концентрированные кислоты и
разных белков характерна
щелочи. Например,
различная чувствительность к
трихлоруксусная кислота,
тепловому воздействию. Часть
белков подвергается денатурации азотная кислота.
2. Соли тяжелых металлов
уже при 40-50°С. Такие белки
(например, CuS04).
называют термолабильными.
Другие белки денатурируют при З. Органические растворители
гораздо более высоких
(этиловый спирт, ацетон)
температурах, они являются
4.Растительные алкалоиды.
термостабильными.
5.Мочевина в высоких
2. Ультрафиолетовое облучение концентрациях
З. Рентгеновское и
радиоактивное облучение
4.Ультразвук
5.Механическое воздействие
(например, вибрация).
69.
СтГМУ,кафедра
клинической
фармакологии
с курсом ДПО
70
70.
7171.
7272.
7373.
Спасибо за внимание!74

















































 chemistry
chemistry








