Similar presentations:
Аминокислоты. Белки
1.
«Уральский государственный медицинский университет»Министерства здравоохранения Российской Федерации
Кафедра общей химии
АМИНОКИСЛОТЫ.
БЕЛКИ
Преподаватель: Катаева Н.Н.
2. АМИНОКИСЛОТЫ (АК)
-органические соединения, в состав которыхвходят карбоксильная группа и аминогруппа
3.
Классификация аминокислотI. По происхождению АК бывают:
природные и синтетические.
II. Природные АК можно условно разделить на:
- аминокислоты – мономеры пептидов и белков;
- «свободные» аминокислоты.
4.
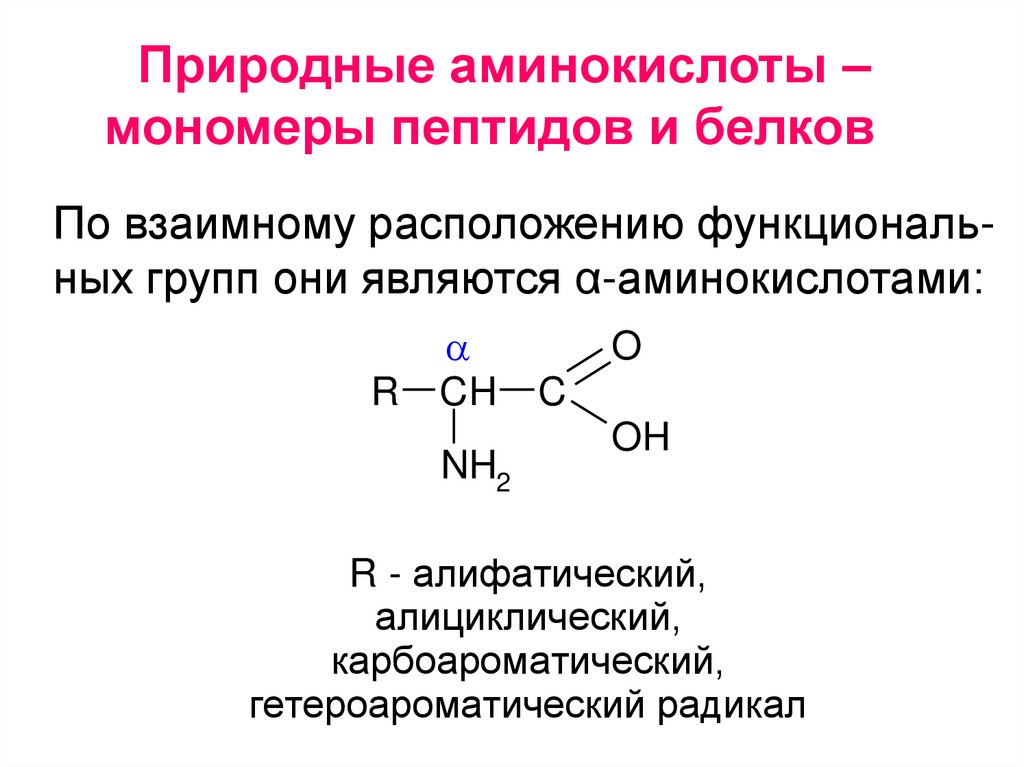
Природные аминокислоты –мономеры пептидов и белков
По взаимному расположению функциональных групп они являются α-аминокислотами:
R
CH
NH2
O
C
OH
R - алифатический,
алициклический,
карбоароматический,
гетероароматический радикал
5.
Все α-аминокислоты (кроме глицина) могутсуществовать в виде двух зеркальных
изомеров (D и L) – энантиомеров.
COOH
COOH
H
C*
NH2
H2N
C*
H
R
R
D-аминокислота
L-аминокислота
6.
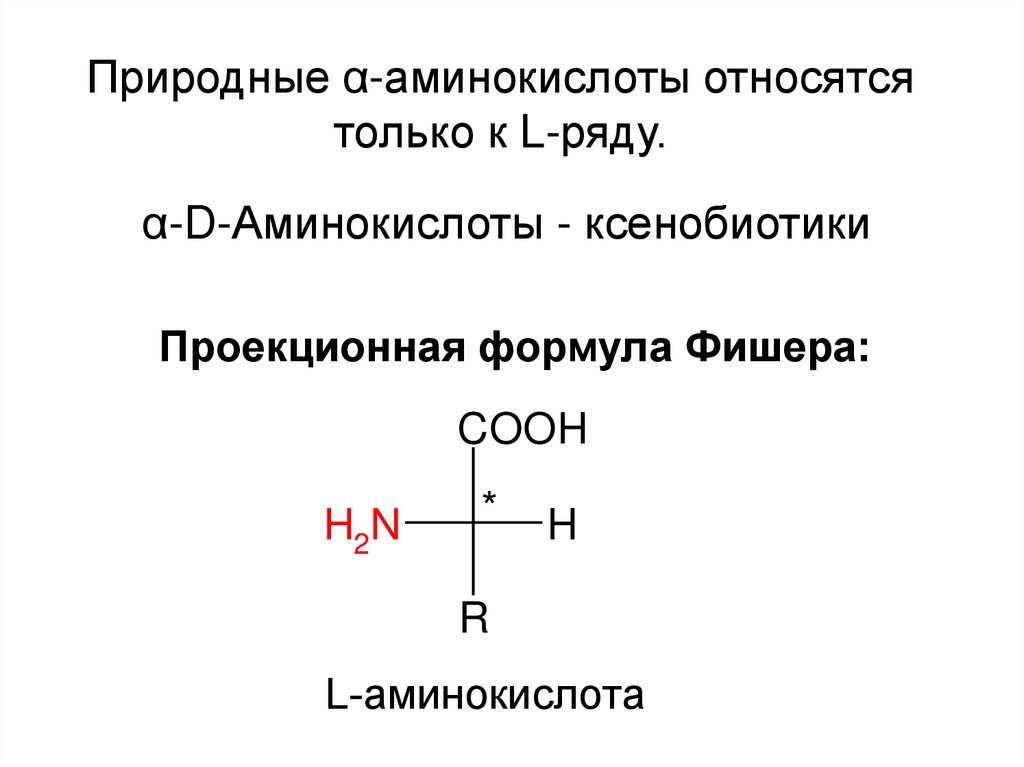
Природные α-аминокислоты относятсятолько к L-ряду.
α-D-Аминокислоты - ксенобиотики
Проекционная формула Фишера:
COOH
H2N
*
H
R
L-аминокислота
7.
20 L-аминокислот(по биологической ценности)
заменимые
незаменимые*
валин
изолейцин,
лейцин,
треонин,
метионин,
лизин,
фенилаланин,
триптофан
+ аргинин,
гистидин (у детей)
8.
Кислотно-основные свойства АКВ зависимости от числа кислотных и основных
функциональных групп АК делятся на:
- нейтральные (1 -NH2 + 1 -COOH);
- кислые (1 -NH2 + 2 -COOH): аспарагиновая
и глутаминовая кислоты;
-основные (2 -NH2 + 1 -COOH): аргинин,
гистидин, лизин.
9.
АК – амфотерные вещества, в твердомсостоянии всегда существуют в виде
биполярного иона:
O
O
R
CH
NH2
C
R
OH
CH C
+
NH3
_
O
биполярный ион
"цвиттер-ион"
В растворе существование АК в виде
биполярного иона зависит от рН среды.
10.
Для каждой АК существует определенноезначение рН, называемое изоэлектрической
точкой (pI), при котором содержание в
растворе биполярного иона максимально.
Для нейтральных АК pI~6 находится в
слабокислой области.
Для кислых АК pI~3 находится в
сильно кислой среде.
Для оснóвных АК pI~9 находится в
щелочной среде.
11.
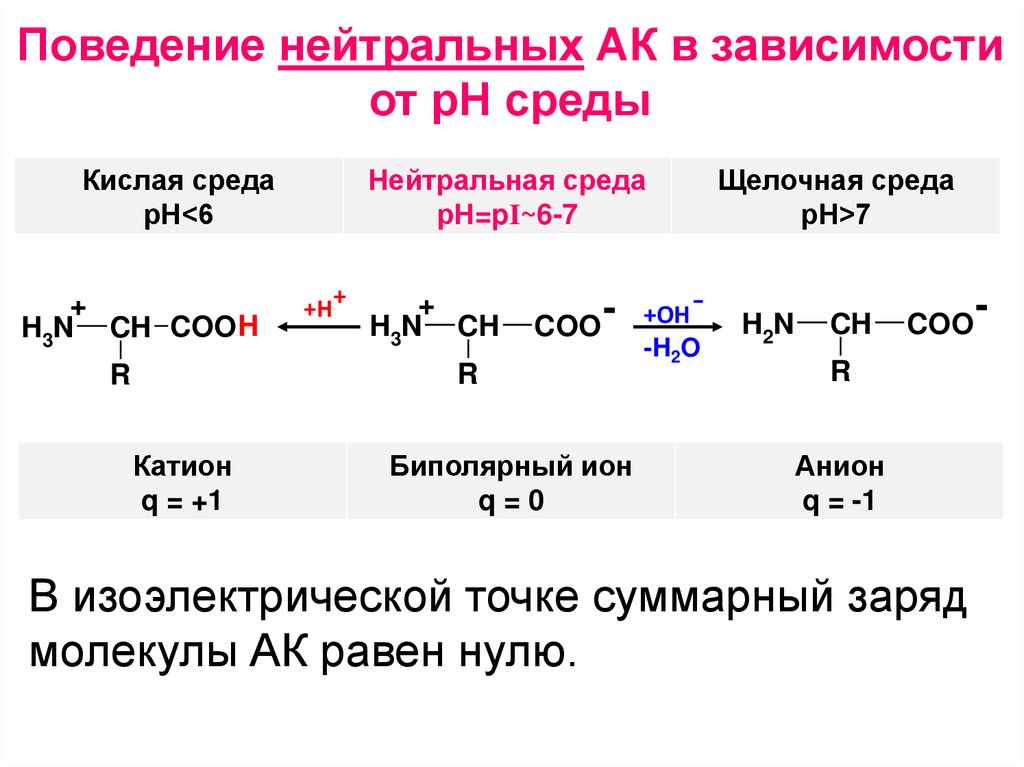
Поведение нейтральных АК в зависимостиот рН среды
Кислая среда
рН<6
+
H3N CH COOH
Нейтральная среда
рН=pI~6-7
+Н+
+
H3N CH
COO
R
R
Катион
q = +1
Биполярный ион
q=0
+ОН -H2O
Щелочная среда
рН>7
H2N
CH
COO
R
Анион
q = -1
В изоэлектрической точке суммарный заряд
молекулы АК равен нулю.
-
12.
Поведение кислых АК в зависимостиот рН среды
Сильнокислая
среда
рН=1-3
Слабокислая
среда
рН=pI~3
COOH
+
NH3
+
NH3
Нейтральная
среда
рН~6-7
COO CH
+
+ОН NH
CH2
CH2
-H2O
COOH
COOH
CH
Катион
q = +1
+Н+
Биполярный ион
q=0
COO 3
CH
CH2
COO-
Анион
q = -1
Щелочная среда
рН>7
+ОН -H2O
COO H2N CH
CH2
COO-
Анион
q = -2
13.
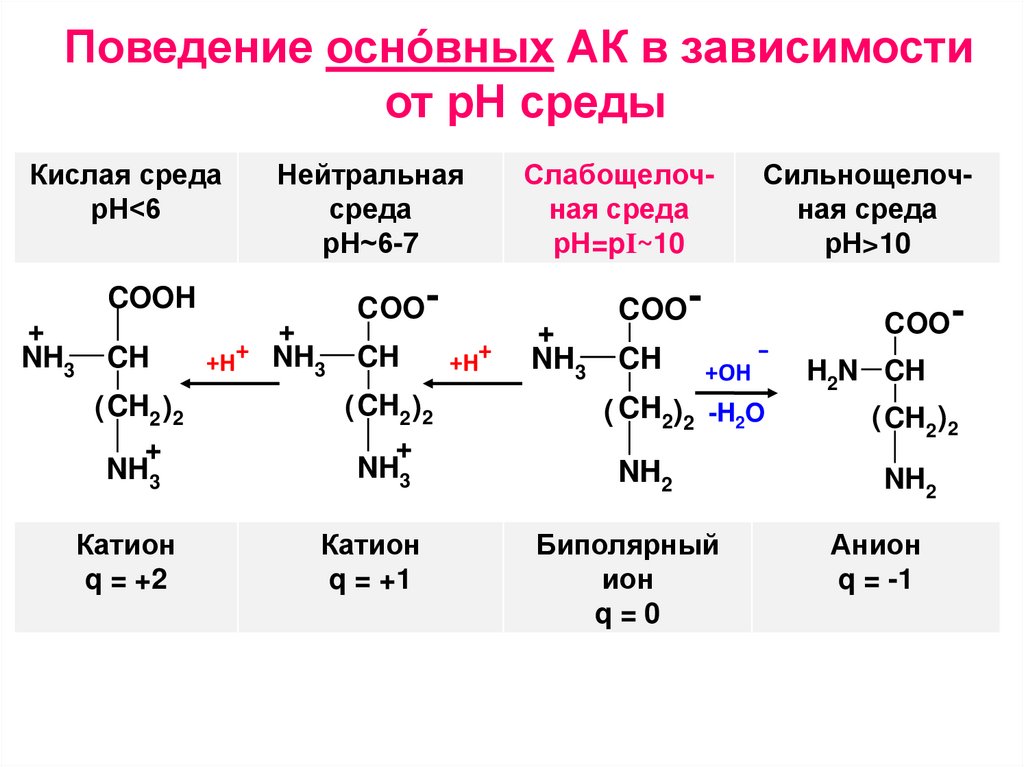
Поведение оснóвных АК в зависимостиот рН среды
Кислая среда
рН<6
Нейтральная
среда
рН~6-7
COOH
+
NH3
CH
+
+Н+ NH3
COO CH
( CH2 )2
+
NH3
( CH2 )2
+
NH3
Катион
q = +2
Катион
q = +1
+Н+
Слабощелочная среда
рН=pI~10
Сильнощелочная среда
рН>10
COO -
COO -
+
NH3
CH
+ОН
-
H2N CH
( CH2)2 -H2O
( CH2 )2
NH2
NH2
Биполярный
ион
q=0
Анион
q = -1
14.
Химические свойства АК1. in vitro
а) реакции по NH2-группе:
- с кислотами;
- с галогеналканами (алкилирование);
- с галогенангидридами карбоновых
кислот (ацилирование).
б) реакции по COOH-группе:
- с акт. Ме, основными оксидами, основаниями;
- со спиртами (этерификация);
- с аммиаком;
- декарбоксилирование.
15.
в) качественные реакции:- α-АК + нингидрин=сине-фиолетовое окраш.
O
OH
OH
O
нингидрин
- ксантопротеиновая реакция – качественная реакция
на (карбо- и гетеро-) ароматические АК:
Ar-АК + HNO3 (конц.) = желтое окрашивание
16.
2. in vivoа) декарбоксилирование (при участии ф.
декарбоксилазы + кофермента: вит. В6) с
образованием биогенных аминов
HO CH2 CH COOH
ф., В6
HO CH2 CH2 NH2 + CO2
NH2
коламин
серин
HOOC
CH2 CH2 CH COOH
NH2
глутаминовая кислота
ф., В6
HOOC
CH2 CH2 CH2
NH2 + CO2
-аминомасляная кислота
(ГАМК)
17.
CH2 CH COOHN
N
H
ф., В6
NH2
CH2 CH2 NH2 + CO2
N
N
H
гистидин
гистамин
б) трансаминирование (переаминирование) –
взаимное превращение амино- и кетокислот.
R1 CH C
NH2
O
OH
+ R2 C
O
C
O
OH
ф., В6
R1 C
O
C
O
OH
+ R2 CH C
NH2
O
OH
1) аланин + ЩУК ↔ ПВК + аспарагиновая к-та
2) аланин + α-кетоглутаровая к-та ↔ ПВК + глутаминовая
3) аспарагиновая к-та + α-кетоглутаровая к-та ↔
ЩУК + глутаминовая к-та
18.
в) окислительное дезаминированиеНАД+
HOOC
CH2 CH2 CH COOH
NH2
НАДН + Н+
глутаминовая кислота
H2O
NH3
HOOC
CH2 CH2 C COOH
O
-кетоглутаровая кислота
HOOC
CH2 CH2 C
COOH
NH
иминоглутаровая кислота
19.
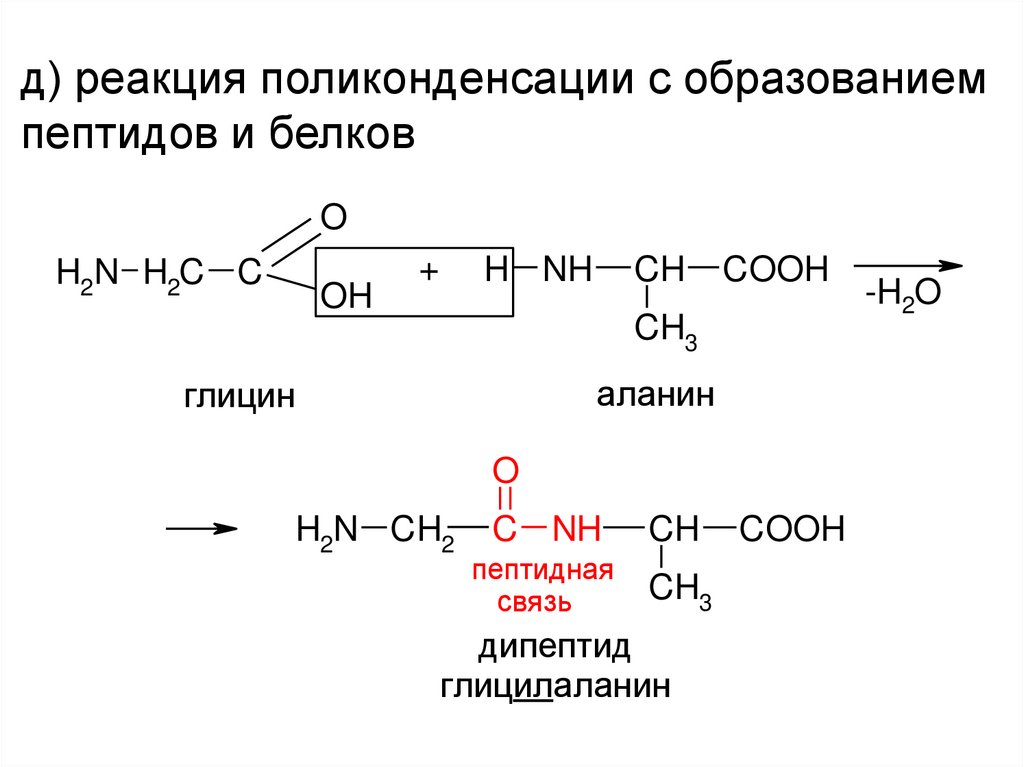
д) реакция поликонденсации с образованиемпептидов и белков
O
H2N H2C C
OH
+
H NH
CH
COOH
CH3
аланин
глицин
O
H2N CH2
C NH
CH
пептидная
связь
CH3
дипептид
глицилаланин
COOH
-H2O
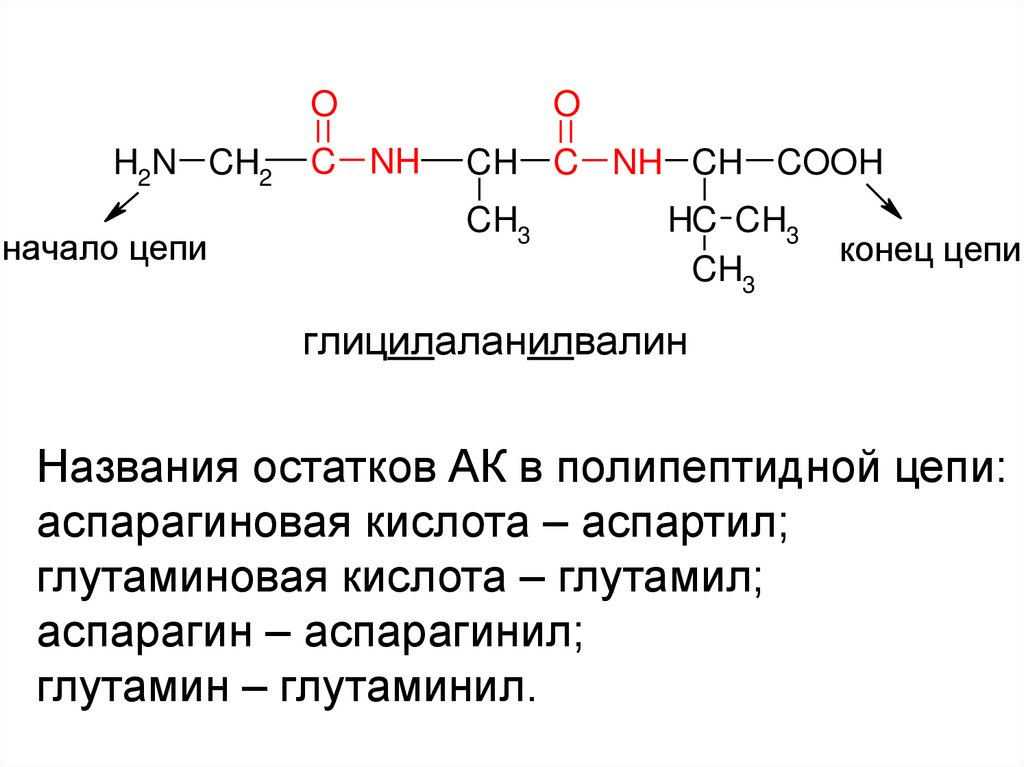
20.
OH2N CH2
начало цепи
C NH
O
CH C NH CH COOH
CH3
HC CH3
CH3
конец цепи
глицилаланилвалин
Названия остатков АК в полипептидной цепи:
аспарагиновая кислота – аспартил;
глутаминовая кислота – глутамил;
аспарагин – аспарагинил;
глутамин – глутаминил.
21.
Биологическое значение АК-Участвуют в биосинтезе белков, гормонов
(адреналина, тироксина), азотистых оснований
НК, медиаторов, нейромедиаторов, глюкозы
(при углеводном голодании);
-глутаминовая и аспарагиновая кислоты
участвуют в обезвреживании NH3;
-аминокислоты-лекарства: глицин, метионин,
глутаминовая к-та, цистеин, триптофан.
22.
ПЕПТИДЫ. БЕЛКИ- природные полимеры, состоящие из
большого числа аминокислотных остатков.
Пептиды, содержащие > 100 аминокислотных
остатков, относят к белкам.
В отличие от пептидов, белки имеют более
сложное строение и синтезируются только
на рибосомах с участием т-РНК.
23.
Классификация белковI. В зависимости от химического состава:
простые белки (только из остатков α-АК)
и сложные белки (+ небелковая часть)
II. Сложные белки можно разделить на:
- гликопротеины (+ углевод);
- нуклеопротеины (+ НК);
- липопротеины (+ липиды);
- гемопротеины (+ гем).
24.
Структурная организация белков1. Первичная структура белка
-это определенная последовательность аминокислотных остатков, связанных пептидной связью
H2N
начало цепи
N-конец
G
A
L
G
S
COOH
конец цепи
C-конец
Первичная структура белка поддерживается
ковалентными связями: пептидными и –S-Sсульфидными (за счет радикалов АК-цистеина)
25.
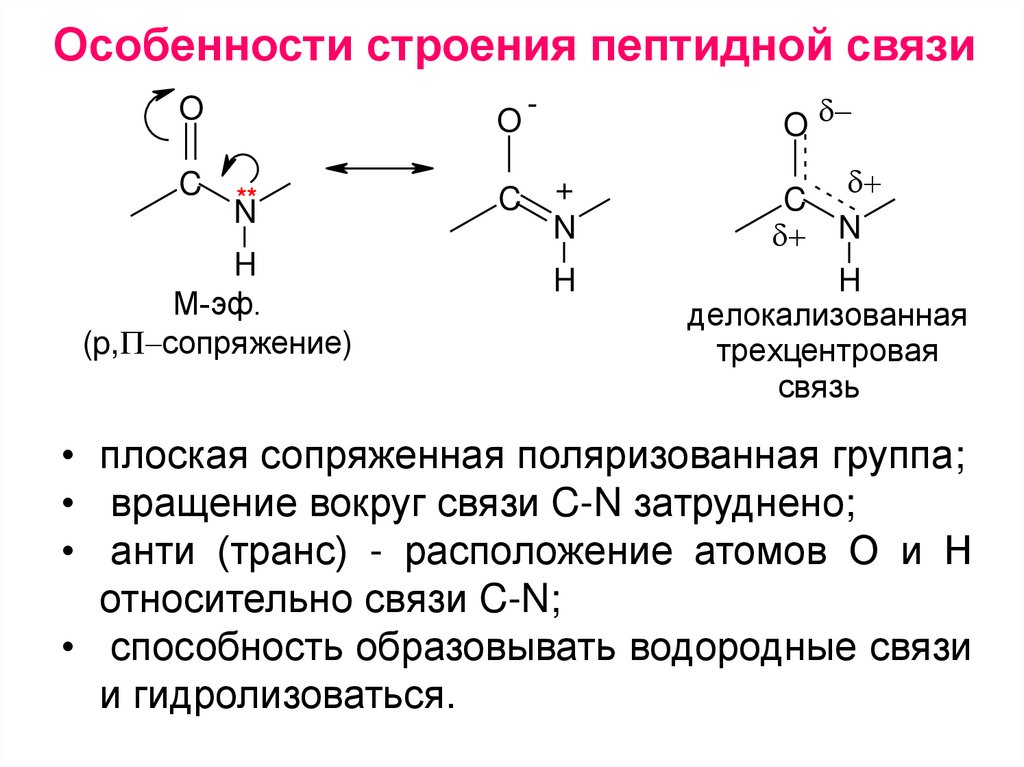
Особенности строения пептидной связиO
C
O
**
N
H
М-эф.
(p, сопряжение)
C
O
+
N
H
C
N
H
делокализованная
трехцентровая
связь
• плоская сопряженная поляризованная группа;
• вращение вокруг связи C-N затруднено;
• анти (транс) - расположение атомов О и Н
относительно связи C-N;
• способность образовывать водородные связи
и гидролизоваться.
26.
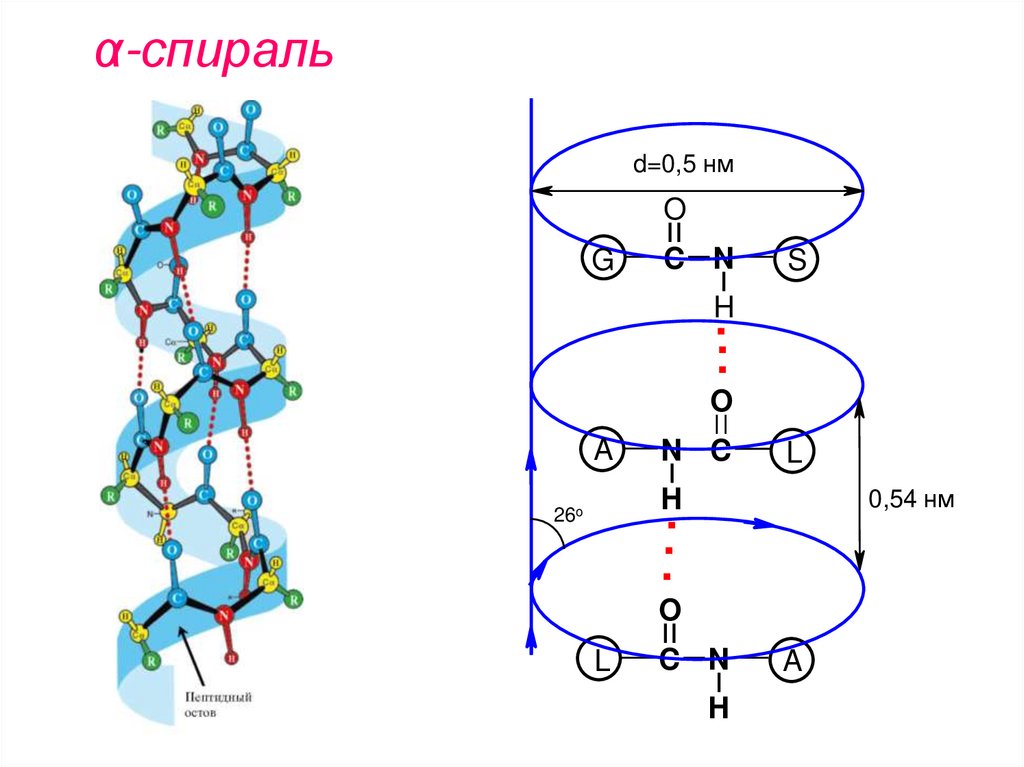
2. Вторичная структура белка- это форма различных участков полипептидной цепи в пространстве
α-спираль -закручивание полипептидной
цепи по часовой стрелке.
На виток спирали приходится 3,6 АК.
α-Спираль поддерживается водородными
связями, в образовании которых участвуют
пептидные группы.
Водородные связи располагаются ǁ оси
спирали, а R- АК – снаружи и ┴ оси спирали.
27.
α-спиральd=0,5 нм
O
G
C N
S
H
..
.
O
A
N C
L
0,54 нм
H
.
.
.
26o
O
L
C N
H
A
28.
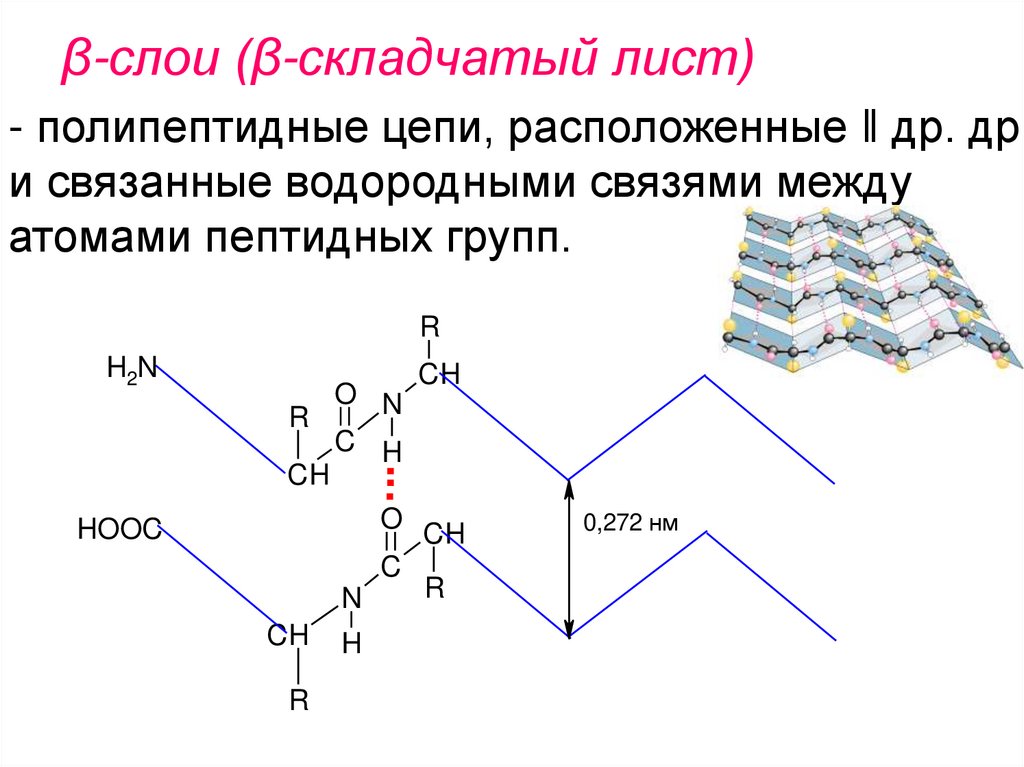
β-слои (β-складчатый лист)- полипептидные цепи, расположенные ǁ др. др.
и связанные водородными связями между
атомами пептидных групп.
R
H2N
O N
R
C H
..
CH
CH
.
O
HOOC
C
N
CH
R
H
CH
R
0,272 нм
29.
3. Третичная структура белка- определенное пространственное расположение элементов вторичной структуры белка.
Глобулярная третичная структура –
глобула (клубок) из α-спиралей.
Глобулярные белки растворимы в воде.
Фибриллярная третичная структура –
волокнистая структура из β-слоев.
Фибриллярные белки не растворимы в воде.
30.
В формировании третичной структуры белкаучаствуют следующие связи:
- водородные (между функциональными
группами боковых R или между ними и
пептидными группами);
- ионные (между ионогенными боковыми R:
асп-, глу-, тир-, цис-, арг+, лиз+, гис+);
- гидрофобное взаимодействие
(дисперсионные силы между алкильными
или карбоароматическими радикалами);
- ковалентные (дисульфидная связь).
31.
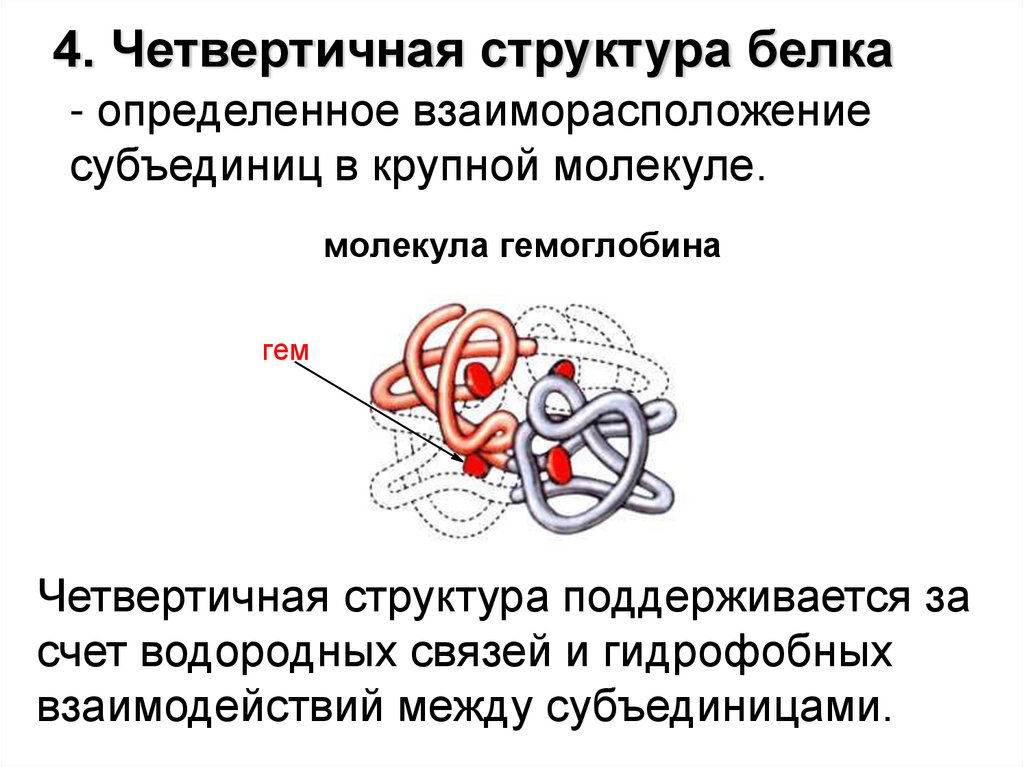
4. Четвертичная структура белка- определенное взаиморасположение
субъединиц в крупной молекуле.
молекула гемоглобина
гем
Четвертичная структура поддерживается за
счет водородных связей и гидрофобных
взаимодействий между субъединицами.
32.
Кислотно-основные свойства белковБелки – амфотерные соединения
Белки можно разделить на:
- нейтральные (-NH2 = -COOH)
- кислые (-COOH > -NH2 )
- основные (-NH2 > -COOH)
33.
Для каждого белка существует свояизоэлектрическая точка (pI), в которой
он электронейтрален.
В изоэлектрической точке белок имеет
наименьшую растворимость в воде.
При pH<pI белок заряжен «+», т.е. существует
в катионной форме и под действием
постоянного эл. тока будет двигаться к катоду.
При pH>pI белок заряжен «-», т.е. существует
в анионной форме и будет двигаться к аноду.
34.
На этом свойстве белков основан методэлектрофореза.
Электрофорез – направленное движение
белков от одного электрода к другому под
действием постоянного эл. тока.
Электрофорез используется для анализа,
очистки и разделения белков и АК; в
клинической диагностике; как метод лечения.
35.
Химические свойства белков1. Денатурация – разрушение четв., трет.,
вторич. структуры белка с сохранением
первичной.
Происходит при изменении Т, pH среды,
действии окислителей и восстановителей,
ионов тяжелых Ме, УФ, ультразвука, лазера.
Денатурация может быть обратимой (при Т↓)
и необратимой (при Т↑).
36.
2. Качественные реакции белкова) Биуретовая реакция – на обнаружение
пептидных связей
Белок + СuSO4 + NaOH = фиолетовое окр.
б) Ксантопротеиновая реакция – на
обнаружение в составе белка
ароматических радикалов АК (см. АК)
37.
Биологические функции белков-Каталитическая ( ферменты);
-Структурная (коллаген, эластин);
-Транспортная (гемоглобин);
-Регуляторная (белки-гормоны);
-Сигнальная (белки-рецепторы);
-Защитная (белки-антитела);
-Алиментарная (белки пищи)



























 chemistry
chemistry








