Similar presentations:
Аминокислоты – структурные единицы белков
1. Аминокислоты – структурные единицы белков
Строение, номенклатура, классификация,физические и химические свойства аминокислот.
Качественные реакции аминокислот.
2.
• Аминокислоты - это гетерофункциональныесоединения, содержащие в своем составе
аминогруппу -NH2 и карбоксильную группу -COOH
NH2 CH COOH
R
n NH2 CH COOH
NH CH CO
R
Аминокислота
Аминокилоты - структурные единицы белков. Лекция
R
n H2O
n
Белок
27.11.2018
3. Историческая справка
• В 1820 г французский ученый Анри Браколио,нагревая кожу, хрящи, сухожилия с водным раствором
серной кислоты, выделил сладкие белые кристаллы.
Вещество назвали гликокол и долгое время считали
углеводом. Впоследствии оно получило название
глицин.
• Глицин – простейшая аминокислота:
NH2 CH2 COOH
Историческая справка
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
4. Классификация АК (по положению аминогруппы)
• В зависимости от положения аминогруппыразличают α, β, γ, …ε – аминокислоты:
NH2 CH COOH
- α- аланин или 2 - аминопропановая кислота
CH3
NH2 CH2 CH2 COOH - β-аланин или 3 - аминопропановая кислота
NH2 CH2 CH2 CH2 COOH
- γ –аминомасляная кислота (ГАМК/GABA) –
нейромедиатор
α – Аминокислоты - структурные единицы белков
Существует 20 АК, которые входят в состав белков и кодируются
генами
Классификация АК (по положению аминогруппы)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
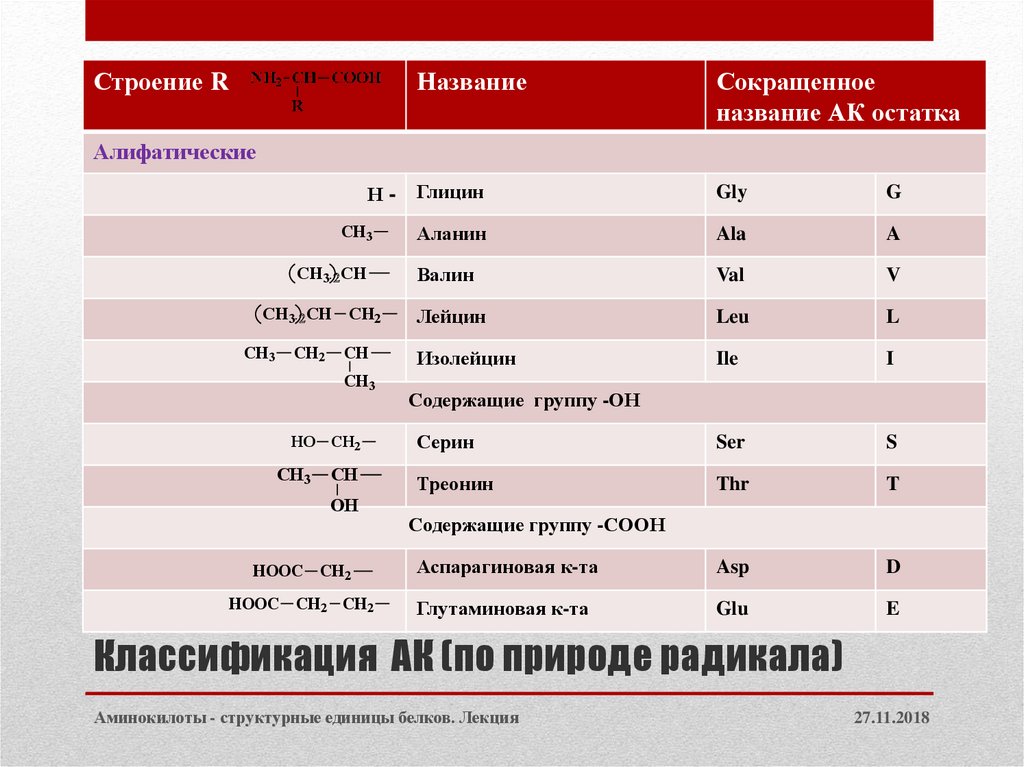
5. Классификация АК (по природе радикала)
Строение RНазвание
Сокращенное
название АК остатка
Глицин
Gly
G
Аланин
Ala
A
Валин
Val
V
Лейцин
Leu
L
Изолейцин
Ile
I
Серин
Ser
S
Треонин
Thr
T
Алифатические
НCH3
CH3 CH
CH3 CH CH2
CH3
CH2
CH
CH3
HO CH2
CH3
CH
OH
Содержащие группу -ОН
Содержащие группу -СООН
HOOC CH2
Аспарагиновая к-та
Asp
D
HOOC CH2 CH2
Глутаминовая к-та
Glu
E
Классификация АК (по природе радикала)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
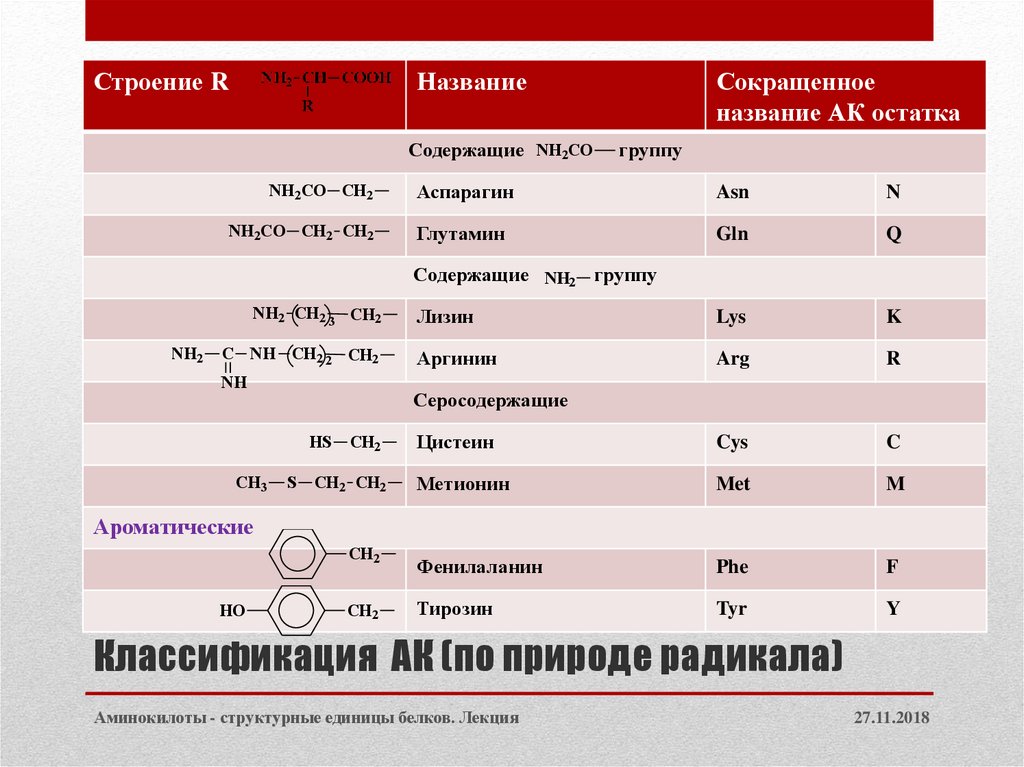
6. Классификация АК (по природе радикала)
Строение RНазвание
Содержащие NH2CO
NH2CO CH2
NH2CO CH2 CH2
Сокращенное
название АК остатка
группу
Аспарагин
Asn
N
Глутамин
Gln
Q
Лизин
Lys
K
Аргинин
Arg
R
Цистеин
Cys
C
Метионин
Met
M
Фенилаланин
Phe
F
Тирозин
Tyr
Y
Содержащие NH2 группу
NH2 CH2 3 CH2
NH2
C NH CH2 2 CH2
NH
Серосодержащие
HS
CH3
S
CH2
CH2 CH2
Ароматические
CH2
HO
CH2
Классификация АК (по природе радикала)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
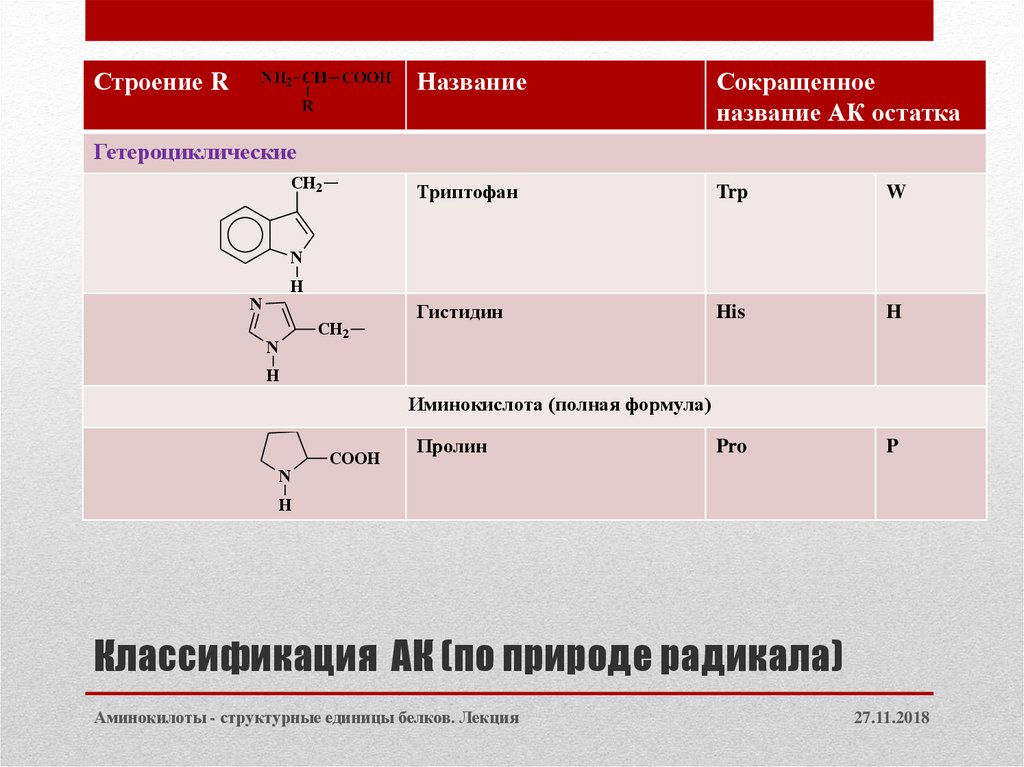
7. Классификация АК (по природе радикала)
Строение RНазвание
Сокращенное
название АК остатка
Триптофан
Trp
W
Гистидин
His
H
Pro
P
Гетероциклические
CH2
N
H
N
N
CH2
H
Иминокислота (полная формула)
N
COOH
Пролин
H
Классификация АК (по природе радикала)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
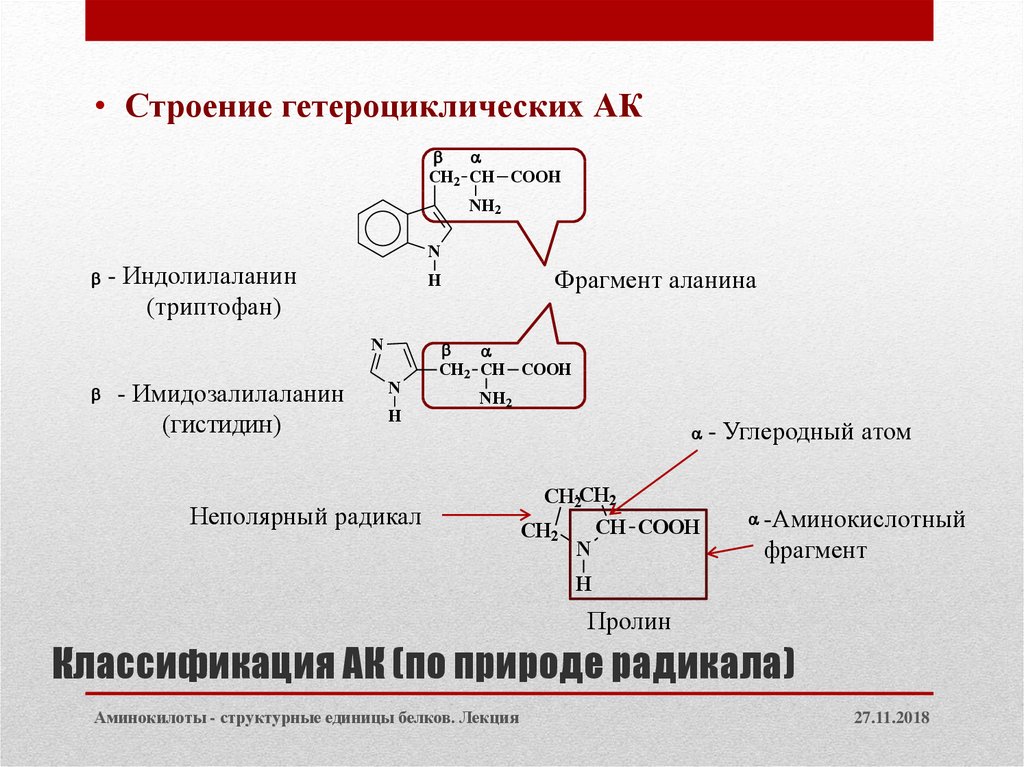
8. Классификация АК (по природе радикала)
• Строение гетероциклических АКCH2 CH COOH
NH2
N
- Индолилаланин
(триптофан)
N
- Имидозалилаланин
(гистидин)
Фрагмент аланина
H
N
H
CH2 CH COOH
NH2
Неполярный радикал
CH2CH2
CH COOH
CH2
N
- Углеродный атом
-Аминокислотный
фрагмент
H
Пролин
Классификация АК (по природе радикала)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
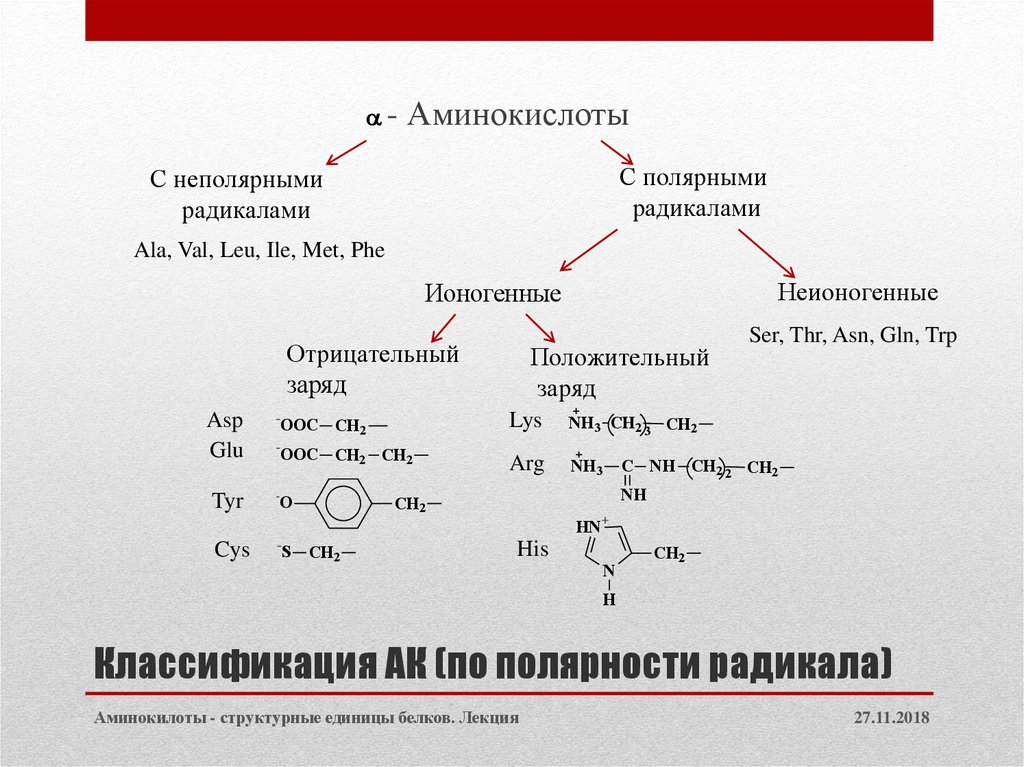
9. Классификация АК (по полярности радикала)
-Аминокислоты
С полярными
радикалами
С неполярными
радикалами
Ala, Val, Leu, Ile, Met, Phe
Неионогенные
Ионогенные
Отрицательный
заряд
Asp
Glu
-
Tyr
-
-
Положительный
заряд
OOC CH2
Lys
NH3 CH2 3 CH2
OOC CH2 CH2
Arg
NH3
O
-
S
CH2
C NH CH2 2 CH2
NH
CH2
HN
Cys
Ser, Thr, Asn, Gln, Trp
+
His
N
CH2
H
Классификация АК (по полярности радикала)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
10. Классификация АК (по биологической функции)
-Аминокислоты
Незаменимые
Заменимые
Синтезируются организмом
Не могут быть синтезированы
организмом из веществ,
поступающих с пищей, в количествах,
достаточных для того, чтобы удовлетворить
физиологические потребности организма
Ile, Leu, Val, Lys, Met, Phe, Tre, Trp (Arg, His, Tyr)
Классификация АК (по биологической функции)
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
11. Стереоизомерия АК
NH2 CH COOHCOOH
R
NH2
H
COOH
H
NH2
R
L- -аминокислота
COOH
H2N
H
CH3
C2H5
L - изолейцин
H
H
H
OH
CH3
L - треонин
NH2
COOH
H2N
CH3
H
C2H5
D - изолейцин
COOH
H2N
D- -аминокислота
COOH
H
H
R
NH2
HO
H
CH3
D - треонин
H
CH3
CH3
C2H5
L – алло-изолейцин
H2N
HO
H
H
CH3
L – алло-треонин
NH2
H
C2H5
D – алло- изолейцин
COOH
COOH
H
H
COOH
COOH
H
H
NH2
OH
CH3
D – алло-треонин
Стереоизомерия АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
12. Некоторые биологически важные АК
• Некоторые АК, которые не кодируются генами, но образуются,например, в результате пострансляционной модификации, тоже
могут входить в состав белков, а также могут выполнять роль
медиаторов – участвовать в биохимических процессах:
- аланин
NH2 CH2 CH2 COOH
таурин
NH2 CH2 CH2 SO3H
-аминомасляная к-та
NH2 CH2 CH2 CH2
ГАМК
-аминомасляная к-та NH2
входит в состав кофермента А
участвует в образовании желчных к-т,
нейромедиатор, продукт метаболизма
цистеина
COOH
нейромедиатор
CH CH2
CH3
COOH конечный продукт
катаболизма НК
Гомоцистеин
HS
CH2 CH2 CH
NH2
COOH
участвует в биосинтезе
цистеина
Гомосерин
HO CH2 CH2 CH
NH2
COOH
Орнитин
NH2 CH2 CH2 CH COOH
NH2
- в метаболизме
аспарагиновой к-ты
и метионина
- в метаболизме аргинина
Некоторые биологически важные АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
13. Некоторые биологически важные АК
3,4- Дигидроксифенилаланинпредшественник меланина и
(ДОФА)
катехоламинов: дофамина,
HO
CH2 CH COOH норадреналина и адреналина
NH2
HO
3-йодтирозин
HO
I
предшественник тироидных
гормонов (н-р тироксина)
CH2 CH COOH
NH2
HO
NH2 CH2 CH CH2 CH2 CH COOH
OH
NH2
5-гидроксилизин
NH
входят в состав
COOH коллагена
4-гидроксипролин
CH CH2 CH COOH участвует в процессе свертывания крови:
связывание ионов кальция
NH2
COOH
протромбин
тромбин
4-карбоксиглутаминовая к-та
HOOC
Некоторые биологически важные АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
14. Кислотно-основные свойства АК
+H
NH3 CH COOH
+
R
H
Катионная форма
-
NH3 CH COO
R
+
H
H+
Биполярный ион
NH2 CH COO
R
Анионная форма
• Изоэлектрическая точка – pI – значение рН при котором
концентрация биполярных ионов максимальна. Заряд АК в
изоэлектрической точке равен нулю.
pI =
pKa n
pKa (n+1)
2
, где n – максимальное число положительных зарядов
в полностью протонированной АК
Кислотно-основные свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
15. Кислотно-основные свойства АК
Серин+
NH3 CH COOH
H
CH2OH
H
-
NH3 CH COO
+
pKa1
+
H
+
NH2 CH COO
H
CH2OH
CH2OH
pKa2 9,2
2,2
pI 5,7
Аспарагиновая кислота
NH3 CH COOH
CH2
COOH
+
H
NH3 CH COO
H+
CH2
H+
H+
pKa1
pKa2
2,1
NH3 CH COO
CH2
H+
COO-
COOH
+
H
-
3,9
NH2 CH COO
CH2
-
pKa3 9,8
COO
pI 3,0
Кислотно-основные свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
16. Химические свойства АК
• 1. Реакции с участием карбоксильных групп:NaOH
R-CH-COOH
R-CH-COONa
- H 2O
NH2
NH2
R-CH-C
O
OH
..
..
CH3OH
R-CH-C
OH
NHCOCH3
R-CH-C
HCl
NH2
O
O
Cl
O
S Cl
- SO2, - HCl
O
R-CH-C ..
O
OH C2H5O C
Cl
NHCOCH3
- HCl
O
NH3
OCH3
-NH4Cl
NH3Cl
R-CH-C
R-CH-C
OCH3
NH2
O
Cl
NHCOCH3
O
O
R-CH-C O C OC2H5
NHCOCH3
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
17. Химические свойства АК
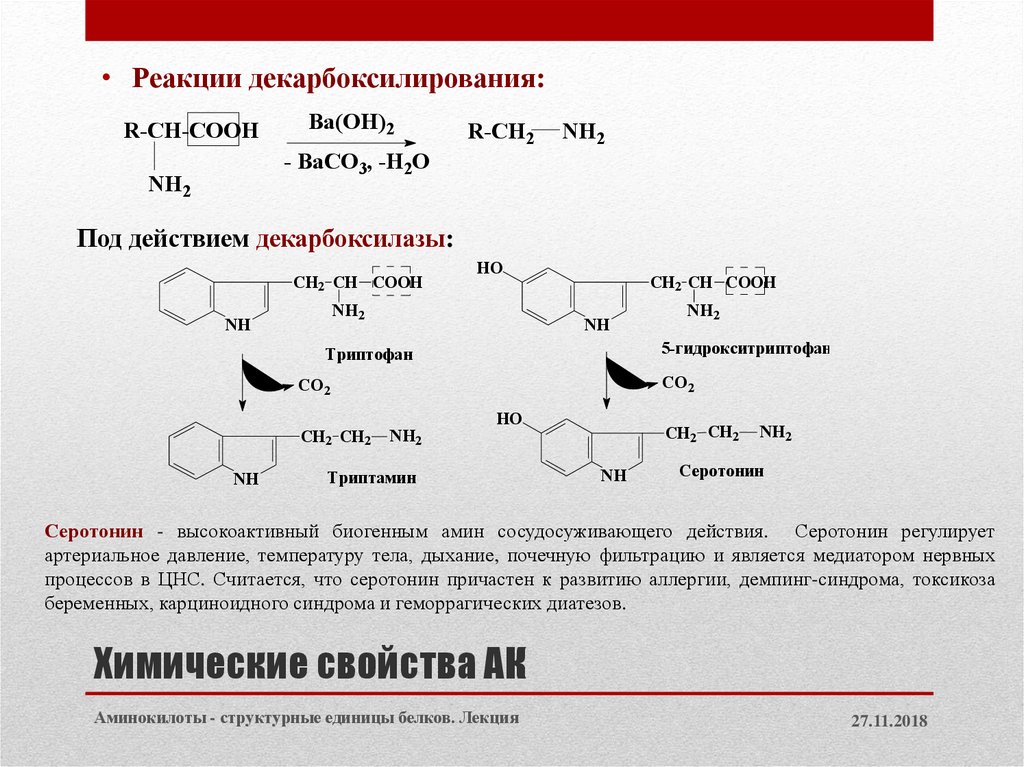
• Реакции декарбоксилирования:R-CH-COOH
Ba(OH)2
R-CH2
NH2
- BaCO3, -H2O
NH2
Под действием декарбоксилазы:
CH2 CH COOH
HO
NH2
NH
CH2 CH COOH
NH
5-гидрокситриптофан
Триптофан
CO2
CO2
CH2 CH2
NH
NH2
NH2
HO
Триптамин
CH2 CH2
NH
NH2
Серотонин
Серотонин - высокоактивный биогенным амин сосудосуживающего действия. Серотонин регулирует
артериальное давление, температуру тела, дыхание, почечную фильтрацию и является медиатором нервных
процессов в ЦНС. Считается, что серотонин причастен к развитию аллергии, демпинг-синдрома, токсикоза
беременных, карциноидного синдрома и геморрагических диатезов.
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
18. Химические свойства АК
NCH2 CH
COOH
NH2
NH
Гистидин
CO2
N
CH2
NH
CH2
NH2
Гистамин
Глутаматдекарбоксилаза –
высокоспецифичный фермент:
HOOC
CH2 CH2 CH COOH
Глутаминовая к-та
NH2
CO2
HOOC
CH2 CH2 CH2 NH2
-аминомаслянная к-та
(ГАМК)
Гистамин оказывает широкий спектр биологического действия.
Обладает сосудорасширяющим свойством. Большое количество
гистамина образуется в области воспаления; вызывая расширение
сосудов в очаге воспаления, гистамин тем самым ускоряет приток
лейкоцитов, способствуя активации защитных сил организма. Кроме
того, гистамин участвует в секреции соляной кислоты в желудке, что
широко используется в клинике при изучении секреторной
деятельности желудка (гистаминовая проба). Он имеет прямое
отношение к явлениям сенсибилизации и десенсибилизации.
При повышенной чувствительности к гистамину в клинике
используют антигистаминные препараты (санорин, димедрол и др.),
оказывающие влияние на рецепторы сосудов.
Гистамину приписывают также роль медиатора боли.
Болевой синдром – сложный процесс, детали которого пока не
выяснены, но участие в нем гистамина не подлежит сомнению.
Интерес к ГАМК объясняется ее тормозящим действием на
деятельность ЦНС. ГАМК используется в клинике как лекарственное
средство при некоторых заболеваниях ЦНС, связанных с резким
возбуждением коры большого мозга. Так, при эпилепсии хороший
эффект (резкое сокращение частоты эпилептических припадков) дает
введение глутаминовой кислоты. Как оказалось, лечебный эффект
обусловлен не самой глутаминовой кислотой, а продуктом ее
декарбоксилирования – ГАМК.
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
19. Химические свойства АК
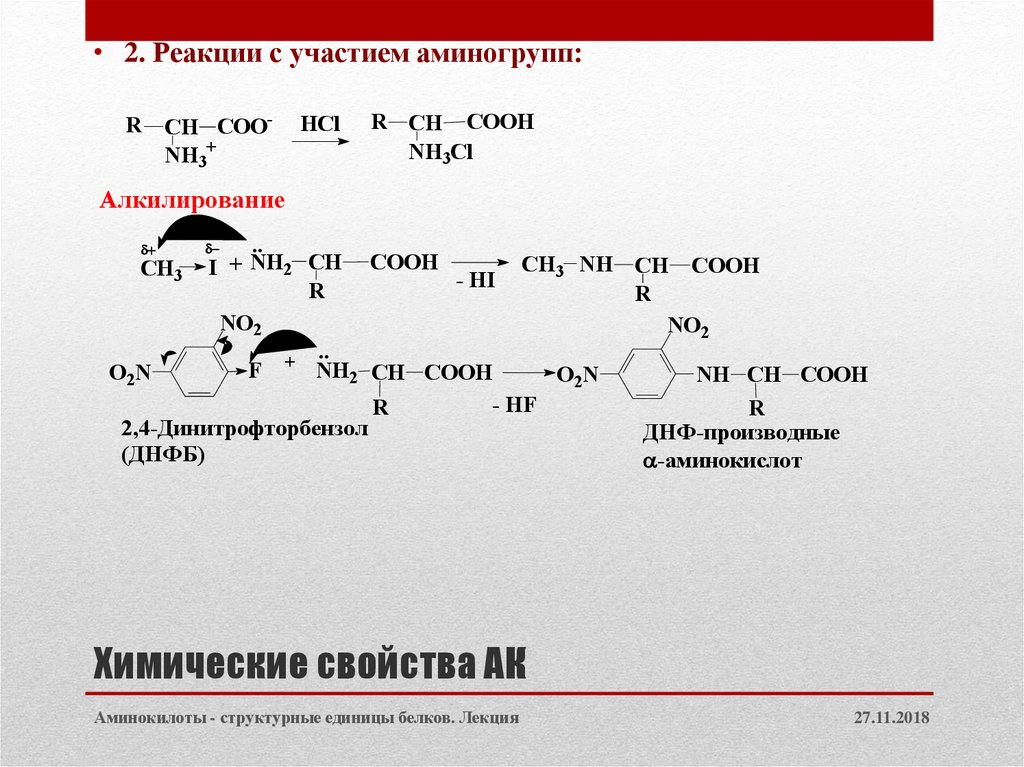
• 2. Реакции с участием аминогрупп:R
CH COONH3+
HCl
R CH COOH
NH3Cl
Алкилирование
..
NH
COOH
+
CH3 NH CH COOH
2 CH
CH3 I
HI
R
R
NO2
NO2
..
F + NH2 CH COOH
O2N
O2N
NH CH COOH
- HF
R
R
2,4-Динитрофторбензол
ДНФ-производные
(ДНФБ)
-аминокислот
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
20. Химические свойства АК
АцилированиеR C
O
Cl
+ NH2 CH
..
R
O
COOH
R C NH CH COOH
- HCl
R
..
H2N CH COOH
R
C6H5 CH2 O C
O
O
C6H5 CH2 O C NH CH COOH
R
H2/Pd
Cl
- HCl
H2N CH COOH + CO2 + C6H5 CH3
R
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
21. Химические свойства АК
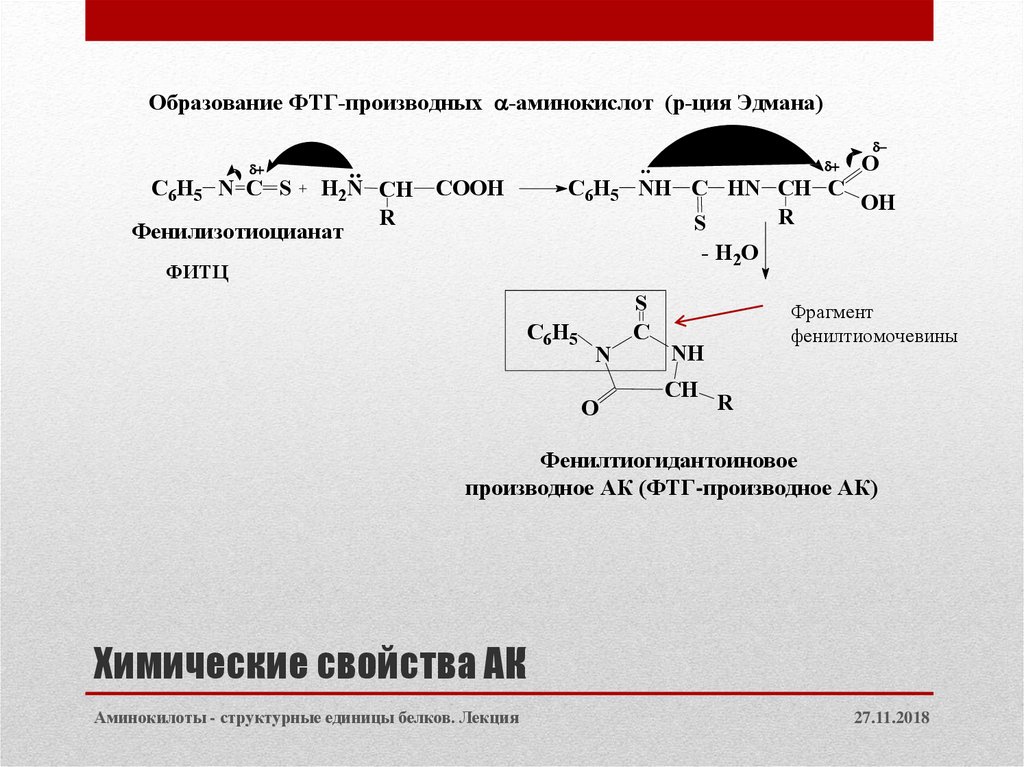
Образование ФТГ-производных -аминокислот (р-ция Эдмана)C6H5 N C S
H2N CH
R
Фенилизотиоцианат
COOH
O
C6H5 NH C HN CH C
OH
R
S
- H 2O
ФИТЦ
C6H5
N
O
S
C
Фрагмент
фенилтиомочевины
NH
CH
R
Фенилтиогидантоиновое
производное АК (ФТГ-производное АК)
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
22. Химические свойства АК
• Реакции дезаминирования:Метод Ван-Слайка
R CH COOH
NH2
HNO2
R CH COOH
OH
N2 H2O
Восстановительное дезаминирование
R CH COOH H2/Pd R CH2 COOH
NH2
Гидролитическое дезаминирование
HO
R CH COOH 2
R CH COOH
NH2
OH
NH3
NH3
Внутримолекулярное дезаминирование
R
CH2 CH COOH
NH2
R CH CH
COOH
NH3
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
23. Химические свойства АК
Окислительное дезаминирование[O]
R CH COOH
R C COOH
NH2
O
NH3
НАД+
HOOC CH2 CH2 CH COOH
HOOC CH2 CH2 C COOH
+
НАДН H
NH2
NH
глутаминовая к-та
иминоглутаровая к-та
H2O
HOOC CH2 CH2 C COOH
HOOC CH2 CH2 C COOH
NH3
NH
O
иминоглутаровая к-та
-оксоглутаровая к-та
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях
рН специфический фермент - глутаматдегидрогеназа, катализирующий окислительное
дезаминирование L-глутаминовой кислоты. В качестве кофермента глутаматдегидрогеназа содержит
НАД (или НАДФ). Первая стадия окисления глутаминовой кислоты аналогична реакции
окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых
ферментов и цитохромной системы с образованием конечного продукта воды. Образовавшийся аммиак
благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного
НАДФН может участвовать в синтезе глутамата из α-кетоглутаровой кислоты. Различают три разных
типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ
(клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и
грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
24. Химические свойства АК
Неокислительное дезаминированиеCH2 OH
H2O H2O
CH NH2
COOH
NH3
CH OH
CH
NH2
COOH
треонин
H2O H2O
NH3
H2O
H2S
C O
серин
CH3
CH3
CH NH2
COOH
пировиноградная к-та
CH3
CH2
CH
CH2 SH
NH2
COOH
2-оксобутановая к-та
NH3
COOH
цистеин
В животных тканях и печени человека
открыты также три специфических фермента (серини треонин-дегидратазы и цистатионин-γ-лиаза),
катализирующие неокислительное дезаминирование
соответственно серина, треонина и цистеина.
Конечными
продуктами
реакции
являются пируват и α-кетобутират, аммиак и
сероводород. Поскольку указанные ферменты
требуют присутствия пиридоксальфосфата в
качестве кофермента, реакция неокислительного
дезаминирования, вероятнее всего, протекает с
образованием
шиффовых
оснований
как
промежуточных метаболитов.
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
25. Химические свойства АК
• 3. Реакции с участием и карбоксильных и аминогрупп:Реакция трансаминирования (переаминирования)
донорная -аминокислота
HOOC CH2 CH COOH
NH2
L-аспарагиновая к-та
акцепторная -оксокислота
HOOC CH2 CH2 C COOH
O
-оксоглутаровая к-та
трансаминаза
пиридоксальфосфат
HOOC CH2 C COOH
O
щавелевоуксусная к-та
акцепторная -оксокислота
HOOC CH2 CH2 CH COOH
NH2
L-глутаминовая к-та
донорная -аминокислота
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
26. Химические свойства АК
Образование дикетопиперазиновR CH
O
C OH
NH H
O
C NH
H NH
t0
CH R
CH R - 2H2O R CH
HO
NH C
C
O
O амидная связь
Образование пептидов
O
H2N CH C OH
R
O
H2N CH C NH CH COOH
H NH CH COOH
- H2O
R
R
R
пептидная связь
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
27. Химические свойства АК
• 4. Реакции с участием боковой цепи:Образование цистина:
дисульфидная связь
CH2
SH
2 CH NH2
COOH
цистеин
[O]
S
CH2
S
CH2
CH NH2
CH NH2
COOH
COOH
H2O
цистин
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
28. Химические свойства АК
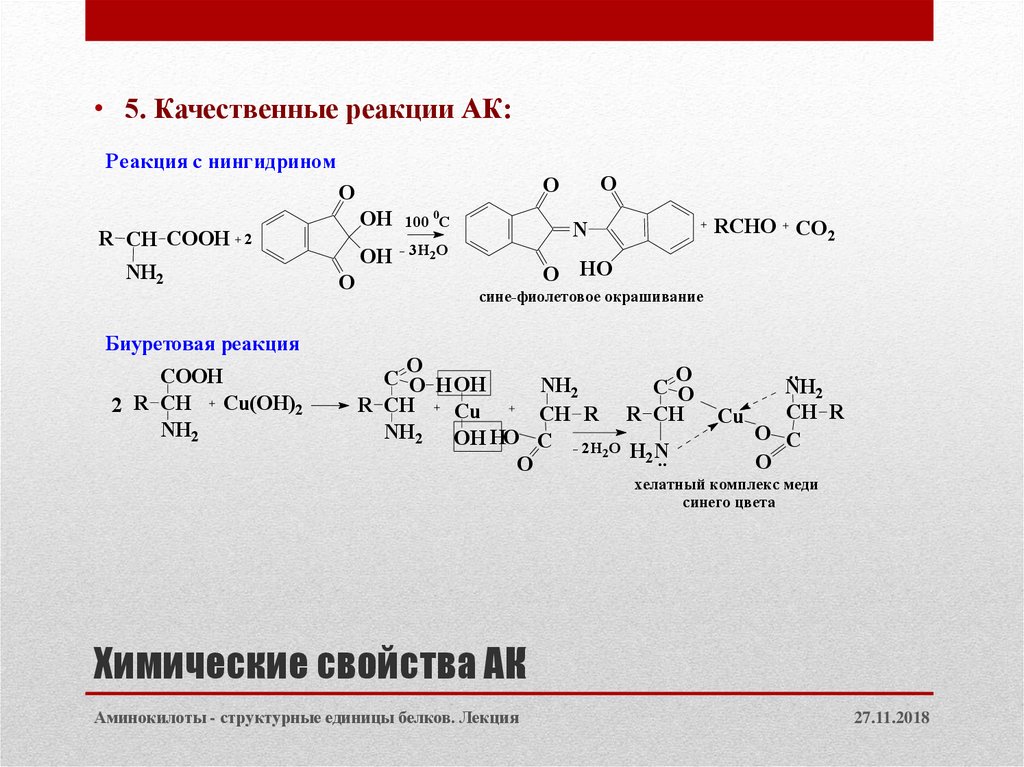
• 5. Качественные реакции АК:Реакция с нингидрином
R CH COOH
2
NH2
Биуретовая реакция
COOH
2 R CH Cu(OH)2
NH2
O
O
O
O
OH
100 С
OH
- 3H2O
0
RCHO CO2
N
O HO
сине-фиолетовое окрашивание
O
O
C O H OH
NH2
C O
R CH
Cu
CH R R CH
NH2 OH HO C
- 2H2O H N
2 ..
O
..
NH2
CH R
Cu
O C
O
хелатный комплекс меди
синего цвета
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
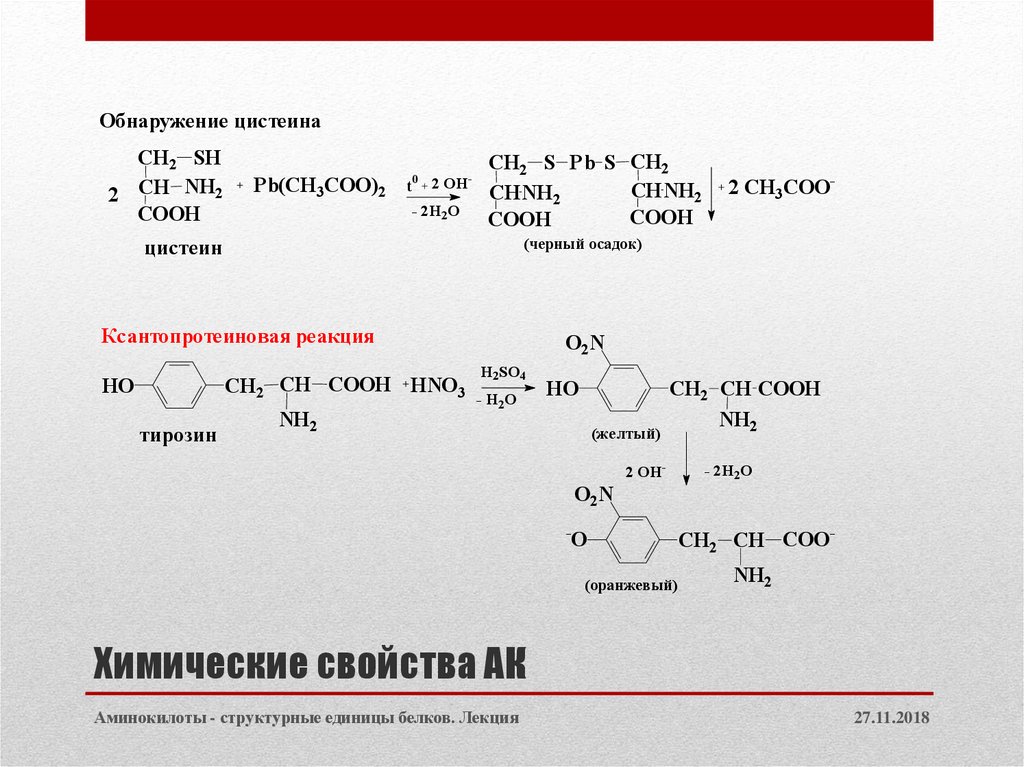
29. Химические свойства АК
Обнаружение цистеинаCH2 SH
2 CH NH2
COOH
Pb(CH3COO)2
0
t
-
2 OH
- 2H2O
CH2 S Pb S CH2
CHNH2
CHNH2
COOH
COOH
(черный осадок)
цистеин
Ксантопротеиновая реакция
CH2 CH COOH HNO3
HO
тирозин
2 CH3COO-
NH2
O2N
H2SO4
- H2O
HO
(желтый)
CH2 CH COOH
NH2
2 OH-
- 2H2O
O2N
-
O
(оранжевый)
CH2 CH COONH2
Химические свойства АК
Аминокилоты - структурные единицы белков. Лекция
27.11.2018
30. АК в биосинтезе
• Схема синтеза биогенных аминовCH2 CH COOH
Фенилаланин
NH2
Гидроксилаза
HO
CH2 CH COOH
NH2
HO
HO
Тирозин
Гидроксилаза
CH2 CH COOH
NH2
HO
HO
3,4-дигидроксифенилаланин
(ДОФА)
-CO2 Декарбоксилаза
CH2 CH2 NH2
Дофамин
HO
HO
Дофамин- -оксидаза
CH CH2 NH2
OH
Норадреналин
Катехоламины
N-метилтрансфераза
HO
HO
CH CH2 NH CH3
OH
Адреналин
АК в биосинтезе
Адреналин вырабатывается хромаффинными клетками
мозгового вещества надпочечников и участвует в
реализации реакций типа «бей» или «беги». Его секреция
резко повышается при стрессовых состояниях,
пограничных ситуациях, ощущении опасности, при
тревоге, страхе, при травмах, ожогах и шоковых
состояниях. Он повышает уровень бодрствования,
психическую энергию и активность, вызывает
психическую мобилизацию, реакцию ориентировки и
ощущение тревоги, беспокойства или напряжения.
Адреналин генерируется при пограничных ситуациях.
Адреналин усиливает глюконеогенез и гликогенолиз,
тормозит синтез гликогена в печени и скелетных
мышцах, усиливает захват и утилизацию глюкозы
тканями, повышая активность гликолитических
ферментов. Также адреналин усиливает липолиз (распад
жиров) и тормозит синтез жиров.
Аминокилоты - структурные единицы белков. Лекция
27.11.2018




















 chemistry
chemistry








