Similar presentations:
Оксокислоты
1.
ОКСОКИСЛОТЫ – соединения,молекулы которых содержат СООН и
оксо-группу С=О
(альдегидо- или кетокислоты)
• Многие из них являются важными
метаболитами, участвуют в обмене
веществ.
• Биологическая роль -оксокислот –
промежуточные соединения в
биосинтезе -аминокислот в живых
организмах
2.
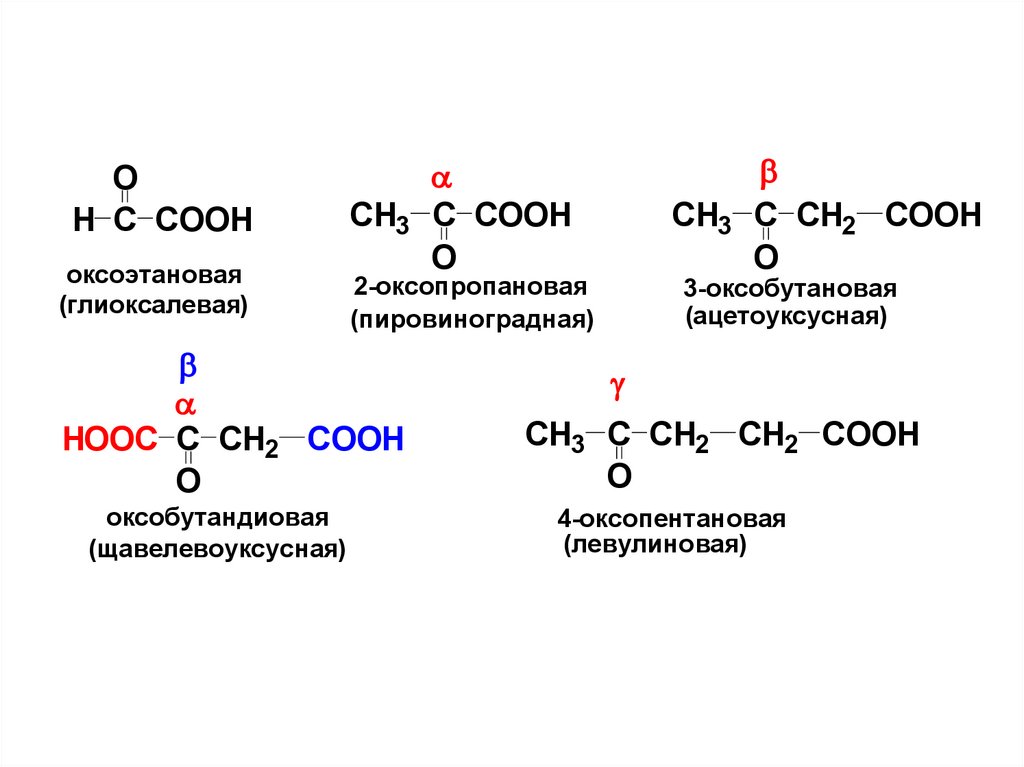
ОН С СООН
оксоэтановая
(глиоксалевая)
2-оксопропановая
(пировиноградная)
НООС С СН2 СООН
О
оксобутандиовая
(щавелевоуксусная)
СН3 С СН2 СООН
О
СН3 С СООН
О
3-оксобутановая
(ацетоуксусная)
СН3 С СН2 СН2 СООН
О
4-оксопентановая
(левулиновая)
3.
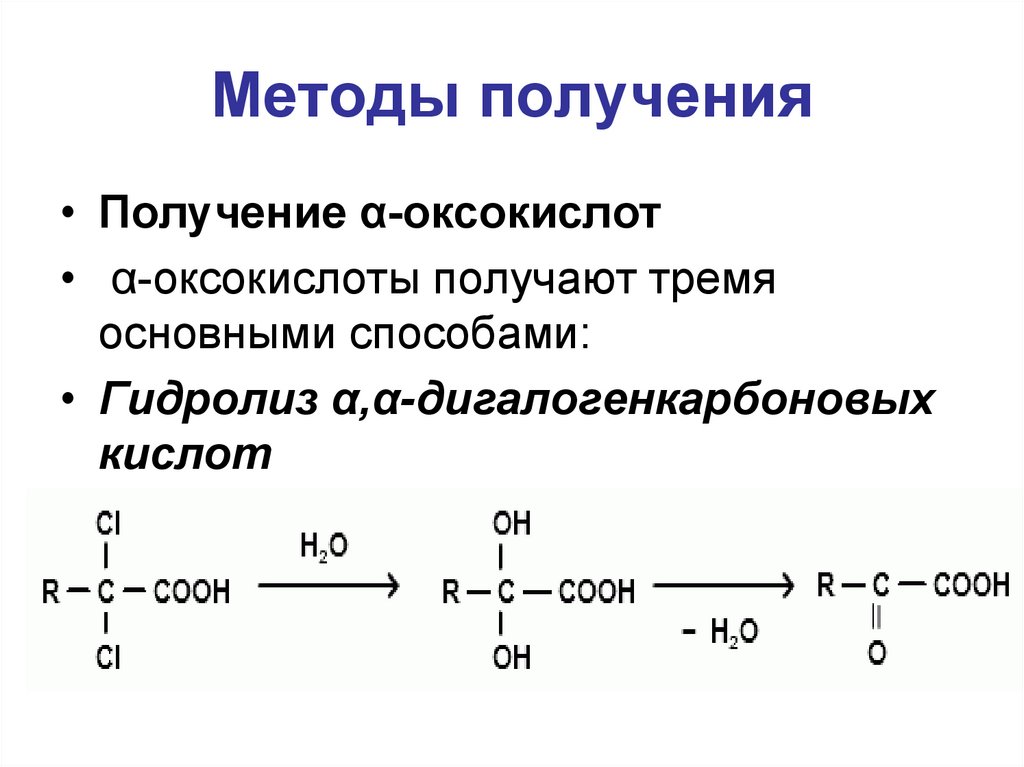
Методы получения• Получение α-оксокислот
• α-оксокислоты получают тремя
основными способами:
• Гидролиз α,α-дигалогенкарбоновых
кислот
4.
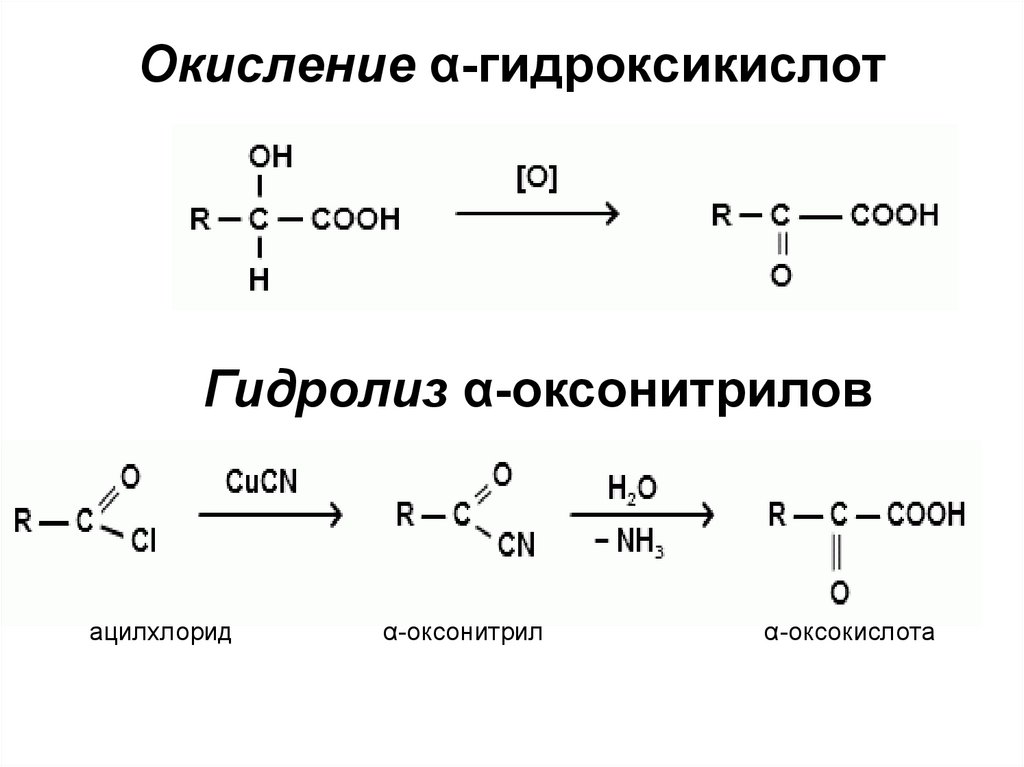
Окисление α-гидроксикислотГидролиз α-оксонитрилов
ацилхлорид
α-оксонитрил
α-оксокислота
5.
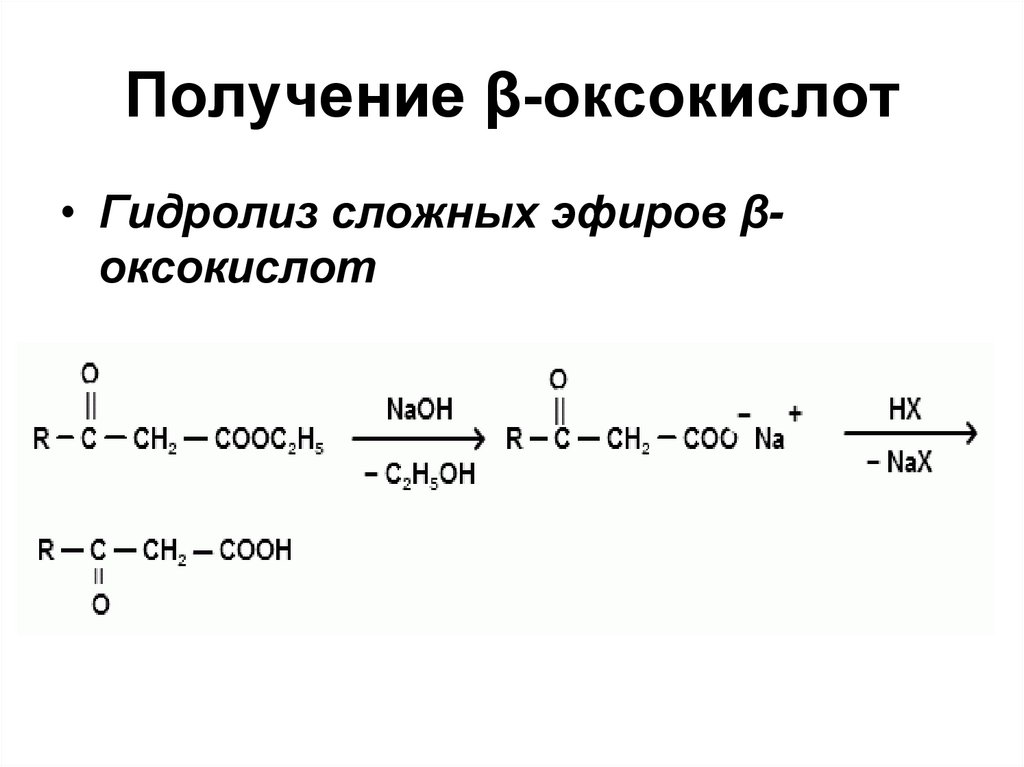
Получение β-оксокислот• Гидролиз сложных эфиров βоксокислот
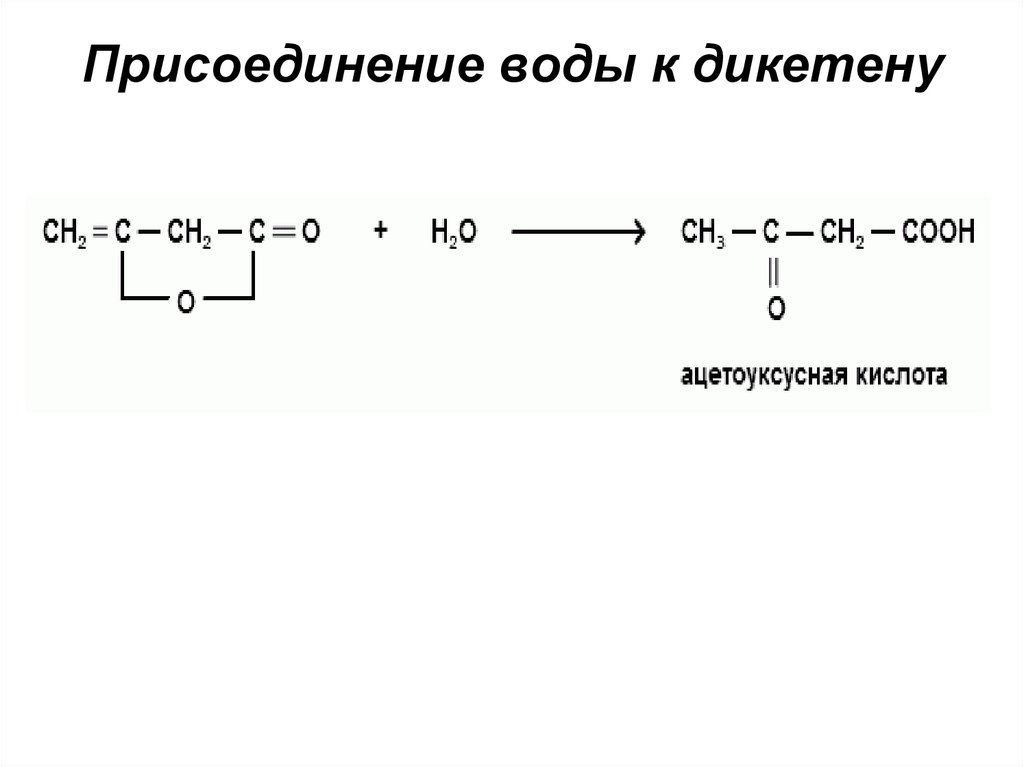
6.
Присоединение воды к дикетену7.
Получение γ- и δ-оксокислот• Окисление гидроксикислот
n = 2 (γ-),
n = 3 (δ-)
8.
ХИМИЧЕСКИЕ СВОЙСТВА• Проявляют многие свойства
карбоновых кислот, альдегидов и
кетонов:
• образуют соли, сложные эфиры,
амиды (по СООН группе)
• Образуют оксимы, гидразоны и
гидроксинитрилы (по С=О группе)
• Имеют и специфические свойства
9.
Декарбоксилированиеоксокислот
• Реакция декарбоксилирования
происходит под действием
разбавленной серной кислоты при
слабом нагревании с получением
альдегидов, а реакция
декарбонилирования при нагревании с
концентрированной серной кислотой с
получением карбоновых кислот:
10.
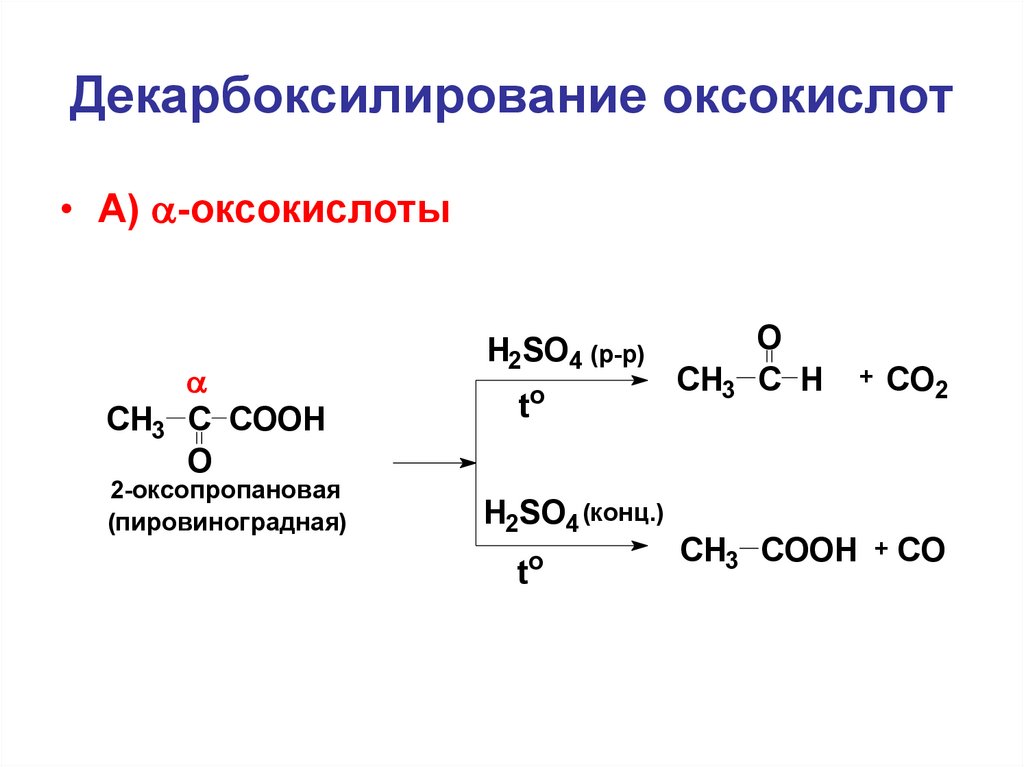
Декарбоксилирование оксокислот• А) -оксокислоты
СН3 С СООН
О
2-оксопропановая
(пировиноградная)
H2SO4 (р-р)
to
H2SO4 (конц.)
o
t
О
СН3 С Н
+ СО
2
СН3 СООН + СО
11.
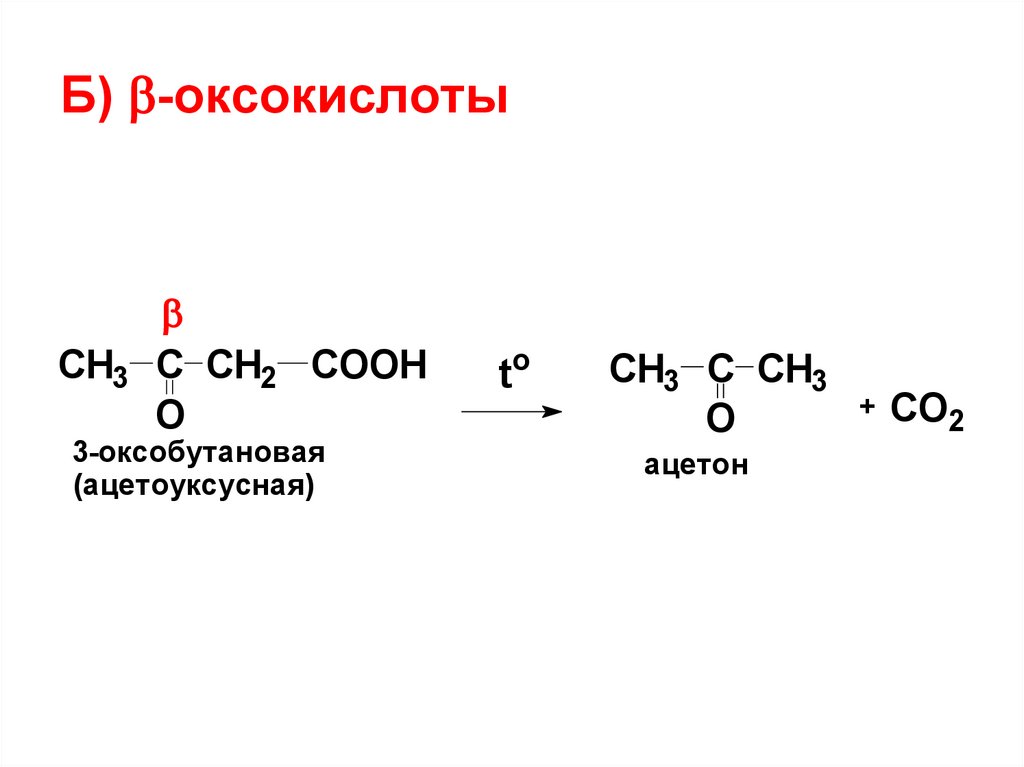
Б) -оксокислотыСН3 С СН2 СООН
О
3-оксобутановая
(ацетоуксусная)
to
СН3 С СН3
О
ацетон
+ СО2
12.
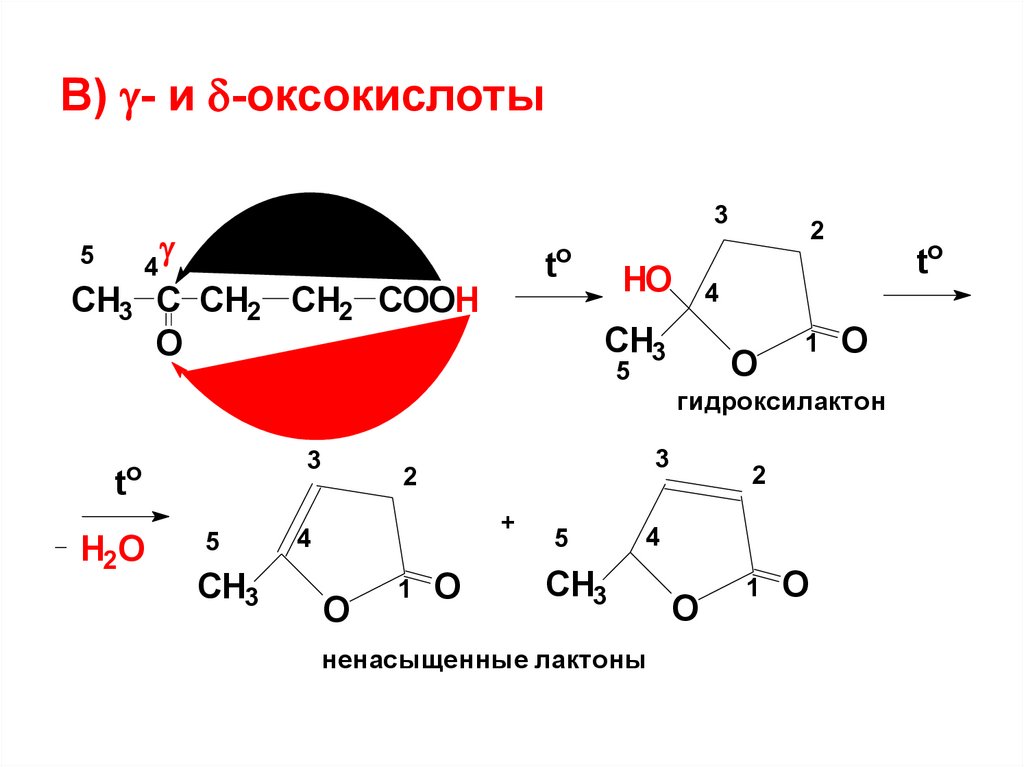
В) - и -оксокислоты4
5
3
3
2
to
1
СН3 С СН2 СН2 СООН
О
HO
2
to
4
CH3
O
5
1
O
гидроксилактон
3
o
t
H2O
5
CH3
3
2
+
4
O
1
O
5
2
4
CH3
ненасыщенные лактоны
O
1
O
13.
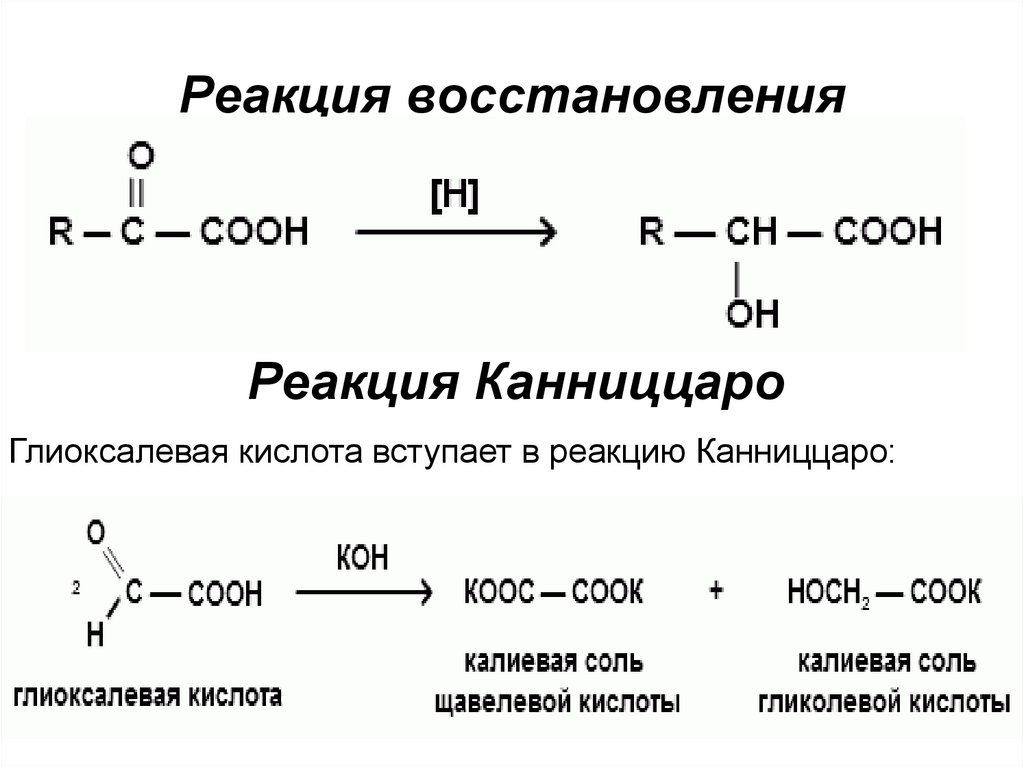
Реакция восстановленияРеакция Канниццаро
Глиоксалевая кислота вступает в реакцию Канниццаро:
14.
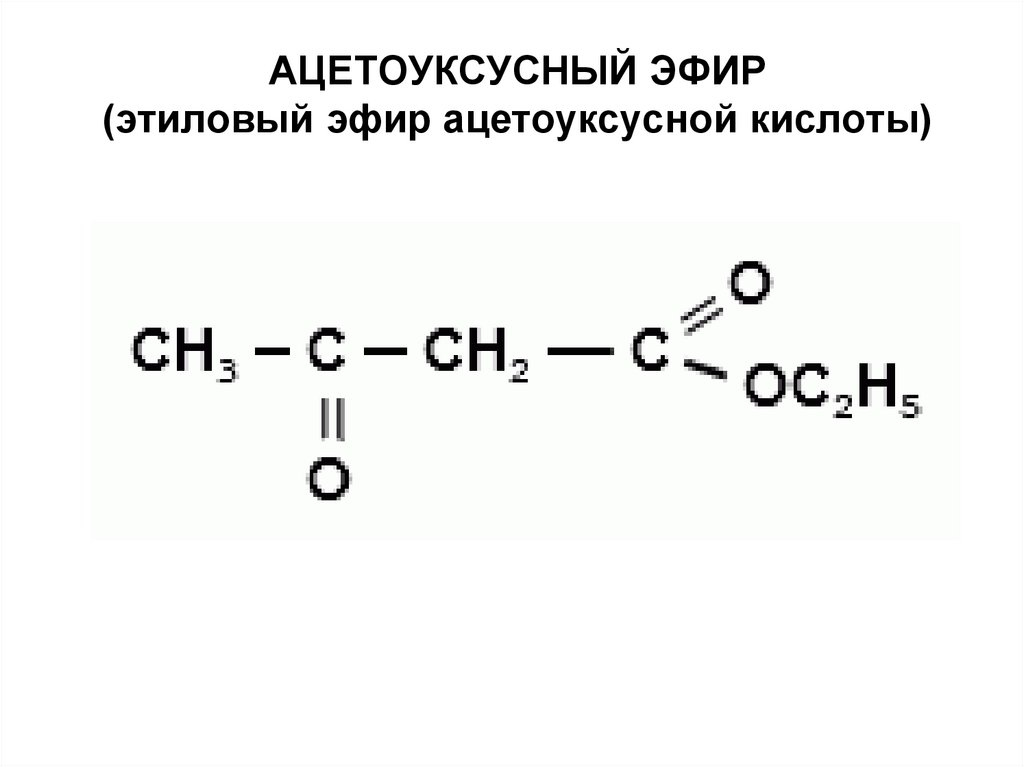
АЦЕТОУКСУСНЫЙ ЭФИР(этиловый эфир ацетоуксусной кислоты)
15.
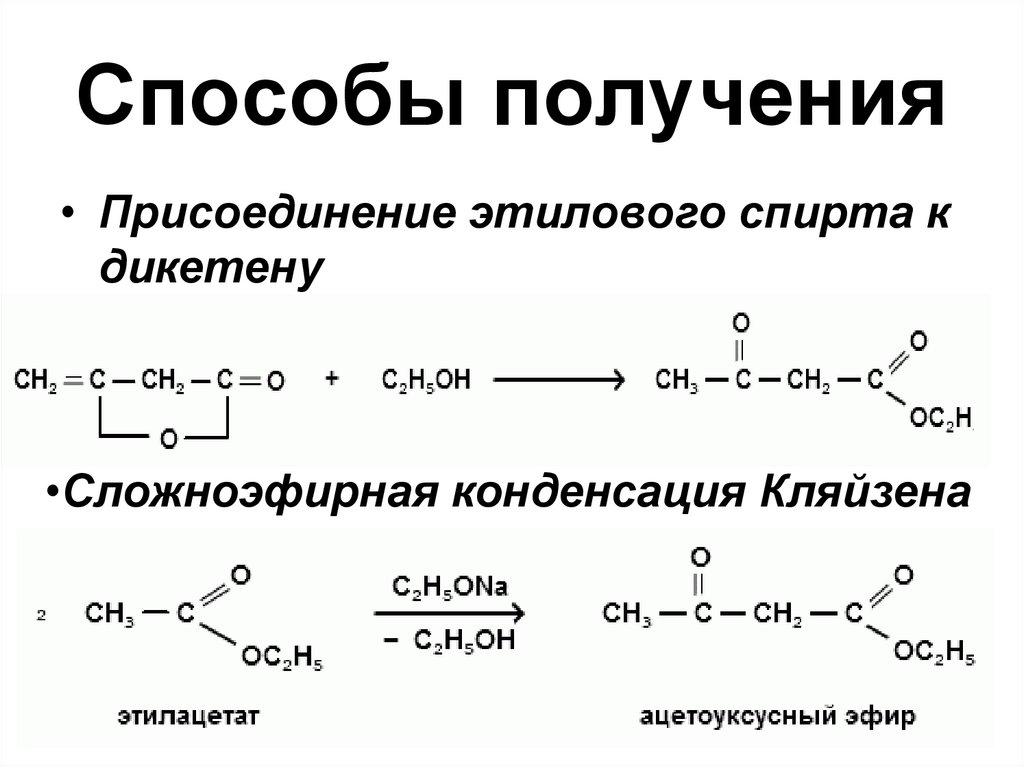
Способы получения• Присоединение этилового спирта к
дикетену
•Сложноэфирная конденсация Кляйзена
16.
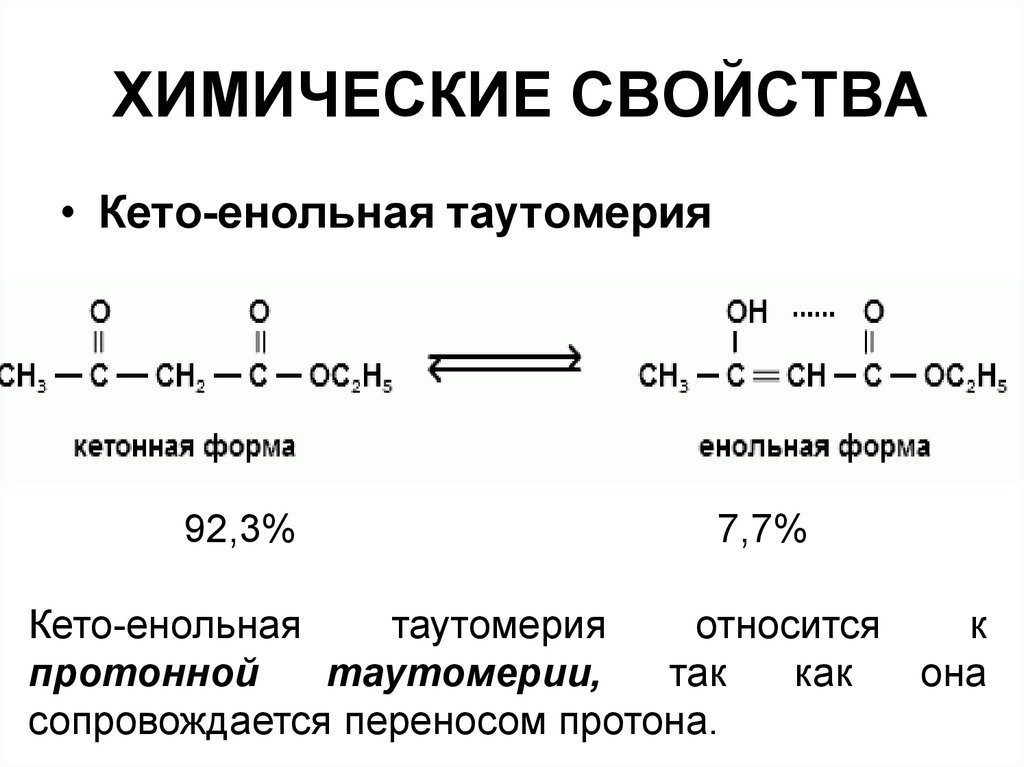
ХИМИЧЕСКИЕ СВОЙСТВА• Кето-енольная таутомерия
92,3%
7,7%
Кето-енольная
таутомерия
относится
к
протонной
таутомерии,
так
как
она
сопровождается переносом протона.
17.
• В обычных условиях, при комнатной температуре,ацетоуксусный эфир содержит 92,3% кетонной
формы и 7,7% - енольой формы.
• Енольная группировка энергетически менее выгодна,
чем кетонная. Однако в данном случае при
образовании енола возникает:
• сопряженная система кратных связей;
• внутримолекулярная водородная связь.
• Выигрыш энергии за счет этих двух факторов
компенсирует в некоторой степени затрату энергии
на образование енола, благодаря чему склонность к
енолизации возрастает.
• В химическом отношении ацетоуксусный эфир
способен давать реакции как для кетонной, так и для
енольной формы.
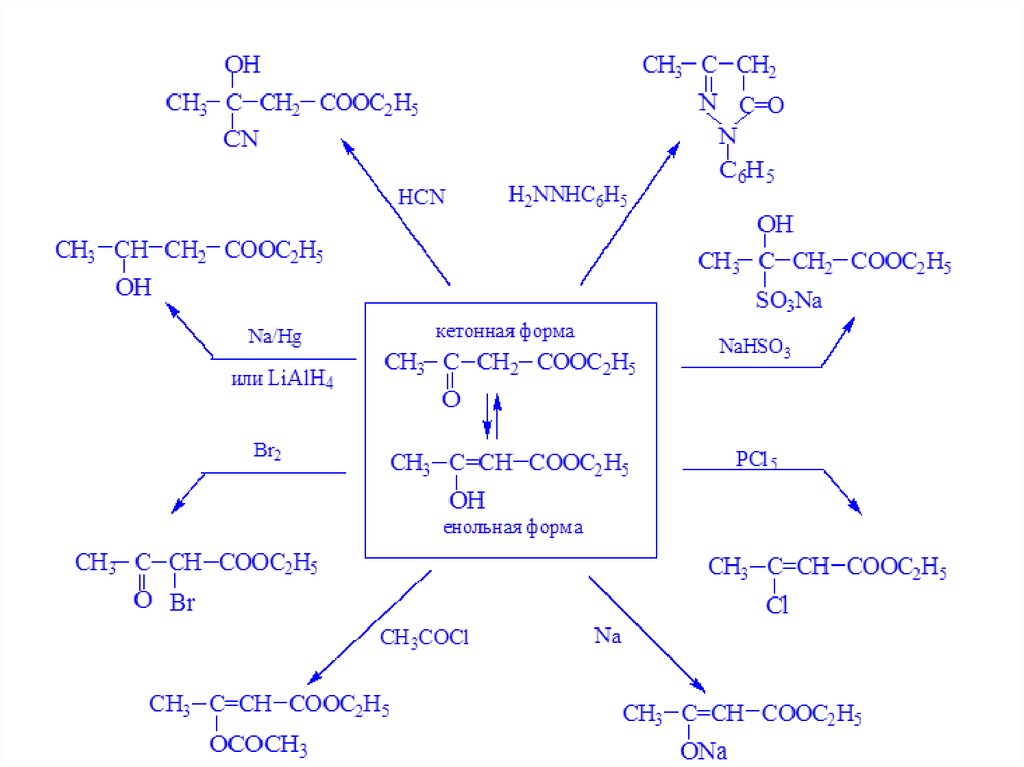
18.
19.
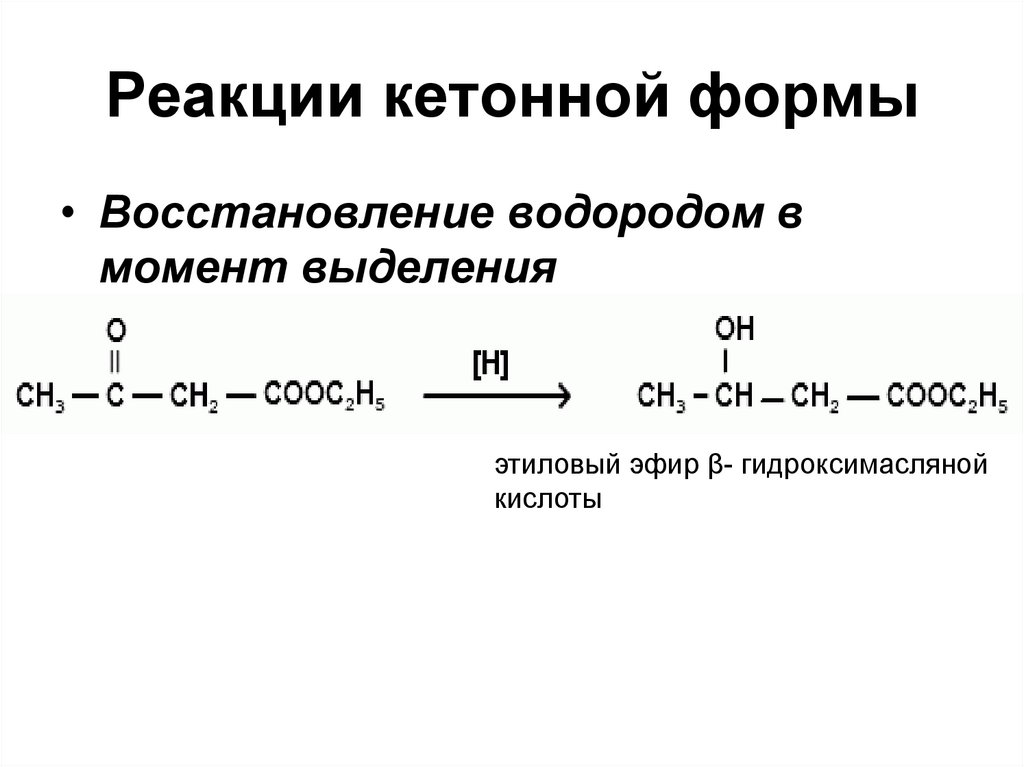
Реакции кетонной формы• Восстановление водородом в
момент выделения
этиловый эфир β- гидроксимасляной
кислоты
20.
Присоединение синильнойкислоты
циангидрин кетоформы
ацетоуксусного эфира
•Взаимодействие с гидросульфитом
натрия
гидросульфитной производное
кетоформы ацетоуксусного эфира
21.
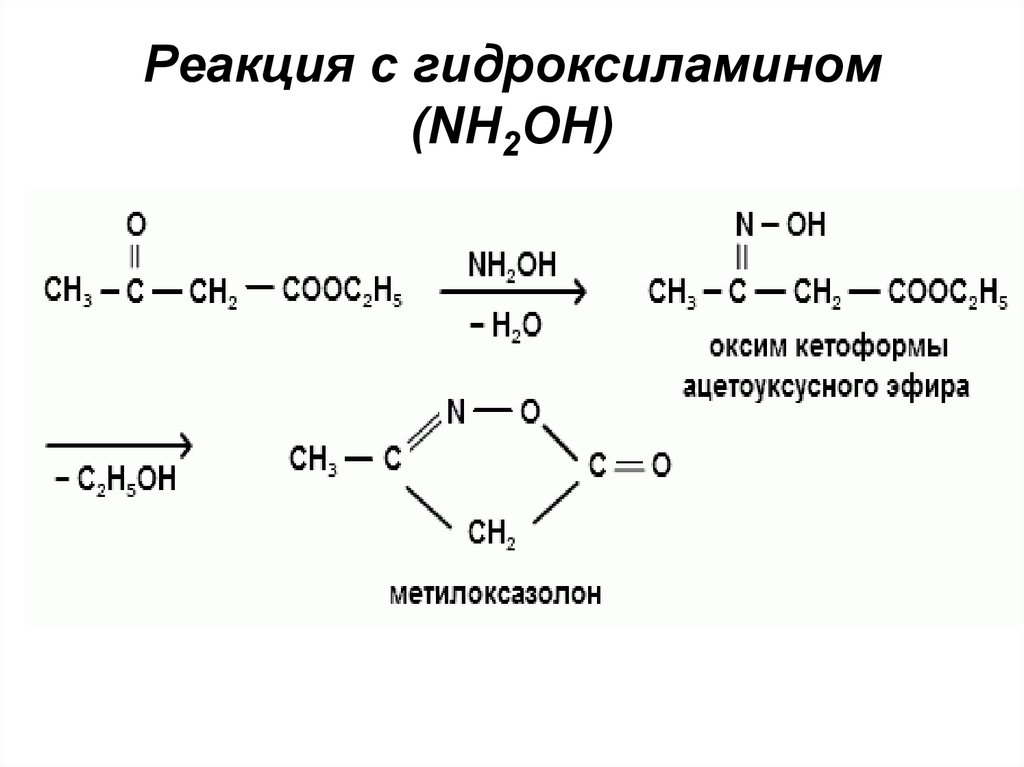
Реакция с гидроксиламином(NH2OH)
22.
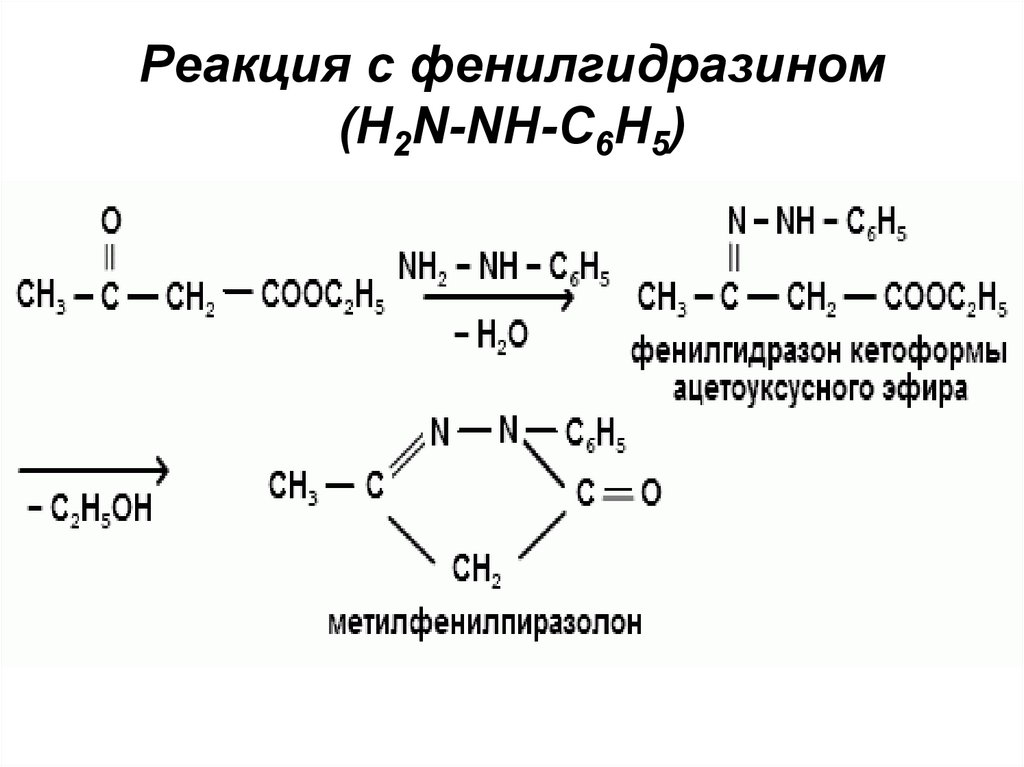
Реакция с фенилгидразином(H2N-NH-C6H5)
23.
Реакции енольной формы• Качественная реакция на енолы
• Для ацетоуксусного эфира характерна
качественная реакция на енолы: при
взаимодействии с раствором хлорида железа
(III) FeCl3 происходит образование сложных
комплексных солей железа, имеющих краснофиолетовую окраску.
24.
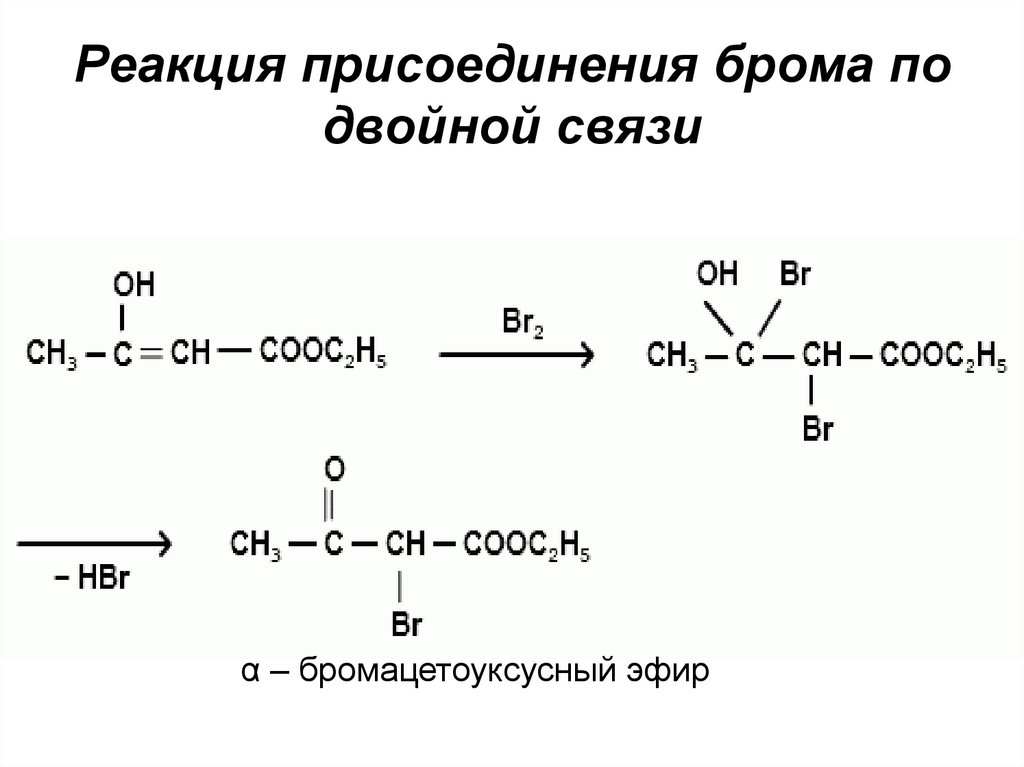
Реакция присоединения брома подвойной связи
α – бромацетоуксусный эфир
25.
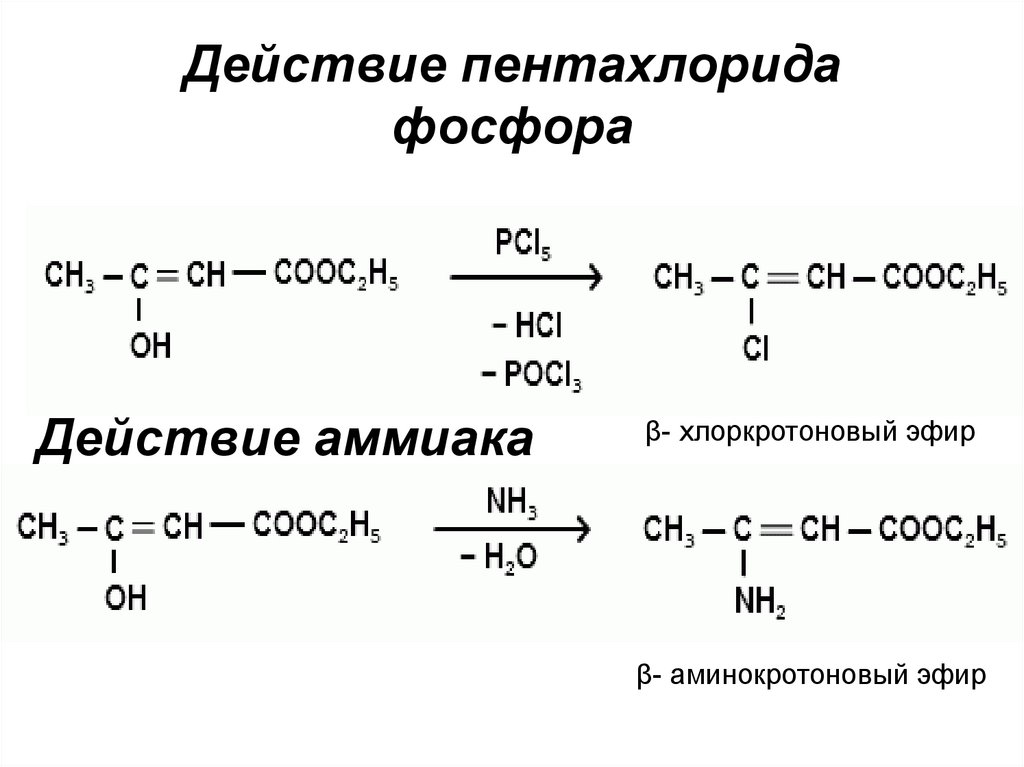
Действие пентахлоридафосфора
Действие аммиака
β- хлоркротоновый эфир
β- аминокротоновый эфир
26.
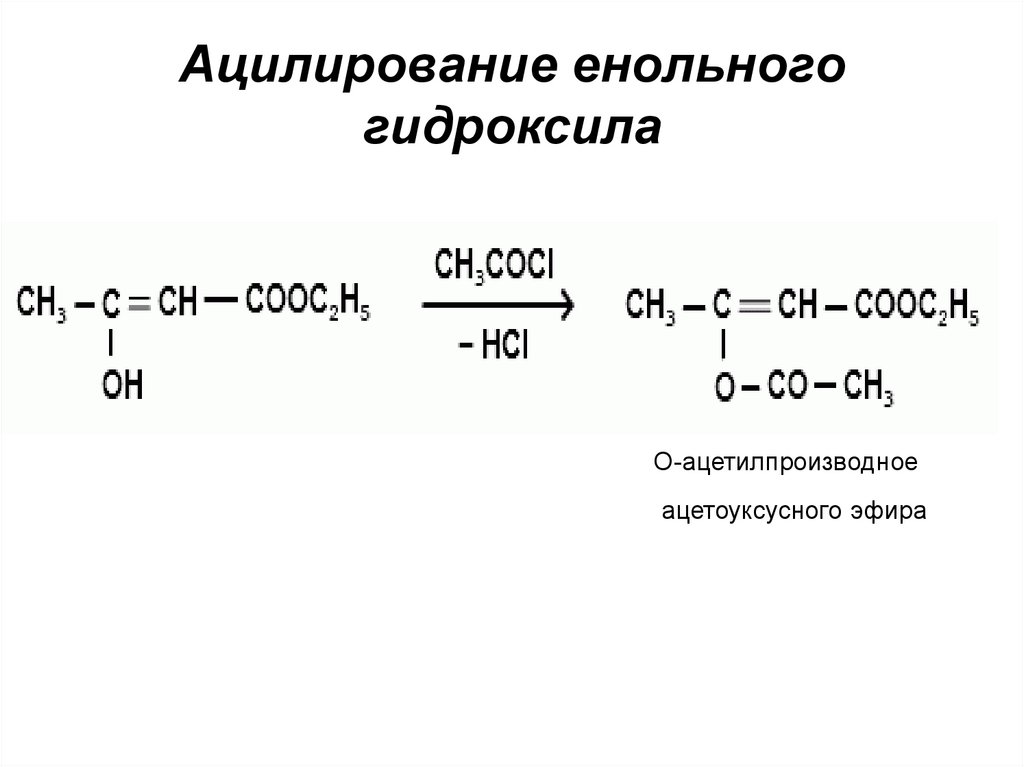
Ацилирование енольногогидроксила
О-ацетилпроизводное
ацетоуксусного эфира
27.
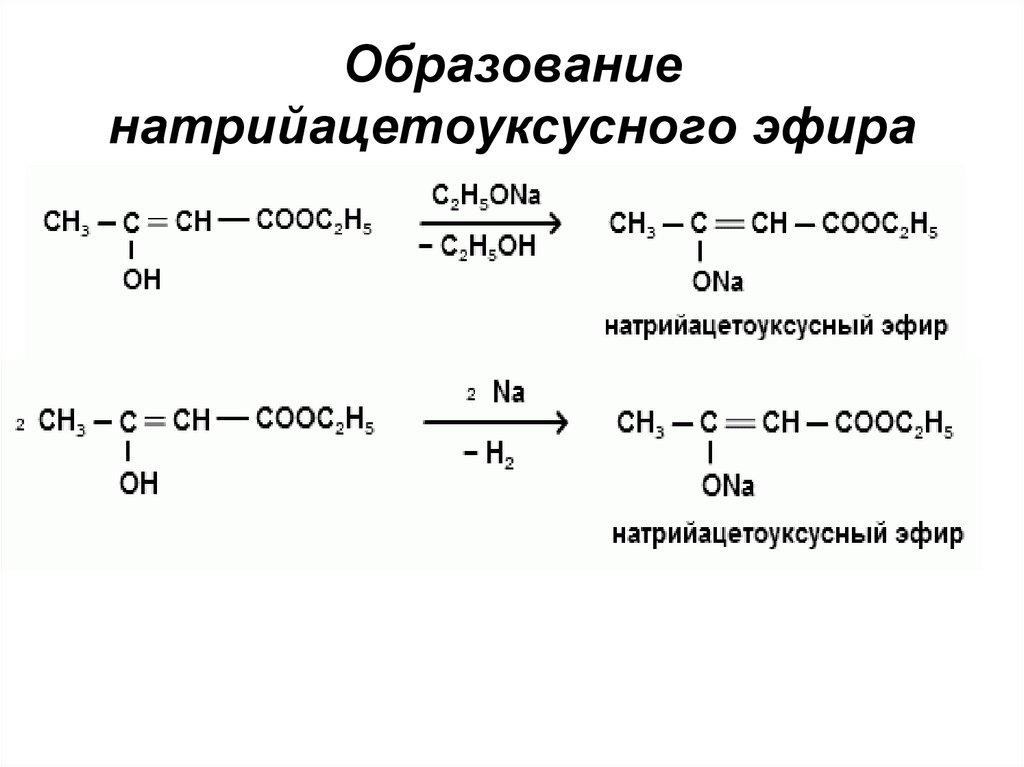
Образованиенатрийацетоуксусного эфира
28.
НАТРИЙАЦЕТОУКСУСНЫЙЭФИР
• При алкилировании и ацилировании
натрийацетоуксусного эфира
наблюдаются реакции с переносом
реакционного центра.
• В результате вместо ожидаемых Оалкил или О-ацилпроизводных
ацетоуксусного эфира образуются
соответствующие С-алкил или Сацилпроизводные:
29.
30.
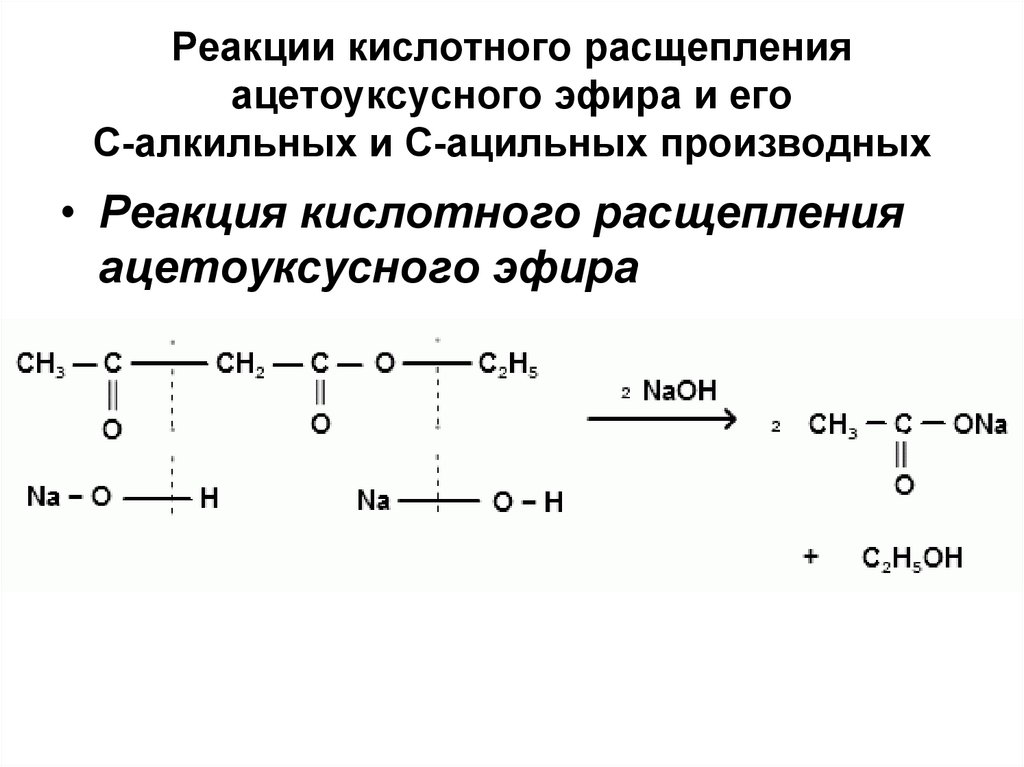
Реакции кислотного расщепленияацетоуксусного эфира и его
С-алкильных и С-ацильных производных
• Реакция кислотного расщепления
ацетоуксусного эфира
31.
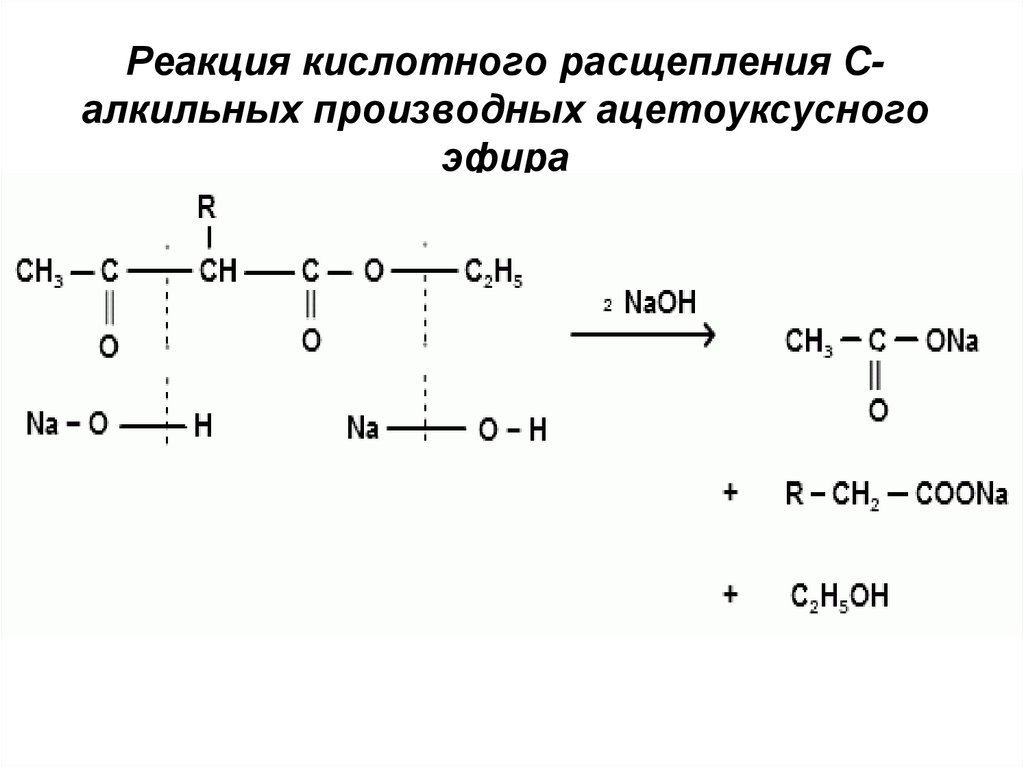
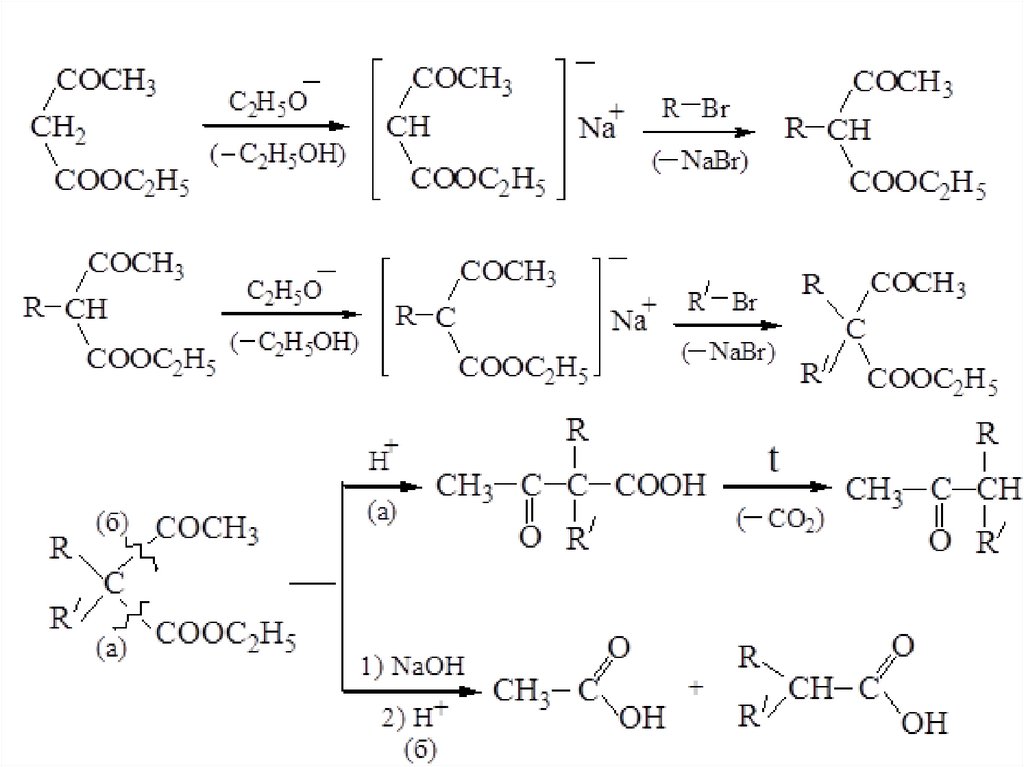
Реакция кислотного расщепления Салкильных производных ацетоуксусногоэфира
32.
Реакция кислотного расщепления Сацильных производных ацетоуксусногоэфира
33.
Реакции кетонного расщепленияацетоуксусного эфира и его
С-алкильных и С-ацильных производных
• Реакции кетонного расщепления
ацетоуксусного эфира
34.
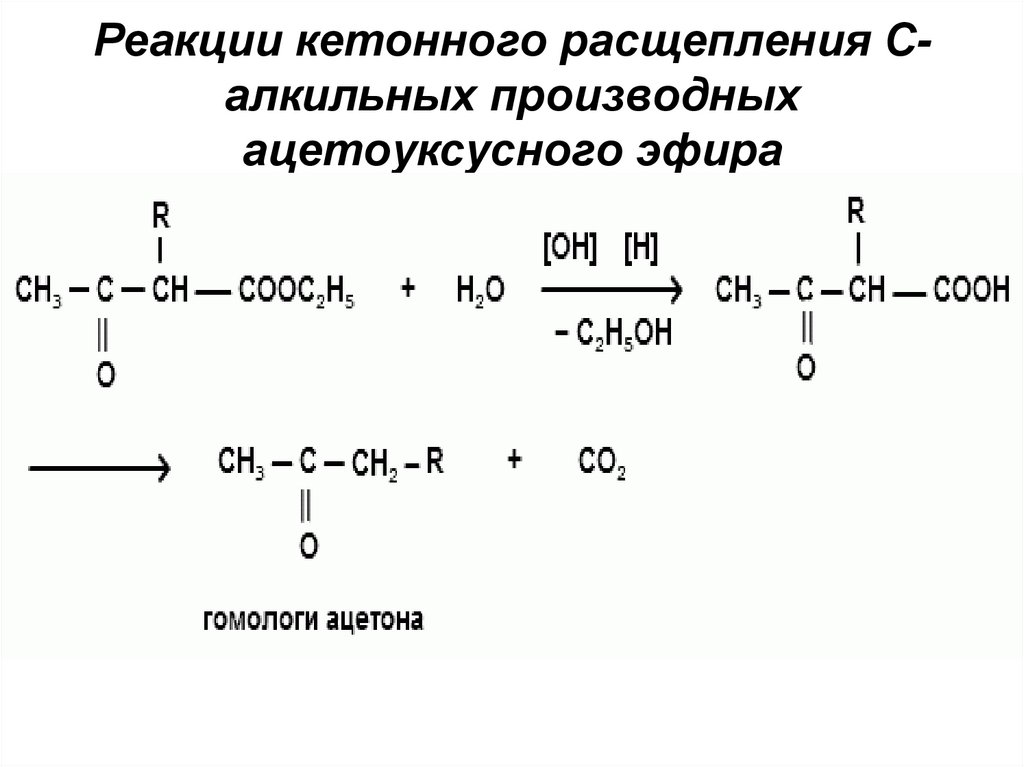
Реакции кетонного расщепления Салкильных производныхацетоуксусного эфира
35.
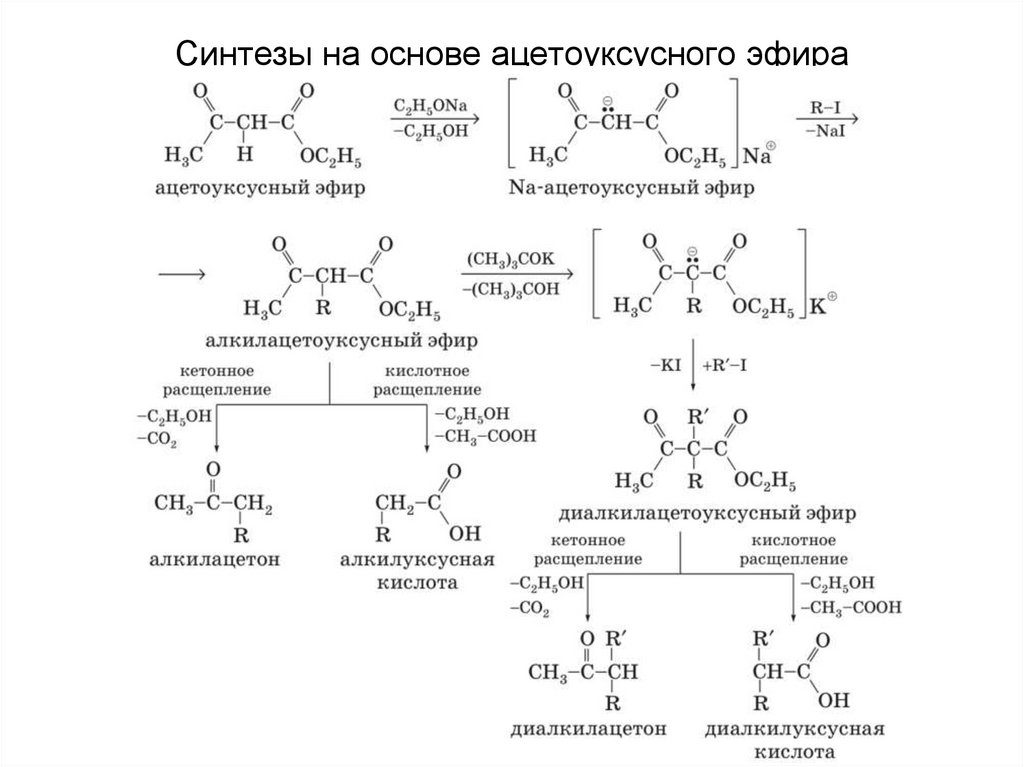
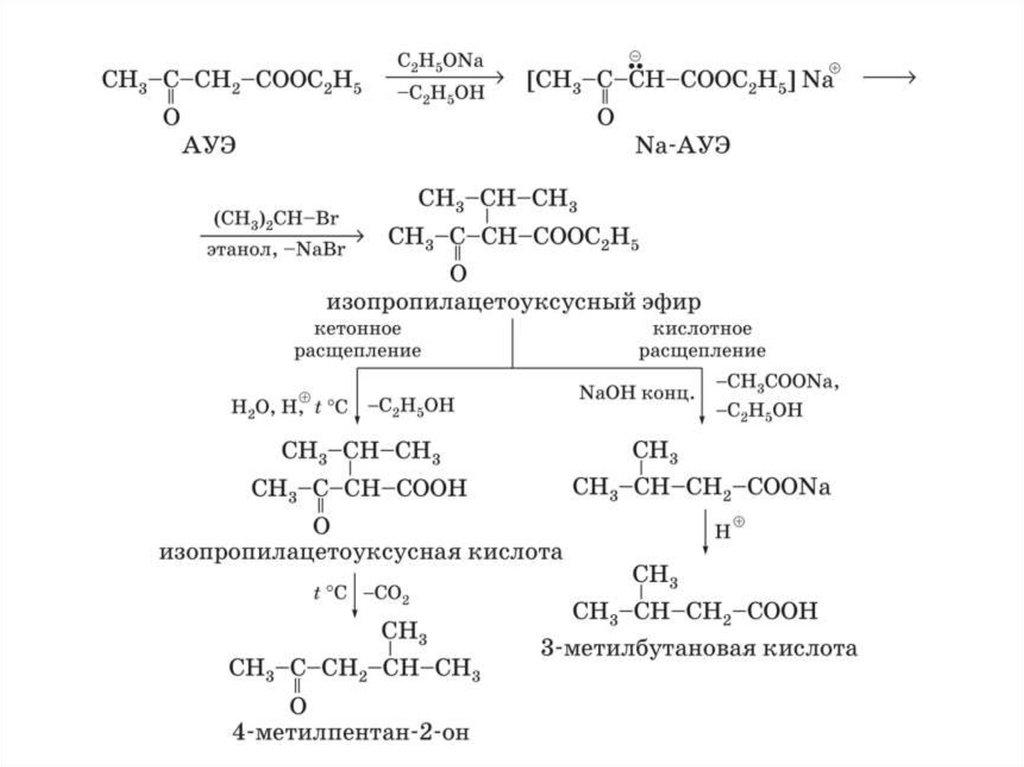
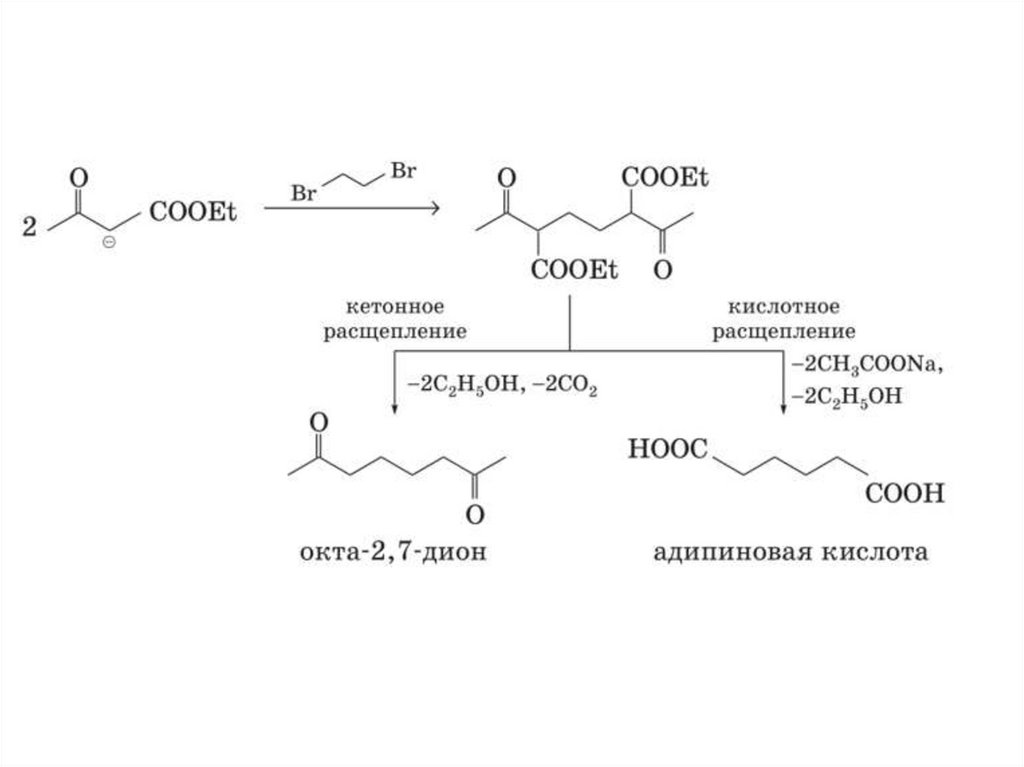
Синтезы на основе ацетоуксусного эфира36.
37.
38.
39.
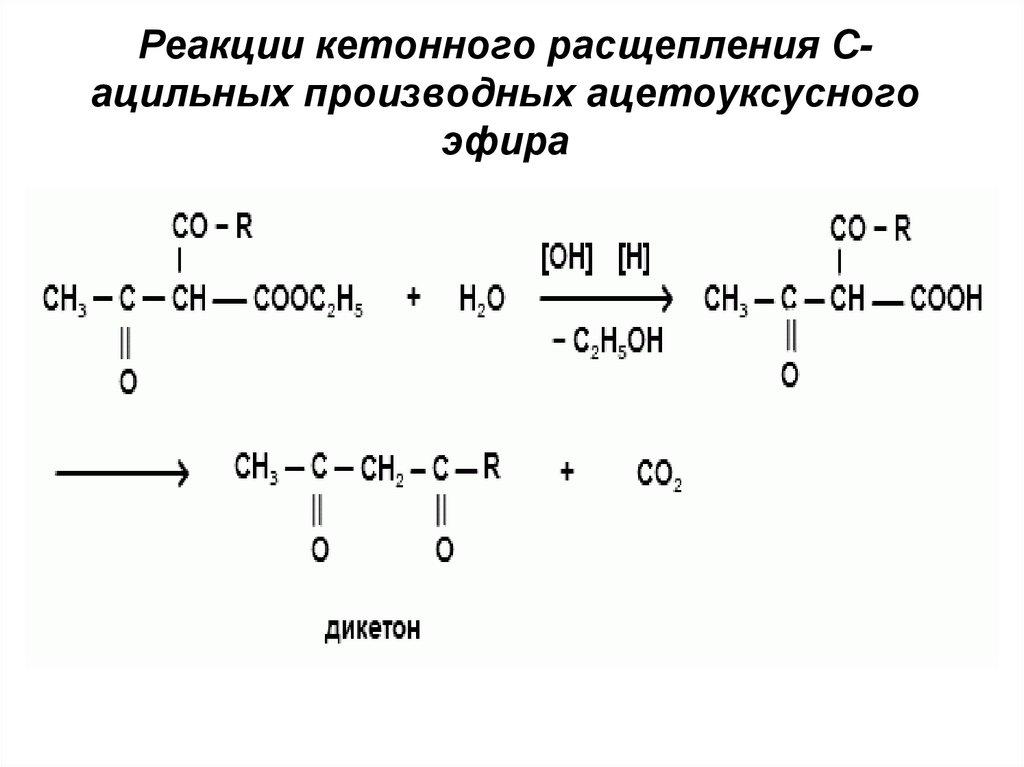
Реакции кетонного расщепления Сацильных производных ацетоуксусногоэфира













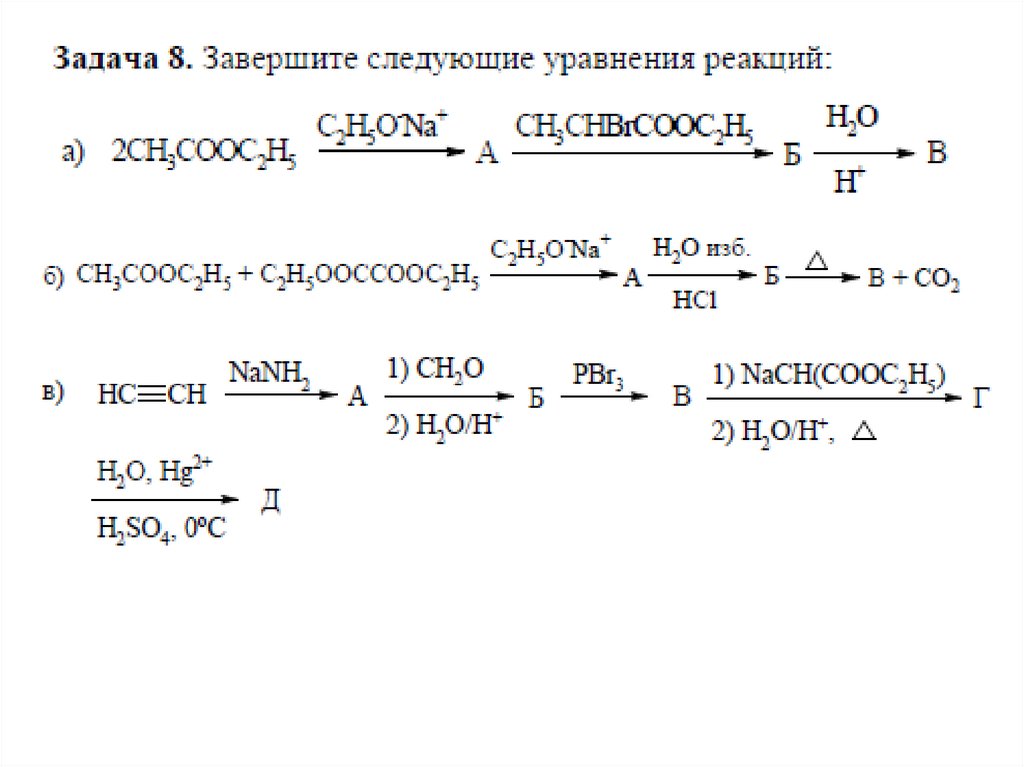
 chemistry
chemistry








