Similar presentations:
Карбоновые кислоты. Гидрокси-, оксокислоты. Лекция 2
1. Лекция 2 КАРБОНОВЫЕ КИСЛОТЫ. ГИДРОКСИ-, ОКСОКИСЛОТЫ
2. Карбоновые кислоты – большая группа органических соединений, содержащие в молекулах не менее 1 карбоксильной группы –СООН.
Карбоновые кислоты классифицируют:1. По количеству групп СООН:
монокарбоновые
дикарбоновые
трикарбоновые
2. По строению углеродного скелета и наличию
двойных связей:
ациклические насыщенные
ациклические ненасыщенные
ароматические
3. По природе дополнительной функциональной группы
выделяют:
гидроксикислоты
оксокислоты
аминокислоты
прочие
3. ФИЗИЧЕСКИЕ СВОЙСТВА
• Карбоновые кислоты – бесцветные жидкие или твердыевещества, растворимые в органических растворителях.
• Низшие насыщенные карбоновые кислоты (С1 – С9) – жидкости
со специфическим резким запахом, обжигают слизистые
оболочки. Первые 3 кислоты во всех отношениях смешиваются
с водой. При удлинении углеводородного скелета уменьшается
растворимость в воде и увеличивается растворимость в
малополярных растворителях.
• Высшие жирные кислоты (С10 и более) – твердые вещества,
малорастворимые в воде, хорошо растворимы в органических
растворителях.
• Низшие ненасыщенные карбоновые кислоты – жидкие,
введение двойных связей снижает т. пл. и растворимость в
воде.
• Дикарбоновые кислоты - твердые кристаллические вещества,
умеренно и хорошо растворимые в воде, при нагревании
разлагаются.
• Гидрокси- и оксокислоты – жидкие или твердые кристаллические вещества, умеренно и хорошо растворимые в воде,
при нагревании разлагаются.
4. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ: Монокарбоновые насыщенные:
НСООН - муравьиная, формиат
СН3СООН - уксусная, ацетат
СН3СН2СООН - пропионовая,
пропионат
СН3(СН2)2СООН - масляная, бутират
СН3(СН2)3СООН - валериановая, валерат
5. Дикарбоновые насыщенные: НООС-СООН - щавелевая, оксалат НООС-СН2-СООН - малоновая, малонат НООС-(СН2)2-СООН - янтарная,
сукцинатНООС-(СН2)3-СООН - глутаровая, глутарат
Монокарбоновые ненасыщенные:
CН2=СН-СООН - акриловая, акрилат
СН3-СН=СН-СООН - кротоновая, кротонат
H2C C COOH
CH3
- метакриловая, метакрилат
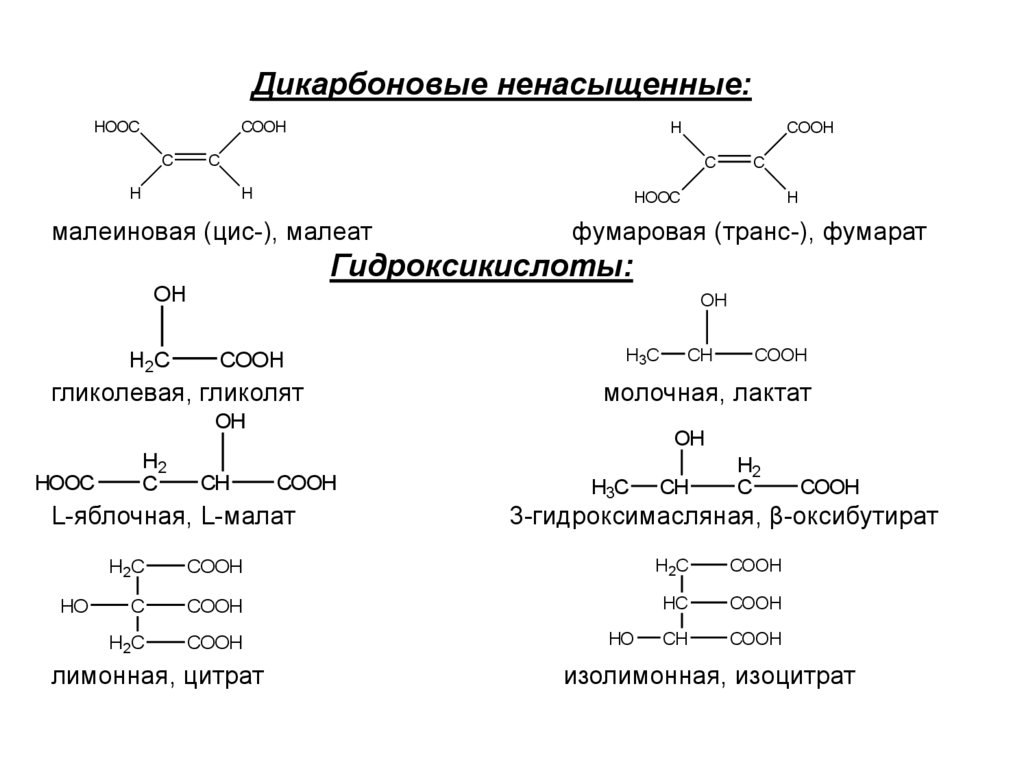
6. Дикарбоновые ненасыщенные: малеиновая (цис-), малеат фумаровая (транс-), фумарат Гидроксикислоты: гликолевая, гликолят
Дикарбоновые ненасыщенные:HOOC
COOH
C
H
COOH
C
C
H
H
C
HOOC
малеиновая (цис-), малеат
H
фумаровая (транс-), фумарат
Гидроксикислоты:
OH
H2C
OH
COOH
гликолевая, гликолят
H3C
HOOC
CH
OH
COOH
L-яблочная, L-малат
HO
COOH
молочная, лактат
OH
H2
C
CH
H3C
CH
H2
C
3-гидроксимасляная, β-оксибутират
H2C
COOH
H2C
COOH
C
COOH
HC
COOH
H2C
COOH
CH
COOH
лимонная, цитрат
COOH
HO
изолимонная, изоцитрат
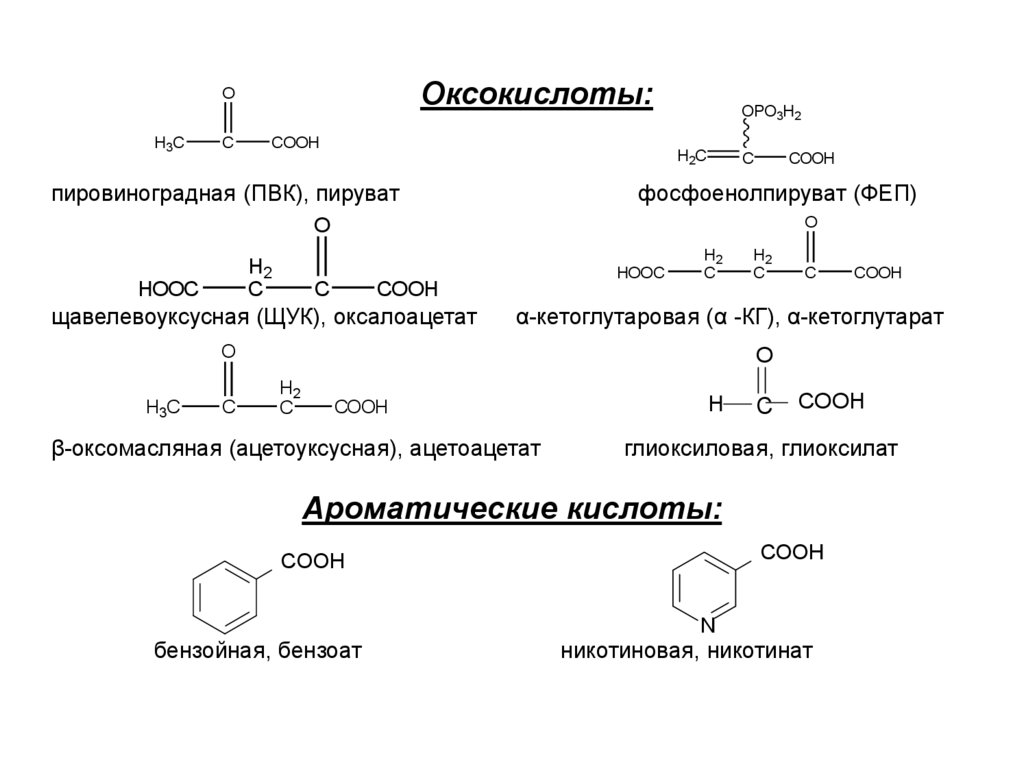
7. Оксокислоты: пировиноградная (ПВК), пируват фосфоенолпируват (ФЕП) щавелевоуксусная (ЩУК), оксалоацетат α-кетоглутаровая (α
Оксокислоты:O
H3C
C
COOH
OPO3H2
H2C
пировиноградная (ПВК), пируват
C
COOH
фосфоенолпируват (ФЕП)
O
O
H2
C
HOOC
C
HOOC
COOH
щавелевоуксусная (ЩУК), оксалоацетат
H2
C
C
C
COOH
α-кетоглутаровая (α -КГ), α-кетоглутарат
O
H3C
H2
C
O
H2
C
COOH
β-оксомасляная (ацетоуксусная), ацетоацетат
H
C
COOH
глиоксиловая, глиоксилат
Ароматические кислоты:
COOH
COOH
N
бензойная, бензоат
никотиновая, никотинат
8. СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ
Карбоксильная (-СООН) и карбоксилатная (-СОО-) группыполярные, электроноакцепторные (- I, - M) сопряженные
функциональные группы.
O
C
O H
1/2 -
O
C
O
+ H+
1/2 -
В жидком и твердом состояниях молекулы RCOOH
ассоциированы
димеризацией
–
образованием
межмолекулярных водородных связей между двумя группами
–СООН.
Наличие ОН в структуре –СООН уменьшает
склонность карбоновых кислот к реакциям AN (характерным
для карбонильных соединений) и SN (они протекают in vitro
только в сильнокислой среде).
Наличие карбонильной группы в структуре –СООН
усиливает ОН-кислотность:
RCOOH – более сильные кислоты, чем вода, спирты
ROH и угольная кислота H2CO3
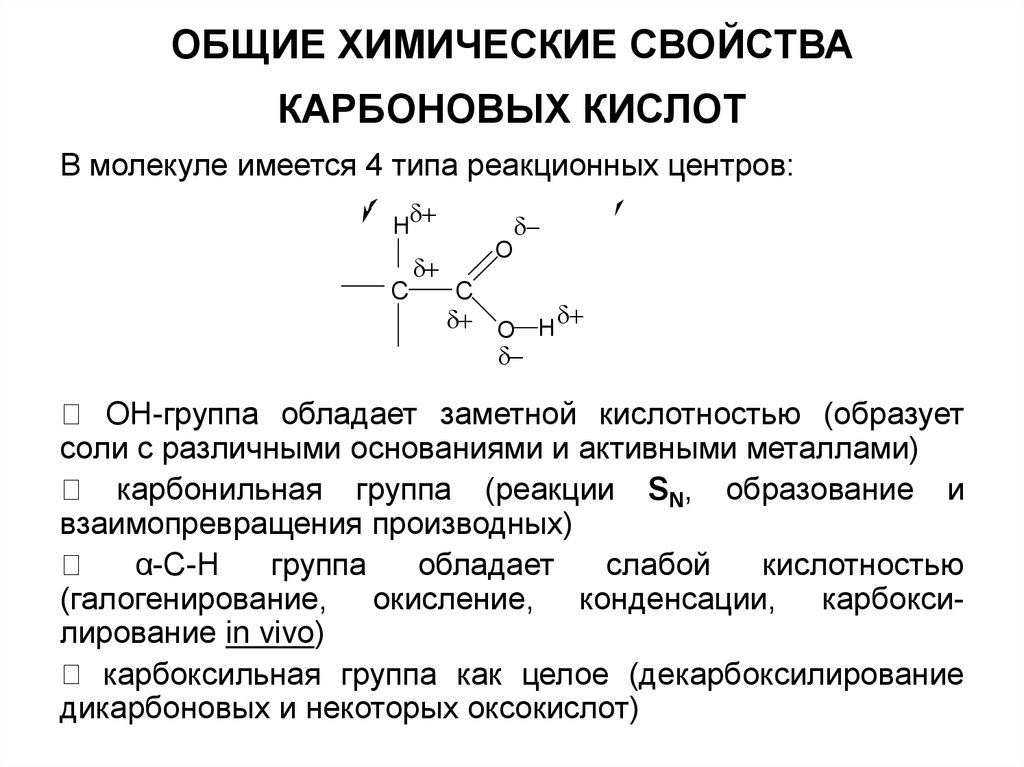
9. ОБЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
В молекуле имеется 4 типа реакционных центров:H
C
O
C
O H
OH-группа обладает заметной кислотностью (образует
соли с различными основаниями и активными металлами)
карбонильная группа (реакции SN, образование и
взаимопревращения производных)
α-С-Н
группа
обладает
слабой
кислотностью
(галогенирование, окисление, конденсации, карбоксилирование in vivo)
карбоксильная группа как целое (декарбоксилирование
дикарбоновых и некоторых оксокислот)
10. КАЧЕСТВЕННЫЕ РЕАКЦИИ КАРБОНОВЫХ КИСЛОТ
- все растворимые кислоты реагируют сводным NaHCO3:
RCOOH + NaHCO3 → RCOO-Na+ + CO2 ↑ + H2O
- щавелевая кислота осаждается ионами
кальция, оксалат кальция СаС2О4 растворяется
в сильных кислотах
- ряд гидрокси- и оксокислот (молочная,
пировиноградная)
образуют
окрашенные
комплексы с солями железа (III)
11. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN) ПРИ КАРБОНИЛЬНОЙ ГРУППЕ
Это многочисленные и разнообразные реакциивзаимных превращений производных карбоновых
кислот:
RCO-X + Y → RCO-Y + X
(где X, Y = OH, OR, NH2, NHR, NR2, SH, SR, Cl, RCO2 и
др.)
Широко используются в живых клетках (in vivo)
Включают реакции:
этерификации/гидролиза сложных эфиров
образования/гидролиза амидов RCONH2, RCONHR,
RCONR2
ацил-КоА и их превращения в другие производные
карбоновых кислот in vivo
прочие
12. Этерификация/гидролиз сложных эфиров: RCOOH + R1OH RCOOR1 + H2O Образование амидов: RCOOH + NH3 → RCOO- NH4+ RCONH2 + H2O
Этерификация/гидролиз сложных эфиров:+
RCOOH + R1OH H
RCOOR1 + H2O
Образование амидов:
t0
+
RCOOH + NH3 → RCOO NH4
RCONH2 + H2O
Ацил-КоА – макроэргические соединения – активированные
производные карбоновых кислот, широко используемые in
vivo в пластических и энергетических целях (окисление):
CH3COOH + HS-KоА + 2АТФ → CH3CO-SKоА + 2(АДФ + Ф)
Коэнзим А
Ацетил-КоА
CH3CO-SKоА + HO-(CH2)2-N+(CH3)3 → CH3C(=O)-(CH2)2-N+(CH3)3 +
HS-KоА
Ацетил-КоА
Холин
3RCO-SKоА + глицерин →
масла) + 3HS-KоА
ацетилхолин
триглицериды (ТГ, жиры и
13. Реакционная способность RCO-X в реакциях SN (RCO-X + Y → RCO-Y + X) в зависимости от природы Х: RCOCl > (RCO)2O ~ RCOSKoA > >
Реакционная способность RCO-X вреакциях SN (RCO-X + Y → RCO-Y + X)
в зависимости от природы Х:
RCOCl > (RCO)2O ~ RCOSKoA >
> RCOOR > RCONH2 > RCOOХлорангидрид > ангидрид ~ ацил-КоА >
> сложный эфир > амид >
карбоксилат-анион
14. ПОВЕДЕНИЕ КИСЛОТ ПРИ НАГРЕВАНИИ
Насыщенные карбоновые кислоты термически устойчивы, толькоих соли декарбоксилируются при нагревании (натриевые соли –
образуют алканы RH, кальциевые соли дают кетоны).
Муравьиная кислота разлагается при нагревании с конц.
H2SO4:
HCOOH → CO + H2O
Дикарбоновые кислоты при нагревании разлагаются:
- щавелевая, малоновая декарбоксилируются;
- янтарная, глутаровая, малеиновая, фумаровая внутримолекулярно дегидратируются, давая циклические ангидриды
Малеиновая кислота изомеризуется в фумаровую.
Гликолевая и молочная кислоты при нагревании
межмолекулярно дегидратируются с образованием димерных
лактидов, а затем полилактидов.
Лимонная кислота при нагревании разлагается сложным
образом.
Пировиноградная
кислота
при
нагревании
декарбоксилируется.
Ацетоуксусная кислота декарбоксилируется уже при 25o с
образованием ацетона.
15. БИОЗНАЧЕНИЕ НАСЫЩЕННЫХ КАРБОНОВЫХ КИСЛОТ
Насыщенные карбоновые кислоты содержатся впищевых жирах, в организме окисляются в виде КоАпроизводных (ацил-КоА) до ацетил-КоА и затем до СО2
и Н2О с кратковременным запасанием энергии в виде
АТФ.
Муравьиная кислота – содержится в муравьях,
крапиве, др. растениях, образуется в организме в виде
фолатного производного, применяется в медицине
(«муравьиный спирт»)
Уксусная кислота съедобна, применяется для
консервирования, в организме образует ацетил-КоА –
центральный клеточный метаболит.
Масляная кислота придает запах прогорклому
маслу.
Валериановая и изовалериановая кислоты
содержатся в корнях валерианы лекарственной.
Карбоновые кислоты входят в состав лекарств.
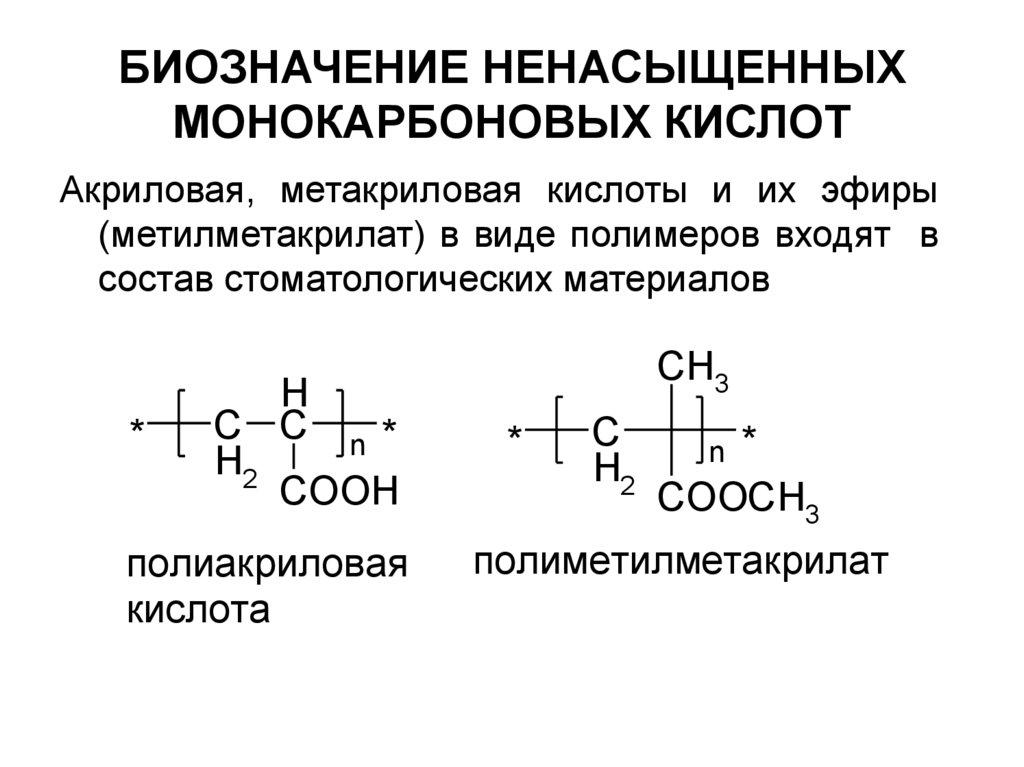
16. БИОЗНАЧЕНИЕ НЕНАСЫЩЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ
Акриловая, метакриловая кислоты и их эфиры(метилметакрилат) в виде полимеров входят в
состав стоматологических материалов
*
H
C C n*
H2
COOH
полиакриловая
кислота
CH3
*
C
H2
*
COOCH3
n
полиметилметакрилат
17. АЦЕТИЛ-КОА – ВАЖНЕЙШИЙ МЕТАБОЛИТ КЛЕТОК
Ацетил-КоА - активированная для метаболических целейформа уксусной кислоты:
● образуется при окислении пировиноградной кислоты (из
глюкозы), жирных кислот (в форме ацил-КоА), кетоновых
тел, из некоторых аминокислот;
● анаэробно окисляется в цикле Кребса (ЦТК) до СО2 с
запасанием энергии в форме субстратов тканевого дыхания
НАДН и ФАДН2, окисляемых далее тканевым дыханием до
НАД, ФАД, Н2О с образованием АТФ;
● используется для биосинтеза малонил-КоА, ацил-КоА,
жирных кислот, липидов, кетоновых тел, холестерина,
ацетилхолина.
CH3CO-SKoA +
CO2 + АТФ →
HOOC-CH2-CO-SKoA
ацетил-КоА
малонил-КоА
→ жирные кислоты
2CH3CO-SKoA → CH3COСH2CO-SKoA → кетоновые тела,
ацетил-КоА
ацетоацетил-КоА
холестерин
18. БИОЗНАЧЕНИЕ ДИКАРБОНОВЫХ КИСЛОТ
Щавелевая, янтарная и фумаровая кислоты –метаболиты клеток:
• щавелевая токсична – вызывает образование
оксалатных камней в почках, образуется из
глицина, аскорбиновой кислоты, содержится в
растениях (щавель и др.).
• янтарная и фумаровая – метаболиты ЦТК,
используются для получения энергии, входят в
состав лекарственных препаратов.
• малеиновая кислота токсична, чужеродное
вещество, в природе не встречается.
19. БИОЗНАЧЕНИЕ ГИДРОКСИ- И ОКСОКИСЛОТ
Ряд гидрокси- и оксокислот – метаболиты клеток,используются в пластических и энергетических целях,
регулируют
метаболические
процессы,
а
также
используются в лечебных целях.
Лактат и пируват образуются из глюкозы при гликолизах:
Окисление лактата в пируват в аэробных условиях
H
H3C C COOH + НАД+
OH
H3C C COOH
+ НАДH/H+
O
Лактат
пируват
Восстановление пирувата в лактат в анаэробных условиях
При карбоксилировании пирувата in vivo образуется
ЩУК – катализатор ЦТК и одно из исходных веществ для
биосинтеза глюкозы (глюконеогенез).
Метаболитами ЦТК являются ЩУК (оксалоацетат),
цитрат, изоцитрат, α-кетоглутарат, L-малат.
Из ЩУК и α-кетоглутарата могут образовываться
аминокислоты аспарагиновая и глутаминовая кислоты.
20.
In vivo гидрокси- и оксокислоты с одинаковым скелетомспособны взаимопревращаться:
L-малат ↔ ЩУК; β-оксибутират ↔ ацетоацетат
(кетоновые тела)
(аналогично лактат ↔ пируват).
Фосфоенолпируват – макроэргическое соединение, с
АДФ in vivo дает пируват и АТФ (субстратное
фосфорилирование)
Кетоновые тела – альтернативное глюкозе и жирным
кислотам клеточное
питание,
вырабатываются
печенью из ацетил-КоА в условиях голодания и
сахарного диабета
Цитрат – ключевой метаболит ЦТК, его регулятор,
используется в биосинтезе жирных кислот, в
медицине вместе с сукцинатом как биостимуляторы.
21. ЦИКЛ КРЕБСА (ЦТК) (ЗНАЧЕНИЕ, РЕАКЦИИ)
ЦТК – центральный путь анаэробного окисления ацетил-КоА сцелью получения энергии, интегрирующий пути обмена углеводов
(глюкоза), липидов (жирные кислоты и глицерин) и белков
(аминокислоты) в единый клеточный метаболизм (обмен веществ).
Важнейшие реакции:
Ацетил-КоА + ЩУК → цитрат
Цитрат → изоцитрат
Изоцитрат + НАД+ → α-кетоглутарат + НАДН/Н+ + СО2
α-кетоглутарат + НАД+ + HSKoA → сукцинил-SКоА + НАДН/Н+ + СО2
сукцинил-SКоА + ГДФ + Ф → сукцинат + ГТФ + HSKoA (субстратное
фосфорилирование)
сукцинат + ФАД → фумарат + ФАДН2
фумарат + Н2О → L-малат
L-малат + НАД+ → ЩУК + НАДН/Н+
22. БИОЗНАЧЕНИЕ ИЗОМЕРИИ КИСЛОТ
Важнейшие метаболиты, могущие иметьизомеры, как правило, работают в клетках
только в форме одного возможного изомера:
Фумаровая кислота (транс-изомер) –
метаболит, а малеиновая (цис-изомер) –
ксенобиотик, токсична
Изоцитрат образуется и преобразуется в
ЦТК в форме 1 оптического изомера (из 4-х
возможных)
В клетках организма образуется и
превращается только L-малат, а D-малат –
ксенобиотик.


















 chemistry
chemistry








