Similar presentations:
Нитросоединения
1.
НИТРОСОЕДИНЕНИЯ2.
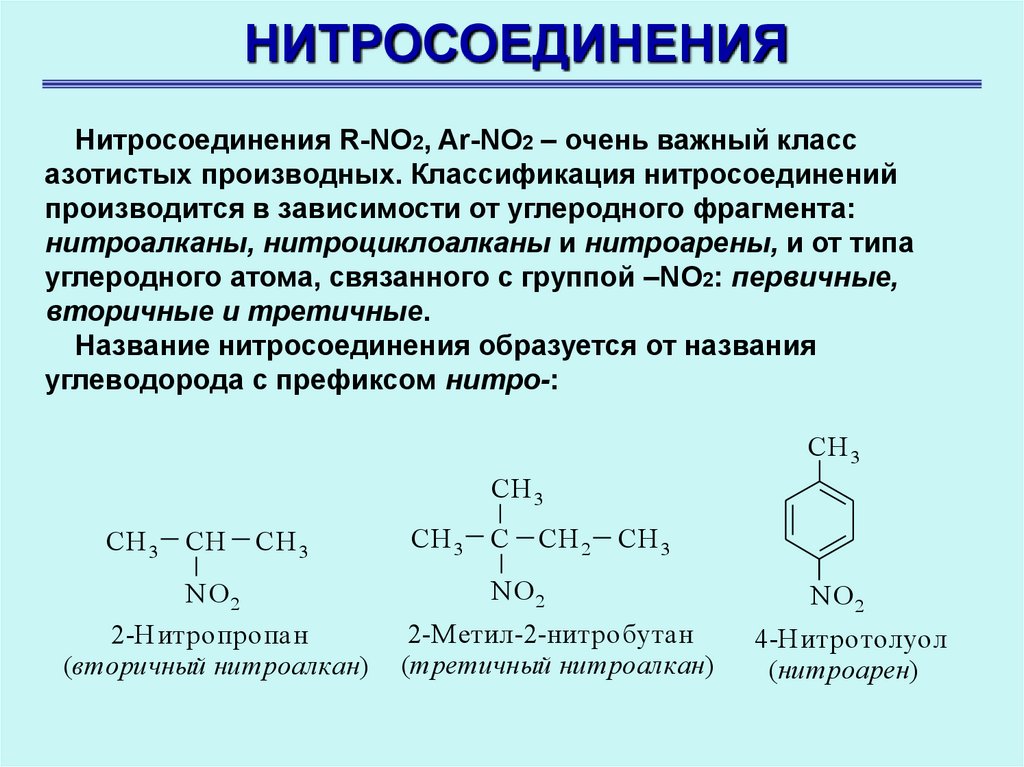
НИТРОСОЕДИНЕНИЯНитросоединения R-NO2, Ar-NO2 – очень важный класс
азотистых производных. Классификация нитросоединений
производится в зависимости от углеродного фрагмента:
нитроалканы, нитроциклоалканы и нитроарены, и от типа
углеродного атома, связанного с группой –NO2: первичные,
вторичные и третичные.
Название нитросоединения образуется от названия
углеводорода с префиксом нитро-:
СН 3
СН 3
CH 3
CH
CH 3
NO 2
2-Нитропропан
(вторичный нитроалкан)
CH 3
C
CH 2
СН 3
NO 2
2-М етил-2-нитробутан
(третичный нитроалкан)
NO 2
4-Нитротолуол
(нитроарен)
3.
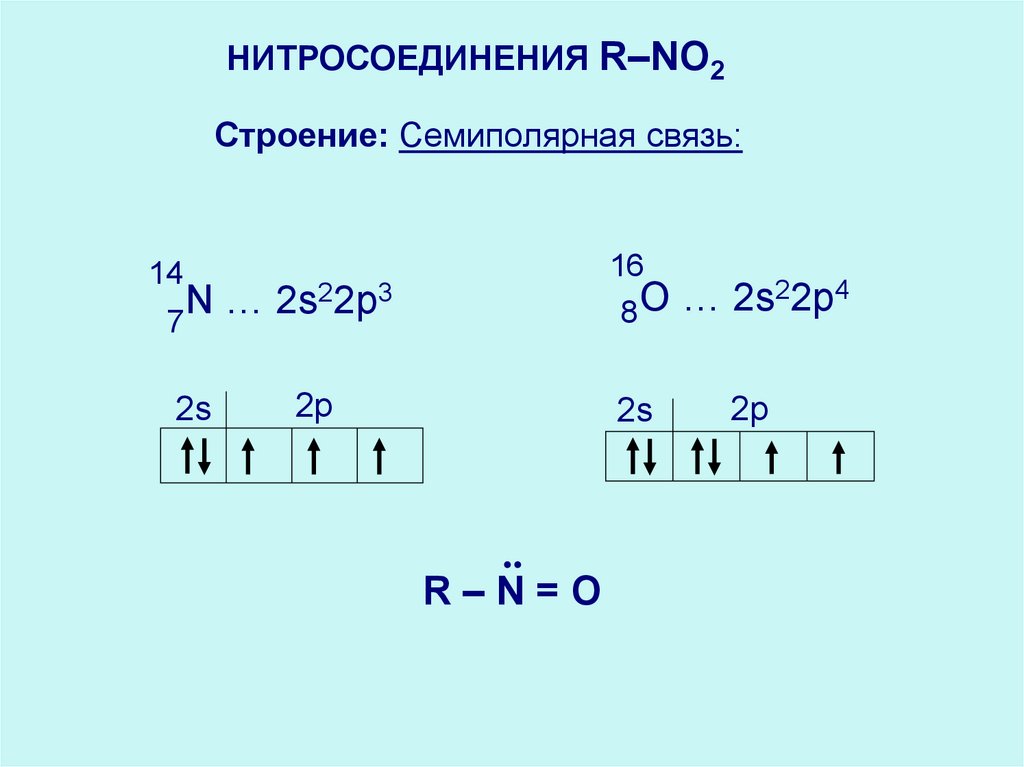
НИТРОСОЕДИНЕНИЯ R–NO2Строение: Семиполярная связь:
16
22p4
O
…
2s
8
14
22p3
N
…
2s
7
2s
2p
2s
..
R–N=O
2p
4.
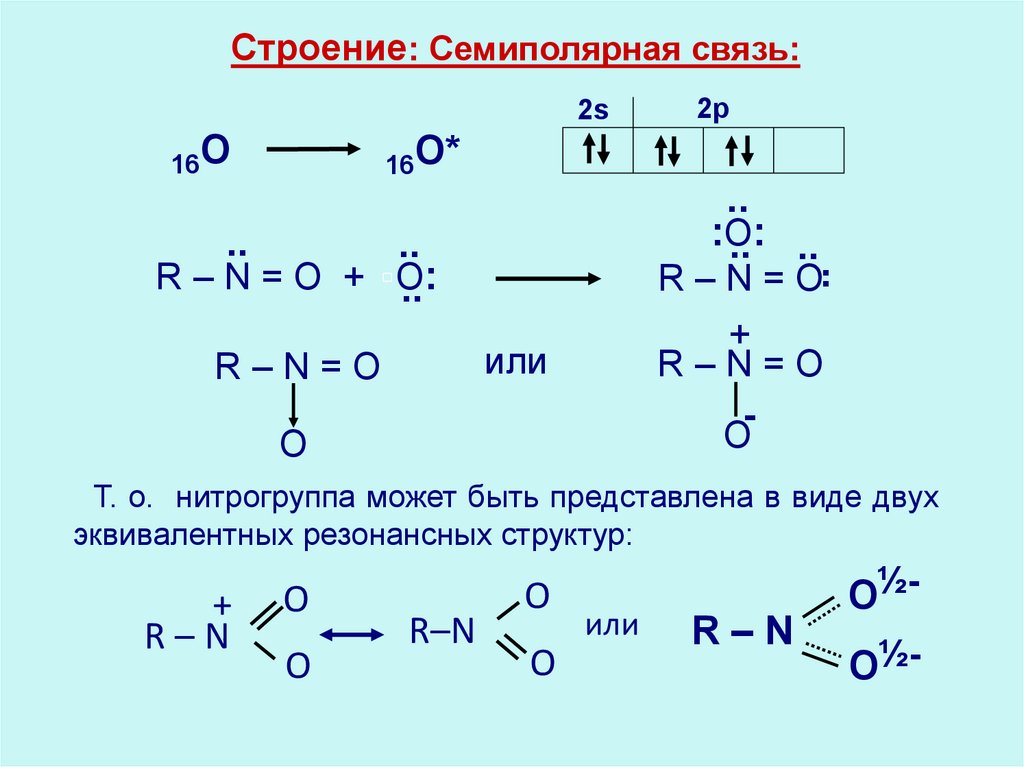
Строение: Семиполярная связь:2s
16O
2p
16O*
..
:O
.. : ..
..
R–N=O
R–N=O
+
R–N=O
..
..
R–N=O + О
.. :
или
-
O
O
Т. о. нитрогруппа может быть представлена в виде двух
эквивалентных резонансных структур:
+
R–N
O
O
R–N
O
O
или
R–N
O½O½-
5.
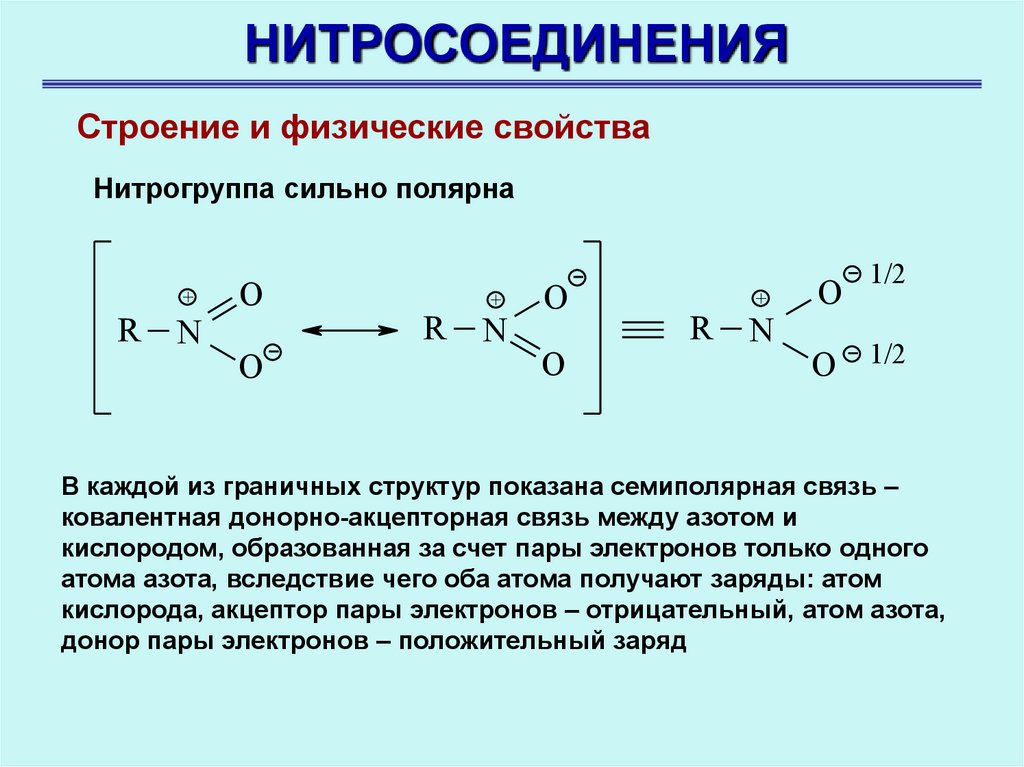
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитрогруппа сильно полярна
+
R
N
O
O
R
+
N
O
O
+
R
N
O
1/2
O 1/2
В каждой из граничных структур показана семиполярная связь –
ковалентная донорно-акцепторная связь между азотом и
кислородом, образованная за счет пары электронов только одного
атома азота, вследствие чего оба атома получают заряды: атом
кислорода, акцептор пары электронов – отрицательный, атом азота,
донор пары электронов – положительный заряд
6.
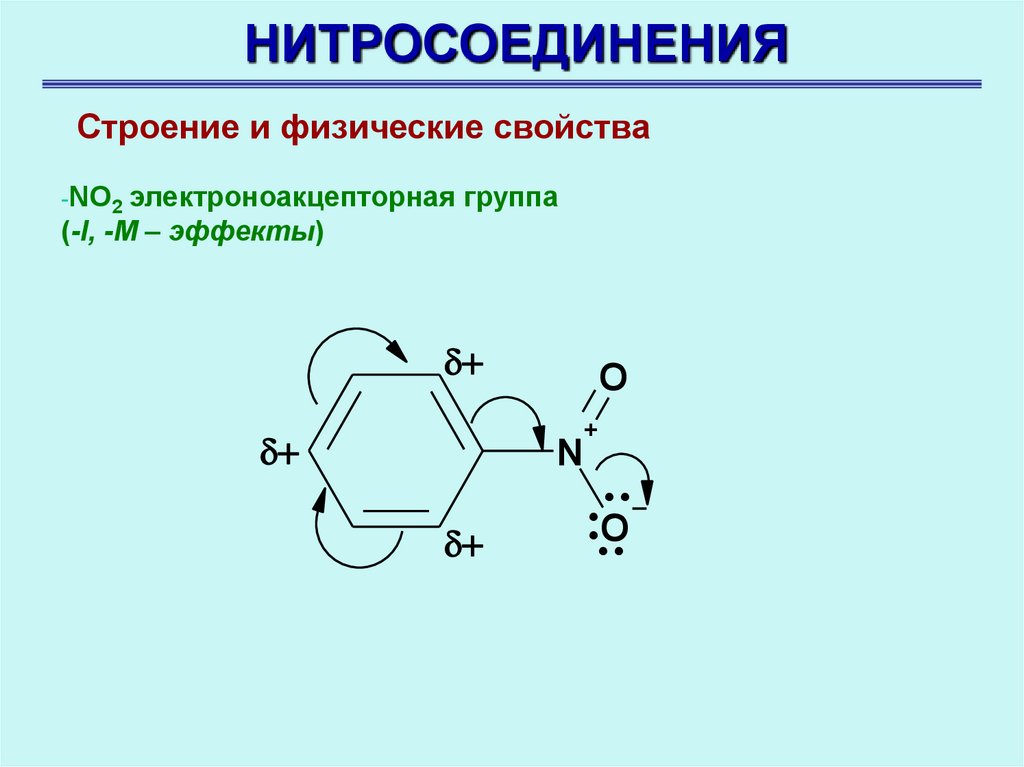
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
-NO2 электроноакцепторная группа
(-I, -M – эффекты)
O
N
+
..
..O
..
7.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитроалканы представляют собой бесцветные жидкости с
высокими для их молекулярных масс температурами кипения.
Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС.
Они обладают приятным запахом, перегоняются без
разложения, мало растворимы в воде, ядовиты. Нитроалкены и
нитроарены – жидкие или твердые вещества желтого цвета. Они
тяжелее воды и не растворимы в ней. Эти нитросоединения
имеют острый запах и высокотоксичны, особенно нитробензол
8.
ФИЗИЧЕСКИЕ СВОЙСТВАНитросоединения жирного ряда – жидкости, обладающие приятным замахом; они мало растворимы в воде,
ядовиты. Это полярные вещества: их дипольные
моменты μ = от 3,5 ÷ 4,0. Поэтому они менее летучи по
сравнению с кетонами с близк. М.м.
Т. кип. (CH3NO2) = 101˚C
Т. кип. (CH3COCH3) = 56˚C
Нитросоединения термодинамически неустойчивы:
CH3NO2
1/2 N2 + CO2 ↑ + 3/2 H2 ;
∆Н = – 67,4 ккал
Могут использоваться в качестве взрывчатых веществ,
например, тринитротолуол (ТНТ)
9.
Токсичные свойстванитросоединений
Нитросоединения
(особенно
ароматические) проникают в организм
через органы дыхания, пищеварения и
кожу, частично выделяются с мочой.
Симптомы острого отравления —
раздражение слизистых оболочек глаз и
дыхательных путей, возбуждение. При
тяжелых отравлениях—отек легких,
судороги, поражение печени.
9
10.
НИТРОСОЕДИНЕНИЯХимические свойства
Термодинамическая неустойчивость нитросоединений
Молярная теплота разложения нитрометана около 270 кДж/моль
СН3NO2→ 1/2 N2 + CO2 + 3/2 H2
Значительная энергия и большая скорость такого процесса
послужили основой для практического применения
нитросоединений в качестве взрывчатых веществ
11.
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Восстановление нитросоединений до аминов – наиболее
важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов оловом или
железом в кислой среде, водородом в условиях гетерогенного
катализа
СН 3NO 2
H 2, Ni
СН 3NH 2 + 2H 2O,
∆Н= -356 кДж/моль
12.
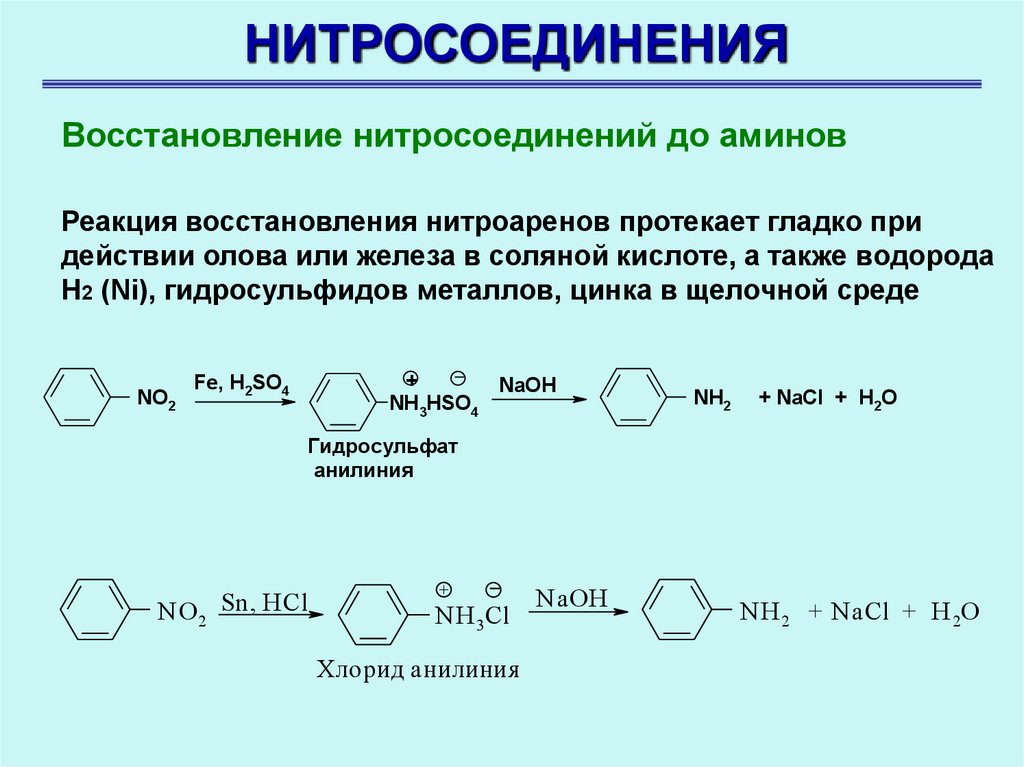
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Реакция восстановления нитроаренов протекает гладко при
действии олова или железа в соляной кислоте, а также водорода
Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде
NO2
+
NaOH
NH3HSO4
Fe, H2SO4
NH2
+ NaCl + H2O
Гидросульфат
анилиния
N O 2 Sn, HCl
+
N H 3Cl
Хлорид анилиния
NaOH
N H 2 + NaCl + H 2O
13.
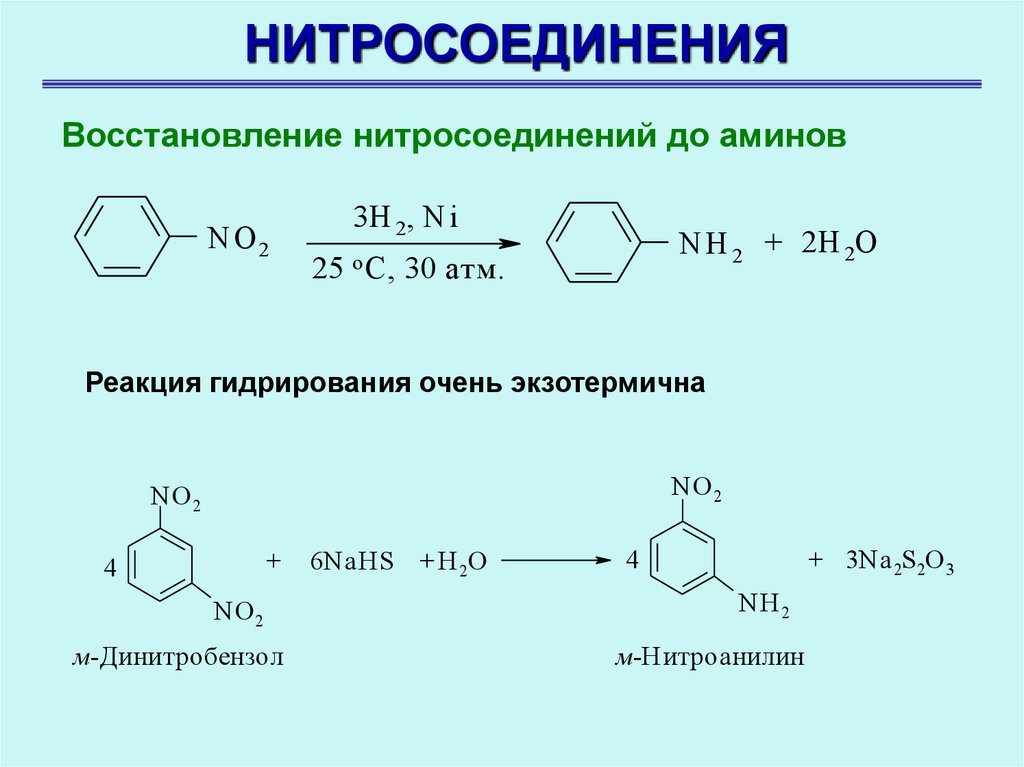
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
NO 2
3H 2, Ni
NH 2 + 2H 2O
25 o C, 30 атм.
Реакция гидрирования очень экзотермична
NO 2
NO 2
+
4
NO 2
м-Динитробензол
6NaHS
+ H 2O
4
+ 3Na 2S2O 3
NH 2
м-Нитроанилин
14.
НИТРОСОЕДИНЕНИЯЗИНИН
Николай Николаевич
(25.VIII.1812–18.II.1880)
академик, возглавлял кафедру
общей химии Медикохирургической академии в
Петербурге, организатор и
первый президент Русского
химического общества. Известен
своими работами в области
ароматических нитросоединений.
15.
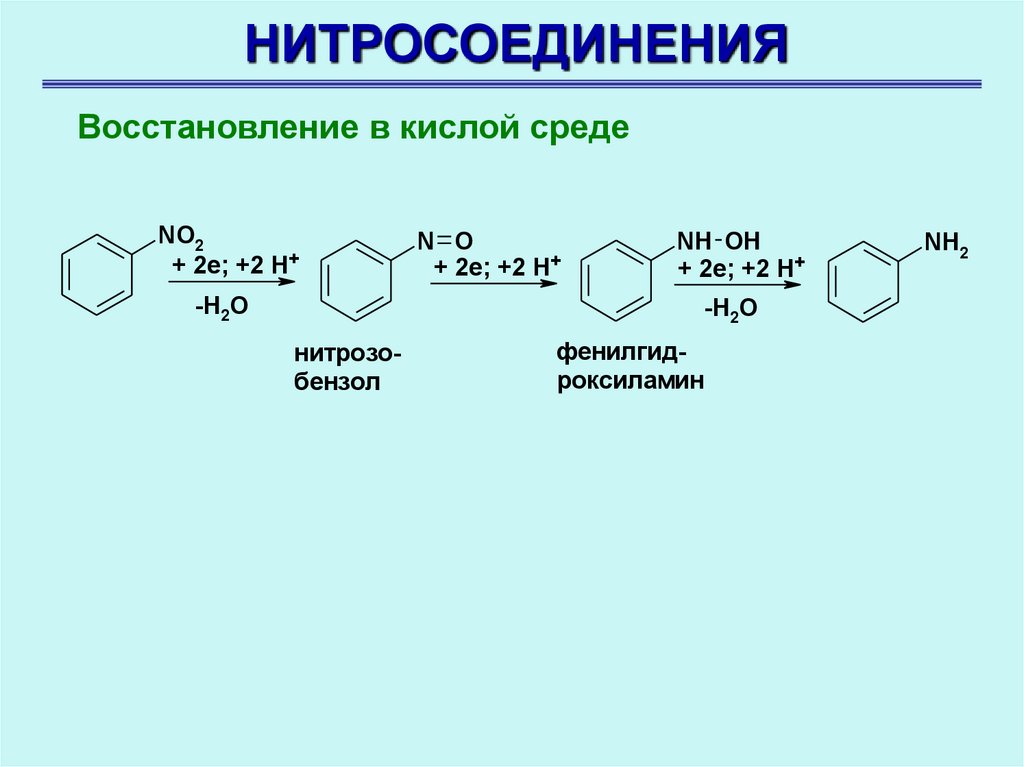
НИТРОСОЕДИНЕНИЯВосстановление в кислой среде
NO2
+ 2e; +2 H+
-H2O
N O
+ 2e; +2 H+
NH OH
+ 2e; +2 H+
-H2O
нитрозобензол
фенилгидроксиламин
NH2
16.
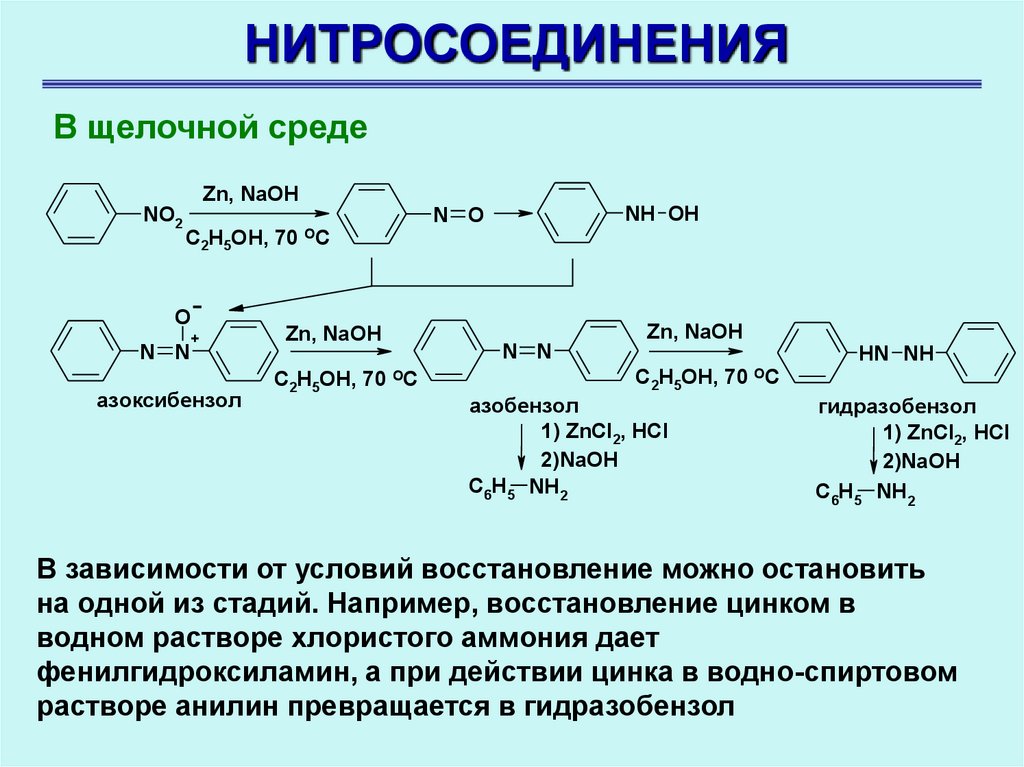
НИТРОСОЕДИНЕНИЯВ щелочной среде
NO2
Zn, NaOH
C2H5OH, 70 OC
O
N N
+
азоксибензол
Zn, NaOH
C2H5OH, 70 OC
NH OH
N O
N N
Zn, NaOH
HN NH
C2H5OH, 70 OC
азобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
гидразобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
В зависимости от условий восстановление можно остановить
на одной из стадий. Например, восстановление цинком в
водном растворе хлористого аммония дает
фенилгидроксиламин, а при действии цинка в водно-спиртовом
растворе анилин превращается в гидразобензол
17.
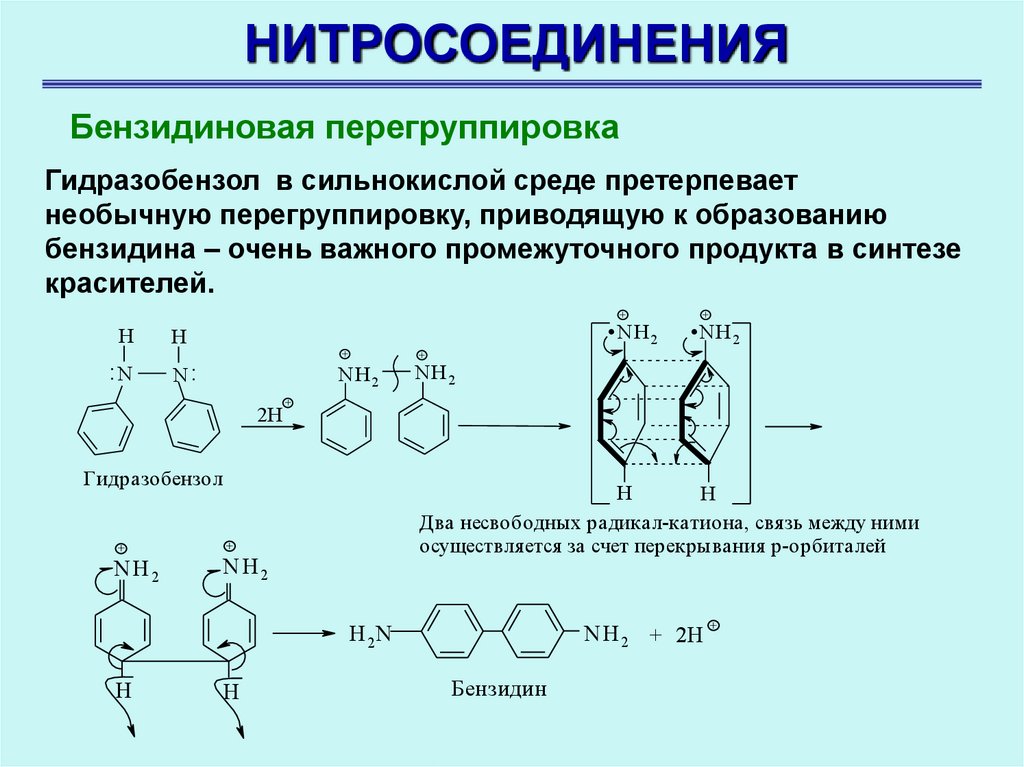
НИТРОСОЕДИНЕНИЯБензидиновая перегруппировка
Гидразобензол в сильнокислой среде претерпевает
необычную перегруппировку, приводящую к образованию
бензидина – очень важного промежуточного продукта в синтезе
красителей.
.NH .NH
+
H
:N
H
2
+
N:
NH 2
+
Гидразобензол
NH2
H
H
Два несвободных радикал-катиона, связь между ними
осуществляется за счет перекрывания р-орбиталей
+
NH2
N H 2 + 2H +
H 2N
H
H
2
+
NH 2
2H
+
+
Бензидин
18.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Нитрометан обладает настолько сильными кислотными
свойствами, что способен растворяться в едком натре
+
CH 2 N
H
OH
+
Na
O
O
+
-H 2O
CH 2 N
O
O
+
CH 2 N
+
Na
O
O
+
CH 2 N
O
O
19.
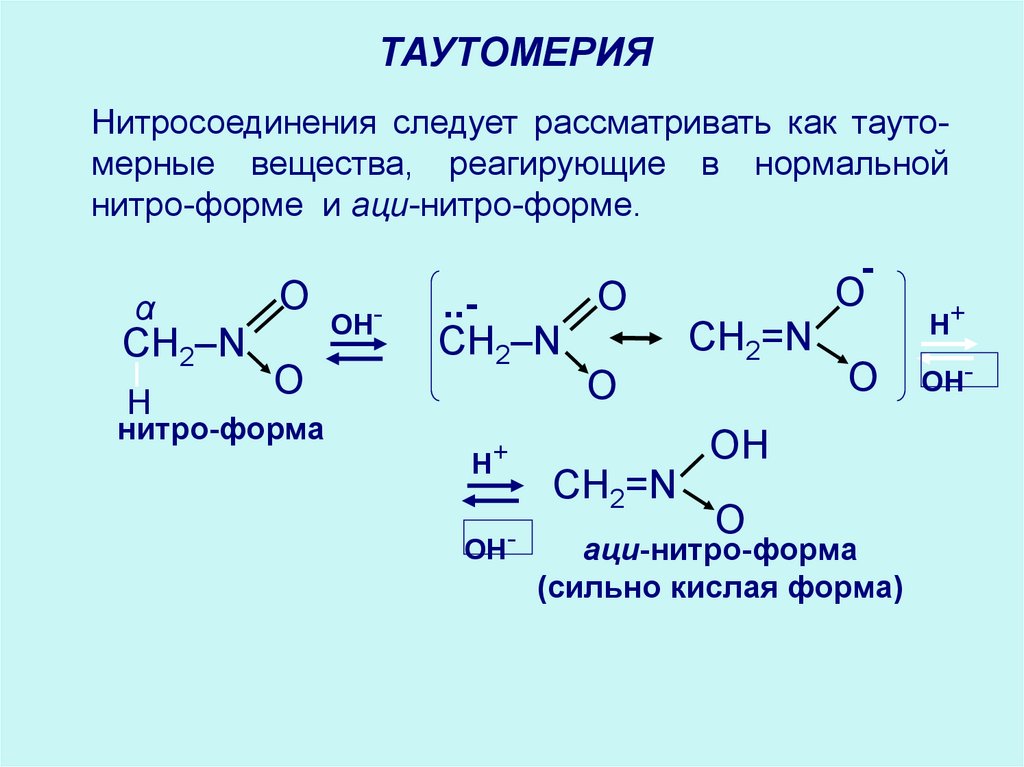
ТАУТОМЕРИЯНитросоединения следует рассматривать как таутомерные вещества, реагирующие в нормальной
нитро-форме и аци-нитро-форме.
α
CH2–N
H
O
O
нитро-форма
OH-
O
..CH2–N
O
H+
OH-
O
CH2=N
O
OН
CH2=N
O
аци-нитро-форма
(сильно кислая форма)
H+
OH-
20.
ТАУТОМЕРИЯ НИТРОСОЕДИНЕНИЙВ растворе нормальные первичные и вторичные
нитроалканы находятся в равновесии с аци-нитроформой. Равновесие между обеими формами
устанавливается при помощи общего аниона
быстро
медленно
Нормальная форма → Анион + Н+ → аци-Форма
Нормальная форма CH3NО2
Каци 5,6∙10–4
Кнорм 6,1.10–11
Количество ациФормы К∙100, %
0,000011
CH3CH2NО2
3,9∙10–5
3,5∙10– 9
(CH3)2CHNО2
7,7 ∙ 10‒6
2,1∙10–8
0,0089
0,275
21.
б).При
разложении
натриевой
соли
ацинитросоединения избытком холодной
минераль-ной
кислоты
(раствор
соли
вливают
в
кислоту)
образуются альдегиды и соответственно кетоны
2RCH=NO-O‒ + 2Н+ → 2RCHO + N2O + Н2O
2R2C=NO-O- + 2Н+ → 2R2CO + N2O + H2O
в). При нагревании первичных нитросоединений с 85%-ной
серной кислотой или с другими сильными кислотами
отщепляется азот в виде гидроксиламина, причем
получаются карбоновые кислоты.
R–СН2‒NO2 + H2SO4 + H2О → R‒СOOH + NH2OH∙H2SO4
22.
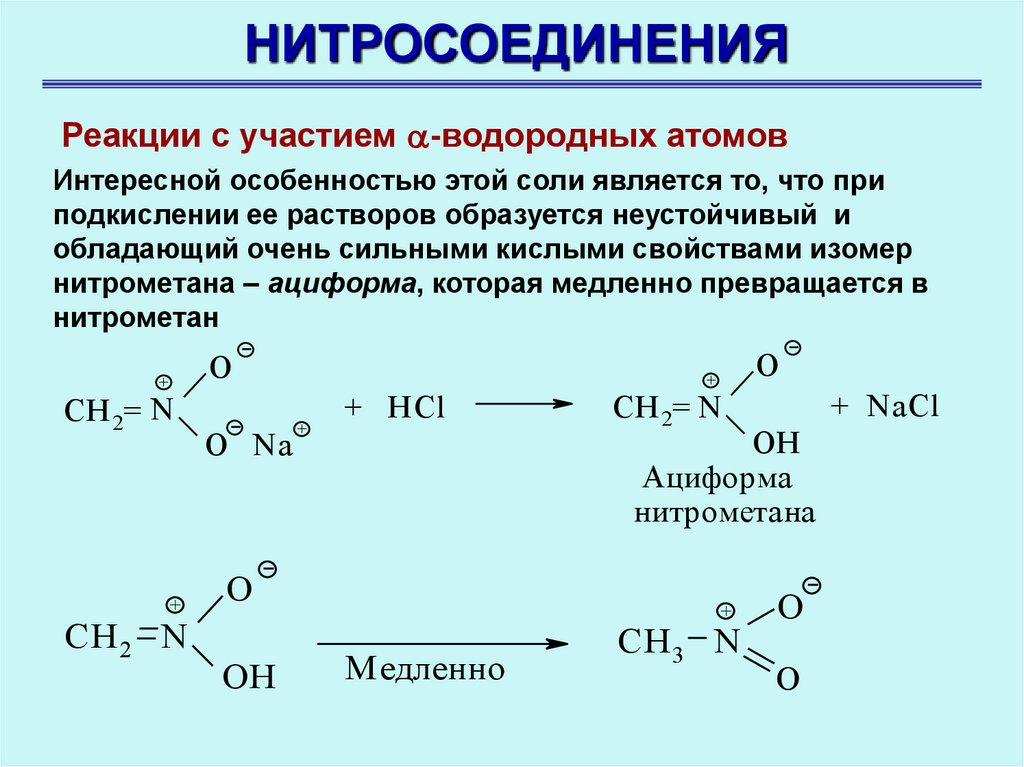
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Интересной особенностью этой соли является то, что при
подкислении ее растворов образуется неустойчивый и
обладающий очень сильными кислыми свойствами изомер
нитрометана – ациформа, которая медленно превращается в
нитрометан
O
+
CH 2= N
+
CH 2 N
O Na
+
+ HCl
+ NaCl
CH 2= N
OH
Ациформа
нитрометана
O
OH
O
+
+
Медленно
CH 3 N
O
O
23.
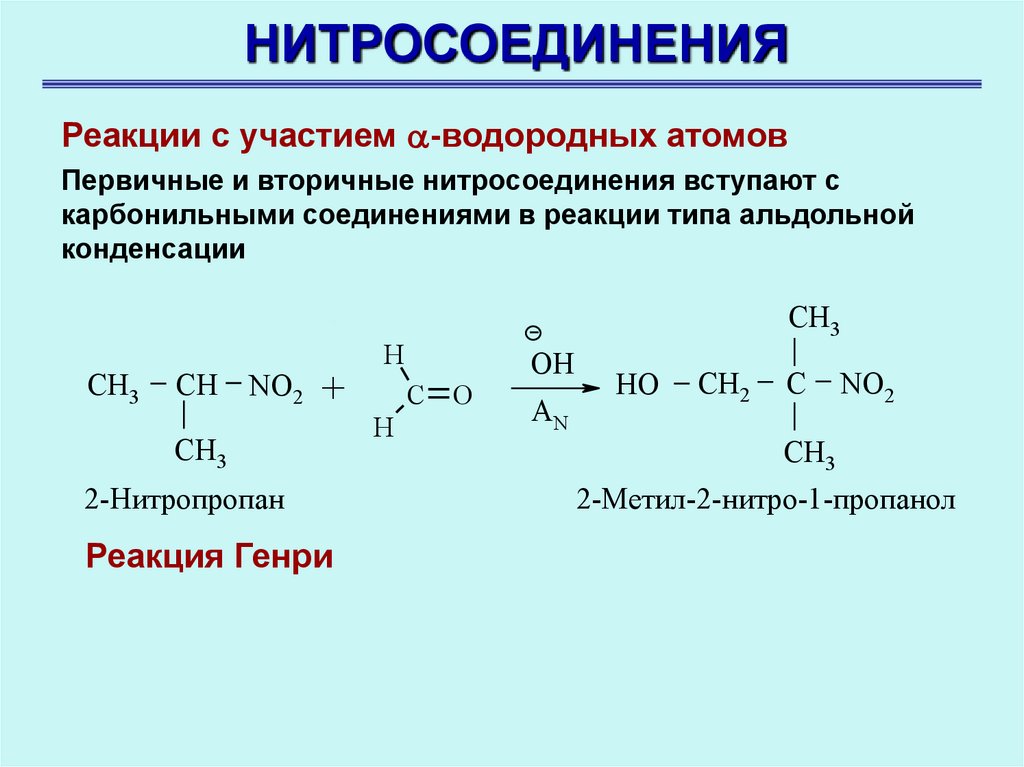
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Первичные и вторичные нитросоединения вступают с
карбонильными соединениями в реакции типа альдольной
конденсации
CH3
CH
NO2 +
CH3
2-Нитропропан
Реакция Генри
CH3
H
C O
H
OH
AN
HO
CH2
C
NO2
CH3
2-Метил-2-нитро-1-пропанол
24.
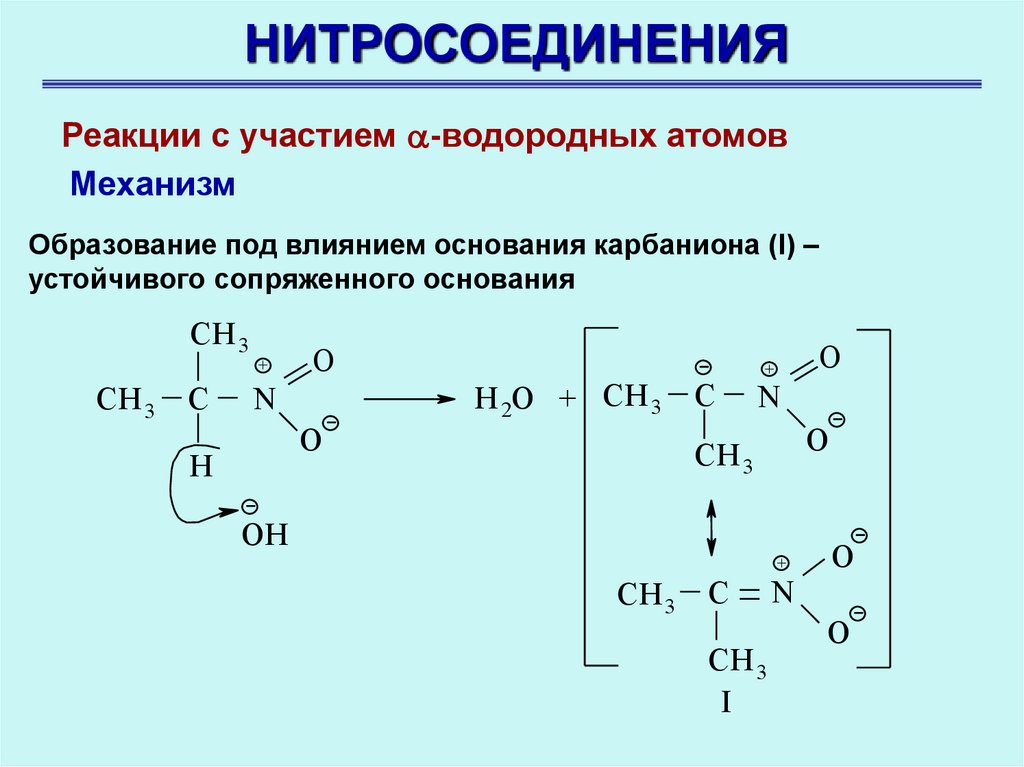
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Образование под влиянием основания карбаниона (I) –
устойчивого сопряженного основания
CH 3
CH 3
C
+
O
N
H 2O + CH 3
O
Н
C
O
+
N
O
CH 3
OH
+
CH 3
C
CH 3
I
O
N
O
25.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Далее происходит взаимодействие муравьиного альдегида с
нуклеофилом (I) и образование промежуточного продукта (II)
O
H 2C
CH 3
C
NO 2
CH 3
I
Н
O
CH 3
C
C
Н
CH 3
II
NO 2
26.
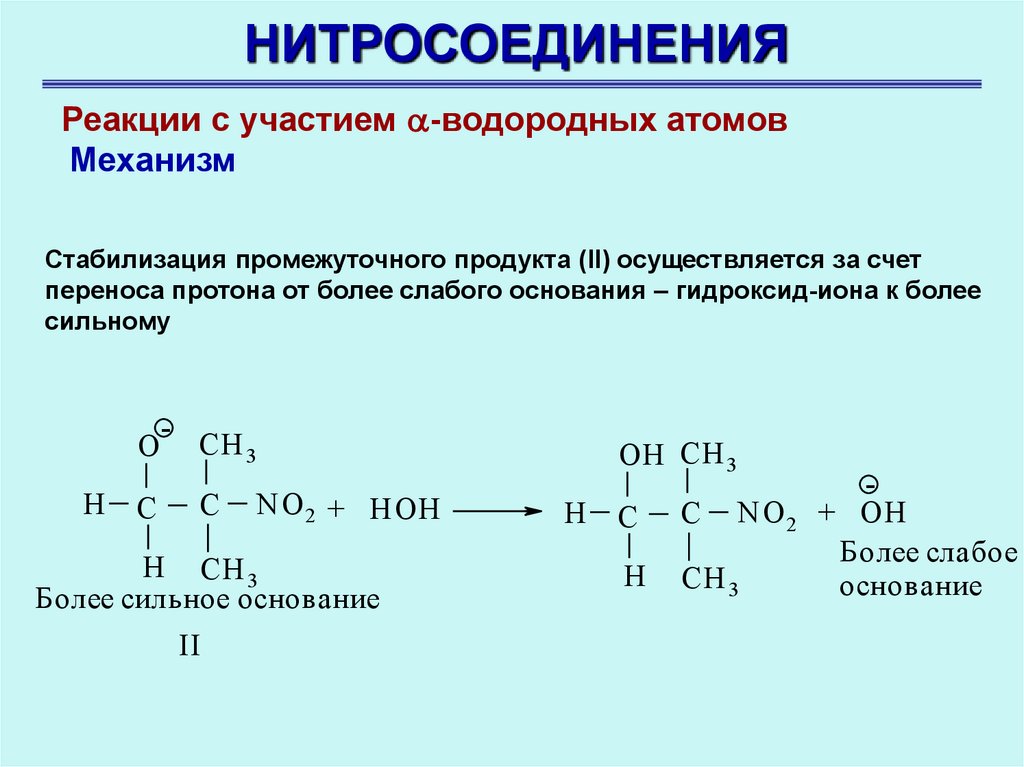
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Стабилизация промежуточного продукта (II) осуществляется за счет
переноса протона от более слабого основания – гидроксид-иона к более
сильному
O
Н
C
-
CH 3
C
OH CH 3
NO 2 + HOH
Н CH 3
Более сильное основание
II
Н
C
Н
-
NO 2 + OH
Более слабое
CH 3
основание
C
27.
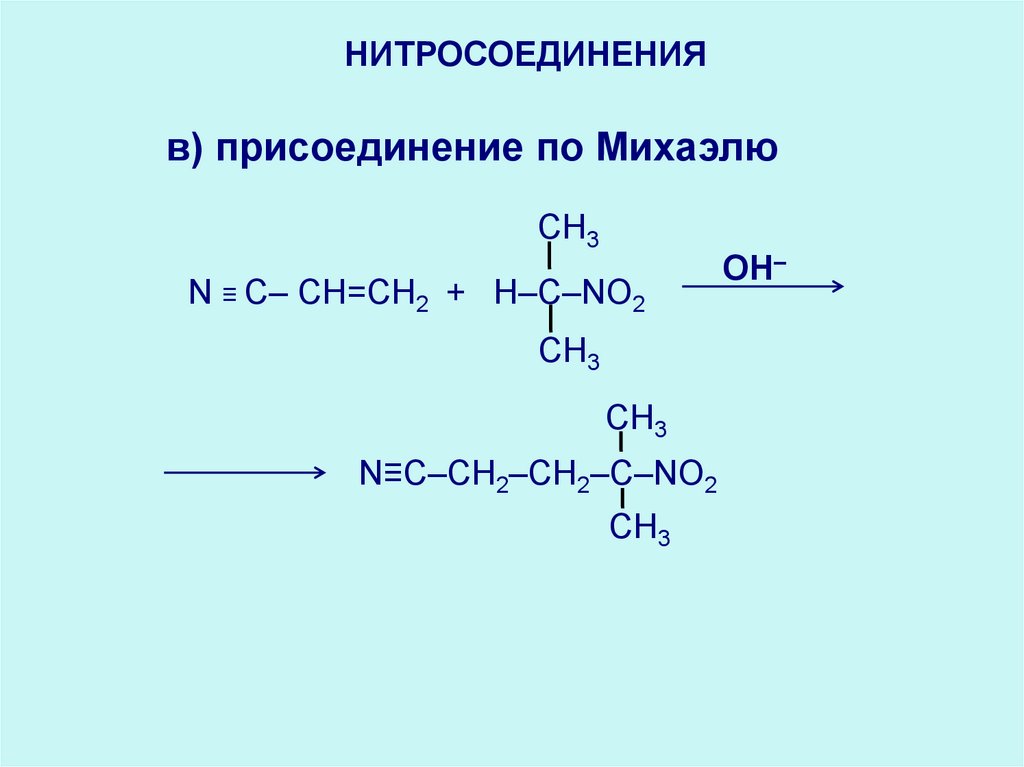
НИТРОСОЕДИНЕНИЯв) присоединение по Михаэлю
CH3
N ≡ C– CH=СН2 + H–C–NO2
CH3
CH3
N≡C–CH2–CH2–C–NO2
CH3
OH–
28.
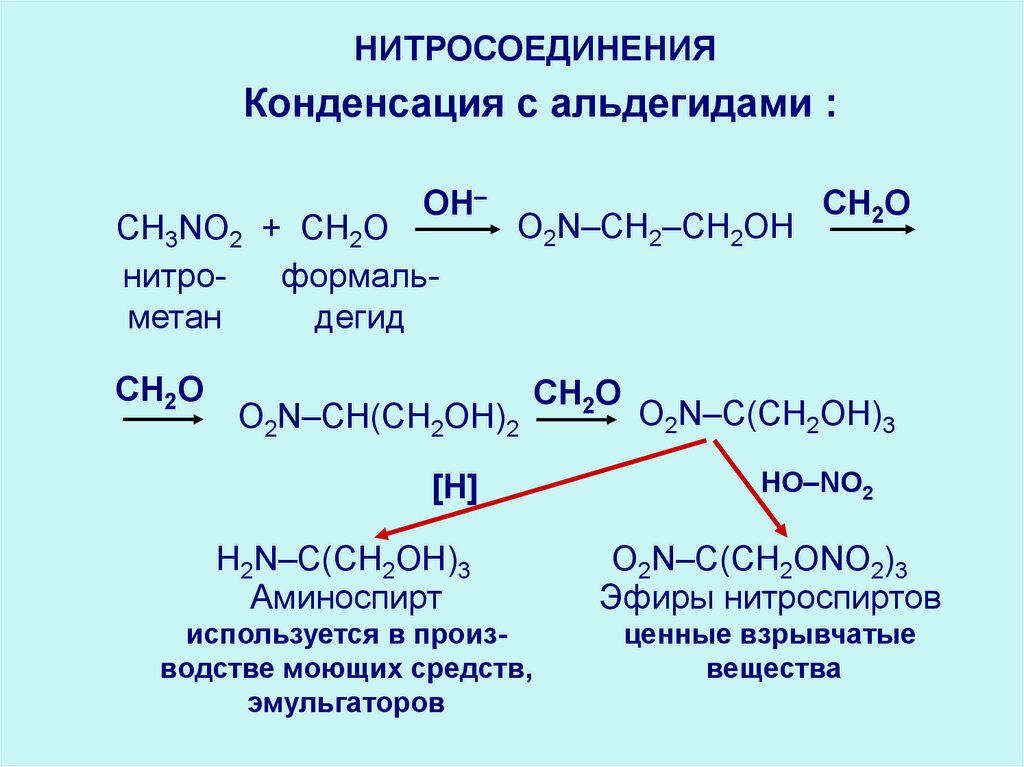
НИТРОСОЕДИНЕНИЯКонденсация с альдегидами :
OН‒
CH3NO2 + CH2O
формальнитродегид
метан
O2N–CH2–CH2OH
CH2O
CH2O
O2N–CH(CH2OH)2
[H]
CH2O
O2N–C(CH2OH)3
HO–NO2
H2N–C(CH2OH)3
Аминоспирт
О2N–C(CH2ONO2)3
Эфиры нитроспиртов
используется в производстве моющих средств,
эмульгаторов
ценные взрывчатые
вещества
29.
НИТРОСОЕДИНЕНИЯСпособы получения
Нитрование алканов. Реакция Коновалова
Известно несколько способов нитрования алканов.
По жидкофазному способу алканы нитруют разбавленной азотной
кислотой, с массовой долей 40-50 %
HNO 3, 120-125 o C, P
CH 3CHCH 2CH 3 + H 2O
CH 3CH 2CH 2CH 3
SR
NO 2
2-Нитробутан
(основной продукт)
По парофазному способу алканы нитруют в парах при температуре
350-500 оС
HNO 3
CH 3CH 2CH 3
CH 3CHCH 3 +
Пропан
NO 2
2-Нитропропан
Выход 40 %
+
CH 3CH 2NO 2
+
Нитроэтан
Выход 10 %
Нитрометан
Выход 25 %
CH 3NO 2
CH 3CH 2CH 2NO 2 +
1-Нитропропан
Выход 25 %
+
H 2O
30.
НИТРОСОЕДИНЕНИЯСпособы получения
Замещение галогена на нитрогруппу в галогеналканах
Удобным лабораторным методом получения первичных нитроалканов
является реакция нуклеофильного замещения галогена нитрит-ионом
R–X + NaNO2 → R–NO2 + NaX
CH 3CH 2CH 2Br
1-Бромпропан
ClCH 2COOH
Хлоруксусная
кислота
O 2N
+
NaNO 2
NaOH
CH 2
ДМФА
SN 2
ClCH 3COONa
CH 3CH 2CH 2NO 2 +
1-Нитропропан
NaNO 2
SN 2
O 2NCH 2COONa
100 o C
CH 3NO 2
COO H
- CO 2 Нитрометан
NaBr
H 3O
+
31.
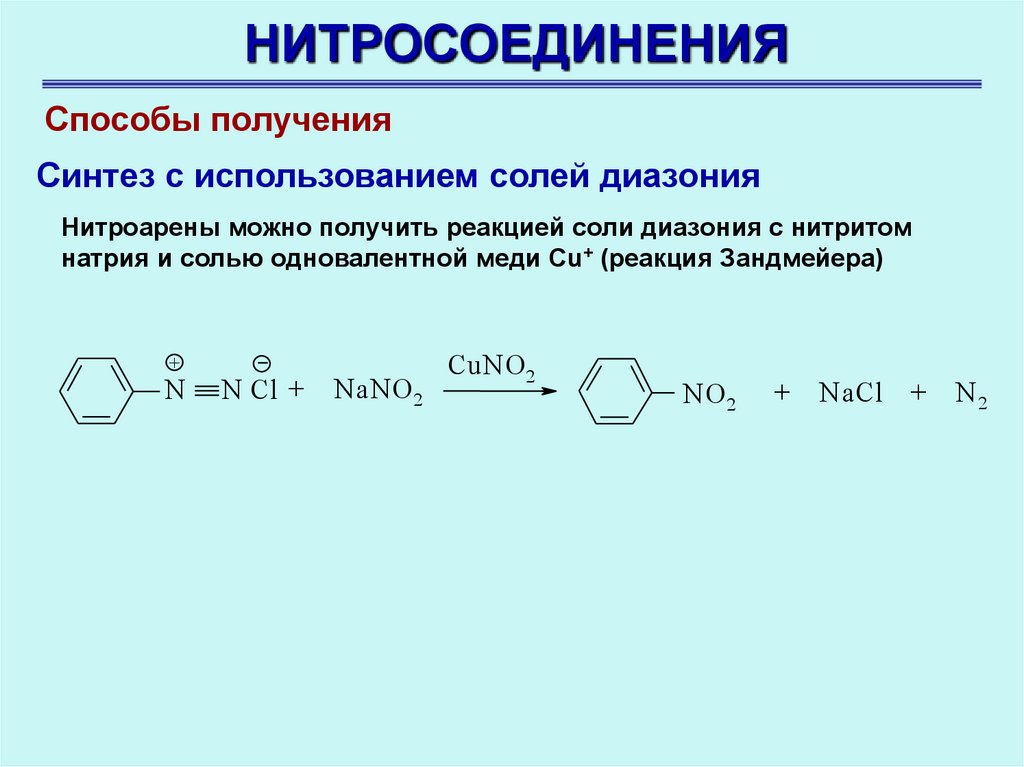
НИТРОСОЕДИНЕНИЯСпособы получения
Синтез с использованием солей диазония
Нитроарены можно получить реакцией соли диазония с нитритом
натрия и солью одновалентной меди Cu+ (реакция Зандмейера)
+
N
N Cl +
NaNO 2
CuNO 2
NO 2
+
NaCl +
N2
32.
Виды нитросоединений• Различают моно-, ди-, три- и полинитросоединения
(поли-Н.). Н. могут быть алифатическими
(нитропарафины и нитроолефины);
ароматическими, содержащими нитрогруппы в
ароматическом ядре,например Нитроанилины,
Нитробензол, Нитротолуолы, Нитронафталины и
др.; жирноароматическими — Н. с нитрогруппами
только в боковой алифатической цепи, например
фенилнитрометан С6Н5СН2NO2, нитростирол C6H5CH
= CHNO2 и др., а также Н. с нитрогруппами в
боковой цепи и ароматическом кольце, например
n-нитрофенилнитрометан O2NC6H4CH2NO2.
33.
• Ароматические Н. — желтоватые жидкости иликристаллические вещества, хорошо растворимые в
органических растворителях, плохо — в воде; их
синтезируют в промышленности и лабораторных
условиях нитрованием ароматических соединений
нитрующими смесями. Ароматические поли-Н.
применяются в качестве взрывчатых
веществ[Тринитротолуол, аммониевая соль
тринитрофенола , тринитрофенилметилнитрамин и
др.]. Восстановление нитрогрупп приводит к
ароматическим аминам — полупродуктам в
производстве различных красителей.
34.
• Алифатические Н. получают впромышленности главным образом
нитрованием парафинов азотной кислотой
или окислами азота. Простейшие
мононитропарафины — бесцветные жидкости
со своеобразным запахом. Нитро-парафины
легко восстанавливаются до гидроксиламинов
и аминов. При действии оснований первичные
и вторичные Н. образуют соли аци-формы
нитросоединений, т. н. изонитросоединений
(I), легко превращающиеся в альдегиды или
кетоны (II):
















 chemistry
chemistry








