Similar presentations:
Практические рекомендации по требованиям мониторинга
1.
Практические рекомендациипо требованиям мониторинга
Лымарева Лилия Александровна
г. Волгоград
Доклад подготовлен при поддержке компании Pfizer
2.
Обязательные требования кмониторингу
Для инициации и контроля терапии при применении
ингибиторов CDK 4/6
3.
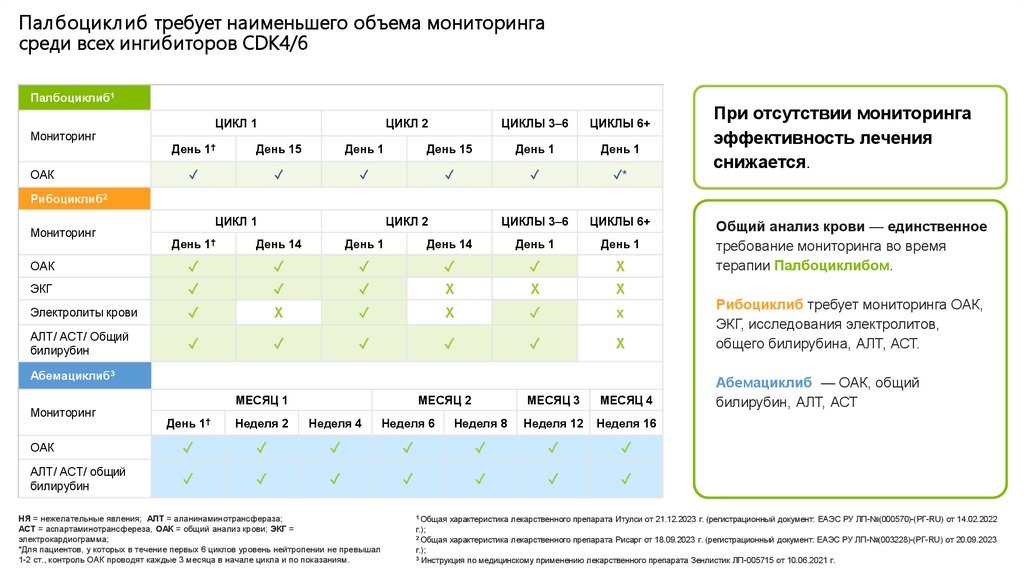
Палбоцикл иб требует наименьшего объема мониторингасреди всех ингибиторов СDK4/6
Палбоциклиб1
Мониторинг
ОАК
ЦИКЛ 1
ЦИКЛ 2
ЦИКЛЫ 3–6
ЦИКЛЫ 6+
День 1†
День 15
День 1
День 15
День 1
День 1
✓
✓
✓
✓
✓
✓*
ЦИКЛЫ 3–6
ЦИКЛЫ 6+
При отсутствии мониторинга
эффективность лечения
снижается.
Рибоциклиб2
Мониторинг
ЦИКЛ 1
ЦИКЛ 2
День 1†
День 14
День 1
День 14
День 1
День 1
ОАК
✓
✓
✓
✓
✓
X
ЭКГ
✓
✓
✓
X
X
X
Электролиты крови
✓
X
✓
X
✓
x
АЛТ/ АСТ/ Общий
билирубин
✓
✓
✓
✓
✓
X
Абемациклиб3
Мониторинг
МЕСЯЦ 1
МЕСЯЦ 2
МЕСЯЦ 3
МЕСЯЦ 4
День 1†
Неделя 2
Неделя 4
Неделя 6
Неделя 8
Неделя 12
Неделя 16
ОАК
✓
✓
✓
✓
✓
✓
✓
АЛТ/ АСТ/ общий
билирубин
✓
✓
✓
✓
✓
✓
✓
НЯ = нежелательные явления; АЛТ = аланинаминотрансфераза;
АСТ = аспартаминотрансфереза, ОАК = общий анализ крови; ЭКГ =
электрокардиограмма;
*Для пациентов, у которых в течение первых 6 циклов уровень нейтропении не превышал
1-2 ст., контроль ОАК проводят каждые 3 месяца в начале цикла и по показаниям.
Общий анализ крови — единственное
требование мониторинга во время
терапии Палбоциклибом.
Рибоциклиб требует мониторинга ОАК,
ЭКГ, исследования электролитов,
общего билирубина, АЛТ, АСТ.
Абемациклиб — ОАК, общий
билирубин, АЛТ, АСТ
1 Общая характеристика лекарственного препарата Итулси от 21.12.2023 г. (регистрационный документ: ЕАЭС РУ ЛП-№(000570)-(РГ-RU) от 14.02.2022
г.);
2 Общая характеристика лекарственного препарата Рисарг от 18.09.2023 г. (регистрационный документ: ЕАЭС РУ ЛП-№(003228)-(РГ-RU) от 20.09.2023
г.);
3 Инструкция по медицинскому применению лекарственного препарата Зенлистик ЛП-005715 от 10.06.2021 г.
4.
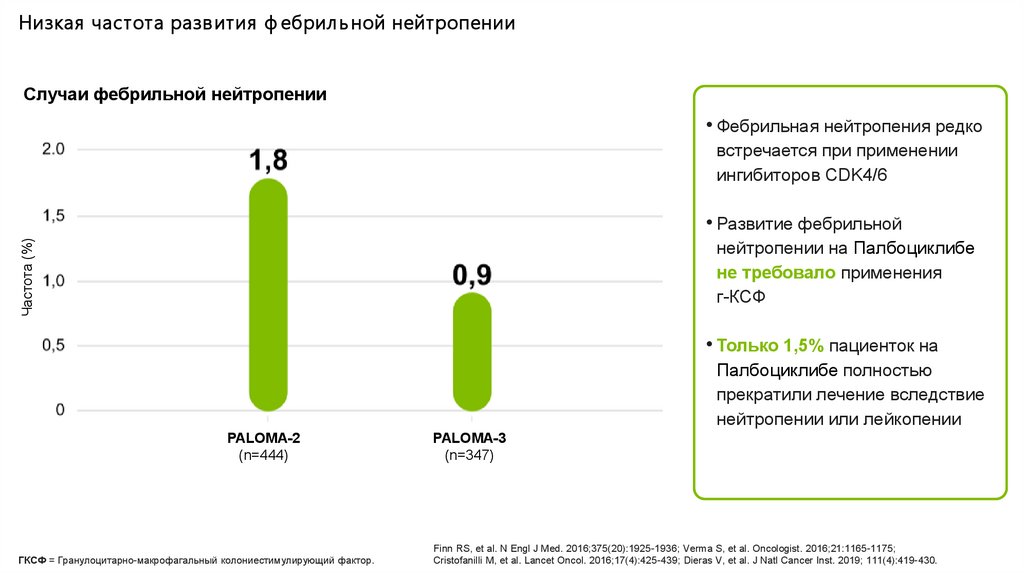
Низкая частота разв ития ф ебрил ь ной нейтропении в кл инических иссл едов аниях Пал боцикл иба
Случаи фебрильной нейтропении
• Фебрильная нейтропения редко
встречается при применении
ингибиторов CDK4/6
Частота (%)
• Развитие фебрильной
нейтропении на Палбоциклибе
не требовало применения
г-КСФ
• Только 1,5% пациенток на
Палбоциклибе полностью
прекратили лечение вследствие
нейтропении или лейкопении
PALOMA-2
(n=444)
ГКСФ = Гранулоцитарно-макрофагальный колониестимулирующий фактор.
PALOMA-3
(n=347)
Finn RS, et al. N Engl J Med. 2016;375(20):1925-1936; Verma S, et al. Oncologist. 2016;21:1165-1175;
Cristofanilli M, et al. Lancet Oncol. 2016;17(4):425-439; Dieras V, et al. J Natl Cancer Inst. 2019; 111(4):419-430.
5.
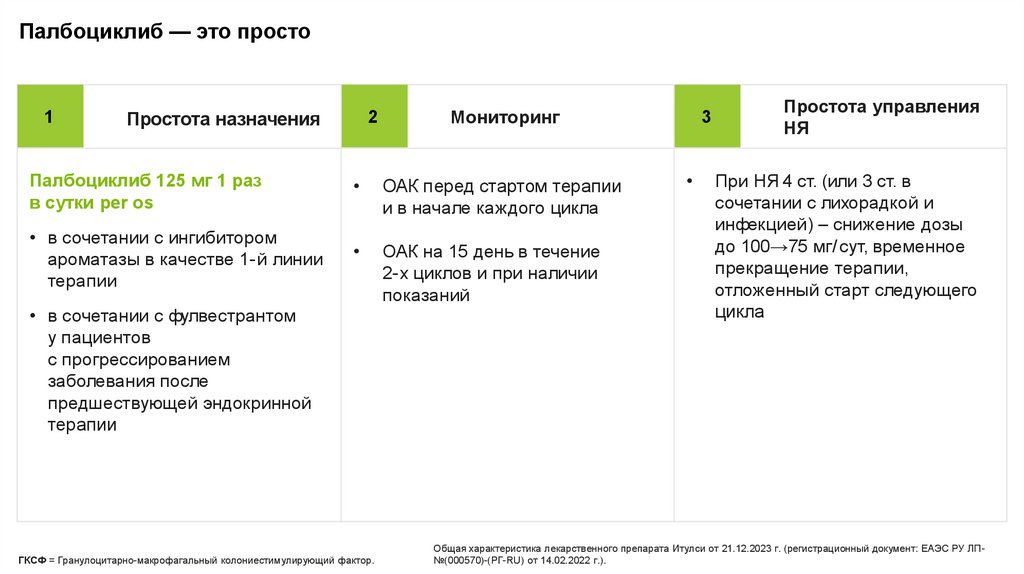
Палбоциклиб — это просто1
Простота назначения
2
Мониторинг
Палбоциклиб 125 мг 1 раз
в сутки per os
ОАК перед стартом терапии
и в начале каждого цикла
• в сочетании с ингибитором
ароматазы в качестве 1-й линии
терапии
ОАК на 15 день в течение
2-х циклов и при наличии
показаний
• в сочетании с фулвестрантом
у пациентов
с прогрессированием
заболевания после
предшествующей эндокринной
терапии
ГКСФ = Гранулоцитарно-макрофагальный колониестимулирующий фактор.
3
Простота управления
НЯ
При НЯ 4 ст. (или 3 ст. в
сочетании с лихорадкой и
инфекцией) – снижение дозы
до 100→75 мг/ сут, временное
прекращение терапии,
отложенный старт следующего
цикла
Общая характеристика лекарственного препарата Итулси от 21.12.2023 г. (регистрационный документ: ЕАЭС РУ ЛП№(000570)-(РГ-RU) от 14.02.2022 г.).
6.
Выборингибитора
CDK4/6 при
сопутствующей
патологии
7.
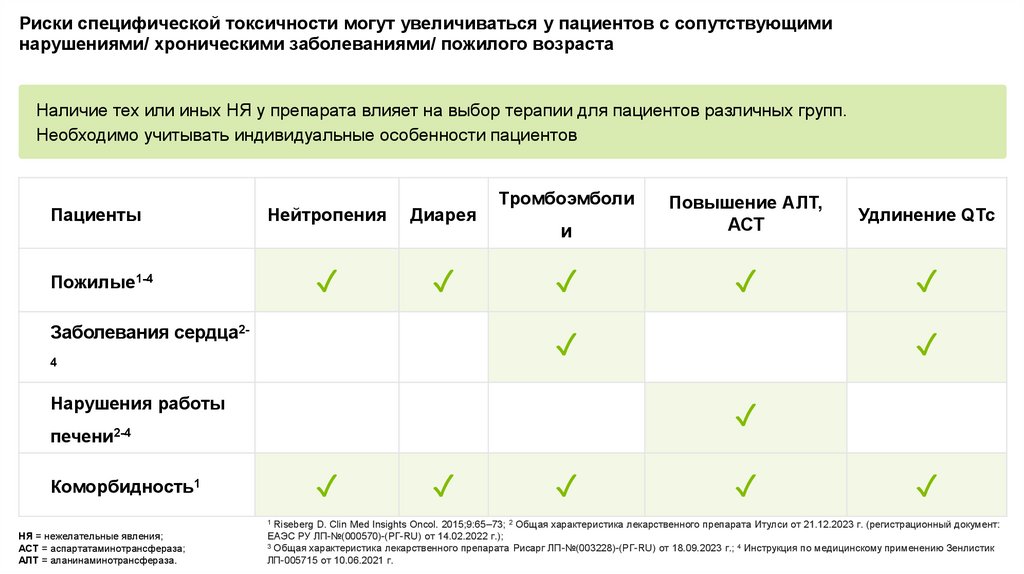
Риски специфической токсичности могут увеличиваться у пациентов с сопутствующиминарушениями/ хроническими заболеваниями/ пожилого возраста
Наличие тех или иных НЯ у препарата влияет на выбор терапии для пациентов различных групп.
Необходимо учитывать индивидуальные особенности пациентов
Пациенты
Нейтропения
Диарея
Пожилые1-4
✓
✓
Заболевания сердца2-
Тромбоэмболи
и
Повышение АЛТ,
АСТ
Удлинение QTc
✓
✓
✓
✓
4
Нарушения работы
✓
печени2-4
Коморбидность1
✓
✓
✓
✓
✓
✓
1 Riseberg D. Clin Med Insights Oncol. 2015;9:65–73; 2 Общая характеристика лекарственного препарата Итулси от 21.12.2023 г. (регистрационный документ:
НЯ = нежелательные явления;
АСТ = аспартатаминотрансфераза;
АЛТ = аланинаминотрансфераза.
ЕАЭС РУ ЛП-№(000570)-(РГ-RU) от 14.02.2022 г.);
3 Общая характеристика лекарственного препарата Рисарг ЛП-№(003228)-(РГ-RU) от 18.09.2023 г.; 4 Инструкция по медицинскому применению Зенлистик
ЛП-005715 от 10.06.2021 г.
8.
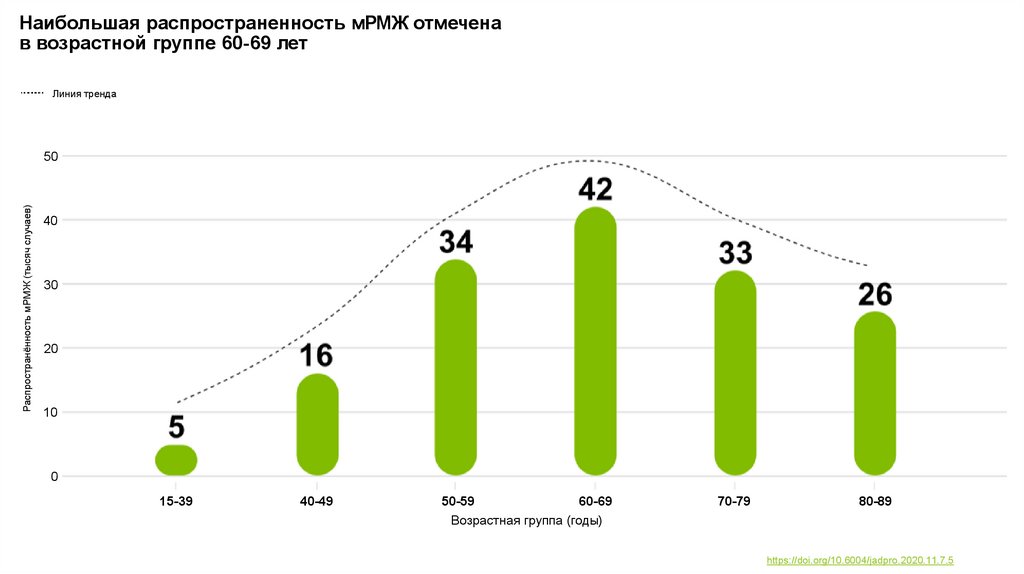
Наибольшая распространенность мРМЖ отмеченав возрастной группе 60-69 лет
Линия тренда
Распространённость мРМЖ (тысяч случаев)
50
40
30
20
10
0
15-39
40-49
50-59
60-69
Возрастная группа (годы)
70-79
80-89
https://doi.org/10.6004/jadpro.2020.11.7.5
9.
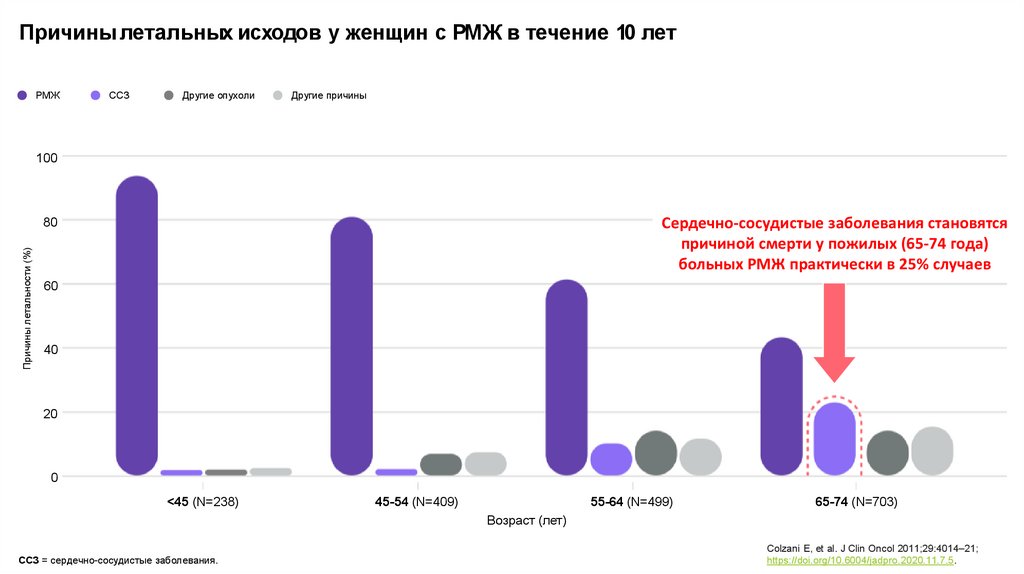
Причины летальных исходов у женщин с РМЖ в течение 10 летРМЖ
ССЗ
Другие опухоли
Другие причины
100
Сердечно-сосудистые заболевания становятся
причиной смерти у пожилых (65-74 года)
больных РМЖ практически в 25% случаев
Причины летальности (%)
80
60
40
20
0
<45 (N=238)
45-54 (N=409)
55-64 (N=499)
65-74 (N=703)
Возраст (лет)
ССЗ = сердечно-сосудистые заболевания.
Colzani E, et al. J Clin Oncol 2011;29:4014–21;
https://doi.org/10.6004/jadpro.2020.11.7.5.
10.
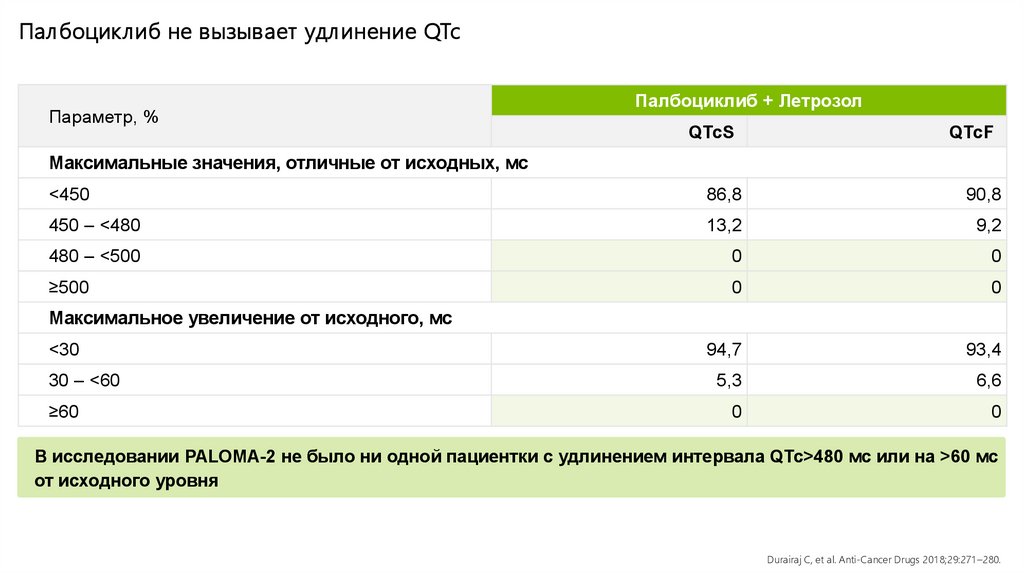
Палбоциклиб не вызывает удл инение QTcПараметр, %
Палбоциклиб + Летрозол
QTcS
QTcF
<450
86,8
90,8
450 – <480
13,2
9,2
480 – <500
0
0
≥500
0
0
<30
94,7
93,4
30 – <60
5,3
6,6
0
0
Максимальные значения, отличные от исходных, мс
Максимальное увеличение от исходного, мс
≥60
В исследовании PALOMA-2 не было ни одной пациентки с удлинением интервала QTc>480 мс или на >60 мс
от исходного уровня
Durairaj C, et al. Anti-Cancer Drugs 201 8;29:271 –280.
11.
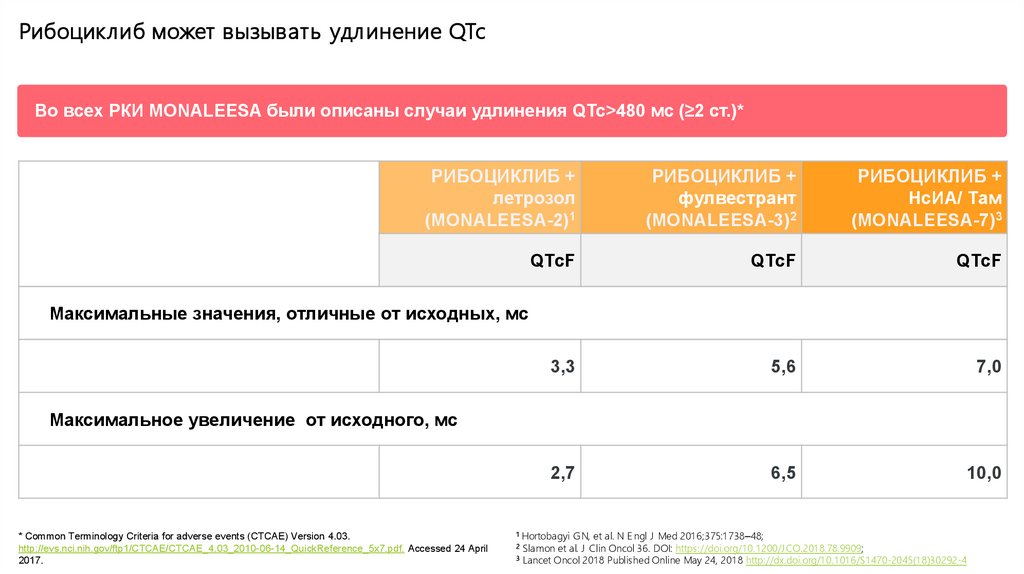
Рибоциклиб может вызывать удл инение QTcВо всех РКИ MONALEESA были описаны случаи удлинения QTc>480 мс (≥2 ст.)*
РИБОЦИКЛИБ +
летрозол
(MONALEESA-2)1
РИБОЦИКЛИБ +
фулвестрант
(MONALEESA-3)2
РИБОЦИКЛИБ +
НсИА/ Там
(MONALEESA-7)3
QTcF
QTcF
QTcF
3,3
5,6
7,0
2,7
6,5
10,0
Максимальные значения, отличные от исходных, мс
Максимальное увеличение от исходного, мс
* Common Terminology Criteria for adverse events (CTCAE) Version 4.03.
http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf. Accessed 24 April
2017.
1 Hortobagyi GN, et al. N E ngl J Med 201 6;375:1 738‒48;
2 Slamon et al. J Clin Oncol 36. DOI: https://doi.org/1 0.1 200/J CO.201 8.78.9909;
3 Lancet Oncol 201 8 Published Online May 24, 201 8 http://dx.doi.org/1 0.1 01 6/S1 470-2045(1 8)30292-4
12.
При выборе ингибитора CDK4/6 необходимо учитыватьриск развития удлинения интервала QTc
В среднем, каждые 2 из 5 пациентов
с HR+ HER2- мРМЖ (1-й линия) имеют
факторы риска удлинения
интервала QTc вследствие
сопутствующих заболеваний или терапии
ТОП-3 сопутствующих
заболеваний:
•ХСН (34%)
•желудочковая аритмия (30%)
•ИМ (21%)
ТОП-3 сопутствующей терапии:
•НПВС (66%)
•антиэметики (43%)
•антидепрессанты (165)
Удлинение QTc не является класс-специфическим эффектом ингибиторов CDK4/6,
и характерно только для рибоциклиба
НЯ 3-4 степени, %
Палбоциклиб
Рибоциклиб
Абемациклиб
Удлинение
интервала QTc
0
3,3*
0
R. Mahtani at al, SABCS 2020, PS7-59.
Finn et al. N Engl J Med 2016;375:1925-36;
Hortobagyi GN, et al. N Engl J Med 2016;375:1738‒48;
Goetz MP, et al. J Clin Oncol. 2017 Nov 10;35(32):3638-3646.
13.
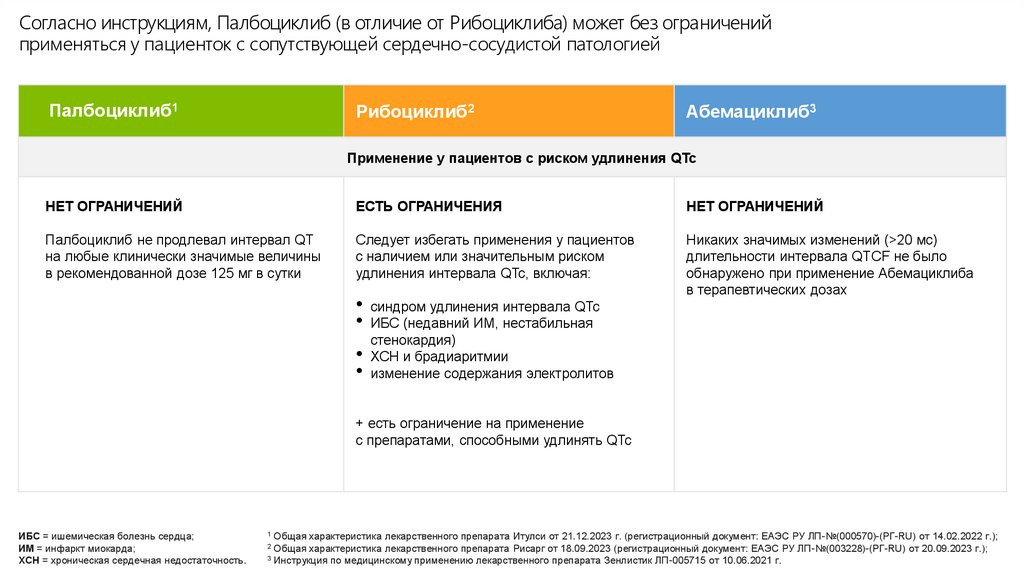
Согласно инструкциям, Палбоциклиб (в отличие от Рибоциклиба) может без ограниченийприменяться у пациенток с сопутствующей сердечно-сосудистой патологией
Палбоциклиб1
Рибоциклиб2
Абемациклиб3
Применение у пациентов с риском удлинения QTc
НЕТ ОГРАНИЧЕНИЙ
ЕСТЬ ОГРАНИЧЕНИЯ
НЕТ ОГРАНИЧЕНИЙ
Палбоциклиб не продлевал интервал QT
на любые клинически значимые величины
в рекомендованной дозе 125 мг в сутки
Следует избегать применения у пациентов
с наличием или значительным риском
удлинения интервала QTc, включая:
Никаких значимых изменений (>20 мс)
длительности интервала QTCF не было
обнаружено при применение Абемациклиба
в терапевтических дозах
• синдром удлинения интервала QTc
• ИБС (недавний ИМ, нестабильная
стенокардия)
• ХСН и брадиаритмии
• изменение содержания электролитов
+ есть ограничение на применение
с препаратами, способными удлинять QTc
ИБС = ишемическая болезнь сердца;
ИМ = инфаркт миокарда;
ХСН = хроническая сердечная недостаточность.
1 Общая характеристика лекарственного препарата Итулси от 21.12.2023 г. (регистрационный документ: ЕАЭС РУ ЛП-№(000570)-(РГ-RU) от 14.02.2022 г.);
2 Общая характеристика лекарственного препарата Рисарг от 18.09.2023 (регистрационный документ: ЕАЭС РУ ЛП-№(003228)-(РГ-RU) от 20.09.2023 г.);
3 Инструкция по медицинскому применению лекарственного препарата Зенлистик ЛП-005715 от 10.06.2021 г.
14.
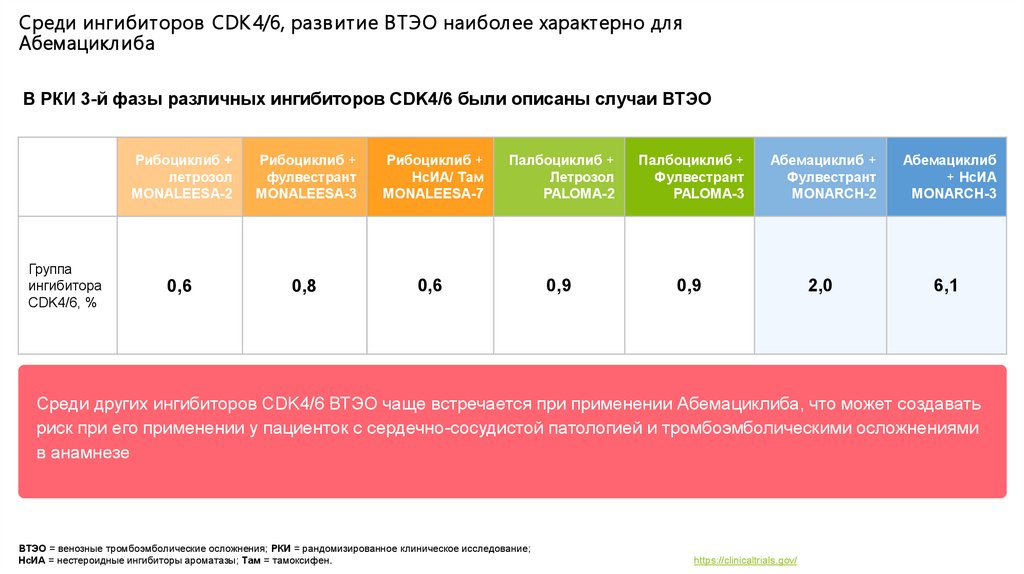
Среди ингибиторов CDK 4/6, разв итие ВТЭО наиболее характерно дляАбемациклиба
В РКИ 3-й фазы различных ингибиторов CDK4/6 были описаны случаи ВТЭО
Группа
ингибитора
CDK4/6, %
Рибоциклиб +
летрозол
MONALEESA-2
Рибоциклиб +
фулвестрант
MONALEESA-3
Рибоциклиб +
НсИА/ Там
MONALEESA-7
Палбоциклиб +
Летрозол
PALOMA-2
Палбоциклиб +
Фулвестрант
PALOMA-3
Абемациклиб +
Фулвестрант
MONARCH-2
Абемациклиб
+ НсИА
MONARCH-3
0,6
0,8
0,6
0,9
0,9
2,0
6,1
Среди других ингибиторов CDK4/6 ВТЭО чаще встречается при применении Абемациклиба, что может создавать
риск при его применении у пациенток с сердечно-сосудистой патологией и тромбоэмболическими осложнениями
в анамнезе
ВТЭО = венозные тромбоэмболические осложнения; РКИ = рандомизированное клиническое исследование;
НсИА = нестероидные ингибиторы ароматазы; Там = тамоксифен.
https://clinicaltrials.gov/
15.
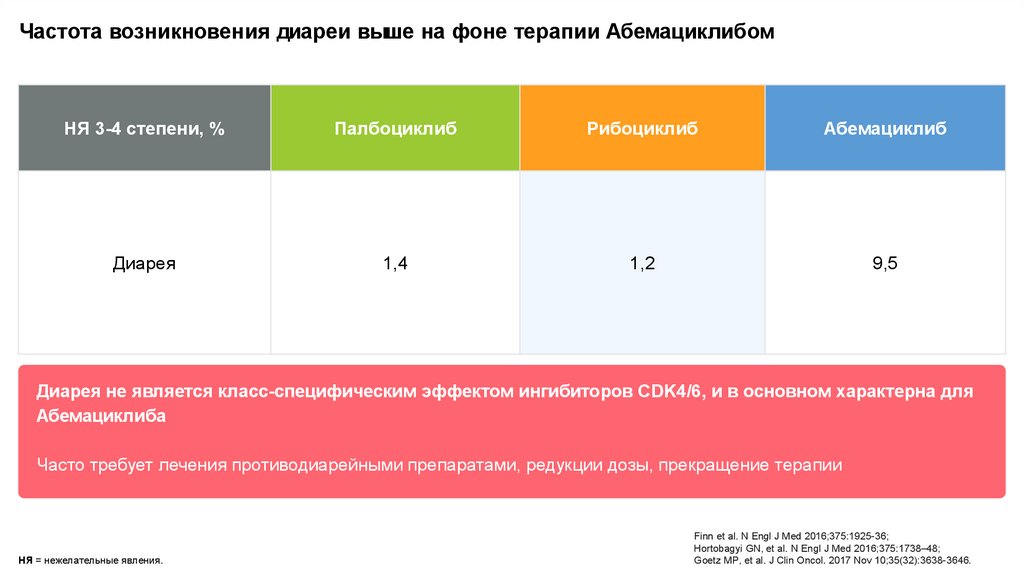
Частота возникновения диареи выше на фоне терапии АбемациклибомНЯ 3-4 степени, %
Палбоциклиб
Рибоциклиб
Абемациклиб
Диарея
1,4
1,2
9,5
Диарея не является класс-специфическим эффектом ингибиторов CDK4/6, и в основном характерна для
Абемациклиба
Часто требует лечения противодиарейными препаратами, редукции дозы, прекращение терапии
НЯ = нежелательные явления.
Finn et al. N Engl J Med 2016;375:1925-36;
Hortobagyi GN, et al. N Engl J Med 2016;375:1738‒48;
Goetz MP, et al. J Clin Oncol. 2017 Nov 10;35(32):3638-3646.
16.
ЗаключениеПри назначении определенного ингибитора CDK4/6 важно учитывать требования
обязательного мониторинга и наличие сопутствующих заболеваний / состояний
сердечно-сосудистые заболевания
нарушение функции печени
патология ЖКТ
риск тромбоэмболических осложнений
риск межлекарственных взаимодействий
Важно обеспечить требуемый мониторинг в полном объеме
Выбор палбоциклиба может быть обоснован в том числе в ситуациях, когда
применение других CDK4/6i сооружено с рисками потенциальной токсичности
1 Общая характеристика лекарственного препарата Итулси от 21 .1 2.2023 г. (регистрационный документ: ЕАЭС РУ ЛП-№(000570)-(РГ-R U) от 1 4.02.2022 г.);
2 Общая характеристика лекарственного препарата Рисарг от 1 8.09.2023 г. (регистрационный документ: ЕАЭС РУ ЛП-№(003228)-(РГ-R U) от 20.09.2023 г.);
3 Инструкция по медицинскому применению лекарственного препарата Зенлистик ЛП-005715 от 1 0.06.2021 г.






 medicine
medicine








