Similar presentations:
Таргетная терапия РМЖ
1. Таргетная терапия РМЖ
Студентка 6 курса Первого МГМУ им. И.М. СеченоваКварианташвили Элена
2. Биологические особенности опухоли
Содержание рецепторов эстрогена и прогестеронаЭкспрессия HER 2
Степень злокачественности (пролиферативный индекс
Ki 67)
Степень распространенности (стадия заболевания)
Возраст пациентки
Гормональный статус (функция яичников)
3. Гены предрасположенности к РМЖ
4.
5. Гены BRCA1 и BRCA2
Половина всех доминантно наследуемых случаевРМЖ
В 10-30 раз повышает риск РМЖ (85% - риск в
течение жизни)
Кодируют белки, участвующие в работе систем
репарации, подавляют транскрипционную
активность рецепторов эстрогенов и регулируют
дифференцировку (гены-супрессоры)
6. BRCA1
РМЖ у молодых женщинАгрессивное течение
Высокая степень пролиферации
Признаки базальноклеточного рака (тройной
негативный РМЖ)
BRCA2
В более позднем возрасте
Медленное течение
Наличие РЭ и РП
7. Соматические мутации при РМЖ
90% РМЖ – спорадическое происхождение50-80 соматических мутаций («пассажирские» и
«драйверные») в опухолевых клетках типичного РМЖ
Наиболее частые мутации: TP53, CDH1, PI3K, CCND1,
PTEN, AKT, TGFB1, EGFR, RAS
Амплификация HER 2, CCND1, MYC
Эпигеномные изменения
8. Белки и сигнальные пути как терапевтические мишени
Сигнальный путь эстрогеновРецепторы андрогенов – экспрессия повышена в HER2- позитивном РМЖ
(активация сигнальных путей Wnt и HER2)
Сигнальные пути факторов роста
1)
HER2: нарушение контроля клеточного цикла в G1/S(повышение
активности циклинов D1, E, Cdk6, деградация p27), ангиогенез
2)
IGF-IR: активация ряда онкогенных киназ, резистентность к анти-HER2 и
HER1 терапии
3)
PI3K/AKT/mTOR: регуляция нескольких сигнальных путей, синтеза белка,
пролиферация, неоангиогенез, резистентность к трастузумабу
VEGF-A
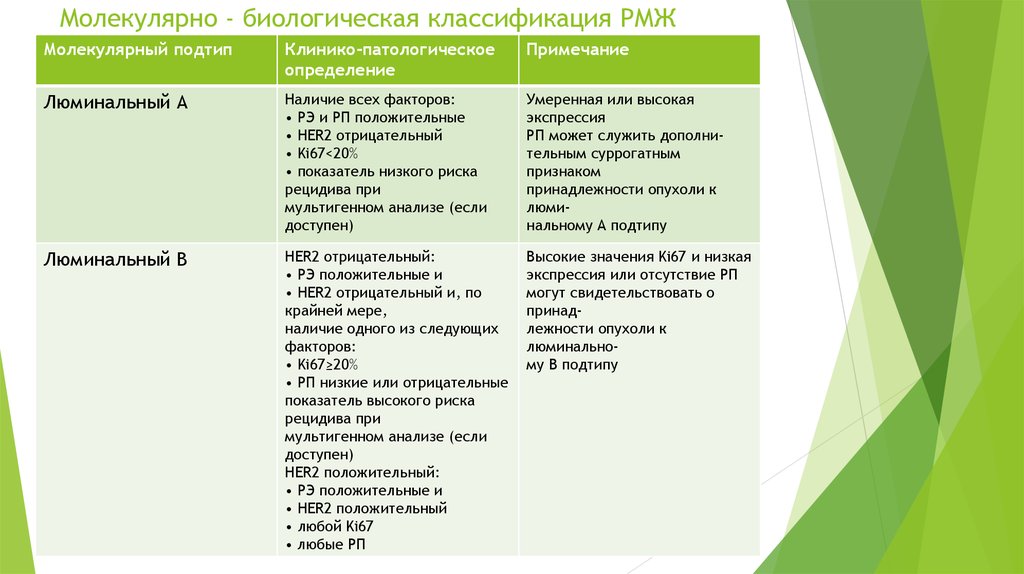
9. Молекулярно - биологическая классификация РМЖ
Молекулярный подтипКлинико-патологическое
определение
Примечание
Люминальный А
Наличие всех факторов:
• РЭ и РП положительные
• HER2 отрицательный
• Ki67<20%
• показатель низкого риска
рецидива при
мультигенном анализе (если
доступен)
Умеренная или высокая
экспрессия
РП может служить дополнительным суррогатным
признаком
принадлежности опухоли к
люминальному А подтипу
Люминальный В
HER2 отрицательный:
• РЭ положительные и
• HER2 отрицательный и, по
крайней мере,
наличие одного из следующих
факторов:
• Ki67≥20%
• РП низкие или отрицательные
показатель высокого риска
рецидива при
мультигенном анализе (если
доступен)
HER2 положительный:
• РЭ положительные и
• HER2 положительный
• любой Ki67
• любые РП
Высокие значения Ki67 и низкая
экспрессия или отсутствие РП
могут свидетельствовать о
принадлежности опухоли к
люминальному В подтипу
10. Молекулярно-биологическая классификация РМЖ
С гиперэкспрессиейHER2
HER2 положительный (не
люминальный)
• гиперэкспрессия HER2 и/или
амплификация
HER2
• РЭ и РП отрицательные
Базальноподобный
Тройной негативный
(протоковый)
• РЭ, РП и HER2
отрицательные
С низкой экспрессией
каудинов
отсутствие/низкая экспрессия
генов, обеспечивающих
межклеточную адгезию,
маркеры эпителиальномезенхимальной
трансформации, признаки
стоволвых клеток
В 80% случаев тройные негативные РМЖ являются базальноподобными. Некоторые случаи
с низким уровнем РЭ могут
относиться к нелюминальным
подтипам
по данным генноэкспрессионного
анализа. Тройной негативный
РМЖ включает также
некоторые
особые гистологические
подтипы,
например, аденокистозный
11.
Биологический подтипВариант адъювантной терапии
Комментарии
Люминальный А
Как правило, только
эндокринная
терапия. При
назначении химиотерапии могут быть
использованы
режимы CMF, AC / FAC /
CAF,
а также режимы с
таксанами
Химиотерапия может быть
назначена
отдельным больным.
Относительными
показаниями для назначения
химиотерапии являются:
• 3 степень злокачественности;
• значительная степень
распространения
болезни (вовлечение ≥4
подмышечных
лимфоузлов, первичная
опухоль ≥Т3);
• молодой возраст (<35 лет);
• показатель высокого риска
рецидива
при мультигенном анализе
(если доступен);
• предпочтения больной
Люминальный В (HER2
отрицательный)
Эндокринная терапия – для
всех
больных; химиотерапия – для
большинства больных.
Химиотерапевтические режимы
должны включать
антрациклины
и таксаны
Назначение химиотерапии, а
также ее
вариант зависят от уровня
рецепторов,
факторов риска, а также
предпочтений
больной
12.
Люминальный В (HER2положительный)
Химиотерапия + анти-HER2
терапия + эндокринная терапия.
Химиотерапевтические
режимы
должны включать
антрациклины
и таксаны
Нет данных о
целесообразности
отказа
от химиотерапии при
этом подтипе
опухоли
HER2 положительный
(не
люминальный)
Химиотерапия + анти-HER2
терапия.
Химиотерапевтические режимы
должны включать
антрациклины
и таксаны
Анти-HER2 терапия
показана при ≥Т1b
или N+
Тройной негативный
(протоковый)
Химиотерапия. Оптимальный
химиотерапевтический режим
не
определен. Целесообразно использование режимов
химиотерапии с включением
антрациклинов
и таксанов
Использование бевацизумаба,
производных платины, гемцитабина,
капецитабина не рекомендуется. Значение
интенсифицированных режимов
химиотерапии
не определено
13. РМЖ с гиперэкспрессией HER-2
18-20% больных РМЖHER2 обогащенный и люминальный В подтипы
Гиперэкспрессия HER2 и отсутствие РЭ и РП
прогрессирование, раннее метастазирование
Окрашивание более 30% опухолевых клеток при иммуногистохимическом
исследовании/ высокий показатель амплификации гена HER2 при FISH
исследовании/ обнаружение HER2 в метастазах
показание к анти
HER2 терапии
быстрое
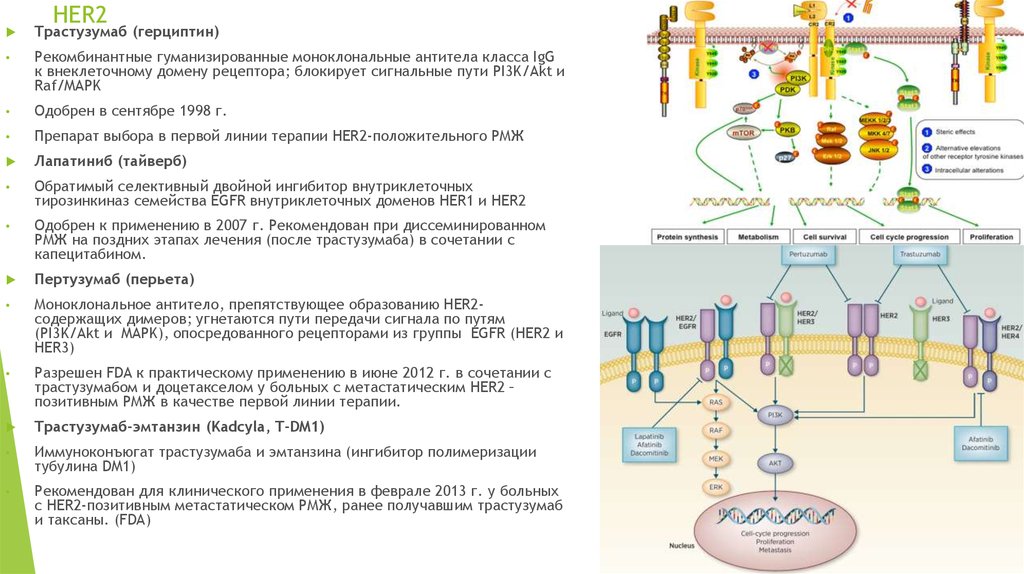
14. HER2
Трастузумаб (герциптин)Рекомбинантные гуманизированные моноклональные антитела класса IgG
к внеклеточному домену рецептора; блокирует сигнальные пути PI3K/Akt и
Raf/MAPK
Одобрен в сентябре 1998 г.
Препарат выбора в первой линии терапии HER2-положительного РМЖ
Лапатиниб (тайверб)
Обратимый селективный двойной ингибитор внутриклеточных
тирозинкиназ семейства EGFR внутриклеточных доменов HER1 и HER2
Одобрен к применению в 2007 г. Рекомендован при диссеминированном
РМЖ на поздних этапах лечения (после трастузумаба) в сочетании с
капецитабином.
Пертузумаб (перьета)
Моноклональное антитело, препятствующее образованию HER2содержащих димеров; угнетаются пути передачи сигнала по путям
(PI3K/Akt и MAPK), опосредованного рецепторами из группы EGFR (HER2 и
HER3)
Разрешен FDA к практическому применению в июне 2012 г. в сочетании с
трастузумабом и доцетакселом у больных с метастатическим HER2 –
позитивным РМЖ в качестве первой линии терапии.
Трастузумаб-эмтанзин (Kadcyla, T-DM1)
Иммуноконъюгат трастузумаба и эмтанзина (ингибитор полимеризации
тубулина DM1)
Рекомендован для клинического применения в феврале 2013 г. у больных
с HER2-позитивным метастатическом РМЖ, ранее получавшим трастузумаб
и таксаны. (FDA)
15. Трастузумаб
Противоопухолевая активность в качестве монотерапии – 25-30%, в комбинации сцитостатическими препаратами – 50-70% (наибольшая активность – в комбинации с
антрациклинами)
Включение в адъювантную химиотерапию при операбельном HER2 позитивном РМЖ улучшает
отдаленные результаты лечения
Данные метаанализа восьми рандомизированных исследований с участием 12000 больных
Сравнение послеоперационного использования трастузумаба в сочетании с химиотерапией и
химиотерапии без трастузумаба
Использование трастузумаба снижает риск рецидива на 40% и повышает общую выживаемость на
34%
Использование антрациклин-содержащих комбинаций, затем паклитаксела в сочетании с
трастузумабом, с последующим применением трастузумаба в течение года дает наилучшие
результаты ( NSABP B-31 и NCCTG N9831)
доцетаксел+ карбоплатин+трастузумаб (при противопоказаниях к антрациклинам: CД,
применение антрациклинов ранее)
Vogel CL, Cobleigh MA, Tripathy D et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20:719-726
Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpress HER2. N Engl J Med 2001; 344:783-792
Lorenzo Moja, Ludovica Tagliabue, Sara Balduzzi et al Trastuzumab containing regimens for early breast cancer
Perez EA, Romond EH, Suman VJ et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal groth factor receptor 2-posotive breast cancer: joint analysis of data from
NSABP B-31 и NCCTG N9831. J Clin Oncol 2011; 29:3366-3373
Slamon D, Eierman W, Robert N et al., Breast Cancer International Research Group. Adjuvant trastuzumab in HER-2 positive breast cancer. N engl J Med 2011, 365: 1273-1283
16. Применение трастузумаба при раннем HER2-положительный РМЖ
Адъювантная терапияМеждународное многоцентровое исследование III фазы HERA (HERceptine
Adjuvant)
включены 5090 женщины с уже диагностированным HER2-позитивным раком
молочной железы на ранних стадиях. К моменту рандомизации все женщины
уже получили химиотерапию и лучевую терапию (если было показано) до или
после операции по поводу рака молочной железы.
Больные были рандомизированы в соотношении 1:1:1 в группы наблюдения,
лечения герцептином в течение одного года и в группу терапии в течение двух
лет.
Выявлено, что оптимальным является введение трастузумаба в течение 1 года
При 8-летнем сроке наболюдения эффективность одно- и двухгодичного
адъювантного введения трастузумаба была равной
Снижение риска прогрессирования на 46% по сравнению с группой наблюдения
Во время последующего наблюдения в течение в среднем 2-х лет, был
зафиксирован показатель абсолютной эффективности, равный 6,3% (80,6% в
группе, получавшей трастузумаб, против 74,3% в группе наблюдения
Perez EA. Advances in monoclonal antibody therapy for breast cancer: further analysis of NCCTG-N9831. Proc Am Soc Clin Oncol.
2005.
Piccart-Gebhart M. Advances in monoclonal antibody therapy for breast cancer: HERA trial. Proc Am Soc Clin Oncol. 2005.
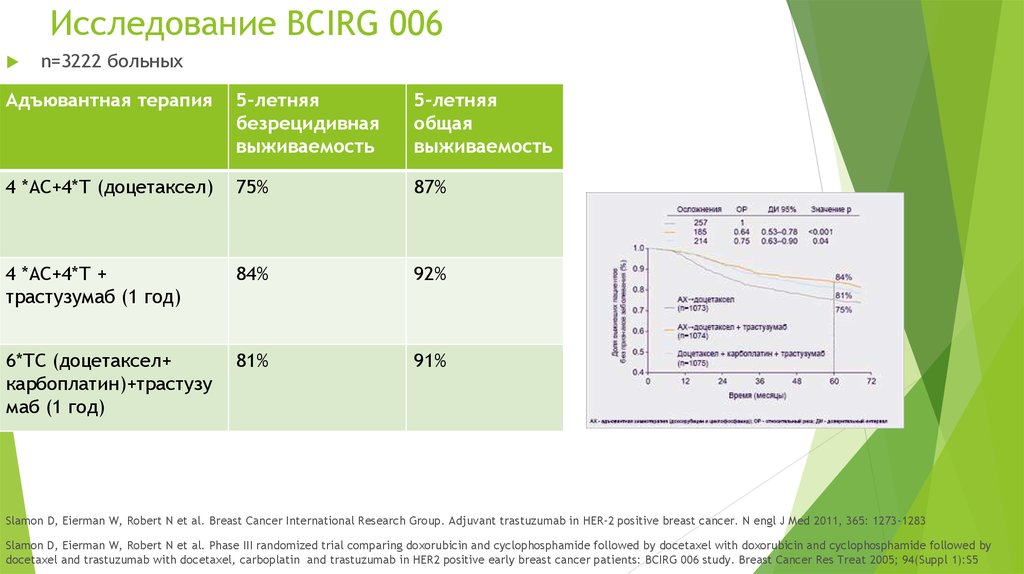
17. Исследование BCIRG 006
n=3222 больныхАдъювантная терапия
5-летняя
безрецидивная
выживаемость
5-летняя
общая
выживаемость
4 *АС+4*Т (доцетаксел)
75%
87%
4 *АС+4*Т +
трастузумаб (1 год)
84%
92%
6*ТС (доцетаксел+
карбоплатин)+трастузу
маб (1 год)
81%
91%
Slamon D, Eierman W, Robert N et al. Breast Cancer International Research Group. Adjuvant trastuzumab in HER-2 positive breast cancer. N engl J Med 2011, 365: 1273-1283
Slamon D, Eierman W, Robert N et al. Phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel with doxorubicin and cyclophosphamide followed by
docetaxel and trastuzumab with docetaxel, carboplatin and trastuzumab in HER2 positive early breast cancer patients: BCIRG 006 study. Breast Cancer Res Treat 2005; 94(Suppl 1):S5
18. Совместный анализ результатов NCCTG N9831 и NSAP B-31
Риск рецидива снизился на 52%, рисксмерти на 33%, по сравнению с группой
без трастузумаба
В случае одновременного назначения
герцептина с паклитакселом вероятность
рецидива снижалась на 36% по
сравнению с его последовательным
назначением (исследование NCCTG
N9831)
Perez EA, Romond EH, Suman VJ et al. Four-year follow-up of trastuzumab plus adjuvant
chemotherapy for operable human epidermal groth factor receptor 2-posotive breast
cancer: joint analysis of data from NSABP B-31 и NCCTG N9831. J Clin Oncol 2011;
29:3366-3373
Romond EH, Perez EA, Bryant J et al. Trastuzumab plus adjuvant chemotherapy for
operable HER2-positive breast cancer. N Engl J Med 2005; 353:1673-1684
19. Применение трастузумаба при раннем HER2-положительном РМЖ
1)В комбинации с таксанами (паклитаксел или
доцетаксел) после антрациклин-содержащих
режимов (доксорубицин+циклофосфамид).
2)
2) В комбинации с доцетакселом и
карбоплатином
3)
3) После хирургического вмешательства и
завершения неоадъювантной или адъювантной
химиотерапии, лучевой терапии
20. Применение трастузумаба при раннем HER2-положительном РМЖ
Неоадъювантная терапия: добавление трастузумаба существенноповышает эффективность химиотерапии. Применение доцетаксела и
карбоплатина в сочетании с трастузумабом повысило ПМЭ с 17% до 40%
При сочетании трастузумаба и лапатиниба с последующим добавлением
паклитаксела отмечается более высокая частота ПМЭ - 51,3% по
сравнению с 29,5% и 24,7%. (исследование Neo ALTTO)
Применение доцетаксела с трастузумабом и пертузумабом
сопровождается маскимальной частотой ПМЭ -39,3%. (исследование
NeoSphere)
Gianni L, Pienkowsky T, Im Y-H et al. Neoadjuvant pertuzumab (P) and trastuzumab (H): Antitumor and safety analysis of a randomized phase II
study (NeoSphere). Cancer Res 2010; 70(24 Suppl): abstract S3-2
Baselga J, Bradbury I, Eidtmann H et al. First results of the NeoALTTO trial (BIG 01-06/ECF 10-6903): A phase III randomized open-label
neoadjuvant study of lapatinib, trastuzumab and their combination plus paclitaxel in women with HER2-positive primary breast cancer. Cancer
Res 2010; 70(24 Suppl): abstract S3-3.
Han HS, Doliny P, Blaya M et al. Does-dense docetaxel, carboplatinum and trastuzumab as neoadjuvant therapy for human epidermal growth
factor receptor-2-positive stage II and III breast cancer. Breast cancer Res Treat 2007; 106(Suppl): abstract 5060
21. Примeнение трастузумаба при местнораспространенном HER2-положительном РМЖ
Примeнение трастузумаба при местнораспространенном HER2положительном РМЖДобавление трастузумаба к индукционной химиотерапии (доксорубицин+паклитаксел
=>паклитаксел=> циклофосфамид+ метотрексат+ фторурацил) позволило улучшить
трехлетнюю бессобытийную выживаемость (71% против 56%). ПМЭ увеличивается вдвое
– 38% против 19%
исследование
режим
ПМЭ,%
NOAH (n=228)
APtx*3=>Ptx*4=>CMF*3+T (1год)
38
APtx*3=>Ptx*4=>CMF*3
19
Сравнение трастузумаба и лапатиниба при добавлении их к индукционной
химиотерапии показало большую эффективность трастузумаба: частота ПМЭ составила
31,7% против 15,7%
Комбинация пертузумаба, трастузумаба и доцетаксела
Gianni L, Eieromann W, Semiglazov V et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in
patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomized controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010;
375:349-350
22. Применение трастузумаба при метастатическом HER2 положительном РМЖ
1)в качестве первой линии терапии в комбинации с таксанами (паклитаксел или доцетаксел),
антрациклинами(только в рамках клинических исследований), винорелбином, капецитабином,
препаратами платины.
2)
В монорежиме после одной и более линии химиотерапии
3)
В комбинации с ИА при гормонозависимом РМЖ у женщин в менопаузе
Примерно 50% больных метастатическим РМЖ имеют резистентность к трастузумабу уже в первой
линии, приобретенная резистентность развивается у большинства больных
Механизмы развития резистентности: повышение активности альтернативных сигнальных путей и
экспрессия «усеченной» формы рецептора, в которой отсутствует внеклеточный домен (место
связывания трастузумаба)
Добавление другого цитостатика может восстановить чувствительность опухоли к трастузумабу
Продолжение лечения трастузумабом после первого эпизода прогрессирования лучше, чем отмена
препарата (исследование BIG 3-05).
156 больных после прогрессирования
Рандомизация на две группы: 1-капецитабин в монорежиме 2-капецитабин+трастузумаб
Медиана времени до прогрессирования составила 8,2 мес в группе комбинированной терапии по
сравнению с 5,6 мес в группе капецитабина
Von Minckwitz G, du Bois A, Schmidt M et al. Trastuzumab beyond progression in human epidermal growth factor receptor 2-positive advanced breast cancer: a German Breast Group
26/Breast International Group 03-05 study. J Clin Oncol 2009; 27:1999-2006
Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med
2001;344:783-792
Marty M, Cognetti F, Maraninchi D et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor
receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 Study Group. J Clin Oncol 2005; 23:4265-4274
Longo R, Torino F, Gasparini G. Targeted therapy of breast cancer. Curr Pharm Des 2007; 13:497-517
23. Лапатиниб
в качестве монотерапии второй линии у больных с местнораспространенным иметастатическим РМЖ
умеренная противоопухолевая активность (24%)
стабилизация процесса на срок больше 6 мес (31%)
продолжительность ответа 28 недель,
общая выживаемость 2 года
В комбинации с капецитабином при резистентности к трастузумабу/ после
антрациклинов, таксанов, трастузумаба у больных с метастатическим HER-2
позитивным РМЖ
Увеличение времени до прогрессирования с 19 до 27 нед по сравнению с
монотерапией капецитабином
в комбинации с летрозолом при HER2 позитивном метастатическом
гормоночувствительном РМЖ
Johnston S, Pippen J, Pivot X et al. Lapatinib combined with letrozole versus letrozole and placebo as first-line therapy for
postmenopausal hormone receptor-positive metastatic breast cancer. J Clin Oncol 2009;27:5538-3346
Cameron D, Casey M, Press M et al. A phase III randomized comparison of lapatinib plus capecitabine versus capecitabine alone in women with
advanced breast cancer that has progressed on trastuzumab: updated efficacy and biomarker analyses. Breast Cancer Res Tream 2008; 12:533-543
Blackwell KL, Burstein HJ, Storniolo AM et al. Randomized study of Lapatinib alone or in combination with trastusumab in women with ErbB2positive, trastuzumab-refractory metastasis breast cancer. J Clin Oncol 2010; 28:1124-1130
Johnston S, Pippen J Jr, Pivot X et al. Lapatinib combined with letrozole versus letrozole and placebo as first-line therapy for postmenopausal
hormone receptor-positive metastatic breast cancer. J Clin Oncol 2009; 27: 5538-5546
Geyer C, Forster J, Lindquist TD et al. lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006; 355:2733-2744
24. NeoALTTO
Изучение комбинаций лапатиниба в качестве неоадъювантной химиотерапии у пациентов сместнораспространенном HER2 позитивным РМЖ
Схема предоперационной терапии
Полная
патоморфологическая
регрессия
Клинический
эффект, %
Лапатиниб+трастузумаб+паклитаксел,n=152
51,5%
80,3%
Трастузумаб+паклитаксел, n=149
29,5%
70,5%
Лапатиниб+паклитаксел, n=154
24,7%
74,0%
Baselga J, Bradbury I, Eidtmann H et al. First results of the NeoALTTO trial (BIG 01-06/ECF 10-6903): A phase III randomized open-label neoadjuvant study of lapatinib, trastuzumab and their combination plus
paclitaxel in women with HER2-positive primary breast cancer. Cancer Res 2010; 70(24 Suppl): abstract S3-3.
25. Лапатиниб
Исследование неоадъювантной терапии GeparQuinto, n=597Частота ПМЭ при назначении стандартной антрациклин-таксан-содержащей химиотерапии в
комбинации с лапатинибом ниже (21,7%) по сравнению с группой больных, получавших
химиотерапию в сочетании с трастузумабом (31,3%)
Схема предоперационной
терапии
ПМЭ
4*EC+4*доцетаксел+трастузумаб
31.3%
4*EC+4*доцетаксел+лапатиниб
21.7%
Исследование III фазы МА.31- прямое сравнение лапатиниба и трастузумаба в
сочетании с таксан-содержащей химиотерапией при метастатическом РМЖ
У больных с метастатическим РМЖ лапатиниб уступил трастузумабу (оба препарата
использовались в сочетании с таксанами) по времени до прогрессирования (8,8 мес
против 11,4 мес)
Untch M, Loibl S, Bischoff J et al. Lapatinib versus trastuzumab in combination with neoadjuvant anthracycline-taxane-based chemotherapy (GeparQuinto, GBG 44): a randomized phase 3
trial. Lancet Oncol 2012; 13:135-144
Grlmon KA, Boyle F, Kaufman B et al. Open-label phase III randomized controlled trial comparing taxane-based chemotherapy with lapatinib or trastuzumab as first-line therapy for
women with HER2+ metastatic breast cancer: Interim analysis of NCNC CTG MA.31/GSK EGF 108919. J Clin Oncol 2012; 30(Suppl): abstract LBA671.
26. Пертузумаб
Пертузумаб и трастузумаб связываются с разными эпитопами HER2, их комбинация обладаетбольшей противоопухолевой активностью
международное рандомизированное исследование III фазы CLEOPATRA
808 больных с HER2-позитивным метастатическим РМЖ
Использование комбинации трастузумаб+пертузумаб+доцетаксел в качестве первой линии
показало лучшие результаты по сравнению со стандартной комбинацией
трастузумаб+доцетаксел
общая эффективность 80,2% по сравнению с 69,3% в контроле
медиана безрицидивной выживаемости увеличилась на 6,1 мес, по сравнению с контролем
Снижение риска смерти на 34%
исследование NeoSphere
Baselga J, Cortes J, Kim SB et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl Med 2012; 366:109-119
Swain SM, Kim SB, Corte J et al. Confirmatori overall survival analysis of CLEOPATRA: a randomized, double-blind, placebo-controlled phase III study with
pertuzumab, trastuzumab, and docetaxel in patients with HER2-positive first-line metastatic breast cancer. Cancer Res 2012; 72(24 Suppl): abstract P5-18-26
Gianni L, Pienkowsky T, Im Y-H et al. Neoadjuvant pertuzumab (P) and trastuzumab (H): Antitumor and safety analysis of a randomized phase II study
(NeoSphere). Cancer Res 2010; 70(24 Suppl): abstract S3-2
27. Трастузумаб-эмтанзин (T-DM1)
Многоцентровое рандомизированное исследование EMILIAсравнение трастузумаба-эмтанзина и комбинации лапатиниба с
капецитабином при HER2-позитивном РМЖ, прогрессировавшем на фоне
терапии таксанами с трастузумабом
медиана выживаемости без прогрессирования составила 9,6 мес при
использовании трастузумаба-эмтанзина против 6,4 мес в контрольной
группе
общая эффективность 43,6% против 30,8%
Медиана продолжительности жизни составила 30.9 против 25.1 мес)
Трастузумаб-эмтанзин переносился лучше, чем комбинация лапатиниба и
капецитабина (частота токсичности 3-й и выше степени была 40.8% и 57.0%
соответственно)
Verma S, Miles D, Gianni L et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl Med 2012; 367^1783-1791
Blackwell KL, Miles D, Gianni L et al. Primary results from EMILIA, a phase III study trastuzumab emtansine (T-DM1) versus capecitabine and
lapatinib in HER2-positive locally advanced or metastatic breast cancer previously treated with trastuzumab and a taxsane. J Clin Oncol2012;
30(18 Soppl):abstract LBA1
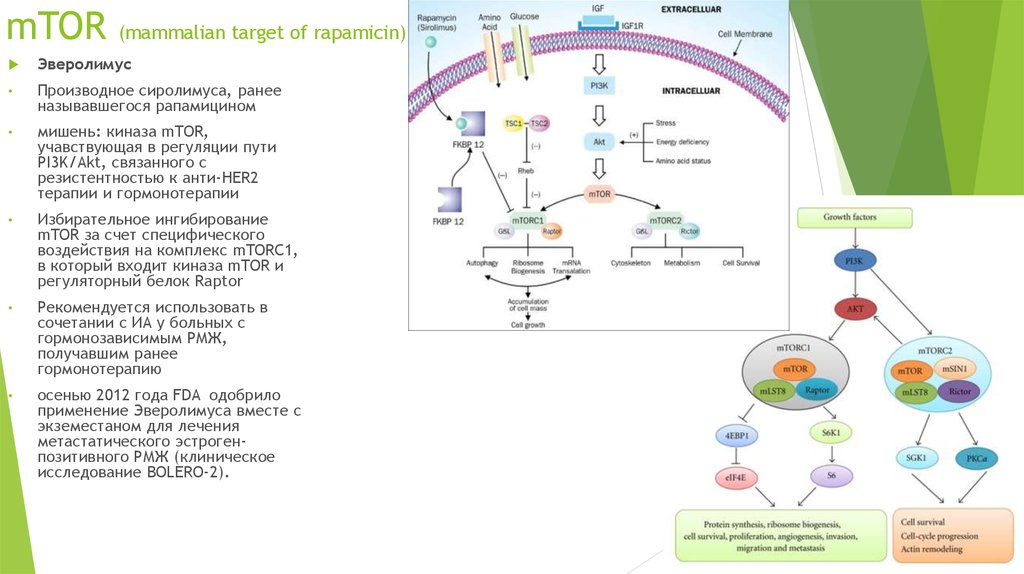
28. mTOR (mammalian target of rapamicin)
ЭверолимусПроизводное сиролимуса, ранее
называвшегося рапамицином
мишень: киназа mTOR,
учавствующая в регуляции пути
PI3K/Akt, связанного с
резистентностью к анти-HER2
терапии и гормонотерапии
Избирательное ингибирование
mTOR за счет специфического
воздействия на комплекс mTORC1,
в который входит киназа mTOR и
регуляторный белок Raptor
Рекомендуется использовать в
сочетании с ИА у больных с
гормонозависимым РМЖ,
получавшим ранее
гормонотерапию
осенью 2012 года FDA одобрило
применение Эверолимуса вместе с
экземестаном для лечения
метастатического эстрогенпозитивного РМЖ (клиническое
исследование BOLERO-2).
29. Эверолимус
Исследование BOLERO-2оценивалась способность эверолимуса восстанавливать чувствительность
опухоли к гормонотерапии ингибиторами ароматазы
с участием больных в менопаузе, страдающих метастатическим
гормонозависимым РМЖ и получавшим гормонотерапию нестероидными
ИА с развитием резистентности к ним
Рандомизация на две группы: одновременный прием эксеместана и
эверолимуса (эксперементальная группа) и монотерапия эксеместаном
(контрольная группа)
Время до прогрессирования было больше в группе, получавшей
эксеместан+эверолимус, по сравнению с группой, получавшей только
монотерапию эксеместаном (10,6 мес против 4,1мес)
Baselga J, Compone M, Piccart M et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012;
366:520-529
30. CDK4/6
Палбоциклиб (ибранса)Обратимый пероральный ингибитор
циклинзависимых киназ CDK4/6
CDK 4/6 являются ключевыми регуляторами
клеточного цикла, которые инициируют клеточную
прогрессию от фазы роста (G1) до фаз, связанных
с репликацией ДНК(S) [4,5]. CDK 4/6, активность
которых часто возрастает при раке молочной
железы, экспрессирующем рецепторы эстрогена
(ER+), являются ключевыми нисходящими
мишенями передачи сигнала, опосредованного ER
при ER+ раке молочной железы.
Данные доклинических исследований показали,
что двойное ингибирование CDK 4/6 и сигнального
пути ER является синергичным и блокирует рост
клеточных линий ER+ рака молочной железы в
фазе G1.
одобрен FDA весной 2015 года для лечения
местнораспространенного РМЖ, РЭ
положительного, HER2 отрицательного совместно
с фулвестраном после предшествующей
гормонотерапии летрозолом
31. Палбоциклиб
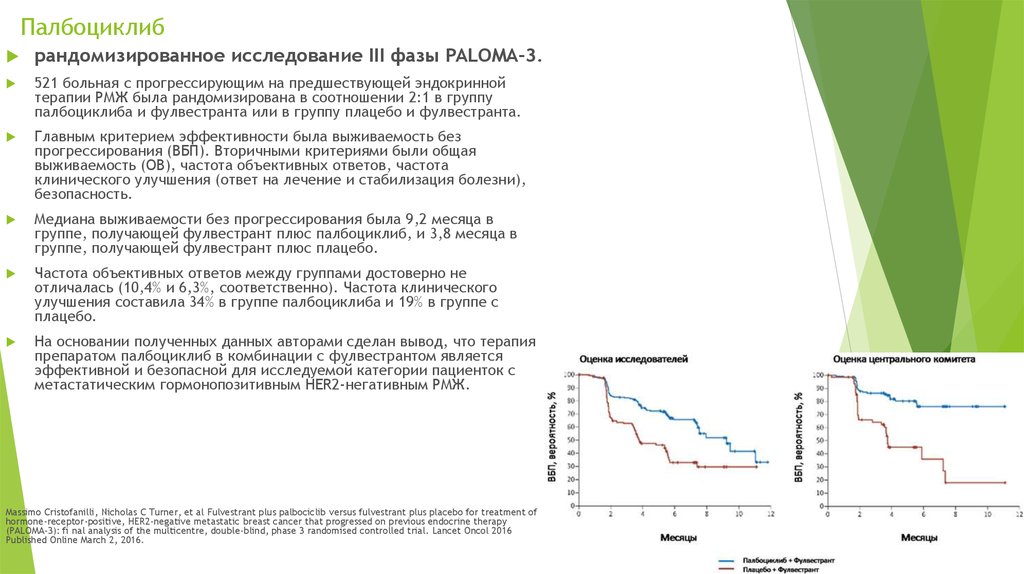
рандомизированное исследование III фазы PALOMA-3.521 больная с прогрессирующим на предшествующей эндокринной
терапии РМЖ была рандомизирована в соотношении 2:1 в группу
палбоциклиба и фулвестранта или в группу плацебо и фулвестранта.
Главным критерием эффективности была выживаемость без
прогрессирования (ВБП). Вторичными критериями были общая
выживаемость (ОВ), частота объективных ответов, частота
клинического улучшения (ответ на лечение и стабилизация болезни),
безопасность.
Медиана выживаемости без прогрессирования была 9,2 месяца в
группе, получающей фулвестрант плюс палбоциклиб, и 3,8 месяца в
группе, получающей фулвестрант плюс плацебо.
Частота объективных ответов между группами достоверно не
отличалась (10,4% и 6,3%, соответственно). Частота клинического
улучшения составила 34% в группе палбоциклиба и 19% в группе с
плацебо.
На основании полученных данных авторами сделан вывод, что терапия
препаратом палбоциклиб в комбинации с фулвестрантом является
эффективной и безопасной для исследуемой категории пациенток с
метастатическим гормонопозитивным HER2-негативным РМЖ.
Massimo Cristofanilli, Nicholas C Turner, et al Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of
hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy
(PALOMA-3): fi nal analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol 2016
Published Online March 2, 2016.
32. Олапариб (Линпарза)
Ингибитор поли(АДФ-рибоза)-полимеразы – PARP – фермент репарации разрушенной ДНКЛечение РМЖ и РЯ, ассоциированных с мутацией BRCA1.
Victoria L. Chiou с соавт. представили результаты первого клинического применения комбинации
олапариба и карбоплатина у больных трижды негативным РМЖ и раком яичников
9 женщин (медиана возраста 59 лет), из которых 47 – с раком яичников(26 gBRCAm+), 10 – с
трижды негативным РМЖ (4 gBRCAm+), 2 – с раком и саркомой тела матки, были
рандомизированы в группу А и в группу B.
Цикл 1
Цикл 2
Циклы 3-8
Циклы 9+
Группа А
Олапариб табл. 200 мг
2 раза в сут. дни 1-7
⇒ карбоплатин AUC4
день 8
Карбоплатин AUC4
день 1 ⇒ олапариб
табл. 200 мг 2 раза в
сут. дни 2-8
Поддерживаю
щая терапия
олапарибом
табл. 300 мг
2 раза в сут.
Группа В
Карбоплатин AUC4
день 1 ⇒ олапариб
табл. 200 мг 2 раза в
сут. дни 2-8
Олапариб табл. 200 мг
2 раза в сут. дни 1-7
⇒ карбоплатин AUC4
день 8
Олапариб
табл. 200 мг 2
раза в сут.
дни 1-7,
карбоплатин
AUC4 день 1
или 2
Частота ответов на лечение в общей группе составила 45%, из которых полных ответов – 2%
(РМЖ, продолжительность ответов – 23 мес.) и частичных ответов – 43% (20 ответов – рак
яичников, 3 – РМЖ, продолжительность – 9 мес.). Наилучшие результаты достигнуты у больных с
мутацией gBRCA: 65% против 17%. При изучении фармакодинамики было показано, что
комбинация олапариба и карбоплатина чаще приводила к нарушению ДНК (comet DNA damage
assay), чем терапия каждым препаратом в отдельности.
Chiou et al. AACR 2015 Annual Meeting.



























 medicine
medicine








