Similar presentations:
Постнеоадъювантная терапия HER2+ РМЖ: доказанная возможность улучшить прогноз для «сложных» пациентов
1.
Постнеоадъювантная терапия HER2+ РМЖ:доказанная возможность улучшить прогноз
для «сложных» пациентов
Лымарева Лилия Александровна -врач онколог отделения противоопухолевой
лекарственной терапии ГБУЗ «Волгоградский областной клинический
онкологический диспансер 04.03.2025 г.Волгоград
Данная презентация подготовлена при поддержке АО «Рош-Москва». Информация предназначена для медицинских работников. Мнение лектора может не совпадать с позицией АО «Рош-Москва»
M-RU-00015398, февраль 2024
2.
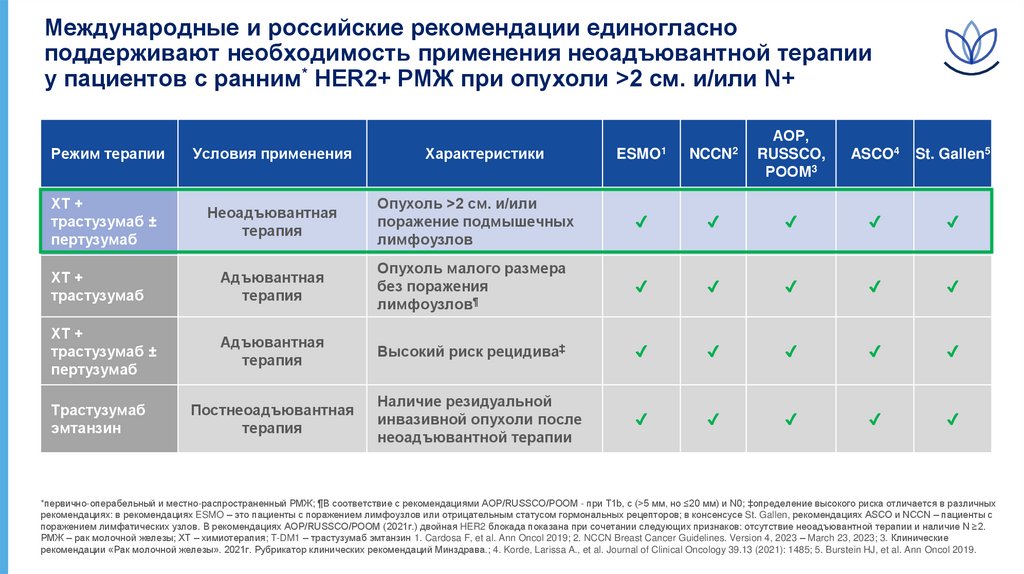
Международные и российские рекомендации единогласноподдерживают необходимость применения неоадъювантной терапии
у пациентов с ранним* HER2+ РМЖ при опухоли >2 см. и/или N+
NCCN2
AОР,
RUSSCO,
РООМ3
ASCO4
St. Gallen5
Режим терапии
Условия применения
Характеристики
ESMO1
ХТ +
трастузумаб ±
пертузумаб
Неоадъювантная
терапия
Опухоль >2 см. и/или
поражение подмышечных
лимфоузлов
✔
✔
✔
✔
✔
ХТ +
трастузумаб
Адъювантная
терапия
Опухоль малого размера
без поражения
лимфоузлов¶
✔
✔
✔
✔
✔
ХТ +
трастузумаб ±
пертузумаб
Адъювантная
терапия
Высокий риск рецидива‡
✔
✔
✔
✔
✔
Трастузумаб
эмтанзин
Постнеоадъювантная
терапия
Наличие резидуальной
инвазивной опухоли после
неоадъювантной терапии
✔
✔
✔
✔
✔
*первично-операбельный и местно-распространенный РМЖ; ¶В соответствие с рекомендациями АОР/RUSSCO/РООМ - при T1b, с (>5 мм, но ≤20 мм) и N0; ‡определение высокого риска отличается в различных
рекомендациях: в рекомендациях ESMO – это пациенты с поражением лимфоузлов или отрицательным статусом гормональных рецепторов; в консенсусе St. Gallen, рекомендациях ASCO и NCCN – пациенты с
поражением лимфатических узлов. В рекомендациях АОР/RUSSCO/РООМ (2021г.) двойная HER2 блокада показана при сочетании следующих признаков: отсутствие неоадъювантной терапии и наличие N ≥2.
РМЖ – рак молочной железы; ХТ – химиотерапия; T-DM1 – трастузумаб эмтанзин 1. Cardosa F, et al. Ann Oncol 2019; 2. NCCN Breast Cancer Guidelines. Version 4, 2023 – March 23, 2023; 3. Клинические
рекомендации «Рак молочной железы». 2021г. Рубрикатор клинических рекомендаций Минздрава.; 4. Korde, Larissa A., et al. Journal of Clinical Oncology 39.13 (2021): 1485; 5. Burstein HJ, et al. Ann Oncol 2019.
3.
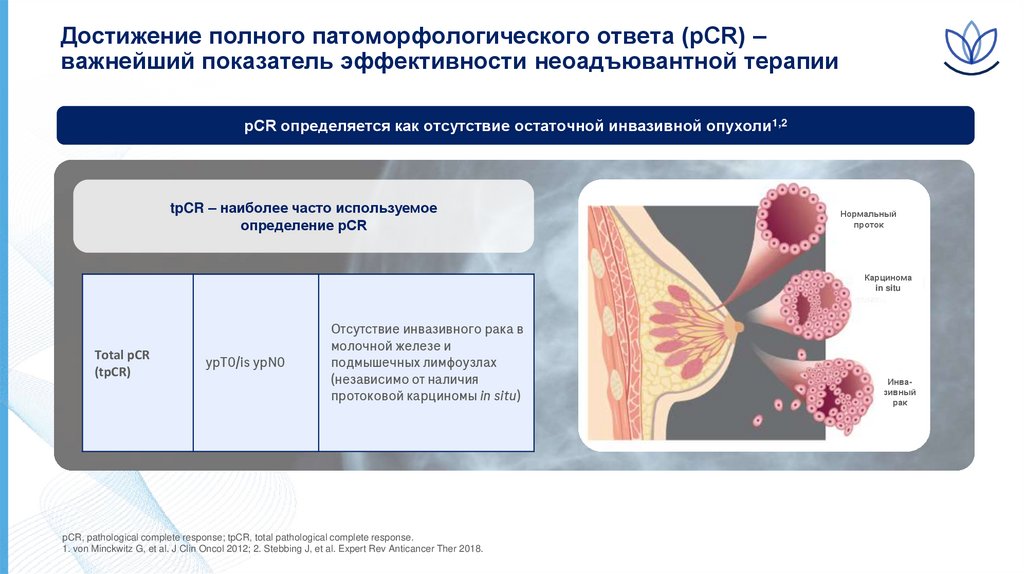
Достижение полного патоморфологического ответа (pCR) –важнейший показатель эффективности неоадъювантной терапии
pCR определяется как отсутствие остаточной инвазивной опухоли1,2
tpCR – наиболее часто используемое
определение pCR
Нормальный
проток
Карцинома
in situ
Total pCR
(tpCR)
ypT0/is ypN0
Отсутствие инвазивного рака в
молочной железе и
подмышечных лимфоузлах
(независимо от наличия
протоковой карциномы in situ)
pCR, pathological complete response; tpCR, total pathological complete response.
1. von Minckwitz G, et al. J Clin Oncol 2012; 2. Stebbing J, et al. Expert Rev Anticancer Ther 2018.
Инвазивный
рак
4.
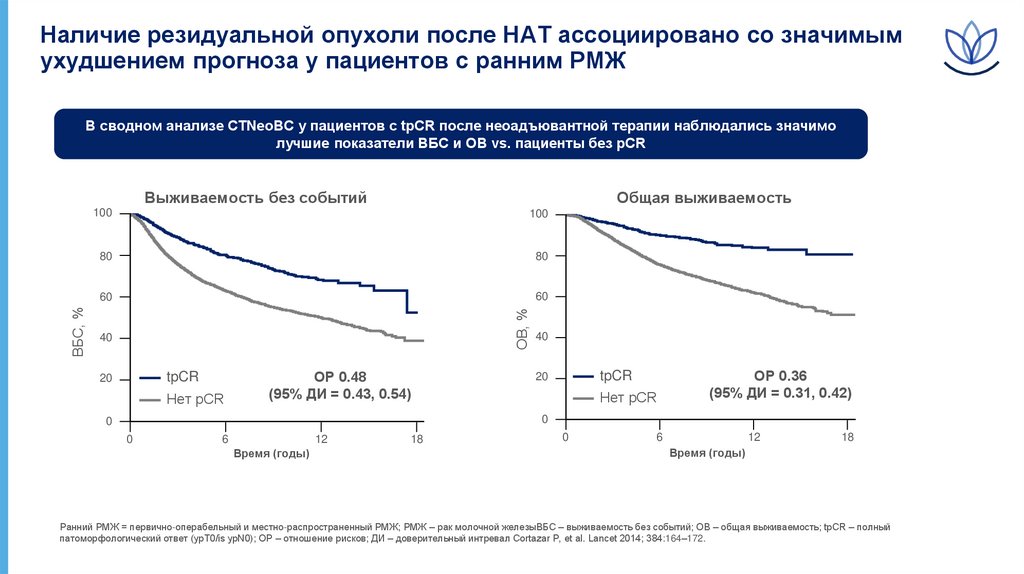
Наличие резидуальной опухоли после НАТ ассоциировано со значимымухудшением прогноза у пациентов с ранним РМЖ
В сводном анализе CTNeoBC у пациентов с tpCR после неоадъювантной терапии наблюдались значимо
лучшие показатели ВБС и ОВ vs. пациенты без pCR
Общая выживаемость
100
100
80
80
60
60
ОВ, %
ВБС, %
Выживаемость без событий
40
tpCR
20
Нет pCR
ОР 0.48
(95% ДИ = 0.43, 0.54)
40
tpCR
20
Нет pCR
ОР 0.36
(95% ДИ = 0.31, 0.42)
0
0
0
6
12
Время (годы)
18
0
6
12
18
Время (годы)
Ранний РМЖ = первично-операбельный и местно-распространенный РМЖ; РМЖ – рак молочной железыВБС – выживаемость без событий; ОВ – общая выживаемость; tpCR – полный
патоморфологический ответ (ypT0/is ypN0); ОР – отношение рисков; ДИ – доверительный интревал Cortazar P, et al. Lancet 2014; 384:164–172.
5.
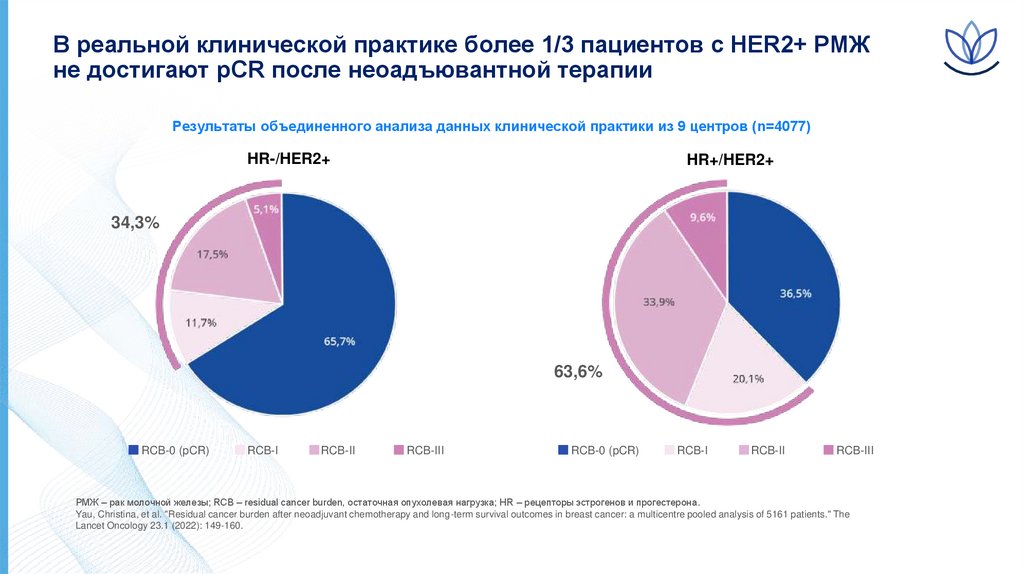
В реальной клинической практике более 1/3 пациентов с HER2+ РМЖне достигают pCR после неоадъювантной терапии
Результаты объединенного анализа данных клинической практики из 9 центров (n=4077)
HR-/HER2+
HR+/HER2+
34,3%
63,6%
RCB-0 (pCR)
RCB-I
RCB-II
RCB-III
RCB-0 (pCR)
RCB-I
RCB-II
RCB-III
РМЖ – рак молочной железы; RCB – residual cancer burden, остаточная опухолевая нагрузка; HR – рецепторы эстрогенов и прогестерона.
Yau, Christina, et al. "Residual cancer burden after neoadjuvant chemotherapy and long-term survival outcomes in breast cancer: a multicentre pooled analysis of 5161 patients." The
Lancet Oncology 23.1 (2022): 149-160.
6.
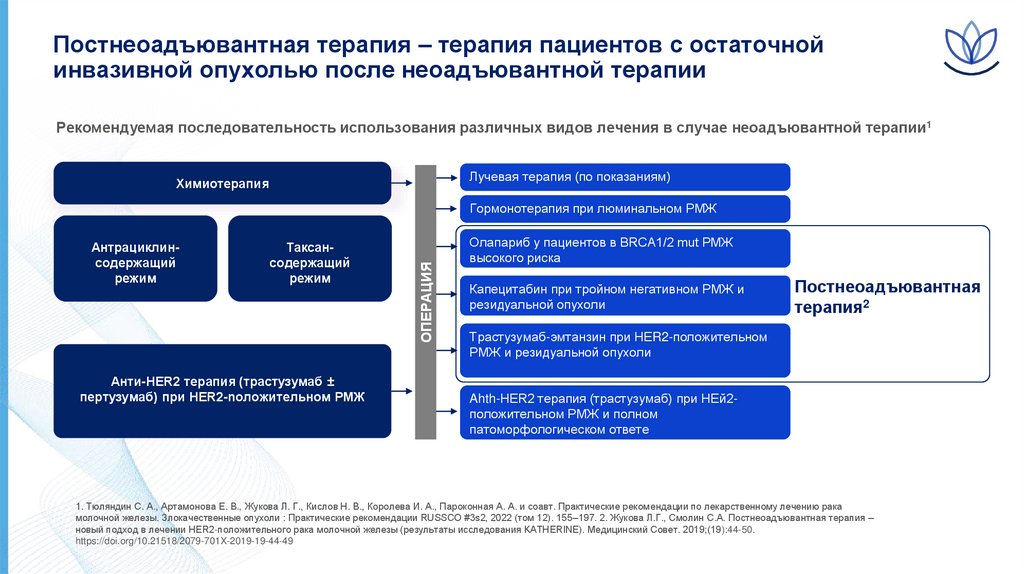
Постнеоадъювантная терапия – терапия пациентов с остаточнойинвазивной опухолью после неоадъювантной терапии
Рекомендуемая последовательность использования различных видов лечения в случае неоадъювантной терапии1
Лучевая терапия (по показаниям)
Химиотерапия
Антрациклинсодержащий
режим
Таксансодержащий
режим
Aнти-HER2 терапия (трастузумаб ±
пертузумаб) при HER2-noложительном РМЖ
ОПЕРАЦИЯ
Гормонотерапия при люминальном РМЖ
Олапариб у пациентов в BRCA1/2 mut РМЖ
высокого риска
Капецитабин при тройном негативном РМЖ и
резидуальной опухоли
Постнеоадъювантная
терапия2
Трастузумаб-эмтанзин при НЕR2-положительном
РМЖ и резидуальной опухоли
Ahth-HER2 терапия (трастузумаб) при НЕй2положительном РМЖ и полном
патоморфологическом ответе
1. Тюляндин С. А., Артамонова Е. В., Жукова Л. Г., Кислов Н. В., Королева И. А., Пароконная А. А. и соавт. Практические рекомендации по лекарственному лечению рака
молочной железы. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2022 (том 12). 155–197. 2. Жукова Л.Г., Смолин С.А. Постнеоадъювантная терапия –
новый подход в лечении HER2-положительного рака молочной железы (результаты исследования KATHERINE). Медицинский Совет. 2019;(19):44-50.
https://doi.org/10.21518/2079-701X-2019-19-44-49
7.
Международные и российские рекомендации поддерживают назначениеT-DM1 у пациентов с HER2+ РМЖ и остаточной инвазивной опухолью
после НАТ
NCCN2
AОР,
RUSSCO,
РООМ3
ASCO4
St. Gallen5
Режим терапии
Условия применения
Характеристики
ESMO1
ХТ +
трастузумаб ±
пертузумаб
Неоадъювантная
терапия
Опухоль >2 см. и/или
поражение подмышечных
лимфоузлов
✔
✔
✔
✔
✔
ХТ +
трастузумаб
Адъювантная
терапия
Опухоль малого размера
без поражения лимфоузлов¶
✔
✔
✔
✔
✔
ХТ +
трастузумаб ±
пертузумаб
Адъювантная
терапия
Высокий риск рецидива‡
✔
✔
✔
✔
✔
Трастузумаб
эмтанзин
Постнеоадъювантная
терапия
Наличие резидуальной
инвазивной опухоли после
неоадъювантной терапии
✔
✔
✔
✔
✔
†первично-операбельный и местно-распространенный РМЖ; ¶В соответствие с рекомендациями АОР/RUSSCO/РООМ - при T1b, с (>5 мм, но ≤20 мм) и N0; ‡определение высокого риска отличается в различных
рекомендациях: в рекомендациях ESMO – это пациенты с поражением лимфоузлов или отрицательным статусом гормональных рецепторов; в консенсусе St. Gallen, рекомендациях ASCO и NCCN – пациенты с
поражением лимфатических узлов. В рекомендациях АОР/RUSSCO/РООМ (2021-24гг.) двойная HER2 блокада показана при сочетании следующих признаков: отсутствие неоадъювантной терапии и наличие N ≥2.
РМЖ – рак молочной железы; ХТ – химиотерапия; T-DM1 – трастузумаб эмтанзин 1. Cardosa F, et al. Ann Oncol 2019; 2. NCCN Breast Cancer Guidelines. Version 4, 2023 – March 23, 2023; 3. Клинические
рекомендации «Рак молочной железы». 2021г. Рубрикатор клинических рекомендаций Минздрава.; 4. Korde, Larissa A., et al. Journal of Clinical Oncology 39.13 (2021): 1485; 5. Burstein HJ, et al. Ann Oncol 2019.
8.
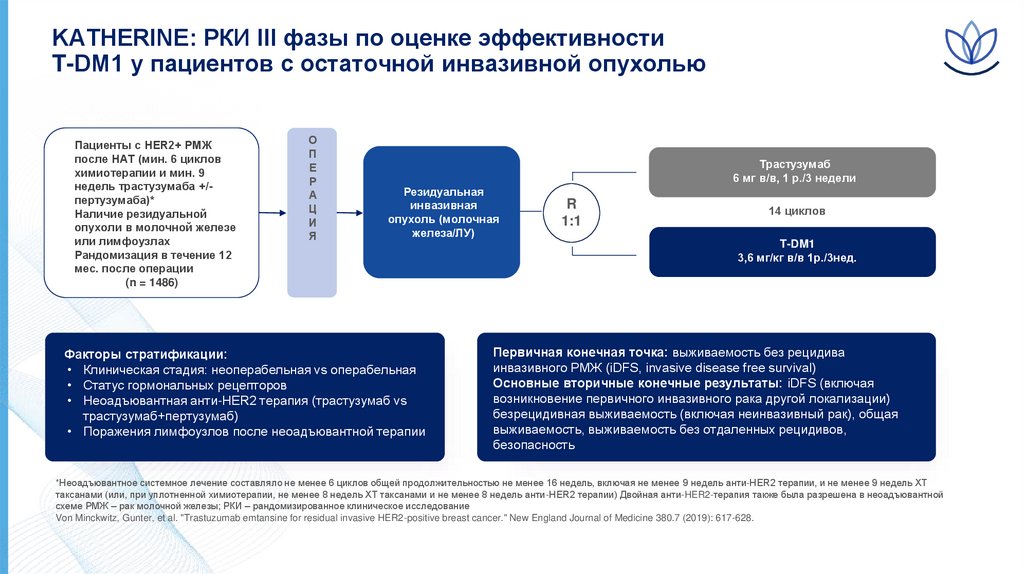
KATHERINE: РКИ III фазы по оценке эффективностиT-DM1 у пациентов с остаточной инвазивной опухолью
• Пациенты с HER2+ РМЖ
после НАТ (мин. 6 циклов
химиотерапии и мин. 9
недель трастузумаба +/пертузумаба)*
• Наличие резидуальной
опухоли в молочной железе
или лимфоузлах
• Рандомизация в течение 12
мес. после операции
(n = 1486)
О
П
Е
Р
А
Ц
И
Я
Трастузумаб
6 мг в/в, 1 р./3 недели
Резидуальная
инвазивная
опухоль (молочная
железа/ЛУ)
Факторы стратификации:
• Клиническая стадия: неоперабельная vs операбельная
• Статус гормональных рецепторов
• Неоадъювантная анти-HER2 терапия (трастузумаб vs
трастузумаб+пертузумаб)
• Поражения лимфоузлов после неоадъювантной терапии
R
1:1
14 циклов
T-DM1
3,6 мг/кг в/в 1р./3нед.
Первичная конечная точка: выживаемость без рецидива
инвазивного РМЖ (iDFS, invasive disease free survival)
Основные вторичные конечные результаты: iDFS (включая
возникновение первичного инвазивного рака другой локализации)
безрецидивная выживаемость (включая неинвазивный рак), общая
выживаемость, выживаемость без отдаленных рецидивов,
безопасность
*Неоадъювантное системное лечение составляло не менее 6 циклов общей продолжительностью не менее 16 недель, включая не менее 9 недель анти-HER2 терапии, и не менее 9 недель ХТ
таксанами (или, при уплотненной химиотерапии, не менее 8 недель ХТ таксанами и не менее 8 недель анти-HER2 терапии) Двойная анти-HER2-терапия также была разрешена в неоадъювантной
схеме РМЖ – рак молочной железы; РКИ – рандомизированное клиническое исследование
Von Minckwitz, Gunter, et al. "Trastuzumab emtansine for residual invasive HER2-positive breast cancer." New England Journal of Medicine 380.7 (2019): 617-628.
9.
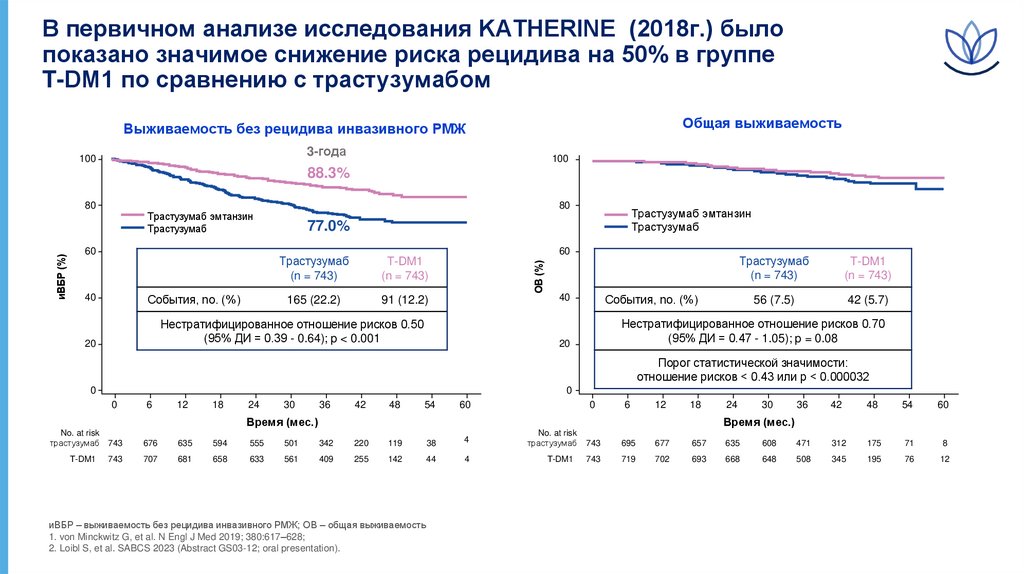
В первичном анализе исследования KATHERINE (2018г.) былопоказано значимое снижение риска рецидива на 50% в группе
T-DM1 по сравнению с трастузумабом
Общая выживаемость
Выживаемость без рецидива инвазивного РМЖ
3-года
100
100
88.3%
80
80
60
События, no. (%)
40
60
Трастузумаб
(n = 743)
T-DM1
(n = 743)
165 (22.2)
91 (12.2)
Нестратифицированное отношение рисков 0.50
(95% ДИ = 0.39 - 0.64); p < 0.001
20
Трастузумаб эмтанзин
Трастузумаб
77.0%
ОВ (%)
иВБР (%)
Трастузумаб эмтанзин
Трастузумаб
Трастузумаб
(n = 743)
T-DM1
(n = 743)
56 (7.5)
42 (5.7)
События, no. (%)
40
Нестратифицированное отношение рисков 0.70
(95% ДИ = 0.47 - 1.05); p = 0.08
20
Порог статистической значимости:
отношение рисков < 0.43 или p < 0.000032
0
0
0
6
12
18
24
30
36
42
48
54
60
0
6
12
18
Время (мес.)
30
36
42
48
54
60
Время (мес.)
No. at risk
трастузумаб 743
676
635
594
555
501
342
220
119
38
T-DM1
707
681
658
633
561
409
255
142
44
743
24
иВБР – выживаемость без рецидива инвазивного РМЖ; ОВ – общая выживаемость
1. von Minckwitz G, et al. N Engl J Med 2019; 380:617–628;
2. Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
4
No. at risk
трастузумаб
743
695
677
657
635
608
471
312
175
71
8
4
T-DM1
743
719
702
693
668
648
508
345
195
76
12
10.
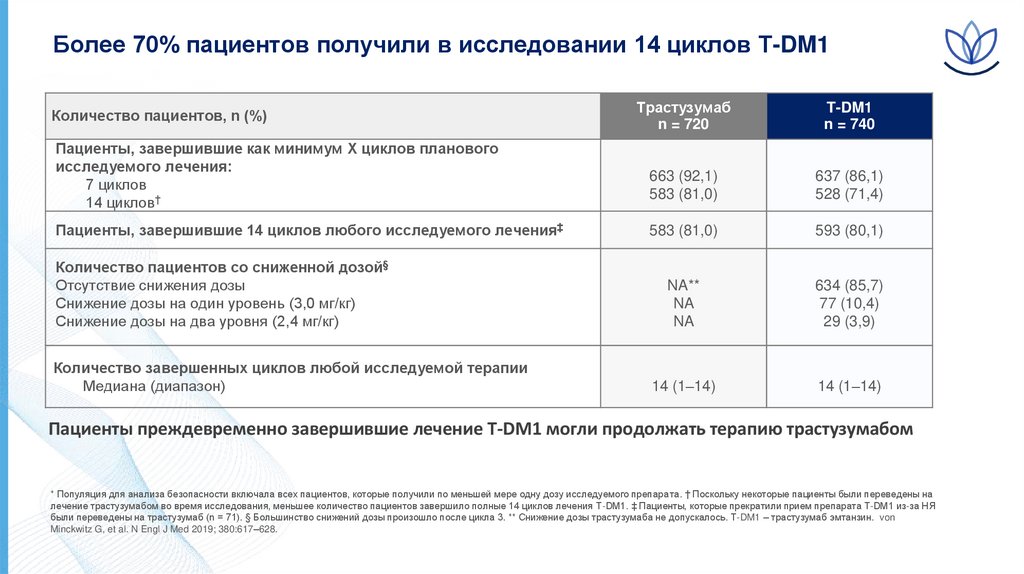
Более 70% пациентов получили в исследовании 14 циклов Т-DM1Количество пациентов, n (%)
Пациенты, завершившие как минимум X циклов планового
исследуемого лечения:
7 циклов
14 циклов†
Пациенты, завершившие 14 циклов любого исследуемого лечения‡
Количество пациентов со сниженной дозой§
Отсутствие снижения дозы
Снижение дозы на один уровень (3,0 мг/кг)
Снижение дозы на два уровня (2,4 мг/кг)
Количество завершенных циклов любой исследуемой терапии
Медиана (диапазон)
Трастузумаб
n = 720
T-DM1
n = 740
663 (92,1)
583 (81,0)
637 (86,1)
528 (71,4)
583 (81,0)
593 (80,1)
NA**
NA
NA
634 (85,7)
77 (10,4)
29 (3,9)
14 (1–14)
14 (1–14)
Пациенты преждевременно завершившие лечение T-DM1 могли продолжать терапию трастузумабом
* Популяция для анализа безопасности включала всех пациентов, которые получили по меньшей мере одну дозу исследуемого препарата. † Поскольку некоторые пациенты были переведены на
лечение трастузумабом во время исследования, меньшее количество пациентов завершило полные 14 циклов лечения T-DM1. ‡ Пациенты, которые прекратили прием препарата T-DM1 из-за НЯ
были переведены на трастузумаб (n = 71). § Большинство снижений дозы произошло после цикла 3. ** Снижение дозы трастузумаба не допускалось. Т-DM1 – трастузумаб эмтанзин. von
Minckwitz G, et al. N Engl J Med 2019; 380:617–628.
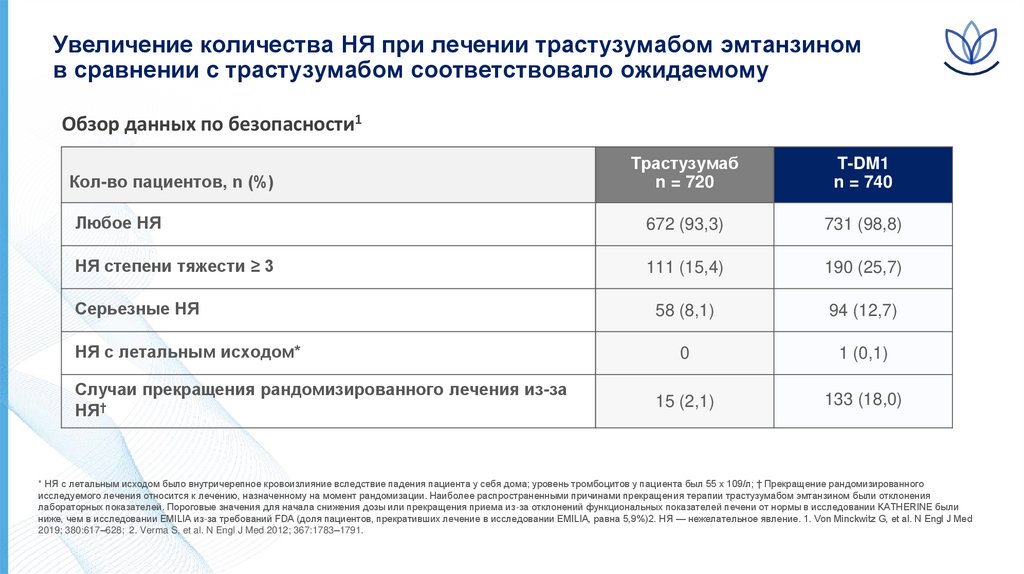
11.
Увеличение количества НЯ при лечении трастузумабом эмтанзиномв сравнении с трастузумабом соответствовало ожидаемому
Обзор данных по безопасности1
Трастузумаб
n = 720
T-DM1
n = 740
Любое НЯ
672 (93,3)
731 (98,8)
НЯ степени тяжести ≥ 3
111 (15,4)
190 (25,7)
Серьезные НЯ
58 (8,1)
94 (12,7)
0
1 (0,1)
15 (2,1)
133 (18,0)
Кол-во пациентов, n (%)
НЯ с летальным исходом*
Случаи прекращения рандомизированного лечения из-за
НЯ†
* НЯ с летальным исходом было внутричерепное кровоизлияние вследствие падения пациента у себя дома; уровень тромбоцитов у пациента был 55 x 109/л; † Прекращение рандомизированного
исследуемого лечения относится к лечению, назначенному на момент рандомизации. Наиболее распространенными причинами прекращения терапии трастузумабом эмтанзином были отклонения
лабораторных показателей. Пороговые значения для начала снижения дозы или прекращения приема из-за отклонений функциональных показателей печени от нормы в исследовании KATHERINE были
ниже, чем в исследовании EMILIA из-за требований FDA (доля пациентов, прекративших лечение в исследовании EMILIA, равна 5,9%)2. НЯ — нежелательное явление. 1. Von Minckwitz G, et al. N Engl J Med
2019; 380:617–628; 2. Verma S, et al. N Engl J Med 2012; 367:1783–1791.
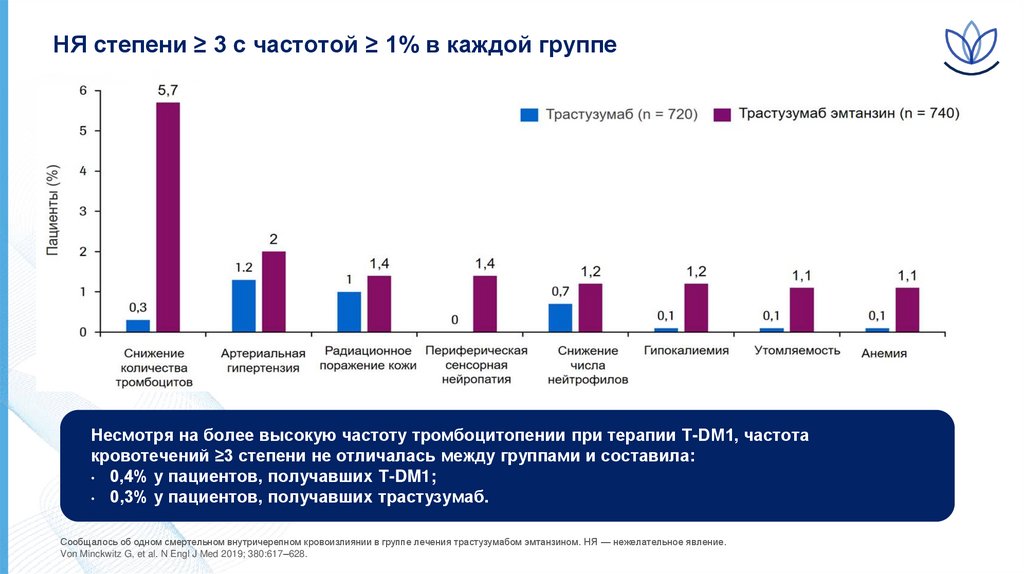
12.
НЯ степени ≥ 3 с частотой ≥ 1% в каждой группеНесмотря на более высокую частоту тромбоцитопении при терапии T-DM1, частота
кровотечений ≥3 степени не отличалась между группами и составила:
• 0,4% у пациентов, получавших T-DM1;
• 0,3% у пациентов, получавших трастузумаб.
Сообщалось об одном смертельном внутричерепном кровоизлиянии в группе лечения трастузумабом эмтанзином. НЯ — нежелательное явление.
Von Minckwitz G, et al. N Engl J Med 2019; 380:617–628.
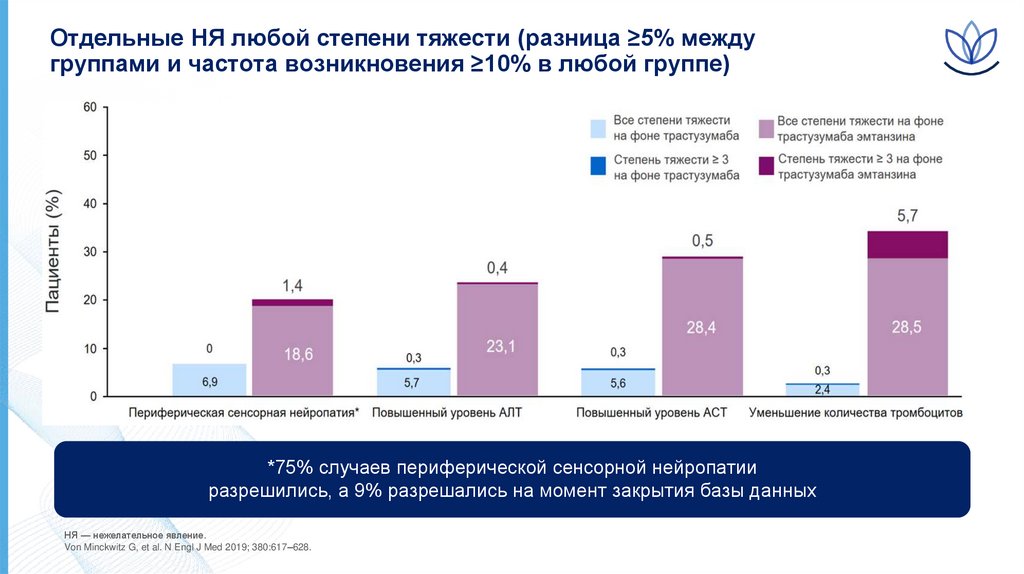
13.
Отдельные НЯ любой степени тяжести (разница ≥5% междугруппами и частота возникновения ≥10% в любой группе)
*75% случаев периферической сенсорной нейропатии
разрешились, а 9% разрешались на момент закрытия базы данных
НЯ — нежелательное явление.
Von Minckwitz G, et al. N Engl J Med 2019; 380:617–628.
14.
Возможные меры по устранению симптомов НЯ на фоне терапии T-DM1Возможными мерами по устранению симптомов нежелательных реакций, развивающихся на фоне
лечения Т-DM1, являются:
• снижение дозы,
• временный перерыв в лечении или
• полное прекращение терапии препаратом Т-DM1.
Если дозу препарата T-DM1 пришлось снизить, то при последующих введениях увеличивать ее нельзя.
Правила снижения дозы (начальная доза 3.6 мг/кг)
Рекомендуемая доза
1-ое снижение дозы
3 мг/кг
2-ое снижение дозы
2.4 мг/кг
Необходимость дальнейшего снижения дозы
Т-DM1 – трастузумаб эмтанзин; НЯ – нежелательные явления
Инструкция по медицинскому применению препарата трастузумаб эмтанзинЛП-№(000832)-(РГ-RU)
Полностью прекратить терапию
15.
SABCS’23:Данные финального анализа первичной
конечной точки и 2-го промежуточного
анализа общей выживаемости в
исследовании KATHERINE
SABCS (San Antonio Brest Cancer Symposium) - ежегодный симпозиум "Рак молочной железы“ в Сан-Антонио, США
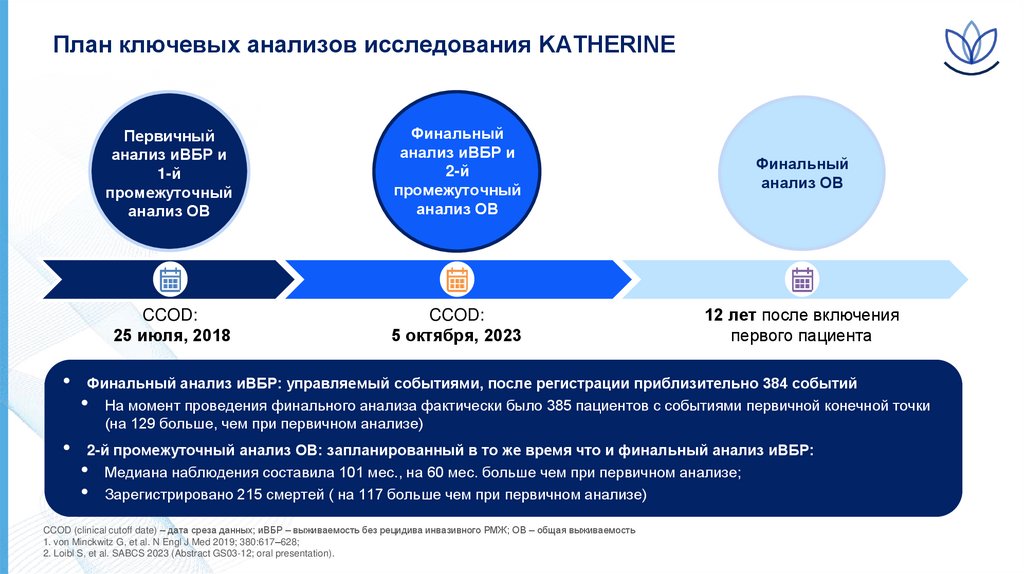
16.
План ключевых анализов исследования KATHERINEПервичный
анализ иВБР и
1-й
промежуточный
анализ ОВ
Финальный
анализ иВБР и
2-й
промежуточный
анализ ОВ
Финальный
анализ ОВ
CCOD:
25 июля, 2018
CCOD:
5 октября, 2023
12 лет после включения
первого пациента
Финальный анализ иВБР: управляемый событиями, после регистрации приблизительно 384 событий
• На момент проведения финального анализа фактически было 385 пациентов с событиями первичной конечной точки
(на 129 больше, чем при первичном анализе)
2-й промежуточный анализ ОВ: запланированный в то же время что и финальный анализ иВБР:
• Медиана наблюдения составила 101 мес., на 60 мес. больше чем при первичном анализе;
• Зарегистрировано 215 смертей ( на 117 больше чем при первичном анализе)
CCOD (clinical cutoff date) – дата среза данных; иВБР – выживаемость без рецидива инвазивного РМЖ; ОВ – общая выживаемость
1. von Minckwitz G, et al. N Engl J Med 2019; 380:617–628;
2. Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
17.
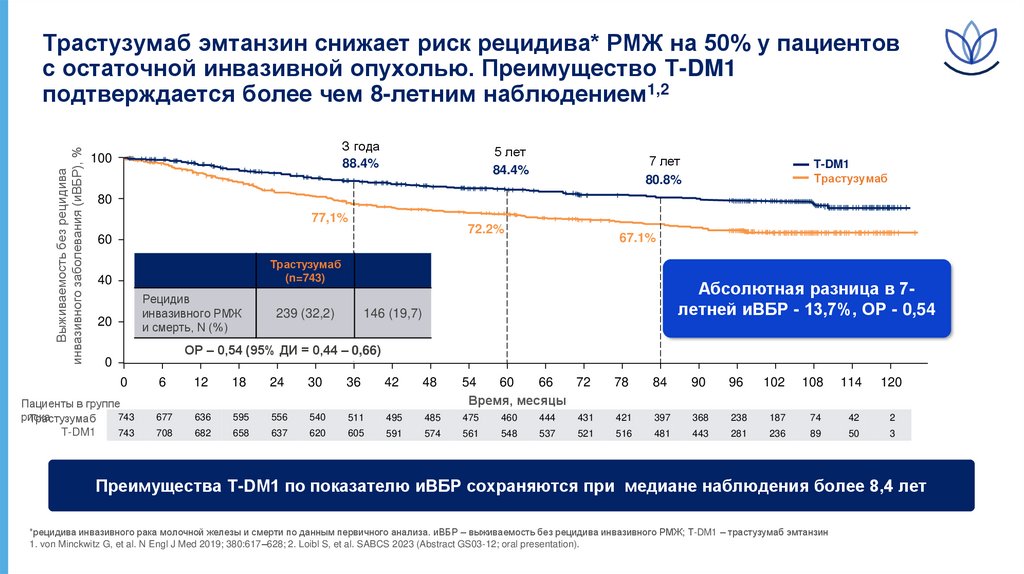
Выживаемость без рецидиваинвазивного заболевания (иВБР), %
Трастузумаб эмтанзин снижает риск рецидива* РМЖ на 50% у пациентов
с остаточной инвазивной опухолью. Преимущество T-DM1
подтверждается более чем 8-летним наблюдением1,2
З года
88.4%
100
5 лет
84.4%
7 лет
80.8%
T-DM1
Трастузумаб
80
77,1%
72.2%
60
40
Рецидив
инвазивного РМЖ
и смерть, N (%)
20
Трастузумаб
(n=743)
T-DM1
(n=743)
239 (32,2)
146 (19,7)
67.1%
Абсолютная разница в 7летней иВБР - 13,7%, ОР - 0,54
ОР – 0,54 (95% ДИ = 0,44 – 0,66)
0
0
6
12
18
24
30
36
42
48
78
84
90
96
102
108
114
120
Пациенты в группе
743
риска
Трастузумаб
T-DM1
743
54
60
66
72
Время, месяцы
677
636
595
556
540
511
495
485
475
460
444
431
421
397
368
238
187
74
42
2
708
682
658
637
620
605
591
574
561
548
537
521
516
481
443
281
236
89
50
3
Преимущества T-DM1 по показателю иВБР сохраняются при медиане наблюдения более 8,4 лет
*рецидива инвазивного рака молочной железы и смерти по данным первичного анализа. иВБР – выживаемость без рецидива инвазивного РМЖ; Т-DM1 – трастузумаб эмтанзин
1. von Minckwitz G, et al. N Engl J Med 2019; 380:617–628; 2. Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
18.
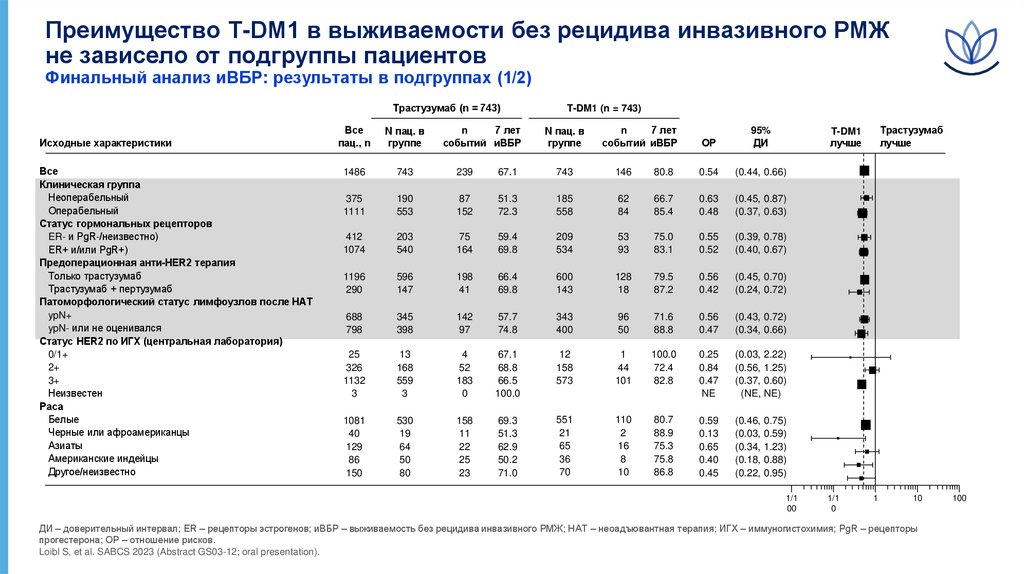
Преимущество T-DM1 в выживаемости без рецидива инвазивного РМЖне зависело от подгруппы пациентов
Финальный анализ иВБР: результаты в подгруппах (1/2)
Трастузумаб (n = 743)
Исходные характеристики
Все
Клиническая группа
Неоперабельный
Операбельный
Статус гормональных рецепторов
ER- и PgR-/неизвестно)
ER+ и/или PgR+)
Предоперационная анти-HER2 терапия
Только трастузумаб
Трастузумаб + пертузумаб
Патоморфологический статус лимфоузлов после НАТ
ypN+
ypN- или не оценивался
Статус HER2 по ИГХ (центральная лаборатория)
0/1+
2+
3+
Неизвестен
Раса
Белые
Черные или афроамериканцы
Азиаты
Американские индейцы
Другое/неизвестно
n
7 лет
событий иВБР
T-DM1 (n = 743)
Все
пац., n
N пац. в
группе
1486
743
239
67.1
743
146
375
1111
190
553
87
152
51.3
72.3
185
558
412
1074
203
540
75
164
59.4
69.8
1196
290
596
147
198
41
688
798
345
398
25
326
1132
3
1081
40
129
86
150
N пац. в
группе
n
7 лет
событий иВБР
ОР
95%
ДИ
80.8
0.54
(0.44, 0.66)
62
84
66.7
85.4
0.63
0.48
(0.45, 0.87)
(0.37, 0.63)
209
534
53
93
75.0
83.1
0.55
0.52
(0.39, 0.78)
(0.40, 0.67)
66.4
69.8
600
143
128
18
79.5
87.2
0.56
0.42
(0.45, 0.70)
(0.24, 0.72)
142
97
57.7
74.8
343
400
96
50
71.6
88.8
0.56
0.47
(0.43, 0.72)
(0.34, 0.66)
13
168
559
3
4
52
183
0
67.1
68.8
66.5
100.0
12
158
573
1
44
101
100.0
72.4
82.8
0.25
0.84
0.47
NE
(0.03, 2.22)
(0.56, 1.25)
(0.37, 0.60)
(NE, NE)
530
19
64
50
80
158
11
22
25
23
69.3
51.3
62.9
50.2
71.0
551
21
65
36
70
110
2
16
8
10
80.7
88.9
75.3
75.8
86.8
0.59
0.13
0.65
0.40
0.45
(0.46, 0.75)
(0.03, 0.59)
(0.34, 1.23)
(0.18, 0.88)
(0.22, 0.95)
Трастузумаб
лучше
T-DM1
лучше
1/1
00
1/1
0
1
10
ДИ – доверительный интервал; ER – рецепторы эстрогенов; иВБР – выживаемость без рецидива инвазивного РМЖ; НАТ – неоадъювантная терапия; ИГХ – иммуногистохимия; PgR – рецепторы
прогестерона; ОР – отношение рисков.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
100
19.
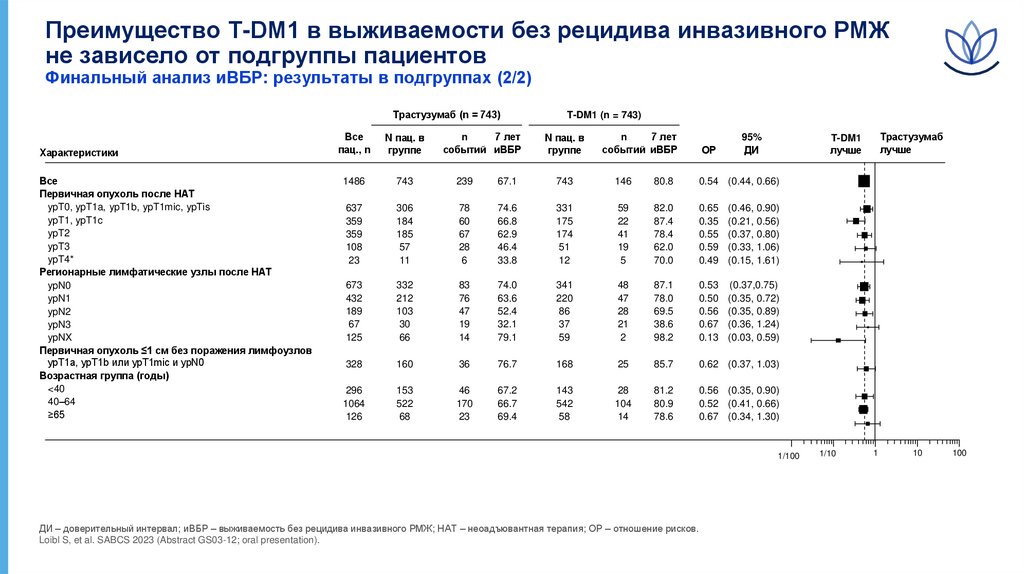
Преимущество T-DM1 в выживаемости без рецидива инвазивного РМЖне зависело от подгруппы пациентов
Финальный анализ иВБР: результаты в подгруппах (2/2)
Трастузумаб (n = 743)
Характеристики
Все
Первичная опухоль после НАТ
ypT0, ypT1a, ypT1b, ypT1mic, ypTis
ypT1, ypT1c
ypT2
ypT3
ypT4*
Регионарные лимфатические узлы после НАТ
ypN0
ypN1
ypN2
ypN3
ypNX
Первичная опухоль ≤1 см без поражения лимфоузлов
ypT1a, ypT1b или ypT1mic и ypN0
Возрастная группа (годы)
<40
40–64
≥65
n
7 лет
событий иВБР
T-DM1 (n = 743)
Все
пац., n
N пац. в
группе
1486
743
239
67.1
743
146
80.8
0.54 (0.44, 0.66)
637
359
359
108
23
306
184
185
57
11
78
60
67
28
6
74.6
66.8
62.9
46.4
33.8
331
175
174
51
12
59
22
41
19
5
82.0
87.4
78.4
62.0
70.0
0.65
0.35
0.55
0.59
0.49
(0.46, 0.90)
(0.21, 0.56)
(0.37, 0.80)
(0.33, 1.06)
(0.15, 1.61)
673
432
189
67
125
332
212
103
30
66
83
76
47
19
14
74.0
63.6
52.4
32.1
79.1
341
220
86
37
59
48
47
28
21
2
87.1
78.0
69.5
38.6
98.2
0.53
0.50
0.56
0.67
0.13
(0.37,0.75)
(0.35, 0.72)
(0.35, 0.89)
(0.36, 1.24)
(0.03, 0.59)
328
160
36
76.7
168
25
85.7
0.62 (0.37, 1.03)
296
1064
126
153
522
68
46
170
23
67.2
66.7
69.4
143
542
58
28
104
14
81.2
80.9
78.6
0.56 (0.35, 0.90)
0.52 (0.41, 0.66)
0.67 (0.34, 1.30)
N пац. в
группе
n
7 лет
событий иВБР
ОР
95%
ДИ
1/100
ДИ – доверительный интервал; иВБР – выживаемость без рецидива инвазивного РМЖ; НАТ – неоадъювантная терапия; ОР – отношение рисков.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
Трастузумаб
лучше
T-DM1
лучше
1/10
1
10
100
20.
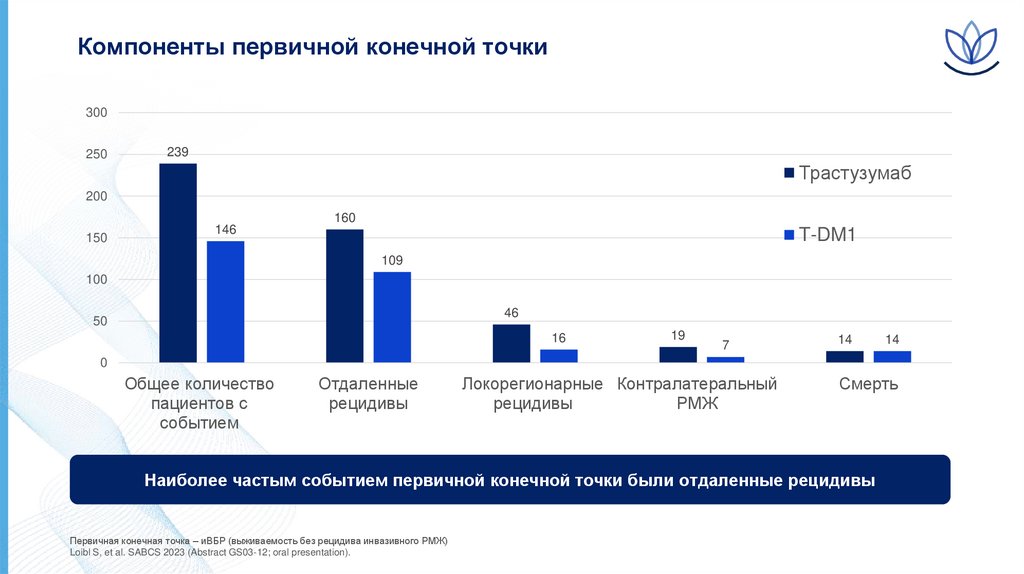
Компоненты первичной конечной точки300
250
239
Трастузумаб
200
150
146
160
T-DM1
109
100
46
50
16
19
7
14
14
0
Общее количество
пациентов с
событием
Отдаленные
рецидивы
Локорегионарные Контралатеральный
рецидивы
РМЖ
Смерть
Наиболее частым событием первичной конечной точки были отдаленные рецидивы
Первичная конечная точка – иВБР (выживаемость без рецидива инвазивного РМЖ)
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
21.
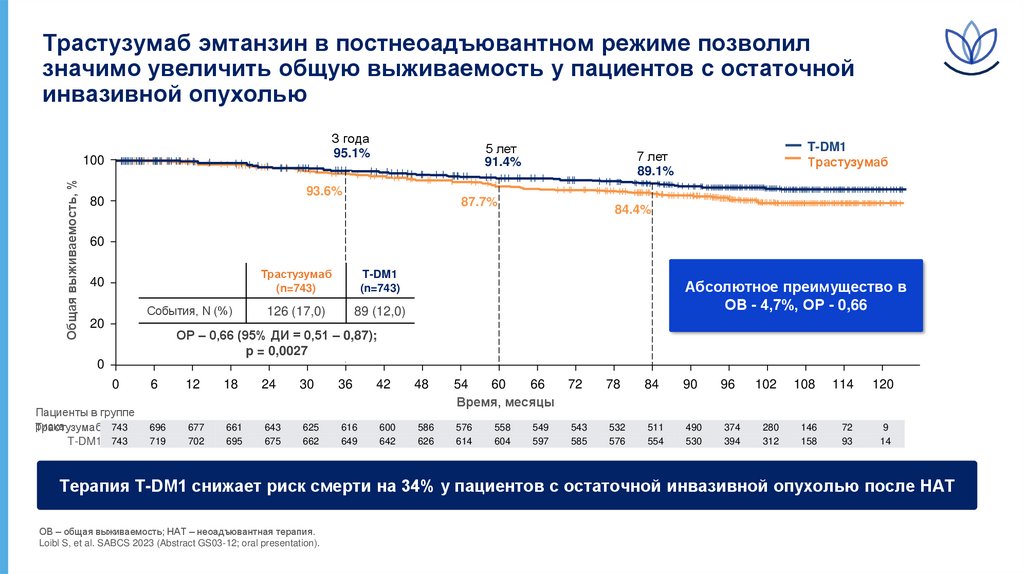
Трастузумаб эмтанзин в постнеоадъювантном режиме позволилзначимо увеличить общую выживаемость у пациентов с остаточной
инвазивной опухолью
З года
95.1%
Общая выживаемость, %
100
5 лет
91.4%
93.6%
80
T-DM1
Трастузумаб
7 лет
89.1%
87.7%
84.4%
60
40
События, N (%)
20
Трастузумаб
(n=743)
T-DM1
(n=743)
126 (17,0)
89 (12,0)
Абсолютное преимущество в
ОВ - 4,7%, ОР - 0,66
ОР – 0,66 (95% ДИ = 0,51 – 0,87);
p = 0,0027
0
0
Пациенты в группе
риска
743
Трастузумаб
T-DM1 743
6
12
18
24
30
36
42
48
54
60
66
Время, месяцы
72
78
84
90
96
102
108
114
120
696
719
677
702
661
695
643
675
625
662
616
649
600
642
586
626
576
614
543
585
532
576
511
554
490
530
374
394
280
312
146
158
72
93
9
14
558
604
549
597
Терапия T-DM1 снижает риск смерти на 34% у пациентов с остаточной инвазивной опухолью после НАТ
ОВ – общая выживаемость; НАТ – неоадъювантная терапия.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
22.
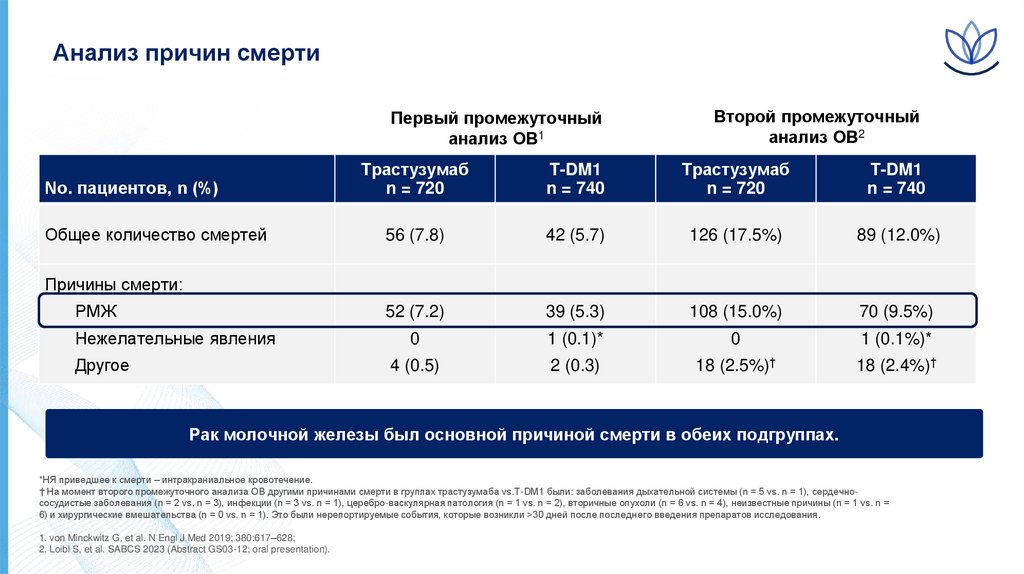
Анализ причин смертиПервый промежуточный
анализ ОВ1
No. пациентов, n (%)
Общее количество смертей
Второй промежуточный
анализ ОВ2
Трастузумаб
n = 720
T-DM1
n = 740
Трастузумаб
n = 720
Т-DM1
n = 740
56 (7.8)
42 (5.7)
126 (17.5%)
89 (12.0%)
52 (7.2)
39 (5.3)
108 (15.0%)
70 (9.5%)
0
1 (0.1)*
0
1 (0.1%)*
4 (0.5)
2 (0.3)
18 (2.5%)†
18 (2.4%)†
Причины смерти:
РМЖ
Нежелательные явления
Другое
Рак молочной железы был основной причиной смерти в обеих подгруппах.
*НЯ приведшее к смерти – интракраниальное кровотечение.
† На момент второго промежуточного анализа ОВ другими причинами смерти в группах трастузумаба vs.Т-DM1 были: заболевания дыхательной системы (n = 5 vs. n = 1), сердечнососудистые заболевания (n = 2 vs. n = 3), инфекции (n = 3 vs. n = 1), церебро-васкулярная патология (n = 1 vs. n = 2), вторичные опухоли (n = 6 vs. n = 4), неизвестные причины (n = 1 vs. n =
6) и хирургические вмешательства (n = 0 vs. n = 1). Это были нерепортируемые события, которые возникли >30 дней после последнего введения препаратов исследования.
1. von Minckwitz G, et al. N Engl J Med 2019; 380:617–628;
2. Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
23.
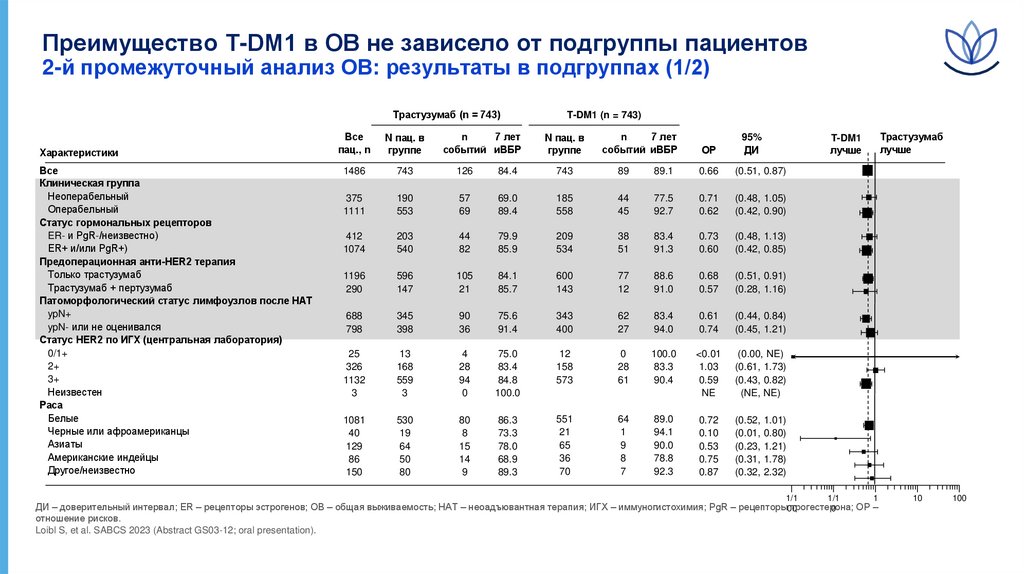
Преимущество T-DM1 в ОВ не зависело от подгруппы пациентов2-й промежуточный анализ ОВ: результаты в подгруппах (1/2)
Трастузумаб (n = 743)
Характеристики
Все
Клиническая группа
Неоперабельный
Операбельный
Статус гормональных рецепторов
ER- и PgR-/неизвестно)
ER+ и/или PgR+)
Предоперационная анти-HER2 терапия
Только трастузумаб
Трастузумаб + пертузумаб
Патоморфологический статус лимфоузлов после НАТ
ypN+
ypN- или не оценивался
Статус HER2 по ИГХ (центральная лаборатория)
0/1+
2+
3+
Неизвестен
Раса
Белые
Черные или афроамериканцы
Азиаты
Американские индейцы
Другое/неизвестно
n
7 лет
событий иВБР
T-DM1 (n = 743)
Все
пац., n
N пац. в
группе
1486
743
126
84.4
743
89
375
1111
190
553
57
69
69.0
89.4
185
558
412
1074
203
540
44
82
79.9
85.9
1196
290
596
147
105
21
688
798
345
398
25
326
1132
3
1081
40
129
86
150
N пац. в
группе
n
7 лет
событий иВБР
ОР
95%
ДИ
89.1
0.66
(0.51, 0.87)
44
45
77.5
92.7
0.71
0.62
(0.48, 1.05)
(0.42, 0.90)
209
534
38
51
83.4
91.3
0.73
0.60
(0.48, 1.13)
(0.42, 0.85)
84.1
85.7
600
143
77
12
88.6
91.0
0.68
0.57
(0.51, 0.91)
(0.28, 1.16)
90
36
75.6
91.4
343
400
62
27
83.4
94.0
0.61
0.74
(0.44, 0.84)
(0.45, 1.21)
13
168
559
3
4
28
94
0
75.0
83.4
84.8
100.0
12
158
573
0
28
61
100.0
83.3
90.4
<0.01
1.03
0.59
NE
(0.00, NE)
(0.61, 1.73)
(0.43, 0.82)
(NE, NE)
530
19
64
50
80
80
8
15
14
9
86.3
73.3
78.0
68.9
89.3
551
21
65
36
70
64
1
9
8
7
89.0
94.1
90.0
78.8
92.3
0.72
0.10
0.53
0.75
0.87
(0.52, 1.01)
(0.01, 0.80)
(0.23, 1.21)
(0.31, 1.78)
(0.32, 2.32)
Трастузумаб
лучше
T-DM1
лучше
1/1
1/1
1
ДИ – доверительный интервал; ER – рецепторы эстрогенов; ОВ – общая выживаемость; НАТ – неоадъювантная терапия; ИГХ – иммуногистохимия; PgR – рецепторы00
прогестерона;
ОР –
0
отношение рисков.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
10
100
24.
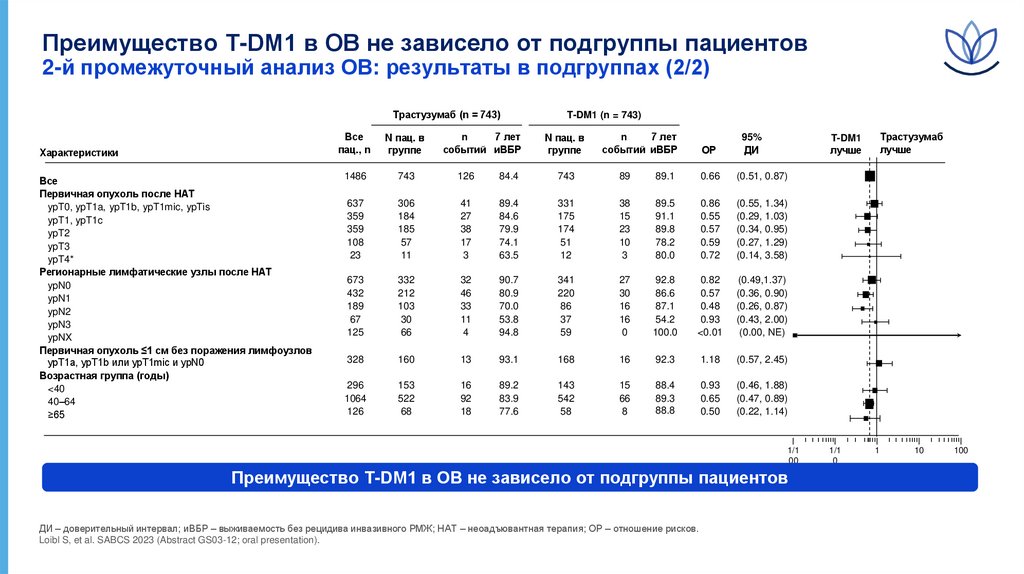
Преимущество T-DM1 в ОВ не зависело от подгруппы пациентов2-й промежуточный анализ ОВ: результаты в подгруппах (2/2)
Трастузумаб (n = 743)
Характеристики
Все
Первичная опухоль после НАТ
ypT0, ypT1a, ypT1b, ypT1mic, ypTis
ypT1, ypT1c
ypT2
ypT3
ypT4*
Регионарные лимфатические узлы после НАТ
ypN0
ypN1
ypN2
ypN3
ypNX
Первичная опухоль ≤1 см без поражения лимфоузлов
ypT1a, ypT1b или ypT1mic и ypN0
Возрастная группа (годы)
<40
40–64
≥65
n
7 лет
событий иВБР
T-DM1 (n = 743)
Все
пац., n
N пац. в
группе
1486
743
126
84.4
743
89
637
359
359
108
23
306
184
185
57
11
41
27
38
17
3
89.4
84.6
79.9
74.1
63.5
331
175
174
51
12
673
432
189
67
125
332
212
103
30
66
32
46
33
11
4
90.7
80.9
70.0
53.8
94.8
328
160
13
296
1064
126
153
522
68
16
92
18
N пац. в
группе
n
7 лет
событий иВБР
ОР
95%
ДИ
89.1
0.66
(0.51, 0.87)
38
15
23
10
3
89.5
91.1
89.8
78.2
80.0
0.86
0.55
0.57
0.59
0.72
(0.55, 1.34)
(0.29, 1.03)
(0.34, 0.95)
(0.27, 1.29)
(0.14, 3.58)
341
220
86
37
59
27
30
16
16
0
92.8
86.6
87.1
54.2
100.0
0.82
0.57
0.48
0.93
<0.01
(0.49,1.37)
(0.36, 0.90)
(0.26, 0.87)
(0.43, 2.00)
(0.00, NE)
93.1
168
16
92.3
1.18
(0.57, 2.45)
89.2
83.9
77.6
143
542
58
15
66
8
88.4
89.3
88.8
0.93
0.65
0.50
(0.46, 1.88)
(0.47, 0.89)
(0.22, 1.14)
1/1
00
Преимущество T-DM1 в ОВ не зависело от подгруппы пациентов
ДИ – доверительный интервал; иВБР – выживаемость без рецидива инвазивного РМЖ; НАТ – неоадъювантная терапия; ОР – отношение рисков.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
Трастузумаб
лучше
T-DM1
лучше
1/1
0
1
10
100
25.
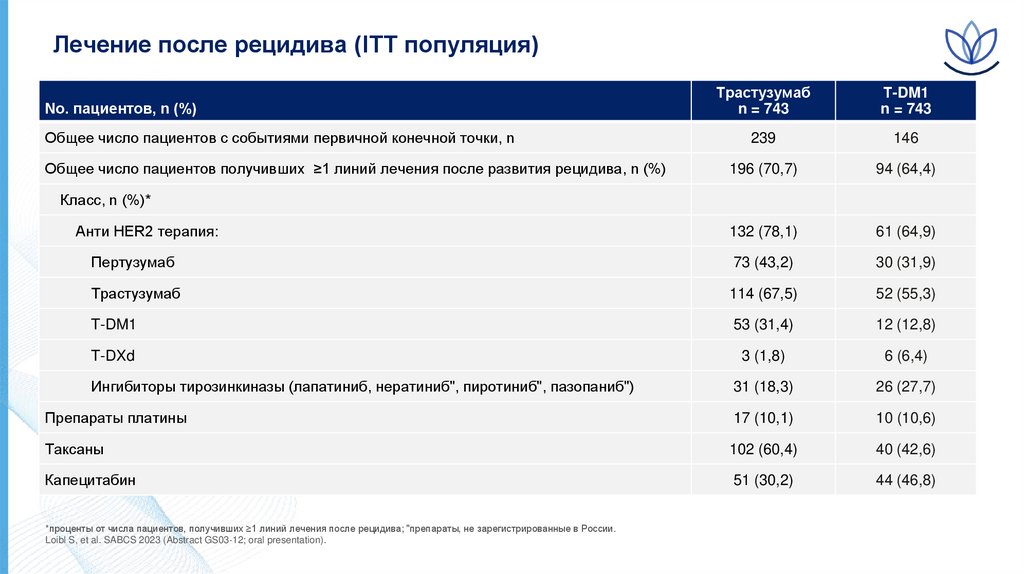
Лечение после рецидива (ITT популяция)Трастузумаб
n = 743
Т-DM1
n = 743
239
146
196 (70,7)
94 (64,4)
132 (78,1)
61 (64,9)
Пертузумаб
73 (43,2)
30 (31,9)
Трастузумаб
114 (67,5)
52 (55,3)
T-DM1
53 (31,4)
12 (12,8)
T-DXd
3 (1,8)
6 (6,4)
Ингибиторы тирозинкиназы (лапатиниб, нератиниб", пиротиниб", пазопаниб")
31 (18,3)
26 (27,7)
Препараты платины
17 (10,1)
10 (10,6)
Таксаны
102 (60,4)
40 (42,6)
Капецитабин
51 (30,2)
44 (46,8)
No. пациентов, n (%)
Общее число пациентов с событиями первичной конечной точки, n
Общее число пациентов получивших ≥1 линий лечения после развития рецидива, n (%)
Класс, n (%)*
Анти HER2 терапия:
*проценты от числа пациентов, получивших ≥1 линий лечения после рецидива; "препараты, не зарегистрированные в России.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation).
26.
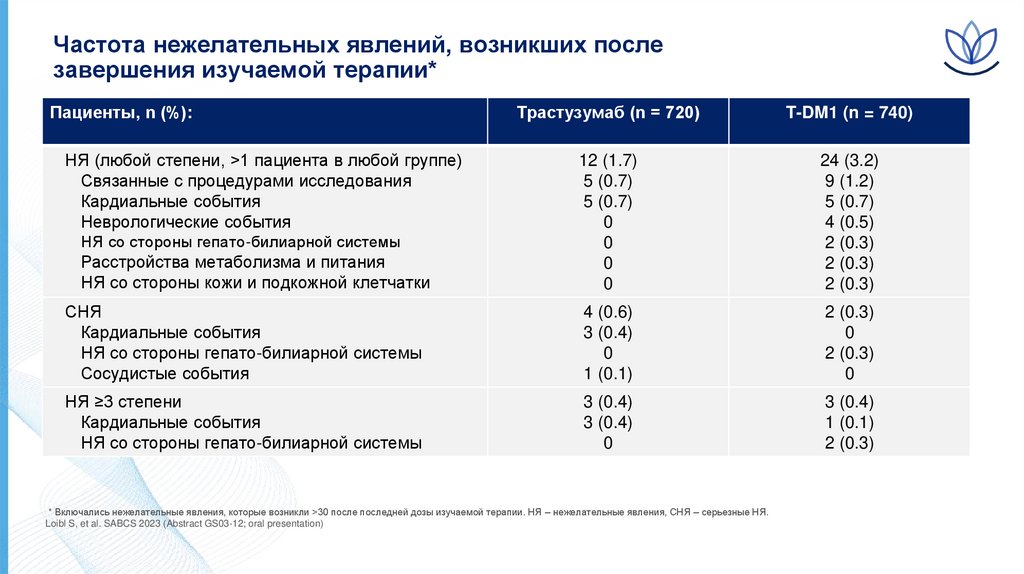
Частота нежелательных явлений, возникших послезавершения изучаемой терапии*
Пациенты, n (%):
Трастузумаб (n = 720)
T-DM1 (n = 740)
Расстройства метаболизма и питания
НЯ со стороны кожи и подкожной клетчатки
12 (1.7)
5 (0.7)
5 (0.7)
0
0
0
0
24 (3.2)
9 (1.2)
5 (0.7)
4 (0.5)
2 (0.3)
2 (0.3)
2 (0.3)
СНЯ
Кардиальные события
НЯ со стороны гепато-билиарной системы
Сосудистые события
4 (0.6)
3 (0.4)
0
1 (0.1)
2 (0.3)
0
2 (0.3)
0
НЯ ≥3 степени
Кардиальные события
НЯ со стороны гепато-билиарной системы
3 (0.4)
3 (0.4)
0
3 (0.4)
1 (0.1)
2 (0.3)
НЯ (любой степени, >1 пациента в любой группе)
Связанные с процедурами исследования
Кардиальные события
Неврологические события
НЯ со стороны гепато-билиарной системы
* Включались нежелательные явления, которые возникли >30 после последней дозы изучаемой терапии. НЯ – нежелательные явления, СНЯ – серьезные НЯ.
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation)
27.
Выводы изисследования
KATHERINE
(8,4 года
наблюдения)
• При медиане наблюдения 8,4 года постнеоадъювантная
терапия T-DM1 у пациентов с остаточной инвазивной
опухолью после НАТ сопровождается клинически и
статистически значимым увеличением общей выживаемости
по сравнению с трастузумабом
• Данные финального анализа выживаемости без рецидива
инвазивного РМЖ подтверждают результаты, полученные
при первичном анализе. Преимущества T-DM1 сохраняются
при увеличении продолжительности наблюдения за
пациентами
• Новых сигналов по безопасности T-DM1 при более
длительном наблюдении за пациентами не получено
• T-DM1 – стандарт и оптимальная опция
постнеоадъювантной терапии у пациентов с остаточной
инвазивной опухолью
НАТ – неоадъювантная терапия
Loibl S, et al. SABCS 2023 (Abstract GS03-12; oral presentation)
28.
Узнай больше о лечении рака молочной железына портале для врачей:
«Рак молочной железы
отА доЯ»
Лекции по диагностике и лечению РМЖ
от ведущих российских экспертов
Ждем Вас на портале!
Для перехода на портал «РМЖ от А до Я»
отсканируйте QR-код или перейдите
по ссылке:
go.roche.com/fromAtoZ
M-RU-00009482, ноябрь 2022
29.
Медицинская информация по препарату пертузумабЧтобы ознакомиться с инструкцией по медицинскому
применению препарата пертузумаб, отсканируйте QR
код или перейдите по ссылке:
https://www.roche.ru/ru/produkty/katalog/perjeta.html
АО «Рош-Москва», 107045, Россия, г. Москва, Трубная площадь,
дом 2, тел.: +7 (495) 229-29-99, www.roche.ru
Если Вам требуется распечатанная актуальная
инструкция, свяжитесь с нами по телефону
+7 (495) 229 29 99, и мы пришлём инструкцию по
указанному Вами адресу
Если у Вас есть вопрос, Вы можете задать его в службу медицинской
информации. http://medinfo.roche.ru/
30.
Медицинская информация по препарату трастузумаб эмтанзинЧтобы ознакомиться с инструкцией по медицинскому
применению препарата трастузумаб эмтанзин,
отсканируйте QR код или перейдите по ссылке:
https://www.roche.ru/ru/produkty/katalog/kadcyla.html
АО «Рош-Москва», 107045, Россия, г. Москва, Трубная площадь,
дом 2, тел.: +7 (495) 229-29-99, www.roche.ru
Если Вам требуется распечатанная актуальная
инструкция, свяжитесь с нами по телефону
+7 (495) 229 29 99, и мы пришлём инструкцию по
указанному Вами адресу
Если у Вас есть вопрос, Вы можете задать его в службу медицинской
информации. http://medinfo.roche.ru/








 medicine
medicine








