Similar presentations:
Периодическая система химических элементов Д.И. Менделеева. Химия. 9 класс
1.
МАОУ СОШ № 25Химия 9 класс
2. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
II
Группы элементов
IV
V
VI
III
VII
VIII
Щелочные металлы
1
1.00797
He
Водород
6,939
11 Mg
19 Ca
65.37
Цинк
37 Sr
85.47
Рубидий
112.41
Кадмий
Иттрий
Барий
Лантан
79 Au
80 Hg Tl
Золото
Ртуть
196.966
10 Франций
87 Ra
[223]
200.59
Радий
Таллий
88 89
[226]
47.90
Zr
91.224
Цирконий
Олово
178.49
Гафний
Свинец
Актиний
[261]
Резерфордий
92.906
51.996
Хром
Селен
Хлор
10
20,18
Неон
17 Ar
35,453
54.938
Марганец
34 Br
78.96
95.94
Молибден
51 Te
121.75
Сурьма
Ta
180.9479
Тантал
82 Bi
207.2
Сера
32,064
9 Ne
18.9984
18
Аргон
39,948
Бром
55.847
35 Kr
79.904
58.933
Железо
Кобальт
58.71
Никель
36
Криптон
83,8
Nb 42 Mo 43 Tс 44 Ru 45 Rh 46 Pd
Ниобий
73
фтор
16 Cl
33 Se
74.9216
Мышьяк
41
F
V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni
50.942
Ванадий
50 Sb
118.71
Ac 104 Rf
227.028
Фосфор
8
15.996
Кислород
15 S
30,9738
32 As
72.59
Германий
81 Pb
204.383
7 O
14.0067
Ti 23
La 72 Hf
138.81
Азот
14 P
28,086
Титан
49 Sn
114.82
Индий
56 57
137.34
22
39 40
88.9059
12,011
Кремний
31 Ge
69.72
Галлий
38 Y
87.62
Стронций
55 Ba
132.905
Цезий
Fr
44.956
Скандий
Ag 48 Cd In
107.868
Серебро
Cs
Кальций
Sс
6 N
Углерод
13 Si
26,9815
Алюминий
20 21
40,08
5 C
10 .811
Cu 30 Zn Ga
63.546
Медь
47
24,312
Магний
39.102
Бор
12 Al
22,988
Калий
Rb
4 В
9,012
Вериллий
Натрий
29
Гелий
3 Be
Литий
2
4,003
Теллур
74
Висмут
Дубний
101.07
53 Xe
Иод
126.904
102.905
Рутений
Родий
106.4
Палладий
54
Ксенон
131,3
W 75 Re 76 Os 77 Ir 78 Pt
183.85
186.2
Рений
84 At
208.982
Полоний
105 Db 106
[262]
52 I
127.60
Вольфрам
83 Po
208.98
99
Технеций
Sg
[263]
Сиборгий
Астат
190.2
85 Rn
210
192.2
Осмий
Иридий
86
Радон
[222]
107 Bh 108 Hs 109 Mt
[262]
Борий
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
3.
Периодическая система химических элементов Д.И.МенделееваI
1
II
2
Li
III
3
Na
4
K
6,939
V
VI
11
22,9898
Натрий
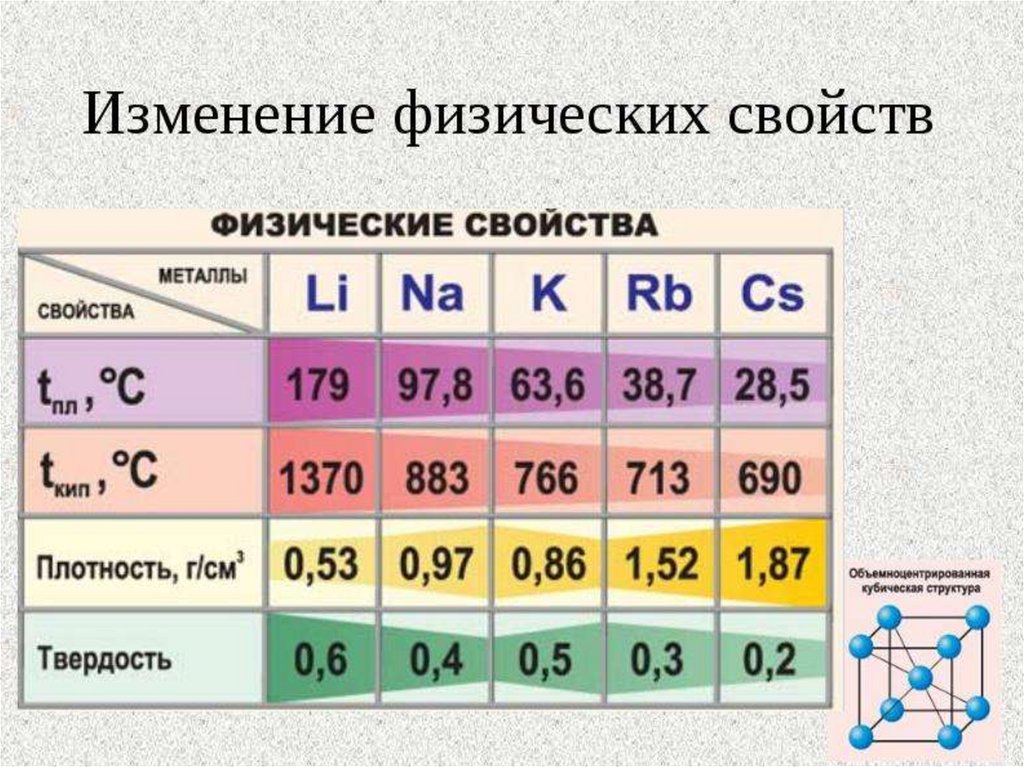
В главной подгруппе:
19
39.102
Калий
Rb
37
Число электронов на внешнем слое
не изменяется
Радиус атома увеличивается
85.47
Рубидий
Электроотрицательность уменьшается
Cs
55
132.905
Цезий
9
VII
VIII
Литий
7
8
VII
3
5
6
III
Щелочные металлы
I
IV
II
Группы элементов
IV
V
VI
Восстановительные свойства усиливаются
Металлические свойства усиливаются
Fr
10 Франций
87
[223]
4.
5.
6.
Соединения щелочныхметаллов
В свободном виде в природе щелочные
металлы не встречаются из-за своей
исключительно высокой химической
активности. Некоторые их природные
соединения, в частности соли натрия и
калия, довольно широко распространены, они
содержатся во многих минералах, растениях,
природных водах.
7.
Гидроксид натрия NаОН в технике известенпод названиями едкий натр, каустическая сода,
каустик.
Техническое название гидроксида калия КОН —
едкое кали.
Оба гидроксида — NaОН и КОН разъедают
ткани и бумагу, поэтому их называют также
едкими щелочами.
Едкий натр применяется в больших количествах
для очистки нефтепродуктов, в бумажной и
текстильной промышленности, для
производства мыла и волокон.
Едкое кали дороже и применяется реже.
Основная область его применения —
производство жидкого мыла.
8.
.Соли щелочных металлов — твердые кристаллические
вещества ионного строения.
Nа2СO3 — карбонат натрия, образует кристаллогидрат
Nа2СO3* 10Н2O, известный под названием
кристаллическая сода, которая применяется в
производстве стекла, бумаги, мыла.
Вам в быту более известна кислая соль — гидрокарбонат
натрия NаНСO3, она применяется в пищевой
промышленности (пищевая сода) и в медицине (питьевая
сода).
К2С03 — карбонат калия, техническое название — поташ,
используется в производстве жидкого мыла.
Nа2SO4 • 10Н2O — кристаллогидратат сульфата
натрия, техническое название — глауберова соль,
применяется для производства соды и стекла и в качестве
слабительного средства.
9.
10.
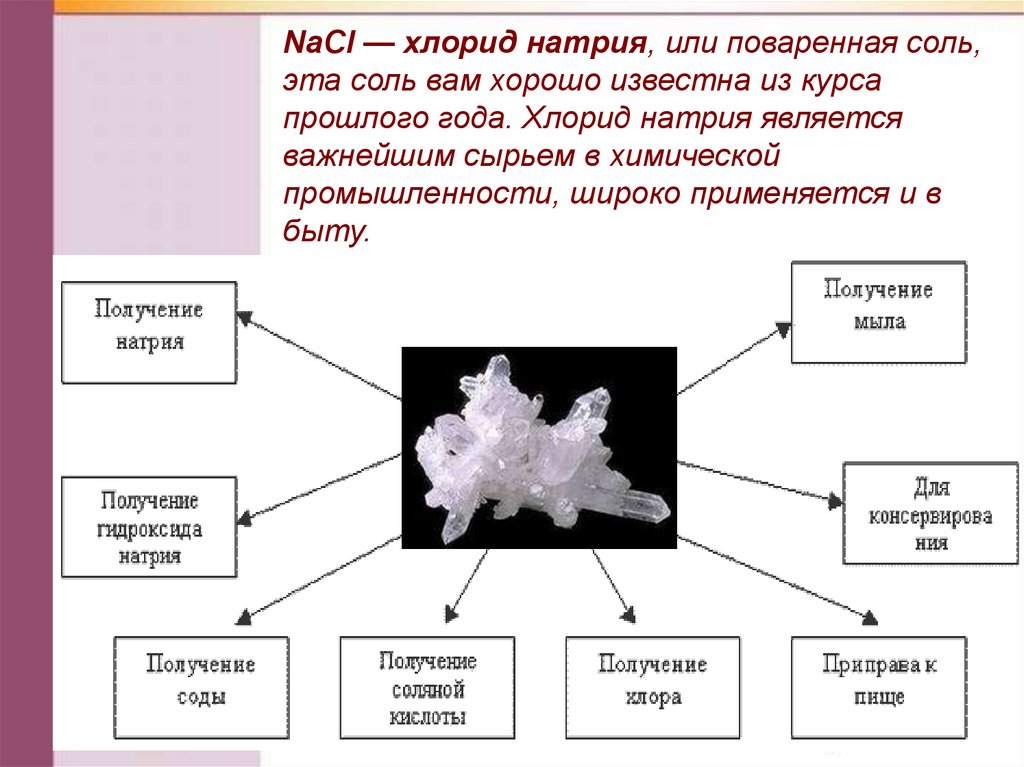
NаСl — хлорид натрия, или поваренная соль,эта соль вам хорошо известна из курса
прошлого года. Хлорид натрия является
важнейшим сырьем в химической
промышленности, широко применяется и в
быту.
11.
12.
Все щелочные металлы чрезвычайноактивны, во всех химических
реакциях проявляют
восстановительные свойства,
отдают свой единственный
валентный электрон, превращаясь в
положительно заряженный катион.
В качестве окислителей могут
выступать простые вещества –
неметаллы, оксиды, кислоты, соли,
органические вещества.
13.
Химические свойства+Г2
MeГ
+O2
Li2O, Na2O2, KO2
+H2
МеH
+ N2
Me3N
+H2O
(бурно)
МеOH +H2
+ к-ты
(бурно)
соль+H2
R-OH
R-OMe +H2
с НеМе
Щелочные
металлы
со сложными
веществами
14.
Химические свойства1) 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются)
2) 4Li + O2 = 2Li2O
2Na + O2 = Na2O2
3) 2Na + Н2 = 2NaН
(при нагревании 200-400oC)
оксид Li
2K + 2O2 = K2O4
пероксид Na
надпероксид K
4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
7) 2C2H5OH + 2Na = 2C2H5ONa + Н2
Щелочные металлы с водой
15.
Качественное определение щелочных металловДля распознавания соединений щелочных металлов по окраске пламени
исследуемое вещество вносится в пламя горелки на кончике железной
проволоки.
Li+ - карминово-красный
Na+ - желтый
Li+
K+ - фиолетовый
Rb + - красный
Na+
Cs+ - фиолетово-синий
K+
16.
Получение щелочных металлов1) Электролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и гидроксидов
щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Схема электролизера для получения натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и
кольцевым железный катодом К, между которыми расположена сетчатая диафрагма.
Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что
позволяет проводить процесс при 610–650°С). Металлический натрий собирается в
верхней части кольцевого катодного пространства, откуда и переходит в сборник. По
мере хода электролиза в ванну добавляют NaCl.
17.
Применение щелочных металловДля
получения
трития
Литий
Получение
сплавов для
подшипников
Химические
источники
тока
Восстановитель
в органическом
синтезе
Пиротехника
18.
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Качественный
анализ
органических
веществ
Восстановитель
в органическом
синтезе
Натрий
Газоразрядные
лампы
Термическое
получение
металлов
Производство
натриевосерных
аккумуляторов
19.
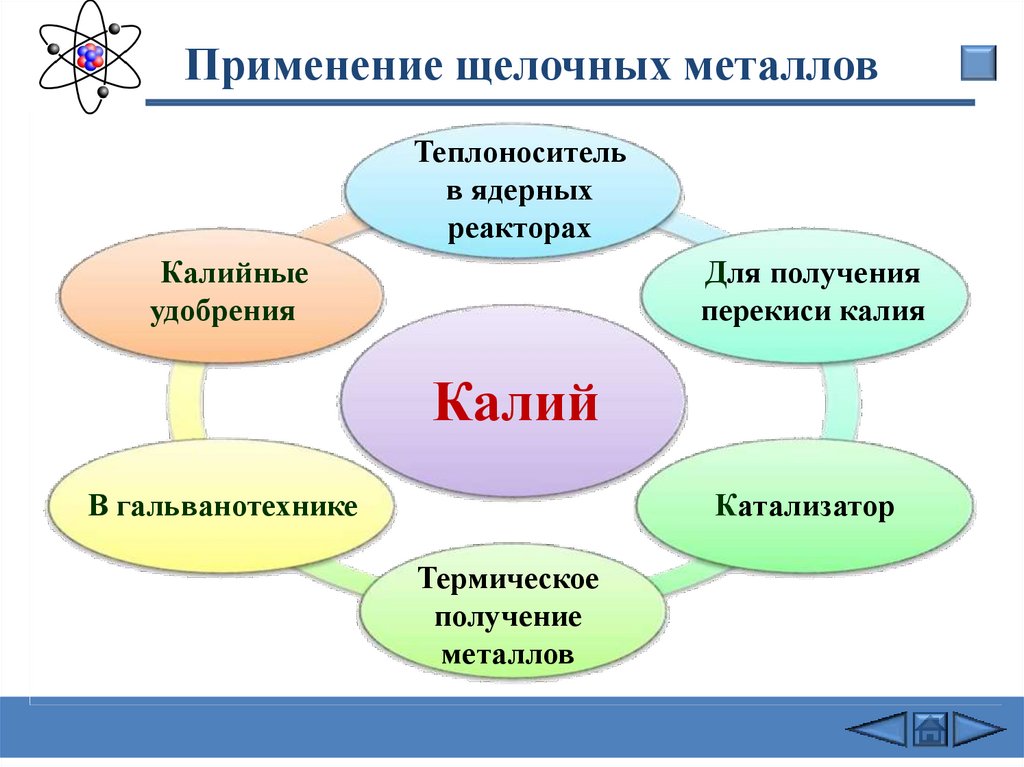
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Калийные
удобрения
Для получения
перекиси калия
Калий
В гальванотехнике
Катализатор
Термическое
получение
металлов
20.
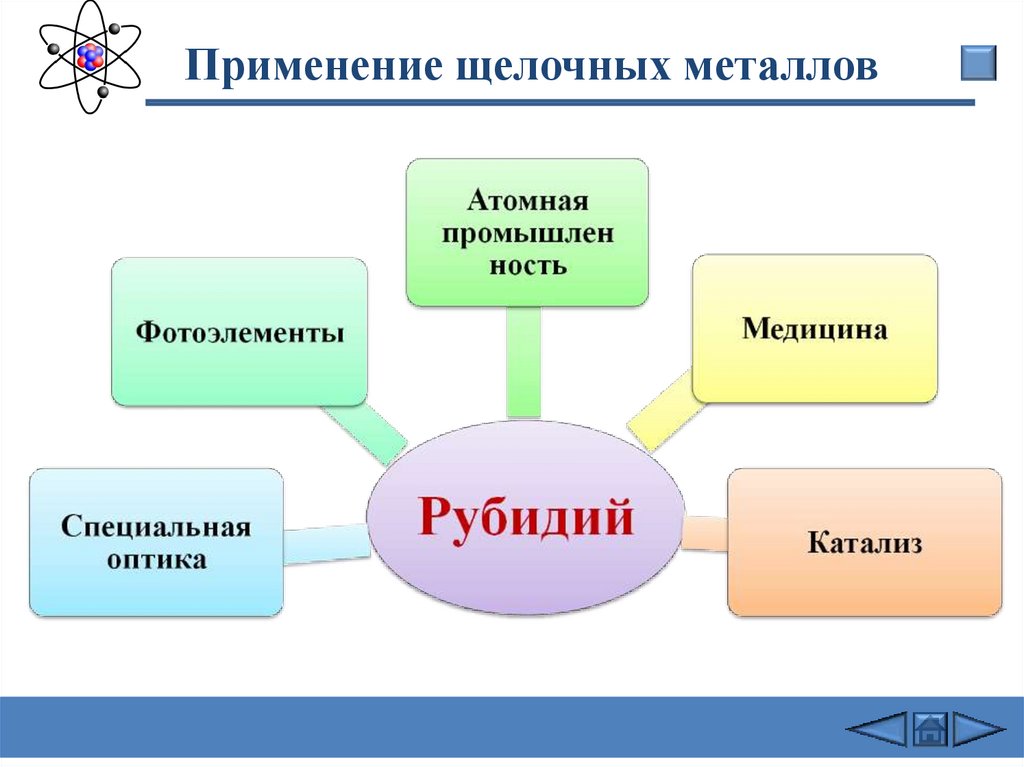
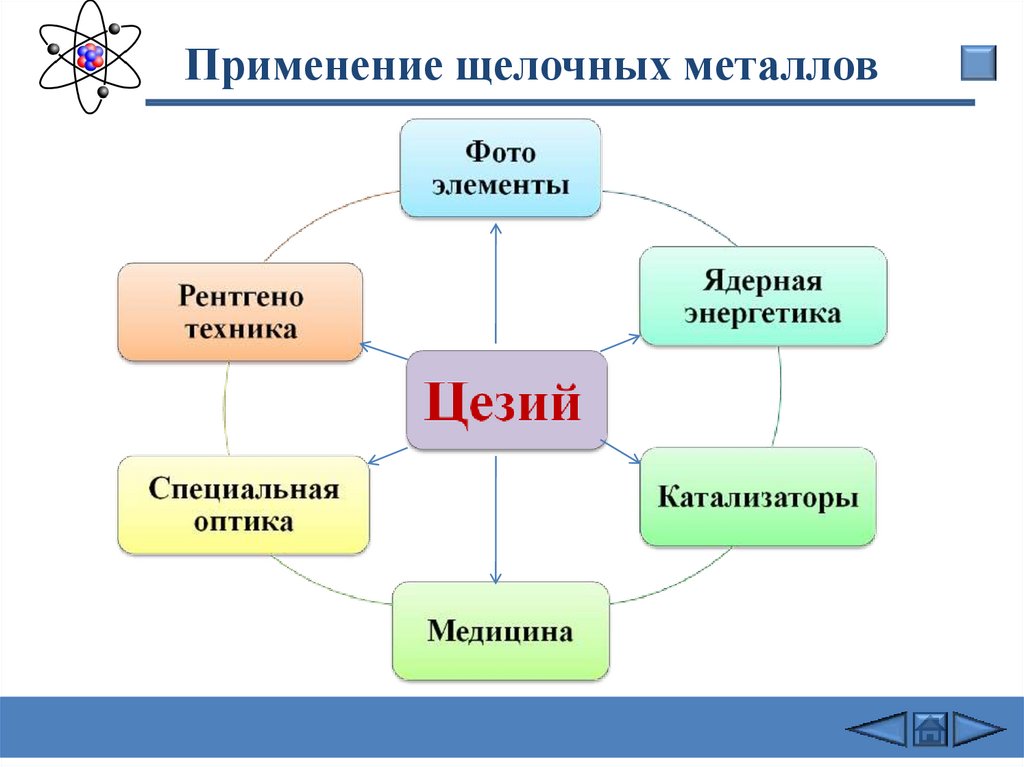
Применение щелочных металлов21.
Применение щелочных металлов22.
Домашнее задание§ 14
Упр.1 (а, б) стр.94 письменно
*Упр.2 – 3 стр.95

















 chemistry
chemistry








