Similar presentations:
Периодическая система химических элементов Д.И. Менделеева
1.
12.
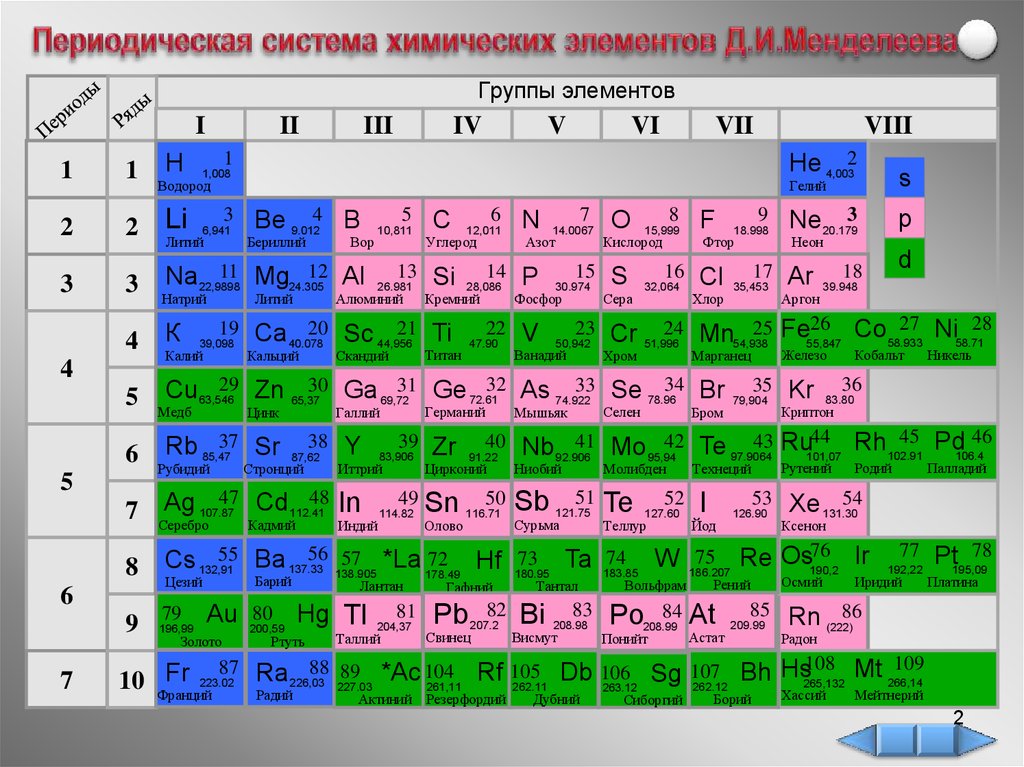
Группы элементовI
1
1
2
2
3
3
4
4
5
6
5
7
8
6
9
7
Н
II
III
IV
V
VI
VII
VIII
1
1,008
Водород
Li
3
6,941
Литий
Be 9.0124 В
Бериллий
Вор
11 Mg 12 Al
Na22,9898
24.305
Натрий
К
Литий
19
39,098
Калий
5
10,811
13
26.981
Алюминий
С
Углерод
Si
Титан
Скандий
14
28,086
Кремний
20 Sc 21 Ti
Ca 40.078
44,956
Кальций
6
12,011
22
47.90
N
7
14.0067
Азот
P
15
30.974
Фосфор
V
23
50,942
Ванадий
О
8
15,999
Кислород
S
Сера
16
32,064
9
F
18.998
Фтор
17
Cl
35,453
Хлор
Цинк
Rb 85,4737 Sr
Рубидий
38
87,62
Стронций
Кадмий
39
Y
83,906
Иттрий
47 Cd 48 In
Ag 107.87
112.41
Серебро
Германий
Галлий
49
Индий
114.82
Zr
Мышьяк
40
91.22
Цирконий
Хром
55 Ba 56 57 *La 72 Hf
Cs 132,91
137.33 138.905
178.49
Барий
Цезий
79
196,99
Au
Золото
80
200,59
Лантан
Hg Tl
Ртуть
87 Ra 88
Fr 223.02
226,03
10 Франций
Радий
81
204,37
Таллий
89
227.03
Гафний
Резерфордий
Ne 20.1793
p
18
d
Неон
Ar
Аргон
39.948
Kr
Кобальт
Никель
36
83.80
Криптон
41 Mo 42 Te 43 Ru44 Rh 45 Pd 46
Nb 92.906
102.91
106.4
101,07
97.9064
95,94
Ниобий
Молибден
Сурьма
73
180.95
52
127.60
Теллур
Ta
Тантал
74
183.85
W
Вольфрам
Висмут
Понийт
*Ac 104
Rf 105
Db 106
Sg
261,11
262.11
263.12
Актиний
35
79,904
Бром
Дубний
Сиборгий
Рутений
Технеций
53
I
126.90
Йод
75
186.207
Астат
107
262.12
Родий
85
209.99
Палладий
54
Xe 131.30
Ксенон
76 Ir
Re Os190,2
Рений
83 Po 84 At
Pb 207.282 Bi 208.98
208.99
Свинец
s
Железо
Марганец
Селен
50 Sb 51 Te
Sn 116.71
121.75
Олово
Гелий
24 Mn 25 Fe26 Co 27 Ni 28
Cr 51,996
58.933
58.71
55,847
54,938
29 Zn 30 Ga 31 Ge 32 As 33 Se 34 Br
Cu 63,546
72.61
78.96
65,37
69,72
74.922
Медб
Не 4,0032
Осмий
77
192,22
Иридий
78
Pt195,09
Платина
Rn (222)86
Радон
108 Mt 109
Bh Hs265,132
266,14
Борий
Хассий
Мейтнерий
2
3.
Группы элементовI
1
1
2
2
3
3
27
4
4
5
6
5
7
+13
II
III
IV
0
V
VI
Открытие
элемента
Содержание в
земной коре
(масс.)
Важнейшие
минералы
8
6
9
7
Радиус атома,
нм
VII
VIII
1825 год Х.Эрстед
1827 год Ф.Велер
8,8%
Алюмосиликаты
Боксит
Корунд
Глинозем
0,143
10
3
4.
1. Из истории открытия2. Положение в ПСХЭ. Строение атома
3. Нахождение в природе
4. Простое вещество. Физические свойства
5. Химические свойства
6. Получение
7. Применение
8. Проверь свои знания
9. Использованные источники
4
5.
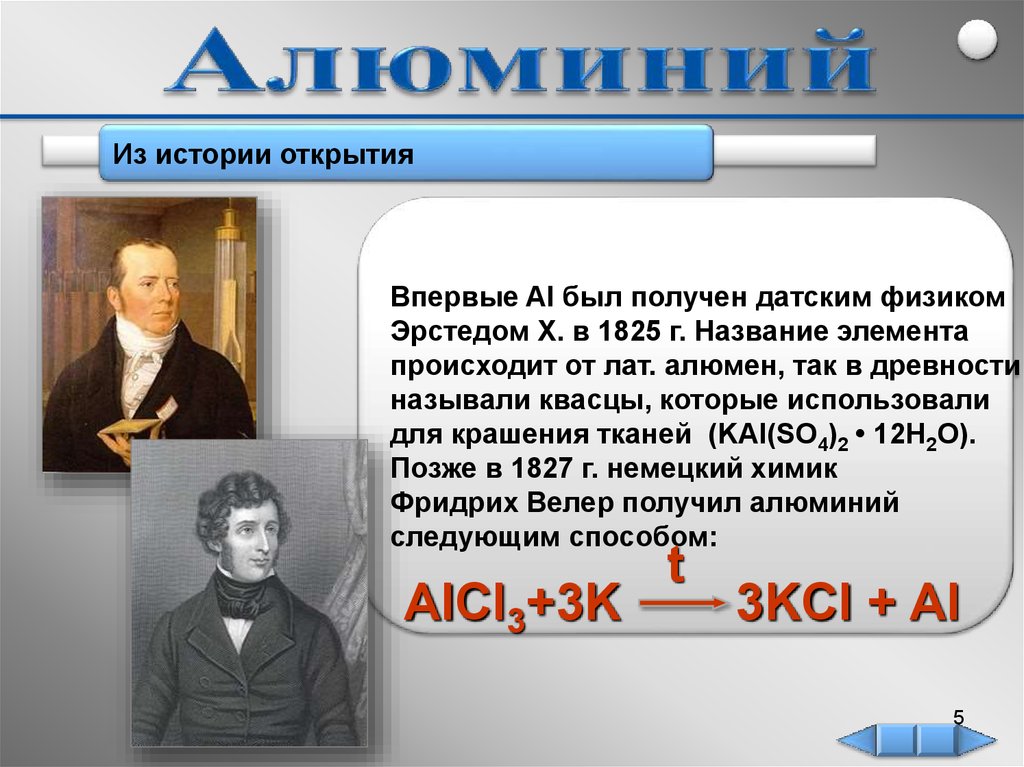
Из истории открытияВпервые Al был получен датским физиком
Эрстедом Х. в 1825 г. Название элемента
происходит от лат. алюмен, так в древности
называли квасцы, которые использовали
для крашения тканей (KAl(SO4)2 • 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
AlCl3+3K
t
3KCl + Al
5
6.
Из истории открытияВ период открытия алюминия - металл
был дороже золота. Англичане хотели
почтить богатым подарком великого
русского химика Д.И Менделеева,
подарили ему химические весы, в
которых одна чашка была изготовлена
из золота, другая - из алюминия. Чашка
из алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных, но и
промышленников и даже императора
Франции.
6
7.
Вставьте пропущенные слова1. Алюминий - элемент III группы, главной подгруппы.
2. Заряд ядра атома алюминия равен +13.
3. В ядре атома алюминия 13 протонов.
4. В ядре атома алюминия 14 нейтронов.
5. В атоме алюминия 13 электронов.
6. Атом алюминия имеет 3 энергетических уровня.
7. Электронная оболочка имеет строение 2е, 8е, 3е.
8. На внешнем уровне в атоме 3 электронов.
9. Степень окисления атома в соединениях равна +3 .
10.Простое вещество алюминий является металлом.
11.Оксид и гидроксид алюминия имеют амфотерный характер
7
8.
Электронное строение27
0
P+ = 13
e- = 13
n0 = 14
+13
2e
8e
3e
3s2
2s2
Порядок заполнения
3p1
2p6
1s2
Краткая электронная запись
8
9.
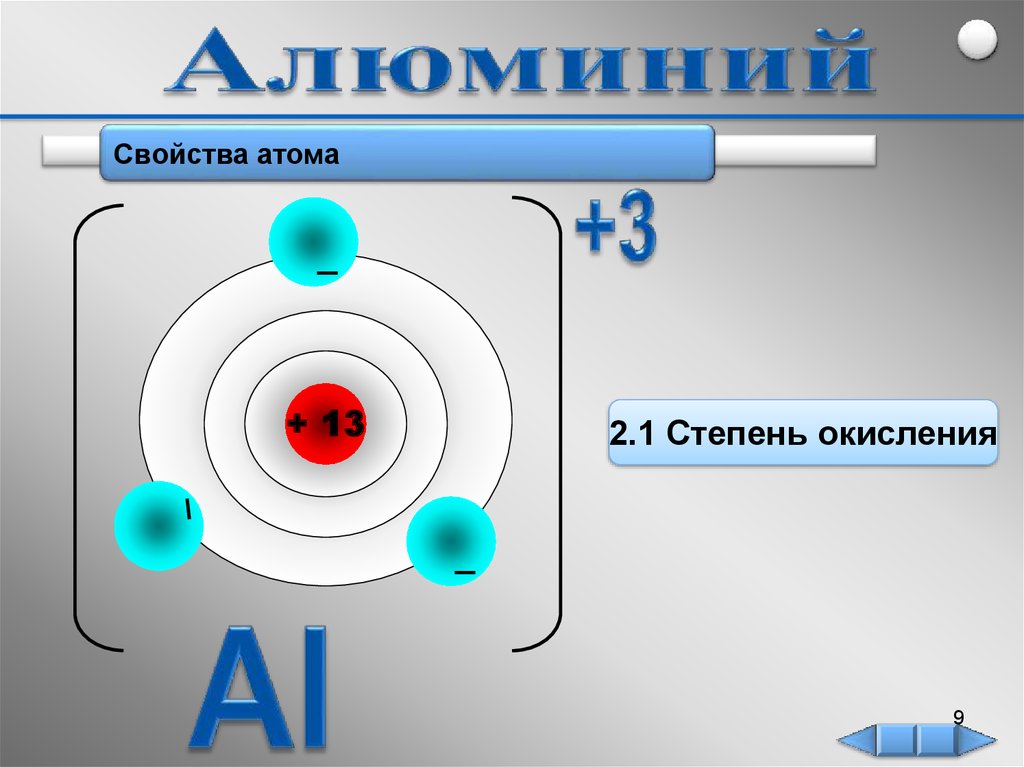
Свойства атома+ 13
2.1 Степень окисления
9
10.
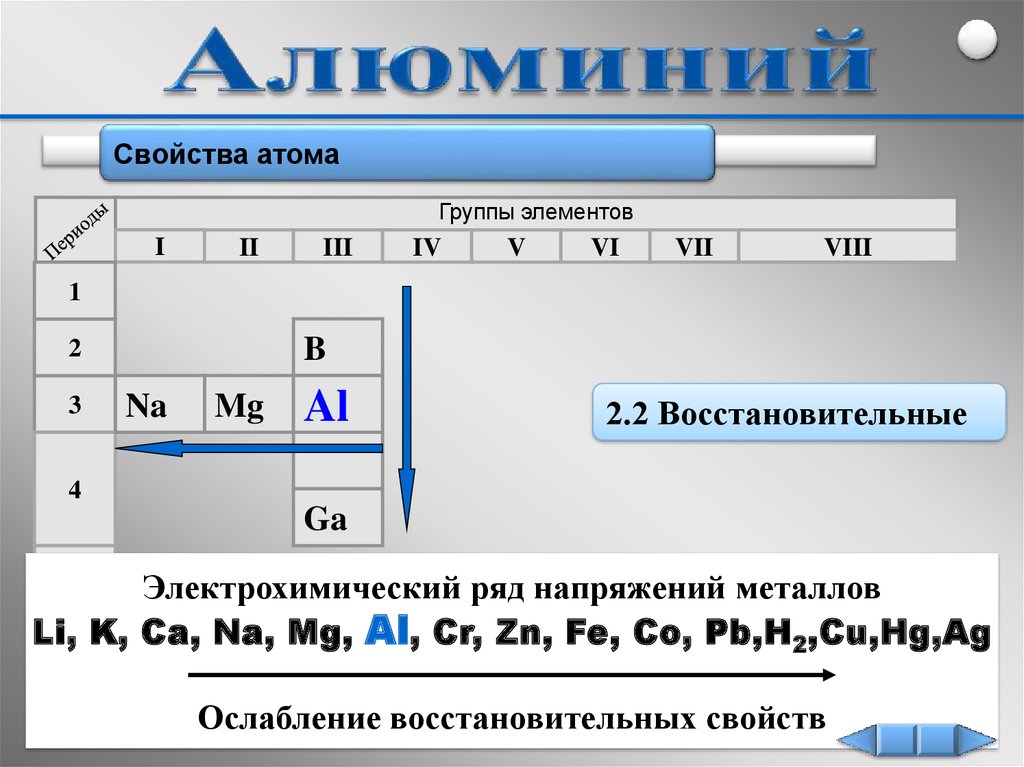
Свойства атомаГруппы элементов
I
II
III
IV
V
VI
VII
VIII
1
B
2
3
Na
Mg
Al
2.2 Восстановительные
4
Ga
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
5
Ослабление восстановительных свойств
10
11.
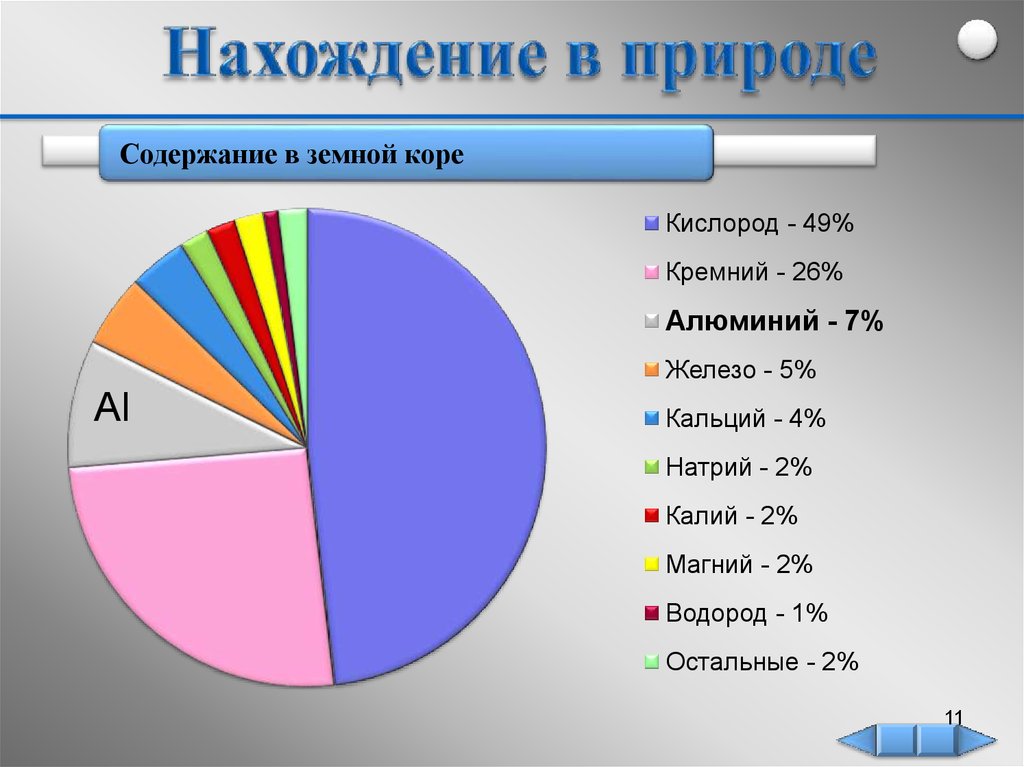
Содержание в земной кореКислород - 49%
Кремний - 26%
Алюминий - 7%
Железо - 5%
Al
Кальций - 4%
Натрий - 2%
Калий - 2%
Магний - 2%
Водород - 1%
Остальные - 2%
11
12.
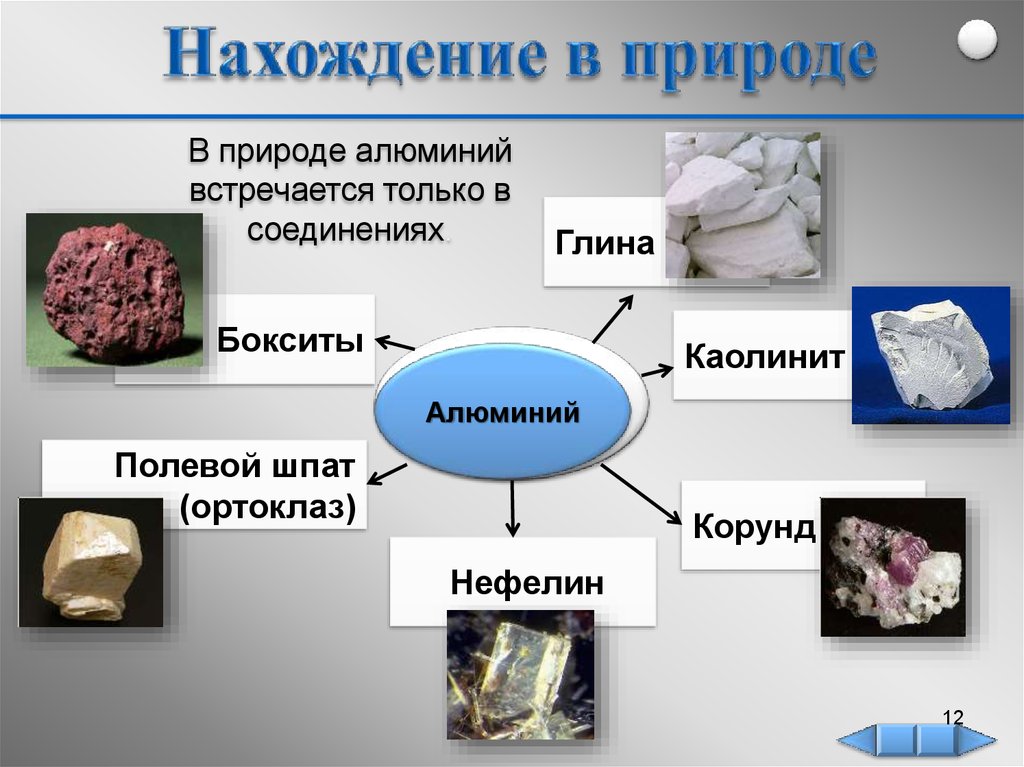
В природе алюминийвстречается только в
соединениях.
Глина
Бокситы
Каолинит
Алюминий
Полевой шпат
(ортоклаз)
Корунд
Нефелин
12
13.
Бокситы (от названия местности ЛеБо, Lex Baux, на юге Франции, гдевпервые обнаружены их залежи) —
алюминиевая руда - смесь
основного оксида AlO(OH) и
гидроксида Al(OH)3, оксидов и
гидроксидов железа и глинистых
минералов. Цвет бокситов зависит
от содержания железа обычно
красный различных оттенков или
серый. В России крупные
месторождения бокситов находятся
на Урале, в Башкирии и Сибири.
13
14.
Известно более 250 минералов, всостав которых входит алюминий,
большинство из них
алюмосиликаты, из которых и
образована в основном земная кора.
При их выветривании образуется
глина, основу которой составляет
минерал каолинит Al2O3•2SiO2•2H2O.
Примеси железа обычно окрашивают
глину в бурый цвет, но встречается и
белая глина – каолин, которую
используют для изготовления
фарфоровых и фаянсовых изделий
14
15.
Каолинит Al2O3•2SiO2•2H2O –минерал подкласса слоистых
силикатов, главная составная
часть белой, огнеупорной и
фарфоровой глины. Обычно
является продуктом
выветривания. Имеет две
полиморфные модификации –
диккит и накрит. Каолинит сильно
гигроскопичен.
15
16.
Изредка встречается твердый (уступает лишьалмазу) минерал корунд – кристаллический
оксид Al2O3 , часто окрашенный примесями в
разные цвета. Его синяя разновидность
(примесь титана и железа) называется
сапфиром, красная (примесь хрома) – рубином.
Разные примеси также могут окрашивать так
называемый благородный корунд в желтый,
оранжевый, фиолетовый и другие цвета и
оттенки.
16
17.
Na2O • Al2O3 • 2SiO2Минералы – серые,
красноватые и другие
кристаллы с характерным
жирным блеском. Главный
минерал щелочных
изверженных пород.
Используется как сырье для
добычи алюминия с
попутным получением
соды.
17
18.
К2O • Al2O3 • 6SiO2Калиевый полевой шпат.
Белый, серый, розовый и
т.д. одна из главных
составных частей гранитов ,
гнейсов и других
изверженных и
метаморфических пород.
Сырье стекольной и
керамической
промышленности
18
19.
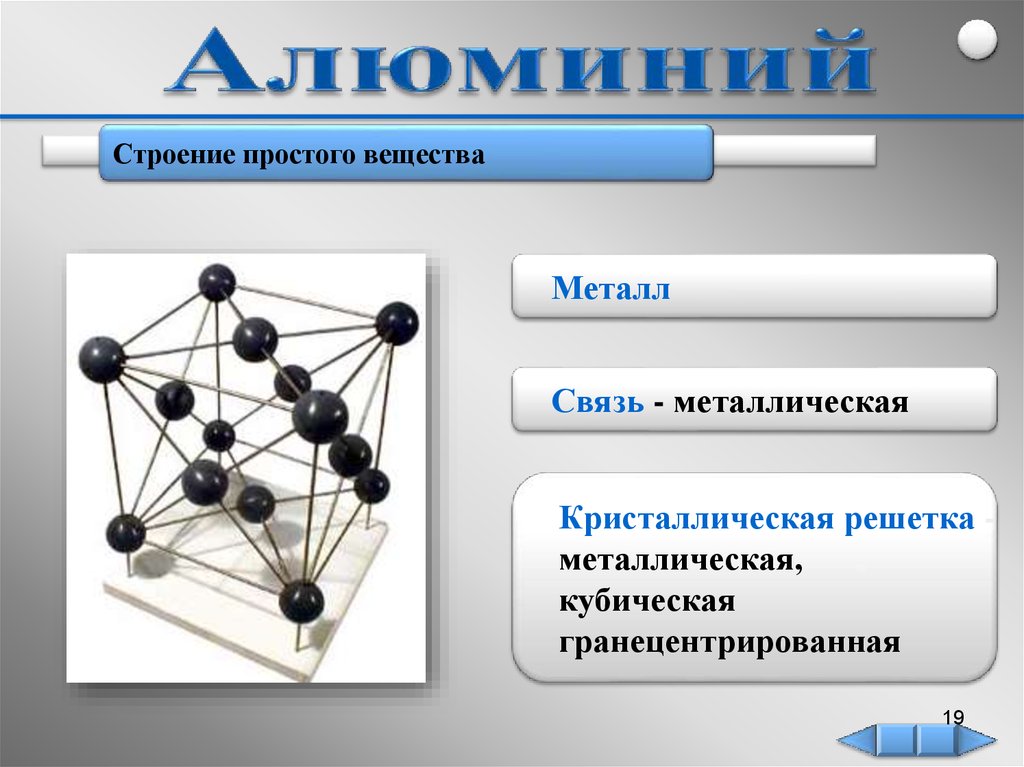
Строение простого веществаМеталл
Связь - металлическая
Кристаллическая решетка металлическая,
кубическая
гранецентрированная
19
20.
Физические свойстваЦвет – серебристо-белый
t пл. = 660°C
t кип. ≈ 2450°C
электропроводный,
теплопроводный
легкий,
плотность ρ = 2,6989 г/см3
мягкий, пластичный
Видео плеер химических экспериментов
20
21.
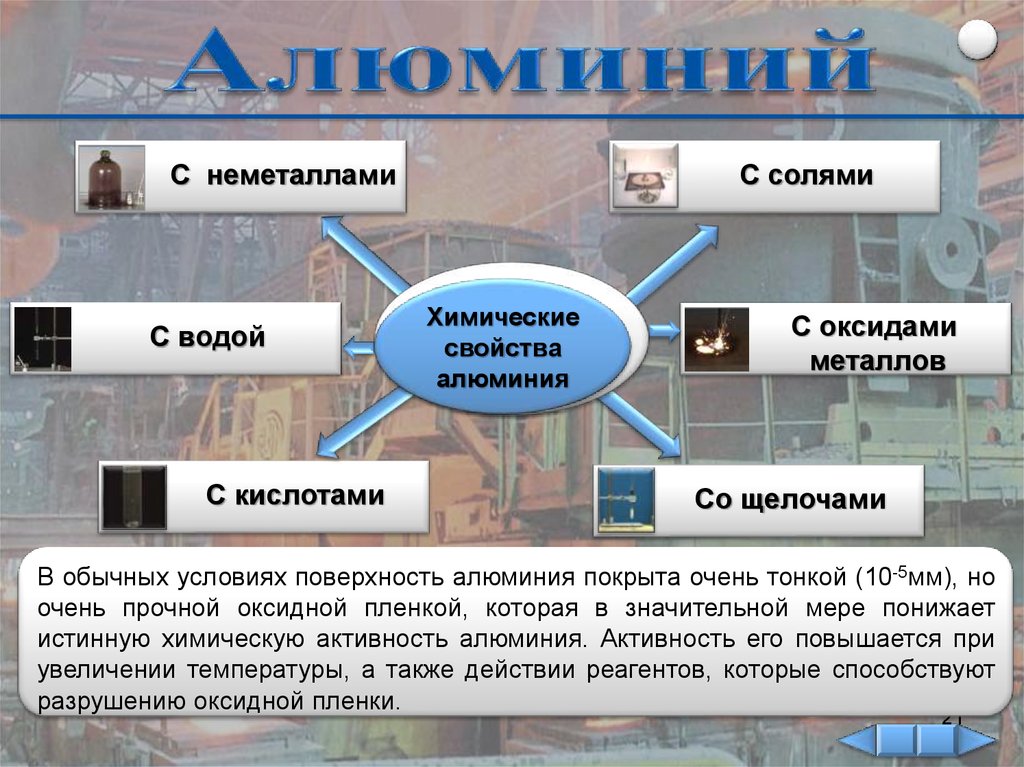
С неметалламиС водой
С кислотами
С солями
Химические
свойства
алюминия
С оксидами
металлов
Со щелочами
В обычных условиях поверхность алюминия покрыта очень тонкой (10-5мм), но
очень прочной оксидной пленкой, которая в значительной мере понижает
истинную химическую активность алюминия. Активность его повышается при
увеличении температуры, а также действии реагентов, которые способствуют
разрушению оксидной пленки.
21
22.
Взаимодействие с неметалламиИз неметаллов
алюминий легче всего
реагирует с кислородом
и галогенами.
4Аl
→2Al
Аl+3O
+ 2O
2O3
2 →
Аl + Br2 →
2Аl +3Br2→2AlBr3
Видео плеер химических экспериментов
22
23.
Взаимодействие с неметалламиC галогенами бромом и
йодом реагирует в
присутствии
небольшого количества
воды
2Аl
Аl+3I
+ 2I→2AlI
2 → 3
2Al+3S→Al
Al + S →2S3
Видео плеер химических экспериментов
4Al+3C→Al
Al + C →4C3
1500-17000С
23
24.
Взаимодействие с водойВ особых условиях
алюминий (очищенный
от оксидной пленки в
инертной атмосфере)
реагирует с водой
Al + H2O →
Видео плеер химических экспериментов
2Al+6H2O → 2Al(OH)3 + 3H2↑
24
25.
Взаимодействие с кислотамиАлюминий достаточно
легко реагирует с
кислотами.
Al + HCl →
Al+H2SO4→
Но!
Видео плеер химических экспериментов
Но! Не реагирует при обычных условиях с очень
разбавленной и концентрированной азотной кислотой
2
4 (пассивируется)
2
34 3
2 2
Al+3H
2Al+6HCl
SO →
→Al
2AlCl
(SO )+ +
3H3H↑ ↑
25
26.
Взаимодействие с солямиLi K Ba Sr Ca Na
Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb
(H2) Cu Hg Ag Pt Au
Алюминий может реагировать с водными растворами отдельных солей.
2Al + 3CuCl
Al + 2CuCl
→ 3Cu
2 →+ 2AlCl3
2Al + Fe2Al
(SO
+ 4Fe
)3 2→
(SO
Al42)(SO
3 →4)3 + 2Fe
26
27.
Взаимодействие с оксидами металловАлюминий – сильный
восстановитель.
Его применяют для
получения из оксидов
многих металлов: Cr,
Mo, Mn, W, Ta, Nb
Al+Fe2O3→
t
Al+WO2→
t
Видео плеер химических экспериментов
00
3+ O →
3+ O + 3Fe
4Al00+Fe
+3WO
2Al
3W
2Al
→
Al
223
2 3
27
28.
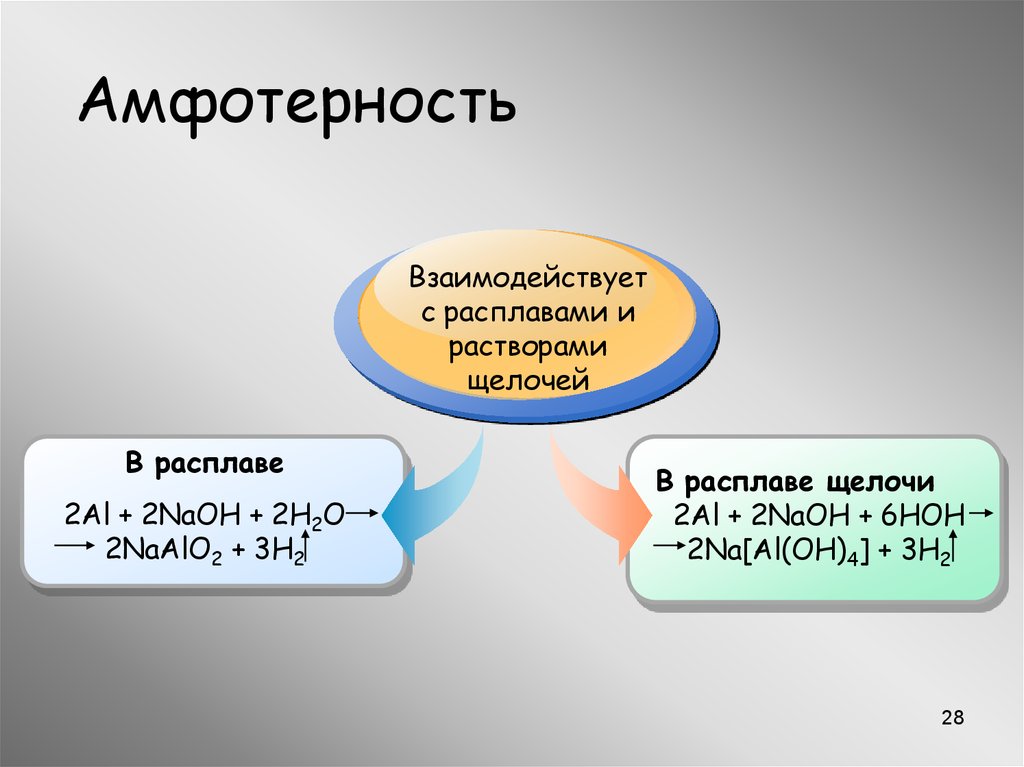
АмфотерностьВзаимодействует
с расплавами и
растворами
щелочей
В расплаве
2Al + 2NaOH + 2H2O
2NaAlO2 + 3H2
В расплаве щелочи
2Al + 2NaOH + 6HOН
2Na[Al(OН)4] + 3H2
28
29.
Взаимодействие со щелочамиАлюминий активно
взаимодействует со
щелочами. Защитная
пленка амфотерного
оксида Al2O3 неустойчива
по отношению к щелочам
и легко растворяется,
образуя в водных
растворах
гидроксоалюминаты
Al+NaOH→
Видео плеер химических экспериментов
2Al+2NaOH+4H2O→2Na[Al(OH)4]+3H2↑
29
30.
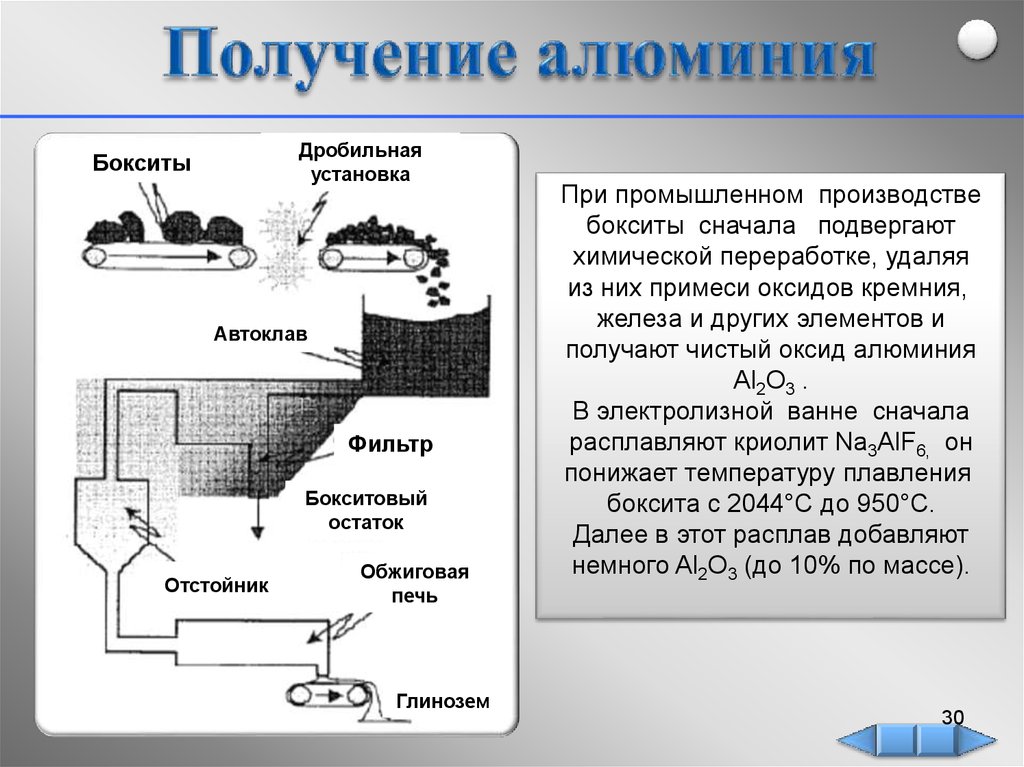
Дробильнаяустановка
Бокситы
Автоклав
Фильтр
Бокситовый
остаток
Отстойник
Обжиговая
печь
Глинозем
При промышленном производстве
бокситы сначала подвергают
химической переработке, удаляя
из них примеси оксидов кремния,
железа и других элементов и
получают чистый оксид алюминия
Al2O3 .
В электролизной ванне сначала
расплавляют криолит Na3AlF6, он
понижает температуру плавления
боксита с 2044°C до 950°C.
Далее в этот расплав добавляют
немного Al2О3 (до 10% по массе).
30
31.
Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) :Катод:
2Al2O3 = 4Al +3O2
Анод (графит) : С + О2 = СО2
31
32.
Искусственныерубины
В машиностроении
Упаковка
Алюминий
Термитные и
взрвчатые смеси
Дизайн
Изготовление
зеркал
Строительство
Электротехника
32
33.
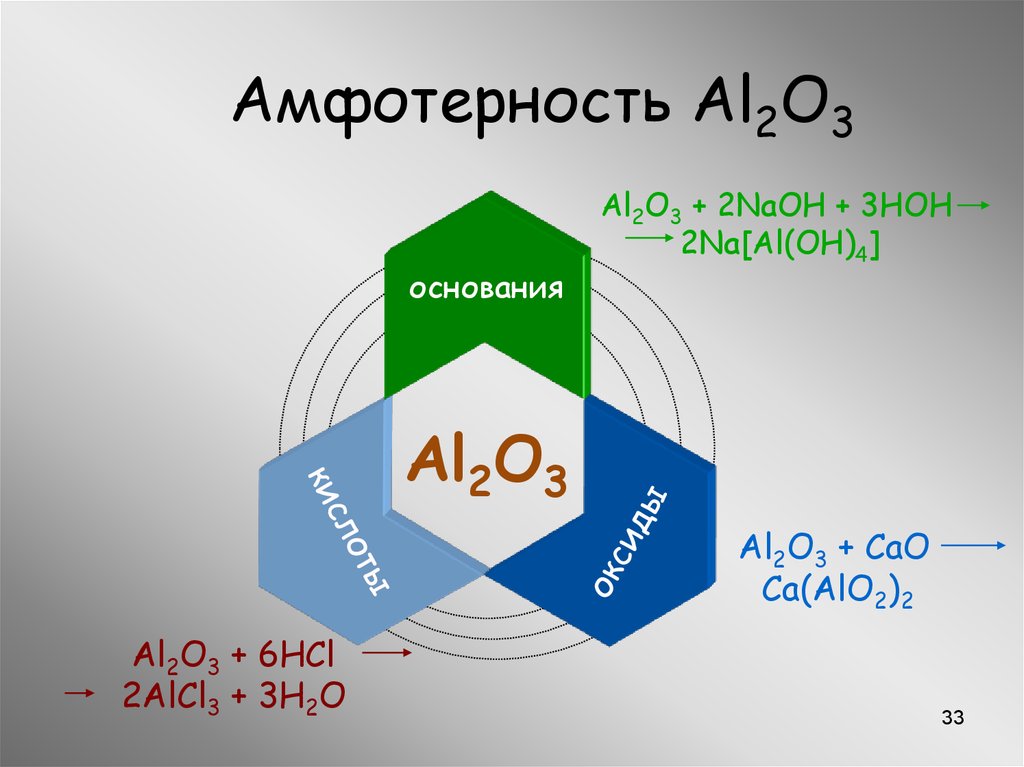
Амфотерность Al2O3основания
Al2O3 + 2NaOH + 3HOH
2Na[Al(OH)4]
Al2O3
Al2O3 + CaO
Ca(AlO2)2
Al2O3 + 6HCl
2AlCl3 + 3H2O
33
34.
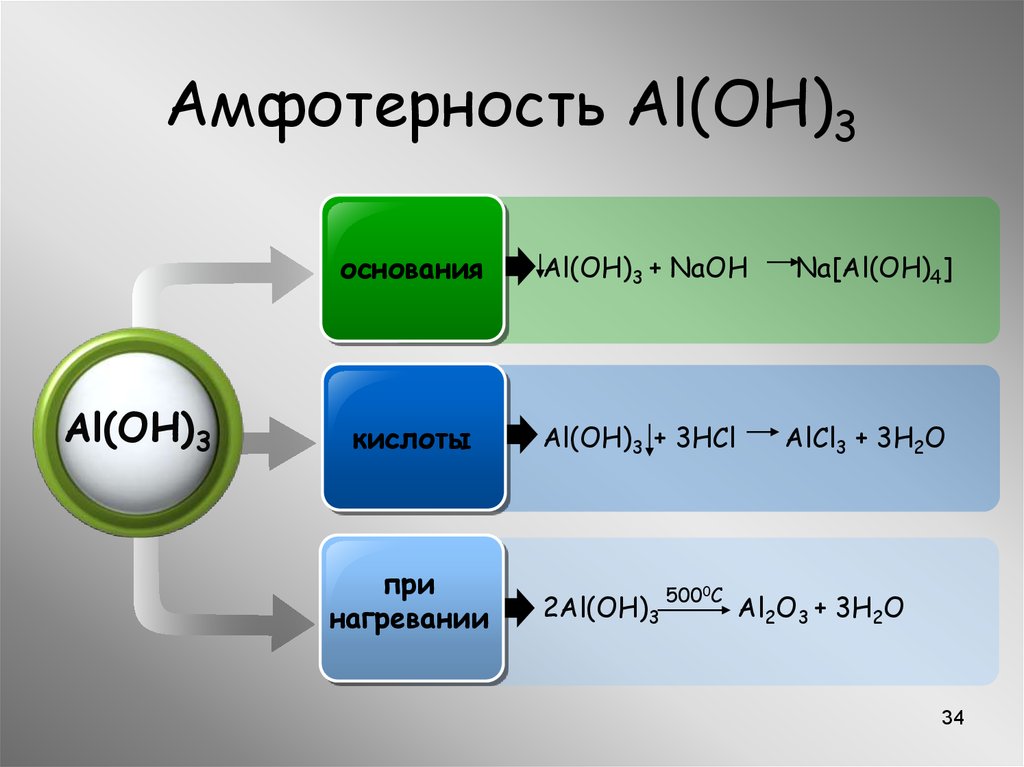
Амфотерность Al(OH)3Al(OH)3
основания
Al(OH)3 + NaOH
кислоты
Al(OH)3 + 3HCl
при
нагревании
2Al(OH)3
5000C
Na[Al(OH)4]
AlCl3 + 3H2O
Al2O3 + 3H2O
34
35.
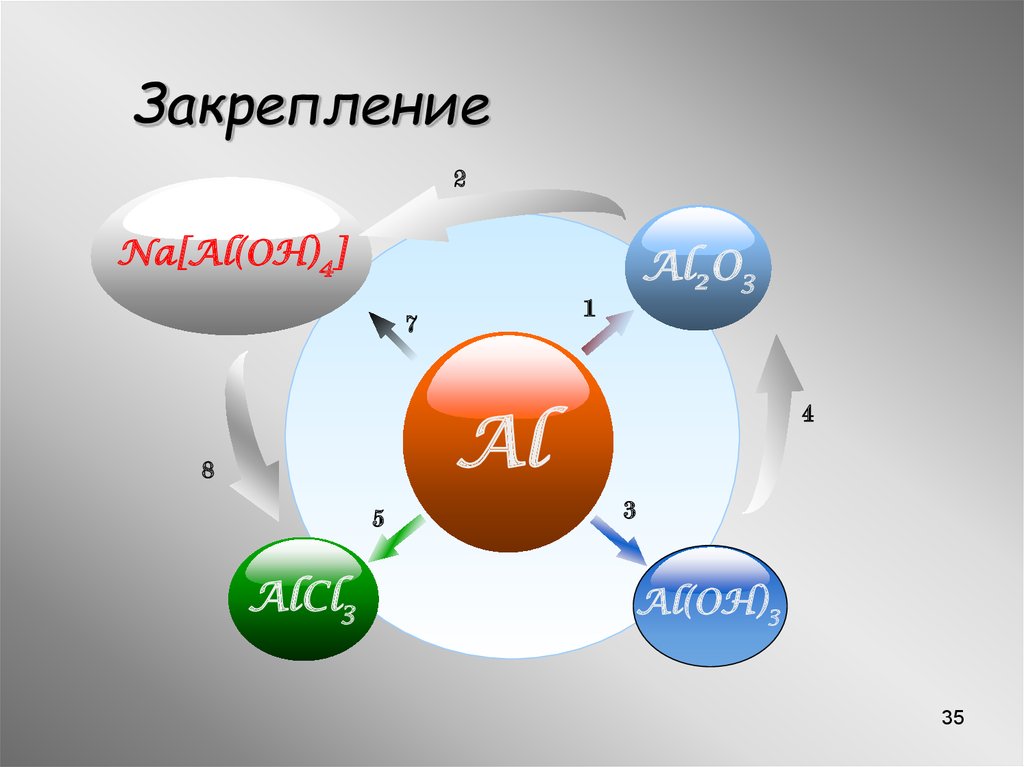
Закрепление2
Na[Al(OH)4]
Al2O3
1
7
Al
8
5
AlCl3
4
3
Al(OH)3
35






















 chemistry
chemistry








