Similar presentations:
Взаимодействие кислот с металлами
1.
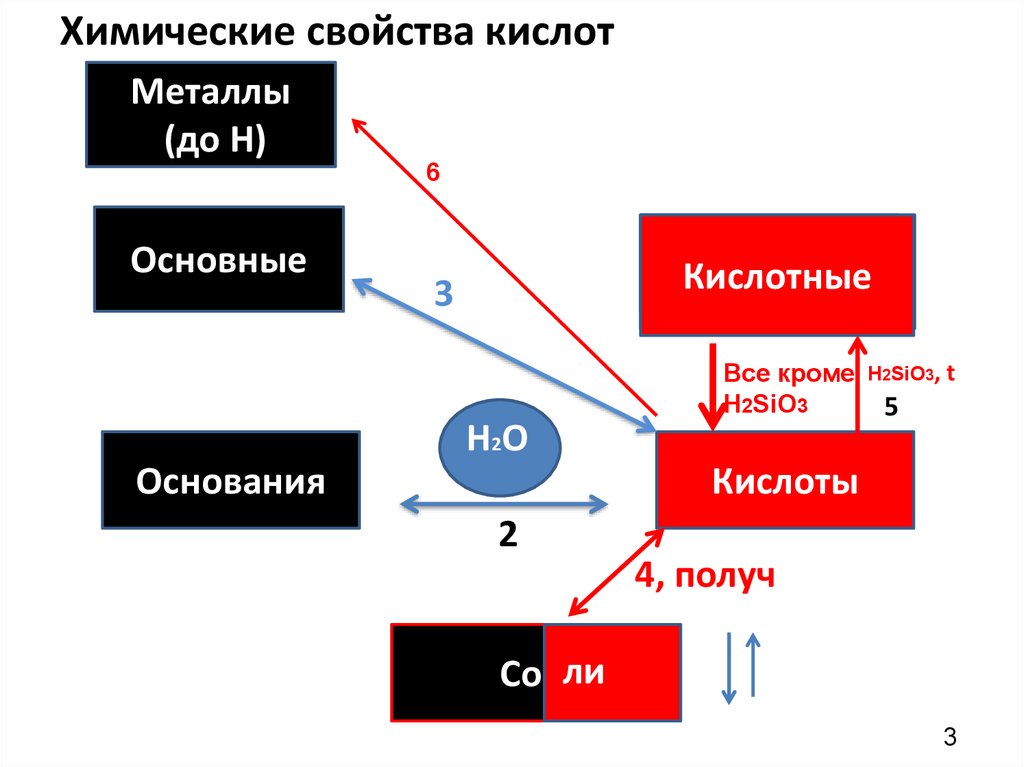
Алгоритм работы: тема : Взаимодействие кислот с металлами:1. У кого нарисована схема(сл.2) – добавить на ней последнее,6 свойство(сл 3),
всем- со слайда 3 записать словами:
металл + кислота = соль + водород (Н2)
2. Посмотреть видео https://youtu.be/nMmf4lbeGC8 по взаимодействию металлов с
кислотами, прочитать §49, стр.179.
Кто учится САМ составлять уравнения реакций, а не списывает с ГДЗ, где куча
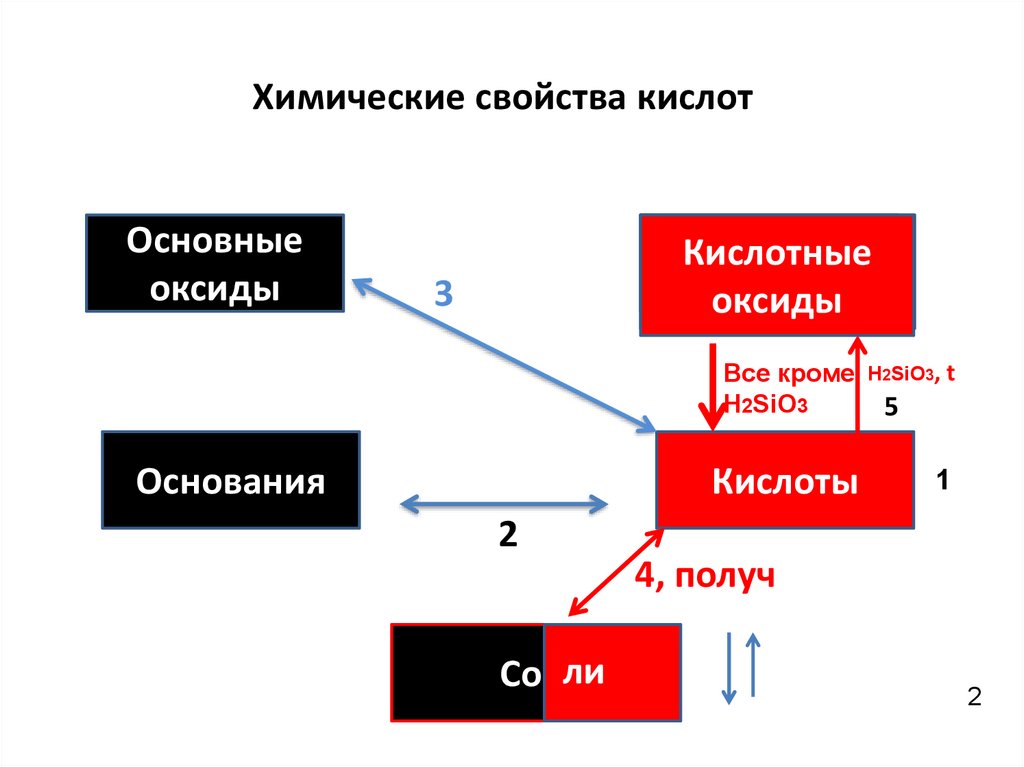
ошибок, тот знает, что оксиды вступают в реакции обмена(образуются соли) и
соединения(с др. оксидами-соли, с водой- гидроксиды). Основания и кислоты – в
реакции обмена и разложения. Сегодня мы научимся составлять и понимать
уравнения реакций замещения:
(простое(Ме) + сложное(кислота)= сложное(соль) + простое (Н2).
Чем принципиально отличаются реакции замещения от реакций обмена?
Тем, что там есть простые вещества. А у простых в-в степень окисления всегда
равна 0!(стр. 66 учебника). Я всем исправляла уравнение( не беда, когда ученик
сам так пишет, страшно, когда ТАК печатают в решебниках!):
+2
-2
+2 -2
0
0
+2 -2
Са + О = СаО А надо:2 Са + О2 = 2 СаО – здесь и Са, и О2 меняют С.О.
А в реакциях обмена, где все в-ва сложные, с.о. не меняется.
0
+2
0
+2
3.Чем отличается Са от Са ? Са – серебристый металл, а Са- бесцветный ион.
(посмотрите картинки на сл 4, цветную вкладку учебника-рис.IV)
1
2.
Химические свойства кислотОсновные
оксиды
Кислотные
НемеО
НемеО
оксиды
3
НО
Основания
Все кроме
Н2SiO3
Н2SiO3, t
Кислоты
1
5
2
4, получ
Соили
2
3.
Химические свойства кислотМеталлы
(до Н)
6
Основные
НемеО
НемеО
Кислотные
3
НО
H2O
Основания
Все кроме
Н2SiO3
Н2SiO3, t
5
Кислоты
2
4, получ
Соили
3
4.
Простые вещества- металлыих ионы в растворах солей
0
Магний Mg простое в-во
Соль магния(хлорид, нитрат,
сульфат) и раствор соли магния
2+
Mg-ион магния в растворе
Точно такие же картинки для алюминия, цинка, кальция и их солей
0
Железо Feпростое в-во
медь Cuпростое в-во
Соли железа:
хлорид железа(II) зеленыйслева
хлорид железа(III) желтый справа
Медь(и все металлы, стоящие в
ряду активности после Н)не реагируют с растворами
кислот.
4
5.
6.
Прочитайте стр 180, обратите внимание на обобщения: первое обобщение- верно,а второе – необязательно
Алгоритм составления реакции взаимодействия металла с кислотой:
1. По ряду активности металлов(на форзаце под табл. «окраска индикаторов»)
определить, реагирует ли металл с кислотой (до Н, на красном фоне – реагируют,
после Н- Cu, Ag,Hg, Au - не реагируют)(проверять, растворимая ли соль при
этом образуется- не надо!)
2 Продуктом реакции всегда будет соль металла и водород- Н2 . Формула
водорода всегда записывается как Н2, независимо от того, сколько атомов
водорода в кислоте (НСl, Н3РО4
Н2 !).
3.Составить формулу соли по зарядам ионов (у железа в реакциях
замещения с.о.+2)- с этим у половины класса – проблемы! Не умеете
составлять формулы(учились во 2 четверти).
4. Расставить коэффициенты. https://youtu.be/cA25vyFcL6A - как составить
уравнение реакции металла с кислотой
Тренируйтесь –составьте уравнения возможных реакций.(кто забыл
формулы кислот, стр 88!, там же повторите названия солей!)
1. литий + соляная кислота =
2 серебро+ серная кислота =
3 Магний + фосфорная кислота =
4*алюминий + соляная кислота=
На слайде 8 нажимаете на прямоугольник - получаете ответ!
7.
8.
2 Li + 2 HCl = 2 LiCl + H21
2
Ag + H2SO4 #
3
4
3 Mg + 2 H3PO4 =Mg3(PO4)2
+
3Н2
2 Al + 6HCl = 2 AlCl3 + 3 H2
Домашнее задание § 49, упр 1,2. * Повторите классификацию оксидов!
Упр 1,2. стр 172!
Следующий урок будет в четверг, 23 апреля – будем готовиться к
проверочной работе по классификации оксидов и свойствам кислот.
Проводить буду по Skype(в 13 .00) и по discord (в 14.00) Если есть
возможность, присоединяйтесь! Задавайте вопросы! У кого нет
возможности,будет презентация с самопроверкой






 chemistry
chemistry








