Similar presentations:
Металлы. Химия металлов
1.
МеталлыХимия металлов
2.
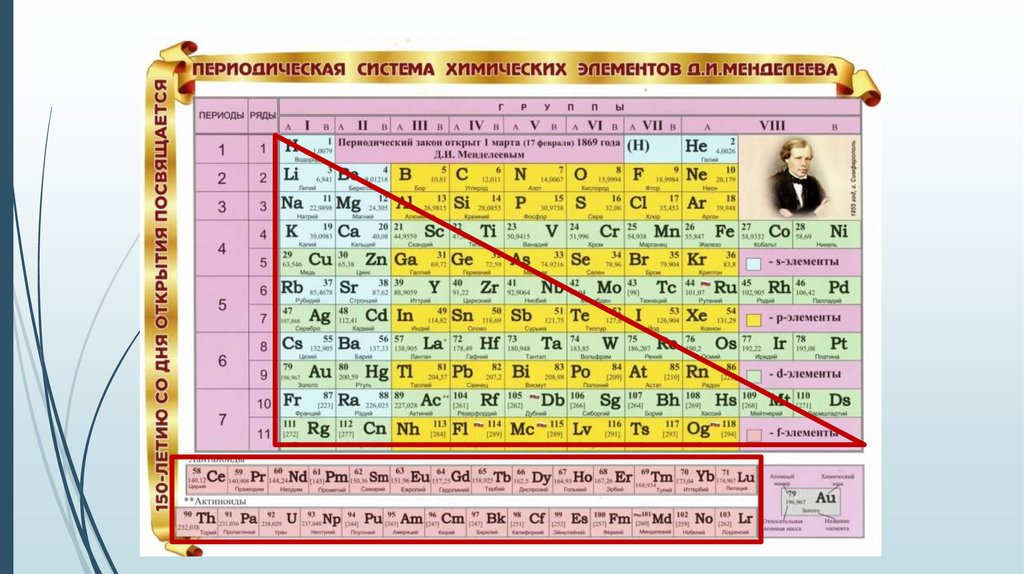
РасположениеЕсли в периодической системе элементов провести
диагональ от бериллия к астату, то справа вверх, будут
находиться элементы неметаллы (исключая элементы
побочных подгрупп), а слева внизу МЕТАЛЛЫ (к ним же
относятся элементы побочных подгрупп).
Элементы, расположенные в близи диагонали
Be, Al, Ti, Ge и др.
Обладают двойственным характером.
3.
4.
Физические свойства металлов5.
Физические свойства металлов1. Агрегатное состояние.
2. Цвет, запах.
3. Металлический блеск
4. Твёрдость.
5. Пластичность.
6. Тепло и электропроводность
7. Магнитные свойства
6.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВАгрегатное
состояние
Все металлы ТВЁРДЫЕ,
а ртуть – жидкая
Цвет
Большинство серебристые или серые.
Медь – красная, золото – жёлтое
Металлический
блеск
Большинство обладает ярким
металлическим блеском. Самый яркий
блеск у серебра и золота.
Твёрдость
Многие твёрдые. Самый твёрдый – хром.
Пластичность
Большинство обладают высокой
пластичностью. Самый пластичный –
золото.
Все металлы обладают способностью
Тепло- и электропроводить ток и тепло. Наибольшая - у
проводность
серебра.
Магнитные
свойства
Только три металла обладают этим
свойством – железо, никель и кобальт.
7.
HgCu
Au
Ag
Cr
Ni
Co
8.
NaK
Mg
Ca
Al
Fe
9.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВI группа главная подгруппа
Li, Na, K, Rb, Cs, Fr
Степень окисления +1
II. Взаимодействие с простыми веществами
1. На воздухе щелочные металлы мгновенно окисляются, образуя оксиды и
пероксиды (Rb и Cs самовозгораются)
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2(пероксид натрия)
2. Активно взаимодействуют с галогенами, образуя соли - галогениды:
2К + Cl2 = 2КCl – хлорид калия
3. При нагревании взаимодействуют с водородом и другими неметаллами:
2Na + H2 → 2NaH(гидрид натрия)
2Na + S → Na2S(сульфид натрия)
6Li + N2 → 2Li3N(нитрид лития)
10.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ1 группа главная подгруппа
Li, Na, K, Rb, Cs, Fr
Степень окисления +1
II. Взаимодействие со сложными веществами
Активно взаимодействуют с водой, с образованием щелочей и водорода:
2Na + 2H2O → 2NaOH + H2↑
2К + 2H2O → 2КOH + H2↑
2. Активно взаимодействуют с кислотами (концентрированными), образуя
соли:
2Na + 2HCl → 2NaCl + H2 ↑
3. В расплаве (!) могут вытеснять из солей менее активные металлы.
3Na + AlCl3 (расплав) → 3NaCl + Al
11.
Получение1 группа главная подгруппа
Li, Na, K, Rb, Cs, Fr
Электролиз расплавов солей, щелочей:
2NaCl →2Na + Cl2↑
4NaOH → 4Na + O2 + 2H2O
12.
МЕТАЛЛЫ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
Характеристика металлов IIА группы
Ве –бериллий
Mg - магний
Са – кальций
Sr - стронций
Ва – барий
Ra - радий
Находятся во II группе, в главной подгруппе.
На наружном слое 2s-электрона.
Степь окисления: 0, +2
Сильные восстановители.
Ве – амфотерный металл
Са, Ва, Sr – щелочно-земельные металлы
Ra – радиоактивный металл
13.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
I.
Взаимодействие с простыми веществами
1. Взаимодействуют с кислородом, образуя оксиды.
Магний - при нагревании, остальные металлы - при обычных условиях.
2Mg + O2 = 2MgO
2Са + O2 = 2СаO
2. Все металлы этой группы при нагревании реагируют с
галогенами: Mg + Cl2 = MgCl2
водородом: Ca + H2 = CaH2 (гидрид кальция)
серой: Ca + S = CaS (сульфид кальция)
азотом, углеродом, кремнием и другими неметаллами:
14.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
I.
Взаимодействие с простыми веществами
1. Взаимодействуют с кислородом, образуя оксиды.
Магний - при нагревании, остальные металлы - при обычных условиях.
2Mg + O2 = 2MgO
2Са + O2 = 2СаO
2. Все металлы этой группы при нагревании реагируют с
галогенами: Mg + Cl2 = MgCl2
водородом: Ca + H2 = CaH2 (гидрид кальция)
серой: Ca + S = CaS (сульфид кальция)
азотом, углеродом, кремнием и другими неметаллами.
15.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
II. Взаимодействие со сложными веществами
1. Взаимодействуют с водой.
Магний - при кипячении:
Mg + 2H2O → Mg(OH)2↓ + H2
Остальные металлы - при обычных условиях, с образованием щелочи и
водорода:
Ca + 2H2O → Ca(OH)2 + H2↑
2. 2. Взаимодействуют с кислотами.
Са + 2HCl → CaCl2 + H2↑
16.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
II. Взаимодействие со сложными веществами
3. Взаимодействие с оксидами и солями металлов.
Магний и щелочноземельные металлы могут восстанавливать многие
металлы из их оксидов и солей:
TiCl4 + 2Mg → Ti + 2MgCl2
V2O5 + 5Ca → 2V + 5CaO
17.
ПОЛУЧЕНИЕ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
1. Барий получают восстановлением оксида:
3BaO + 2Al
3Ba + Al2O3
1. Остальные металлы получают электролизом
расплавов хлоридов:
CaCl2 Ca + Cl2↑
18.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ2 группа главная подгруппа
Be, Mg, Ca, Sr, Ba, Ra
Степень окисления +2
II. Взаимодействие со сложными веществами
3. Взаимодействие с оксидами и солями металлов.
Магний и щелочноземельные металлы могут восстанавливать многие
металлы из их оксидов и солей:
TiCl4 + 2Mg → Ti + 2MgCl2
V2O5 + 5Ca → 2V + 5CaO
19.
Al (алюминий)Степень окисления +3
Оксид Al2O3 – амфотерный; Гидроксид Al2 (OH)3 – амфотерный
ХИМИЧЕСКИЕ СВОЙСТВА
1. В мелкораздробленном состоянии при нагревании алюминий
взаимодействует кислородом. Реакция сопровождается выделением большого
количества теплоты.
2Al+3O2=2Al2O3
2. С галогенами
2Al+3Cl2=2AlCl3
3. С серой
2Al+3S=2Al2S3
4. С водой
2Al+6H2O= 2 Al(OH)3 + 3H2
5. С кислотами
2 Al+ 2NaOH = 2NaAlO2 + 2Na2O + 3H2
6. С оксидами
2Al + Cr2O3 = Al2O3 + Cr
20.
Fe (железо)Степень окисления +2, +3, +6 (редко)
Оксиды , гидроксиды (II) - основные; оксиды, гидроксиды (III) – амфотерный
ХИМИЧЕСКИЕ СВОЙСТВА
1. C кислородом.
3Fe+3O2 = 2Fe2O3
4Fe+3O2 + 6H2O = 4Fe(OH)3
2. С галогенами
2Fe+3Cl2=2FeCl3
3. С серой
Fe+S= FeS
4. С водой
2Fe+4H2O= Fe3O4 + 4H2
5. С кислотами
Fe+ H2SO4 = FeSO4 + H2
6. С солями
Fe + CuSO4 = FeSO4 + Cu



















 chemistry
chemistry








