Similar presentations:
Металлы
1.
Департамент здравоохранения города МосквыГосударственное бюджетное профессиональное образовательное учреждение
Департамента здравоохранения города Москвы
«Медицинский колледж № 1»
(ГБПОУ ДЗМ «МК № 1»)
Методическое пособие для проведения
теоретического занятия № 52
Тема: МЕТАЛЛЫ
преподаватель СП1 Диденко И.В.
2.
Цель: изучить особенности элементов металлов, образованных имипростых веществ и соединений.
развивать умения анализировать, сравнивать, доказывать, обобщать,
ставить и разрешать проблемные ситуации, развивать мыслительную
деятельность обучающихся и их творческие способности.
План лекции:
1. Общая характеристика металлов.
2. Общие физические свойства металлов.
3. Общие химические свойства металлов.
4. Применение металлов и их сплавов.
5. Получение металлов.
6. Способы защиты от коррозии.
3.
Конкурс “Разминка”1. Пули для ружей и пистолетов изготавливаются из этого металла (свинец)
2. Какой металл плавится от тепла человеческой руки? (цезий)
3. Самый распространённый металл в земной коре (алюминий)
4. От соединений какого металла зависит красный цвет крови? (железо)
5. Химический элемент, названный в честь нашей планеты (теллур)
6. Этот металл называют крылатым (алюминий)
7. Свойство атома химического элемента образовывать несколько простых веществ (аллотропия)
8. Металл "консервной банки" (олово)
9. Какой металл участвует в свертывании крови? (Кальций)
10. Металл, входящий в состав нержавеющих и жаропрочных сталей (хром)
11. Какой металл принесён в жертву "рыжему дьяволу"? (железо)
12. Без какого металла невозможна фотография? (серебро)
13. Какие металлы можно зажечь холодной водой? (щелочные)
14. Металл, входящий в состав рубина, граната, сапфира, бирюзы (алюминий)
15. Название металла происходит от латинского слова, которое в переводе означает "известь" (кальций)
16. Название металла в переводе с шумерского языка означает "капнувший с неба" (железо)
17. Ядро атома металла содержит 80 протонов (ртуть)
18. Самый пластичный металл. (Золото).
19. Атом какого металла содержит 12 электронов? (магний)
20. Самый тугоплавкий металл (вольфрам)
21. Какие металлы использовались в древние и средние века? (Fe, Cu, Sn, Pb, Hg, Au, Ag)
22. Какие металлы называют черными, какие цветными?
(Черные - железо и его сплавы, цветные – Al, Cu, Pb, Zn, Sn, Ag)
23. Самый легкий металл? (Литий)
24. Какой металл убивает бактерий? (Серебро).
25.Самый твердый металл. (Хром)
26. Какой самый распространенный на Земле металл? (Алюминий)
27. Самый тяжелый металл (Осмий)
28.В какой металл упаковывают еду для космонавтов и конфеты для ребят? (Алюминий)
29.Металл- жидкость. ( Ртуть)
30. Самый используемый металл в мире. (Железо)
4.
1. Общая характеристика металловМеталлы в природе. Из 118 известных на данный момент химических
элементов 96 образуют простые вещества с металлическими свойствами,
поэтому их называют металлическими элементами. Металлические
химические элементы в природе могут встречаться как в виде простых
веществ, так и в виде соединений. То, в каком виде встречаются
металлические элементы в природе, зависит от химической активности
образуемых ими металлов.
Ряд активности металлов
Li,K,Ba,Ca,Na,
Mg,Al,Mn,Zn,Cr,Fe,Ni,Sn,Pb
активные
металлы
металлы средней
активности
H2
Cu,Hg,Ag,Pt,Au
неактивные
металлы
• Металлические элементы, образующие химически активные
металлы (Li–Mg), в природе чаще всего встречаются в виде солей
(хлоридов, фторидов, сульфатов, фосфатов и других).
• Соли, образуемые этими металлами, являются главной
составной частью распространённых в земной коре минералов
и горных пород.
5.
Сильвин — хлорид калияKCl с примесями
Минерал галит состоит
из хлорида натрия
NaCl
Минерал кальцит
состоит из карбоната
кальция CaCO₃
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме
того, соли активных металлов — важная составная часть живых организмов. Например, фосфат
кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в
природе чаще всего встречаются в виде оксидов и сульфидов.
Минерал корунд
состоит из оксида
алюминия Al₂O₃
Оксид железа(III) Fe₂O₃
образует минерал
гематит
Минерал галенит
cостоит из сульфида
свинца(II) PbS
6.
Металлические элементы, образующие химически неактивные металлы(Cu–Au), в природе чаще всего встречаются в виде простых веществ.
Самородное золото Au
Самородное серебро Ag
Самородная платина Pt
Исключение составляют медь и ртуть, которые в природе встречаются также в
виде химических соединений.
Минерал медный блеск
состоит из сульфида
меди I) Cu₂S
Гидроксокарбонат
меди(II) (CuOH)₂CO₃
малахит
Минерал киноварь
состоит из сульфида
ртути(II) HgS
7.
В Периодической системе химических элементов металлы занимаютлевый нижний угол и находятся в главных (А) и побочных (Б)
группах.
• В электронной оболочке атомов металлов на внешнем
энергетическом уровне, как правило, содержится
от 1 до 3 электронов. Исключение составляют только
металлы IVА, VА и VIА группы, у которых на наружном
энергетическом уровне находятся соответственно четыре, пять
или шесть электронов.
• Радиусы атомов металлов больше, чем у атомов неметаллов того
же периода. В силу отдалённости положительно заряженного
ядра атомы металлов слабо удерживают свои валентные
электроны (электроны внешнего энергетического уровня).
• Характер изменения радиусов атомов химических элементов в
периодах и в группах. Радиусы атомов металлов существенно
больше, чем радиусы атомов неметаллов, находящихся в том
же периоде.
• Главное отличительное свойство металлов — это их сравнительно
невысокая электроотрицательность (ЭО) по сравнению с
неметаллами.
8.
2. Общие физические свойства металлов
Металлы — это простые вещества, образованные металлическими
химическими элементами.
В металлах существует особый вид связи — металлическая химическая
связь.
Металлическая связь — это химическая связь, образующаяся за счёт
притяжения катионов (положительно заряженных ионов) металлов и
свободно перемещающихся электронов (так называемого
«электронного газа»), заряженных отрицательно.
На рисунке изображена модель кристаллической решётки металлов: в узлах
кристаллической решётки находятся как электрически нейтральные, так и
положительно заряженные катионы металлов, а между ними свободно
перемещаются отрицательно заряженные электроны (электронный газ).
За счёт наличия в кристаллах свободно движущихся электронов для большинства
металлов характерны общие физические свойства: особый металлический блеск,
высокие электропроводность и теплопроводность, ковкость и другие.
9.
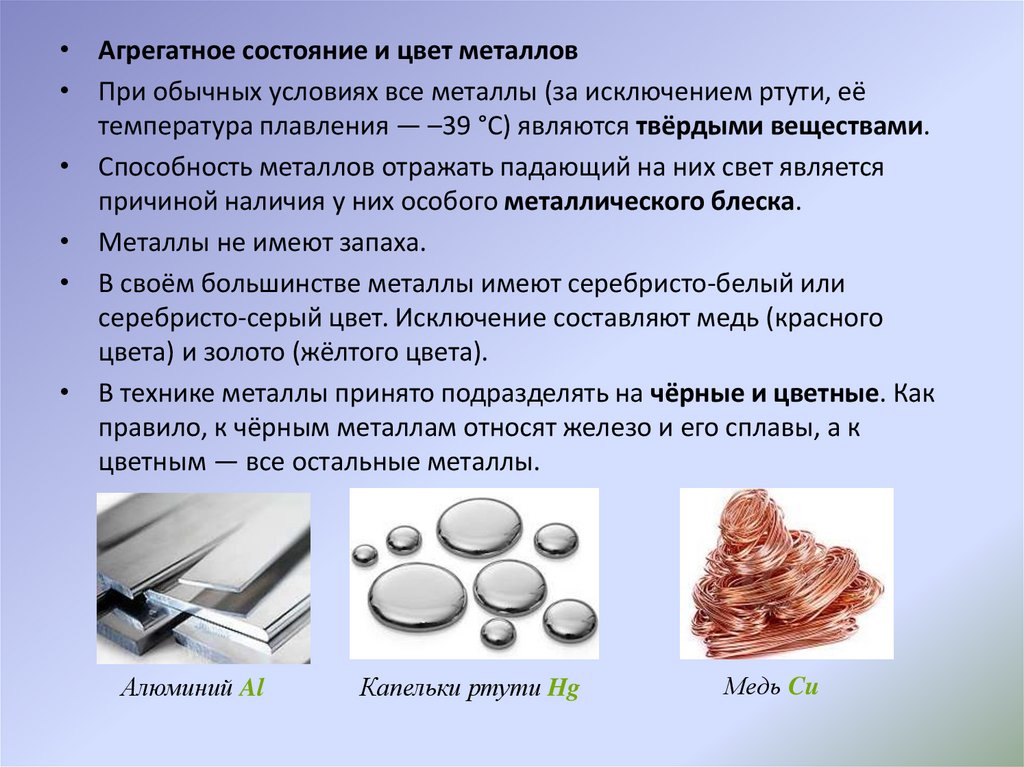
• Агрегатное состояние и цвет металлов• При обычных условиях все металлы (за исключением ртути, её
температура плавления — –39 °C) являются твёрдыми веществами.
• Способность металлов отражать падающий на них свет является
причиной наличия у них особого металлического блеска.
• Металлы не имеют запаха.
• В своём большинстве металлы имеют серебристо-белый или
серебристо-серый цвет. Исключение составляют медь (красного
цвета) и золото (жёлтого цвета).
• В технике металлы принято подразделять на чёрные и цветные. Как
правило, к чёрным металлам относят железо и его сплавы, а к
цветным — все остальные металлы.
Алюминий Al
Капельки ртути Hg
Медь Cu
10.
• Электро- и теплопроводностьМеталлы хорошо проводят тепло. Все металлы хорошо проводят
электрический ток, что обусловлено наличием в кристаллической
решётке электронов, которые способны свободно
перемещаться. Очень хорошими проводниками электрического
тока являются золото Au, медь Cu и серебро Ag.
• Пластичность
Металлы в большинстве своём пластичны. Их можно ковать,
вытягивать в проволоку и прессовать. Исключение составляют
сурьма и висмут, они хрупкие и от удара рассыпаются.
• Температура плавления
Температура плавления металлов изменяется в широком
интервале: от –39 °C у ртути до 3420 °C у вольфрама. По
температуре плавления металлы условно подразделяют на:
легкоплавкие (температура плавления до 1000 °C);
среднеплавкие (температура плавления от 1000 °C до 1600 °C);
тугоплавкие (температура плавления выше 1600 °C).
11.
3. Общие химические свойства металлов• Среди металлов традиционно выделяют несколько групп.
Входящие в их состав представители характеризуются отличной
от других металлов химической активностью. Такими группами
являются:
• благородные металлы (серебро, золото, платина);
• щелочные металлы (металлы, образованные элементами IА
группы периодической системы);
• щелочноземельные металлы (кальций, стронций, барий,
радий).
• Простые вещества, обладающие металлическими свойствами, в
химических реакциях всегда являются восстановителями.
Положение металла в ряду активности характеризует то,
насколько активно данный металл способен вступать в
химические реакции (т. е. то, насколько сильно у него
проявляются свойства восстановителя).
12.
Взаимодействие с простыми веществами-неметаллами• 1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется
оксид магния:
+2 -2
2Mg+O2→2Mg O.
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
• 2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом
и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид
натрия:
+1 -1
2Na+Cl2→2Na Cl.
• 3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
-2
Zn+S→Zn S
13.
4. Активные металлы при нагревании реагируют с азотом, фосфором и
некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li+N2→2Li₃N.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca+2P→Ca₃P₂.
Взаимодействие со сложными веществами
• 1. Щелочные и щелочноземельные металлы взаимодействуют с водой при
обычных условиях, образуя растворимое в воде основание (щёлочь)
и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и
водород:
2Na+2H₂O→2NaOH+H₂.
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной
температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный
оксид — железную окалину Fe₃O₄ и водород:
3Fe+4H₂O→FeO⋅Fe₂O₃+4H₂
14.
• 2. Металлы, стоящие в ряду активности металлов левееводорода, взаимодействуют с растворами кислот, образуя
соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной
кислотой образуются сульфат алюминия и водород:
2Al + 3H₂SO4 → Al₂(SO₄)₃ + 3H₂.
• 3. Металлы реагируют с солями менее активных металлов
в растворе, образуя соль более активного металла
и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного
металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди(II)
образуются сульфат железа(II) и медь:
Fe + CuSO₄ → FeSO₄ + Cu
15.
Применение металлов и их сплавов
Свойства металлов меняются при их сплавлении, известно это с
древности. 5 тысяч лет тому назад наши предки научились делать
бронзу — сплав олова с медью. Бронза по твёрдости превосходит оба
металла, входящие в её состав.
Свойства чистых металлов, как правило, не соответствует
необходимым требованиям, поэтому во всех сферах нашей
деятельности используют не чистые металлы, а их сплавы.
Сплав — это материал, который образуется в результате затвердения
расплава двух или нескольких отдельных веществ.
В состав сплавов кроме металлов могут входить также неметаллы,
например, такие как углерод или кремний.
Добавляя в определённом количестве примеси других металлов и
неметаллов, можно получить многие тысячи материалов с самыми
разнообразными свойствами, в том числе и такими, каких нет ни у
одного из составляющих сплав элементов.
Конструкция из
стальных балок
Радиаторы центрального
отопления
Ажурные перила, отлитые
из чугуна
16.
Сплав по сравнению с исходным металлом может быть:
механически прочнее и твёрже, со значительно более высокой или
низкой температурой плавления;
устойчивее к коррозии;
устойчивее к высоким температурам;
практически не менять своих размеров при нагревании или
охлаждении.
Н-р, чистое железо — сравнительно мягкий металл. При добавлении в железо
углерода твёрдость его существенно возрастает. По количеству углерода, а
следовательно, и по твёрдости, различают сталь (содержание углерода
менее 2 % по массе), чугун (С — более 2 %). Но не только углерод изменяет
свойства стали. Добавленный в сталь хром делает её нержавеющей, вольфрам
делает сталь намного более твёрдой, добавка марганца делает сплав
износостойким, а ванадия — прочным.
1.
2.
3.
Применение сплавов в качестве конструкционных материалов
Сплавы, используемые для изготовления различных конструкций,
должны быть прочными и легко обрабатываемыми.
В строительстве и в машиностроении наиболее широко
используются сплавы железа и алюминия.
Такие сплавы железа, как стали, отличаются высокой прочностью и
твёрдостью. Их можно ковать, прессовать, сваривать.
17.
• Чугуны используют для изготовления массивных и очень прочныхдеталей. Например, раньше из чугуна отливали радиаторы
центрального отопления, канализационные трубы, до сих
пор изготавливают котлы, перила и опоры мостов. Изделия из чугуна
изготавливаются с применением литья.
• Сплавы алюминия, используемые в конструкциях, наряду с
прочностью должны отличаться лёгкостью. Дюралюминий,
силумин — сплавы алюминия, они незаменимы в самолёто-, вагонои кораблестроении.
• В некоторых узлах самолётов используются сплавы магния, очень
лёгкие и жароустойчивые.
• В ракетостроении применяют лёгкие и термостойкие сплавы на
основе титана.
• Для улучшения ударопрочности, коррозионной стойкости,
износоустойчивости сплавы легируют — вводят специальные
добавки. Добавка марганца делает сталь ударопрочной. Чтобы
получить нержавеющую сталь, в состав сплава вводят хром.
18.
5. Получение металлов• Рудами называют минералы и горные породы, содержащие металлы и их
соединения, из которых технически возможно и экономически
целесообразно получать чистые металлы.
Получение металлов из руд — задача металлургии.
• Металлургия — это и наука о промышленных способах получения металлов
из руд, а также соответствующая отрасль промышленности.
Любой металлургический процесс — это процесс восстановления
катионов металла с помощью различных восстановителей.
Существует несколько способов получения металлов:
пирометаллургический,
электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких
температурах с помощью углерода C, оксида углерода(II) CO, водорода H2,
металлов — алюминия Al, магния Mg.
19.
• 1. Восстановление металлов из их оксидов с помощью углерода (ввиде кокса, раньше — в виде древесного угля) или оксида углерода
(II) называется карботермией.
Н-р, олово восстанавливают из оловянного камня углеродом:
SnO₂ + C → t° Sn + CO₂
• 2. Восстановление металлов из их оксидов с помощью металлов
называется металлотермией.
Н-р, хром восстанавливают из оксида хрома(III) при помощи
алюминия называется алюминотермия.
Cr₂O₃ + 2Al → t° 2Cr0 + Al₂O₃
• 3. Восстановление металлов из их оксидов с помощью водорода.
Таким образом получают металлы с высокой степенью чистоты.
Н-р, так восстанавливают вольфрам из оксида вольфрама(VI):
WO₃ + 3H₂ → t° W + 3H₂O
• 4. Руды, образованные сульфидами металлов, предварительно
подвергают обжигу (окисляют кислородом воздуха), а затем металл
восстанавливают из образовавшегося оксида.
Н-р, цинковую обманку (сульфид цинка) подвергают обжигу (при этом
образуется оксид цинка и диоксид серы), а затем полученный оксид
цинка восстанавливают углеродом:
1) 2Zn + 2S + 3O₂ → t° 2ZnO + 2SO₂;
2) ZnO + C → t° Zn + CO₂.
20.
Электрометаллургия — восстановление металлов из растворов или расплавових соединений под действием электрического тока (электролиз).
В процессе электролиза за счёт электрической энергии осуществляется
химическая реакция, которая самопроизвольно идти не может.
1. Восстановление активных металлов электролизом из расплавов их солей
(галогенидов).
Н-р, натрий можно получить из расплавленного хлорида натрия под
действием электрического тока:
2Na + Cl₂ → электролиз 2Na+Cl₂
2. Восстановление металлов средней активности и неактивных
металлов электролизом из растворов их солей.
Например, олово образуется при электролизе раствора хлорида олова(II):
SnCl₂ → электролиз Sn + Cl₂
Медь образуется при электролизе раствора сульфата меди(II):
2CuSO₄ + 2H₂O → электролиз 2Cu + O₂ + 2H₂SO₄
21.
6. Способы защиты от коррозииКоррозия — это процесс самопроизвольного разрушения металлов и их
сплавов под влиянием внешней среды (от лат. corrosio — «разъедание»).
• 1. Нанесение защитных покрытий.
Металлическое изделие покрывают другими металлами (никелирование,
хромирование, цинкование, лужение — покрытие оловом).
Хромированный кран
Консервные банки, изготовленные
из лужёной жести
Металлические изделия покрывают лаками, красками, эмалями, маслами, полимерами.
Никелированная труба
Нанесение защитного покрытия Эмалированная стальная
кастрюля
на поверхность металла
Металлочерепица изготавливается
из жести, покрытой полимером
22.
• 2. Применение сплавов, стойких к коррозии.Детали машин, аппаратов, инструменты и предметы быта изготовляют из
нержавеющей стали, содержащей специальные легирующие (замедляющие
коррозию) добавки: хром, никель и другие металлы.
• 3. Протекторная защита.
К защищаемой металлической конструкции присоединяют кусок более
активного металла (протектор), который разрушается, защищая основной
металл. В качестве протектора при защите корпусов судов, трубопроводов,
кабелей используют магний, алюминий, цинк.
Изделия из нержавеющей стали
4. Изменение состава среды.
Для того чтобы предотвратить потери из-за коррозии, проводится специальная обработка
электролита или той среды, в которой находится защищаемая металлическая конструкция.
Практикуется также введение ингибитора — вещества, замедляющего коррозию
Например, при подготовке воды, поступающей в котельные установки, проводят удаление
растворённого в воде кислорода (деаэрацию).
23.
• Задания для выполнения (на выбор):1. Какой металл в следующем ряду является наиболее
активным: Fe, Zn, Mn, K, Au? Поясните ответ.
2. Осуществить цепочку превращений:
3. Как называют способы защиты от коррозии, при котором
создают контакт с более активным металлом?
- Использованием нержавеющих сталей
- Ингибированием
- Протекторной защитой
- Лужением
4. Вычисли, какая масса меди потребуется для
реакции с 0,06 моль кислорода.
Введи ответ с точностью до двух знаков после запятой.
24.
5. Решить задачу: сколько литров углекислого газа выделитсяпри взаимодействии соляной кислоты с 4 г. карбоната
кальция, если выход составит 90% от теоретически
возможного.
6. Какие с.о. может проявлять медь, железо, марганец,
хром? Назовите их высшие оксиды.
7. Чем отличается электролиз расплавов от электролиза
водных растворов?
8. Вычислите массу чугуна , содержащего 94% железа,
которую можно получить из 1 т. красного железняка (Fe₂O₃).
9. Составьте уравнения ОВР получения:
а) меди из оксида меди(II) с помощью углерода и оксида
углерода (II);
б) кадмия из оксида кадмия (II) и марганца из оксида
марганца (IV);
в) хрома из оксида хрома (III) с помощью алюминия.
25.
Рефлексия
Вспомним из теории, что химически активные металлы в
природе чаще всего встречаются в виде солей.
Повторение общих физических свойств металлов:
поверхность всех металлов обладает высокой
отражающей способностью;
все металлы хорошо отражают падающий на них свет;
все металлы хорошо проводят электрический ток;
все металлы хорошо проводят тепло;
все металлы (за исключением ртути) при обычных
условиях — твёрдые вещества;
для большинства металлов характерна ковкость;
для большинства металлов характерна пластичность;
большинство металлов имеет серебристо-белый или
серебристо-серый цвет;
все металлы не имеют запаха.
26.
• Сплавы металлов получают путём сплавления одногометалла с другими или металла с неметаллическими
элементами.
• Для изготовления массивных и очень прочных деталей,
например, перил и опор мостов, используют чугун.
• В искусстве используется оловянная бронза.
• С водой при комнатной температуре реагируют только
щелочные и щелочноземельные металлы.
• Металлы, которые не вытесняют водород из растворов
кислот, стоят в ряду активности металлов правее водорода.
• Металл вытесняет другой металл из раствора его соли в
том случае, если вступающий в реакцию металл химически
активнее металла, находящегося в соли. Следовательно,
металл, стоящий в ряду активности металлов правее, не
вытеснит металл, стоящий в этом ряду левее, из его соли.
27.
Домашнее задание1.Оформить конспект лекции в рабочей
тетради.
2.Выполнить задания, указанные на сладах
23 и 24.


























 chemistry
chemistry








