Similar presentations:
Кислородосодержащие органические соединения. Спирты (алкоголи)
1.
Кислородосодержащиеорганические соединения
Спирты (алкоголи)
2.
Спирты (алкоголи) – это производныеуглеводородов, содержащие в молекуле одну или
несколько гидроксильных групп – ОН у насыщенных
атомов углерода.
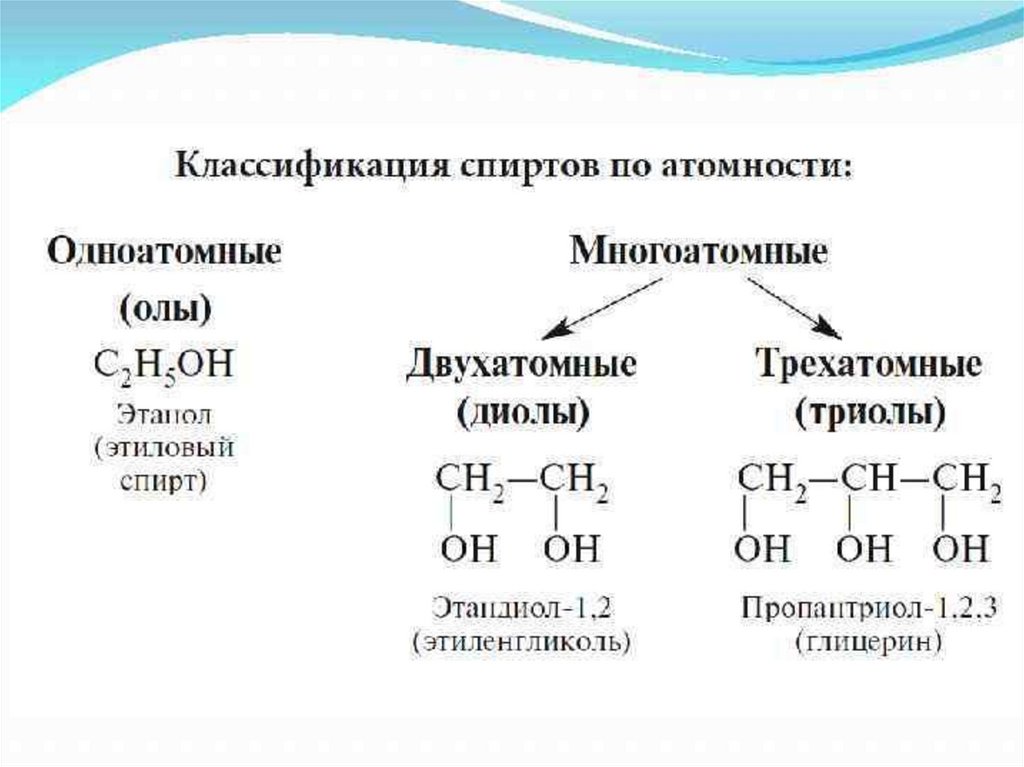
Общая формула спиртов: CnH2n+1OH или СnH2n+2O
R(OH)m
R - УВ радикал;
m- число функциональных гидроксильных
групп – ОН, которое определяет атомность спирта
3.
4.
5.
Правила составления названий алканолов сразветвленной цепью по международной номенклатуре
1) Найти в молекуле самую длинную углеродную цепь, связанную
с гидроксильной группой;
2) Пронумеровать атомы «С» в этой цепи так, чтобы атом «С»,
связанный с группой –ОН, имел наименьший номер;
3) Назвать алкан, соответствующий самой длинной цепи, указав
положение всех заместителей;
4) Обозначить гидроксильную группу суффиксом –ОЛ;
5) Цифрой указать положение группы -ОН
6.
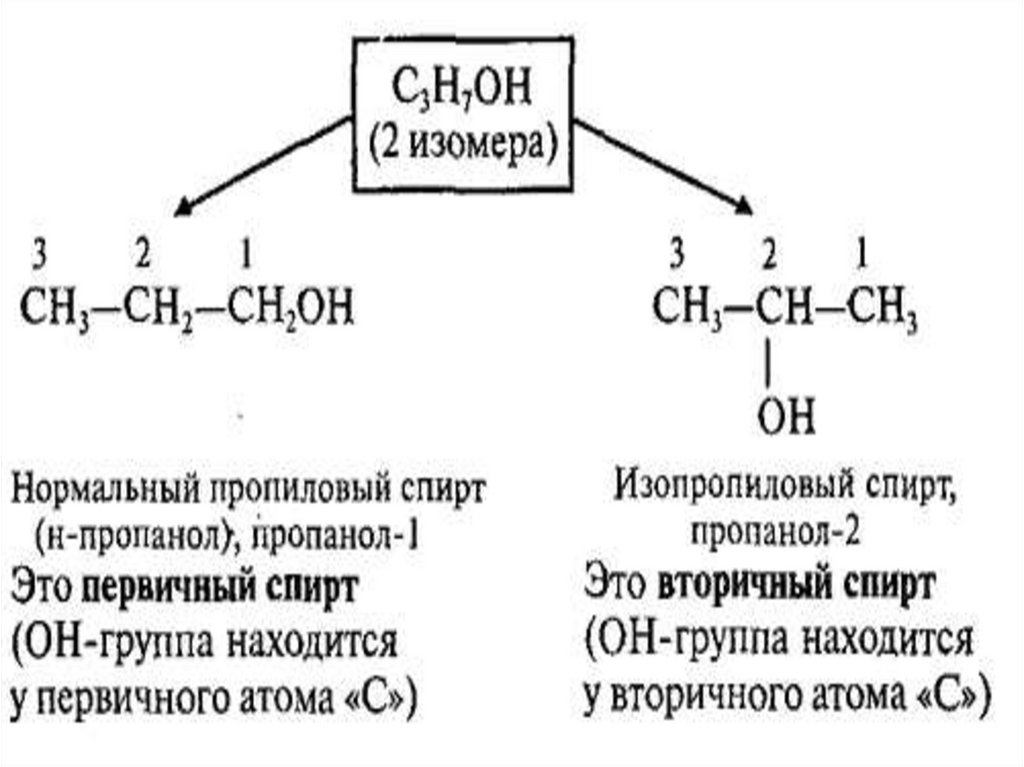
Изомерия и НоменклатураТипы изомерии:
• изомерия цепи (углеродного скелета)
• изомерия положения функциональной
группы
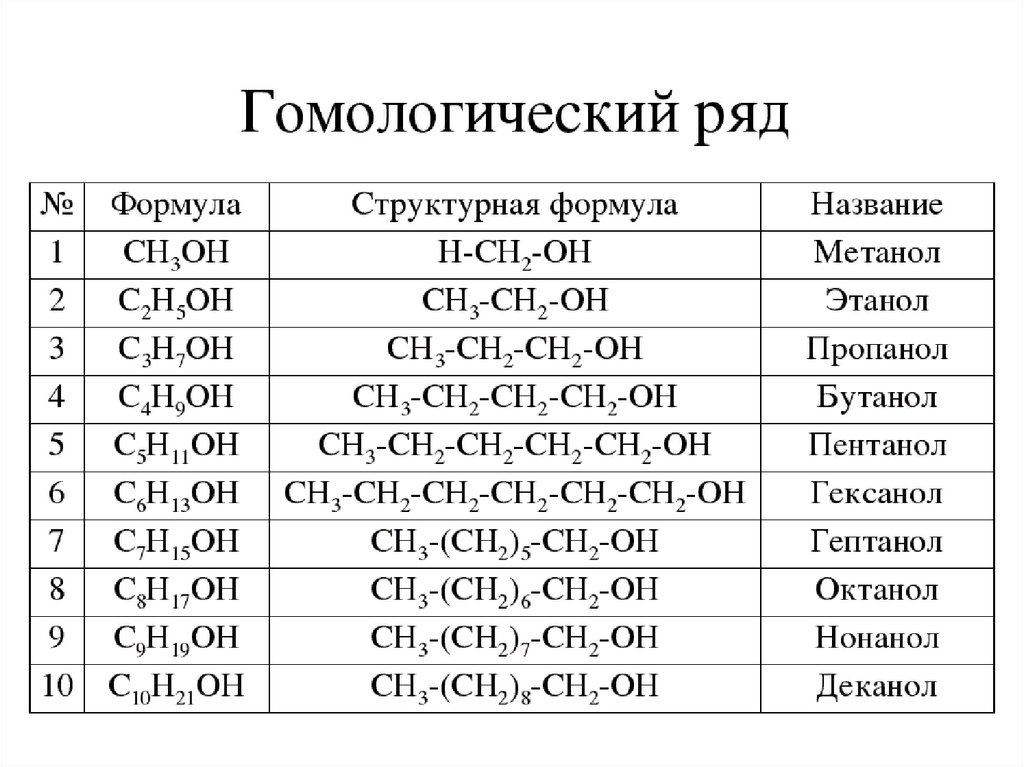
Первые два члена гомологического ряда – CH3OH и C2H5OH –
не имеют изомеров!
7.
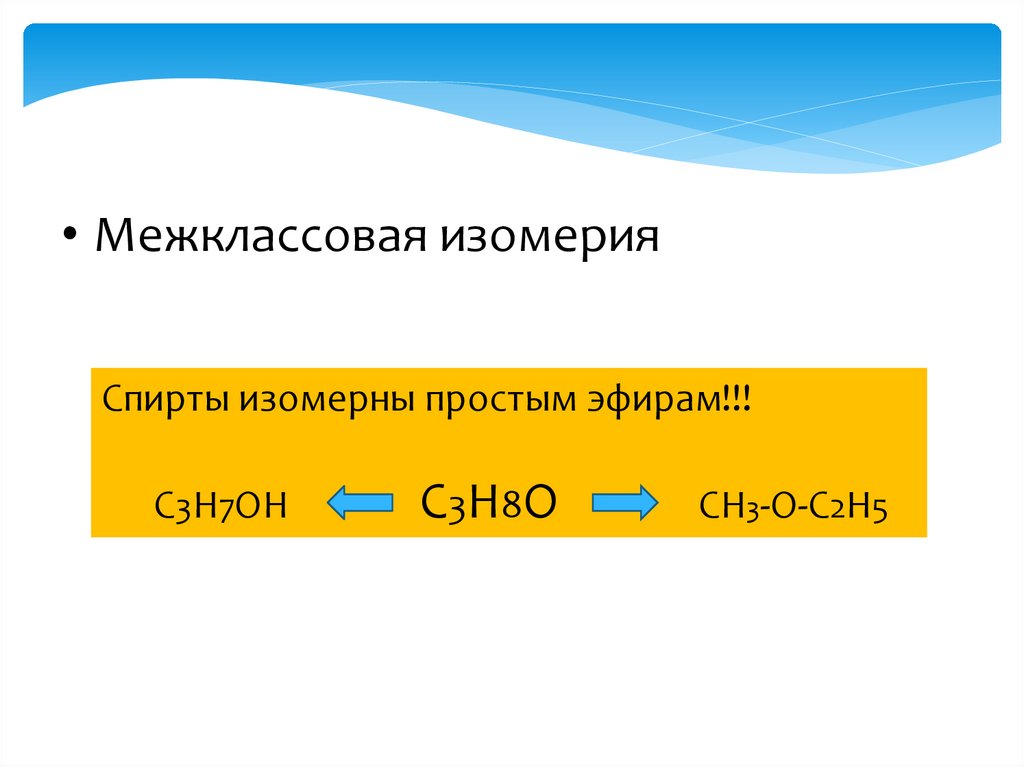
• Межклассовая изомерияСпирты изомерны простым эфирам!!!
C3H7OH
C3H8O
CH3-O-C2H5
8.
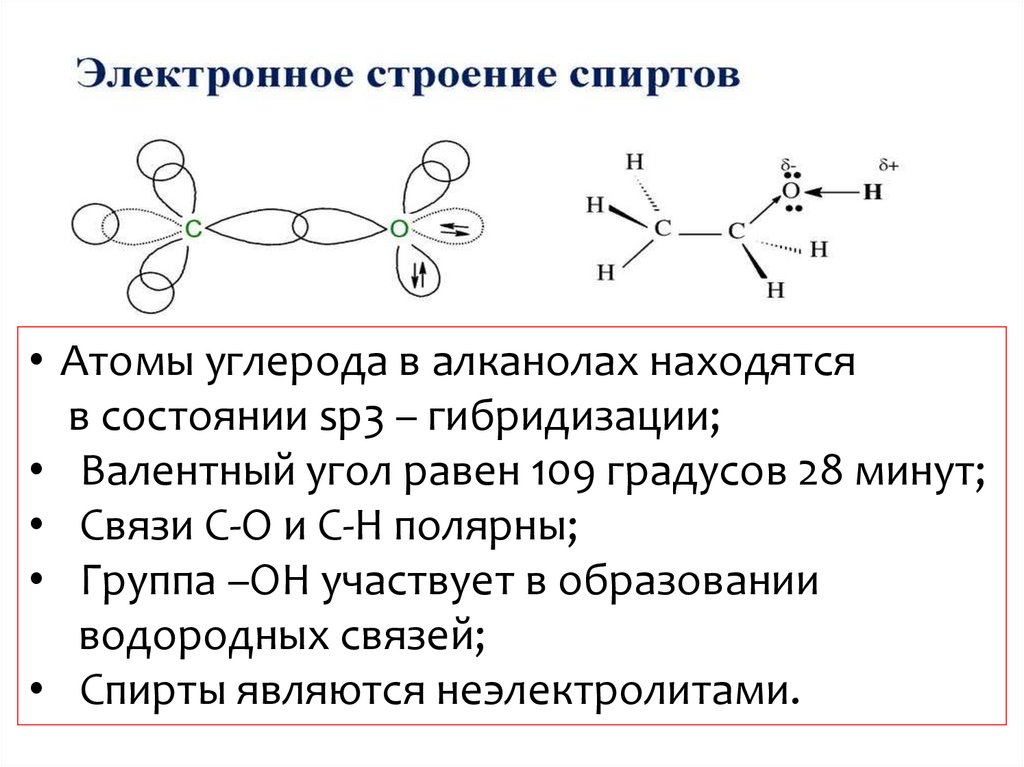
9.
• Атомы углерода в алканолах находятсяв состоянии sp3 – гибридизации;
• Валентный угол равен 109 градусов 28 минут;
• Связи С-О и С-Н полярны;
• Группа –ОН участвует в образовании
водородных связей;
• Спирты являются неэлектролитами.
10.
Физические свойстваПри обычных условиях:
С1 – С11 – жидкости , С12 - …. - твердые вещества;
Все алканолы легче воды;
Бесцветны;
Жидкие имеют резкий запах, твердые запаха не имеют;
Метанол, этанол и пропанол неограниченно
растворяются в воде.
11.
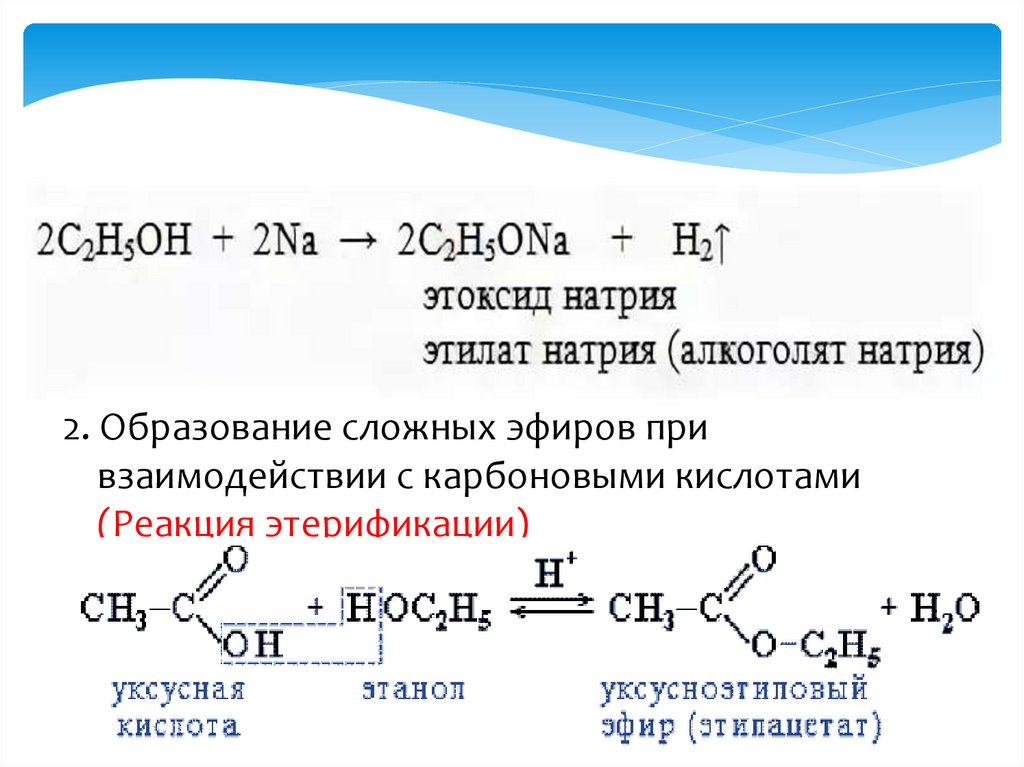
Химические свойстваI Реакции замещения
1. Взаимодействие со щелочными металлами с
образованием алкоголята и водорода:
12.
2. Образование сложных эфиров привзаимодействии с карбоновыми кислотами
(Реакция этерификации)
13.
3) Взаимодействие с галогеноводородами собразованием галогеналканов:
14.
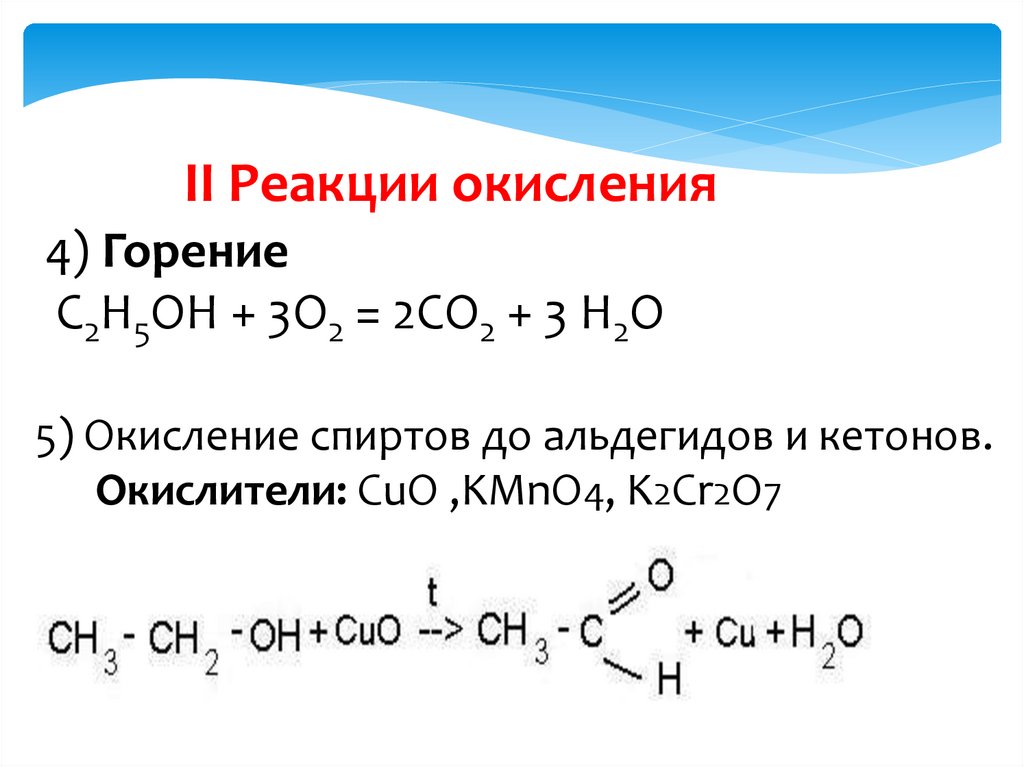
II Реакции окисления4) Горение
С2Н5ОН + 3О2 = 2СО2 + 3 Н2О
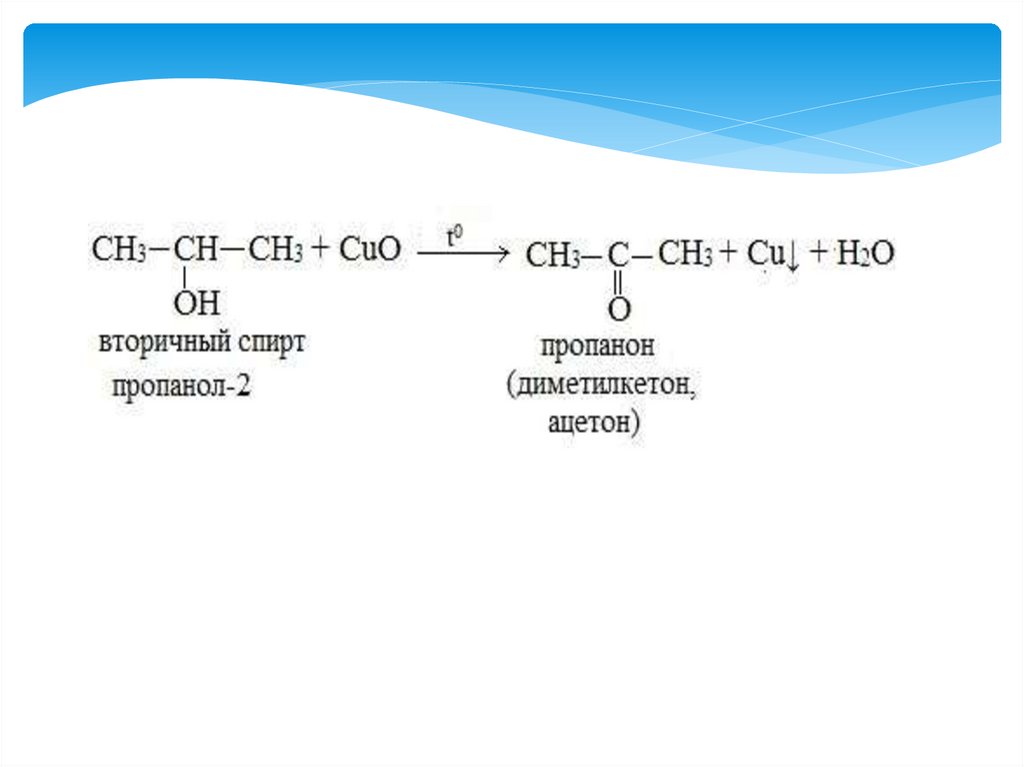
5) Окисление спиртов до альдегидов и кетонов.
Окислители: CuO ,KMnO4, K2Cr2O7
15.
16.
III Реакции дегидратацииМежмолекулярная дегидратация спиртов с
образованием простых эфиров R-O-R. Эти реакции
могут протекать с участием одного спирта или смеси
двух и более спиртов.
17.
Внутримолекулярная дегидратация спиртов собразованием алкенов. Отщепление воды происходит
от одной молекулы спирта.
(Отщепление происходит по правилу А.М.Зайцева)
пропен
Пропанол-1
18.
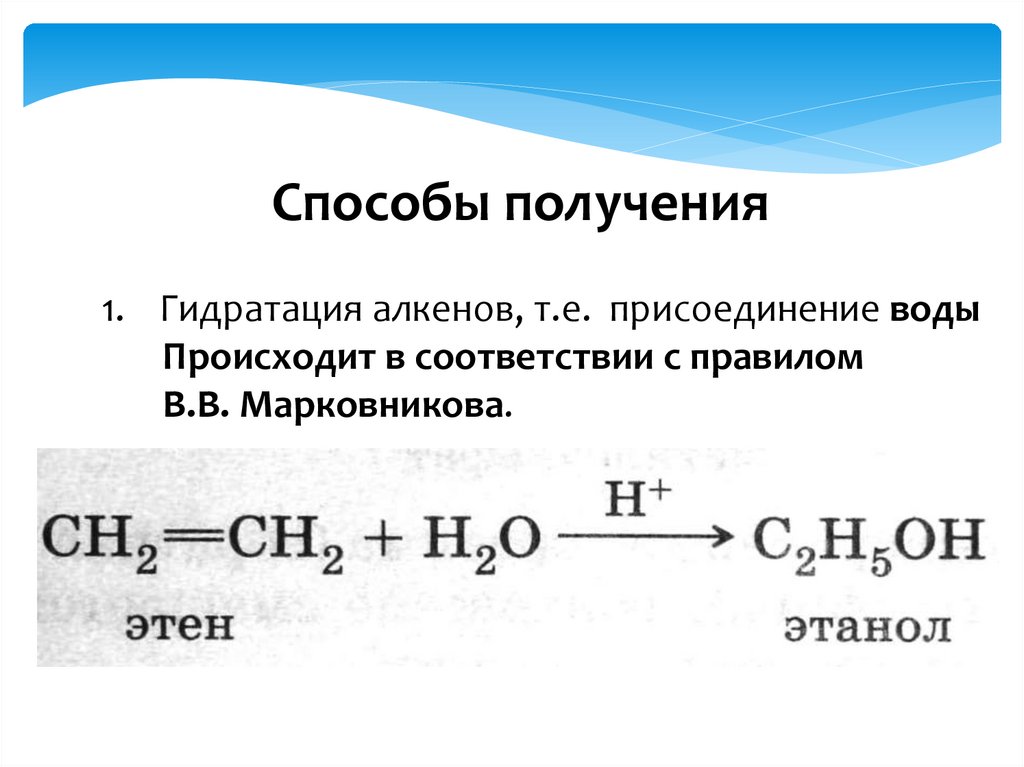
Способы получения1. Гидратация алкенов, т.е. присоединение воды
Происходит в соответствии с правилом
В.В. Марковникова.
19.
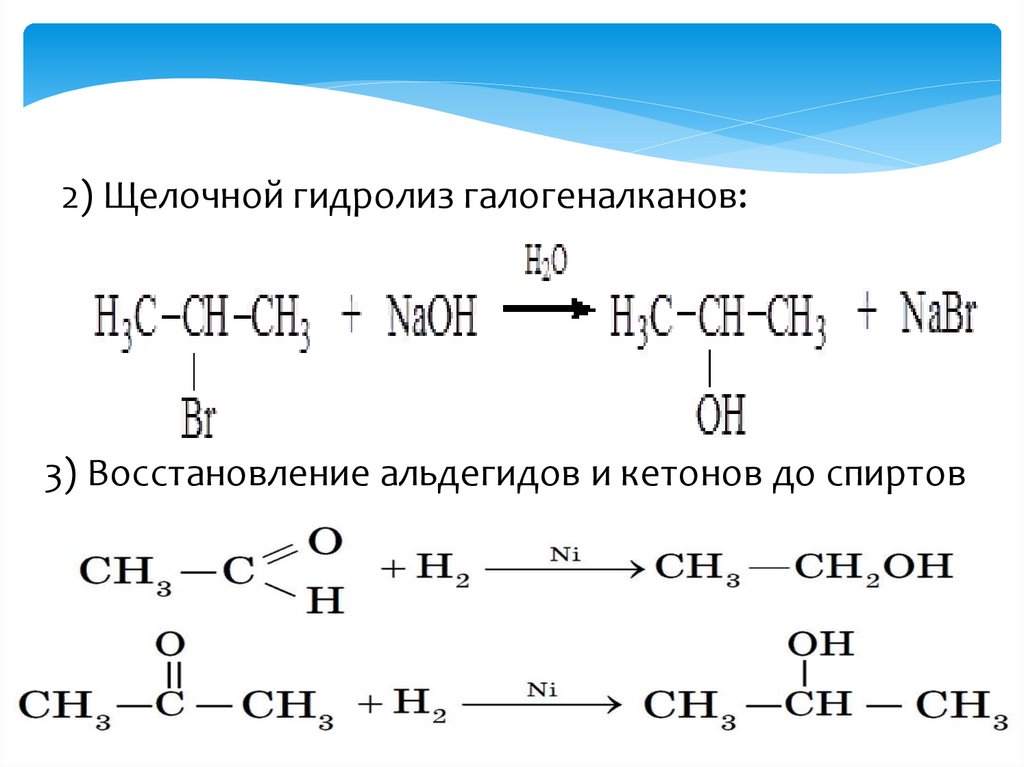
2) Щелочной гидролиз галогеналканов:3) Восстановление альдегидов и кетонов до спиртов
20.
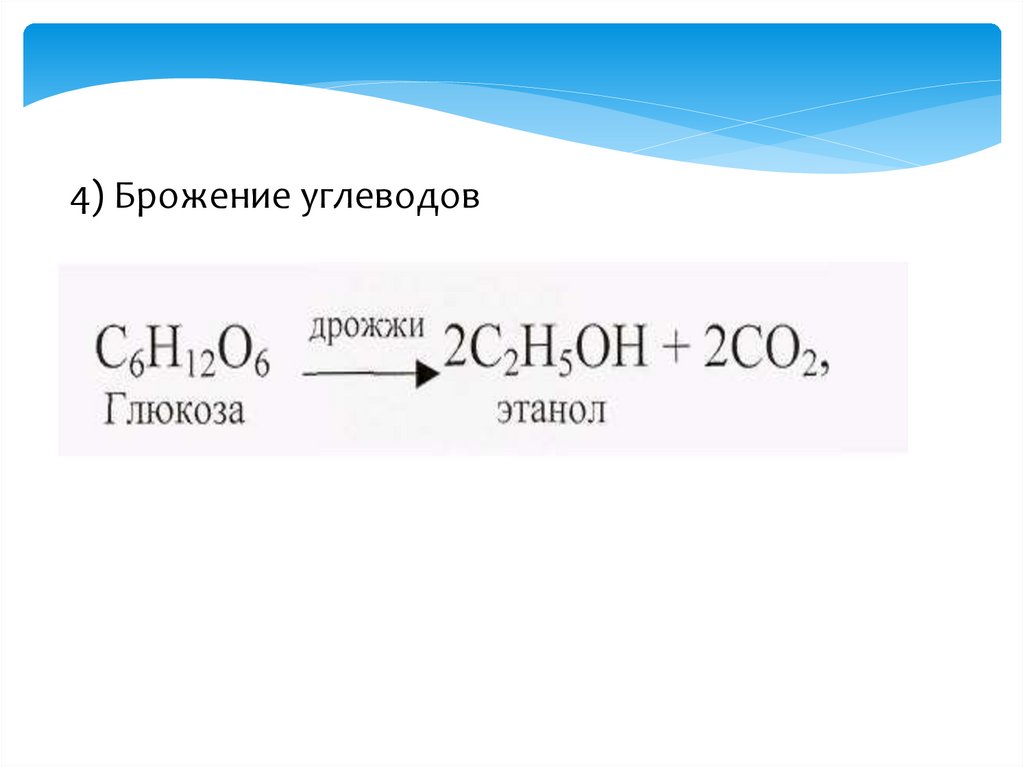
4) Брожение углеводов21.
Применение спиртов• Этанол применяется для изготовления спиртных
напитков;
• В медицине как дезинфицирующее средство;
• В качестве топлива;
• Применяется в качестве растворителя;
• В промышленности, как исходное вещество
в производстве лаков, медикаментов, душистых
веществ.
22.
Медицина1. Как обеззараживающее и подсушивающее
средство, наружно.
2. Растворитель для лекарственных средств,
для приготовления настоек, экстрактов из
растительного сырья;
3. В согревающих компрессах;
4. Пеногаситель при подаче кислорода,
искусственной вентиляции легких
23.
5. Антидот при отравлении этиленгликолем иметиловым спиртом;
6. Этиловый спирт используется для обработки
операционного поля или в некоторых методиках
обработки рук хирурга.












 chemistry
chemistry








