Similar presentations:
Спирты. Классификация спиртов (10 класс)
1.
Спирты2.
• Спиртами называются органические соединения, вмолекулах которых содержится одна или несколько
гидроксильных групп (-ОН), соединенных с
углеводородным радикалом.
• Спирты – это производные углеводородов, в молекулах
которых один или несколько атомов углерода замещены
на гидроксильную группу (-ОН).
• Спирты – это производные углеводородов, содержащие
в молекуле одну или несколько гидроксильных групп
(-ОН) у насыщенных атомов углерода (sp3гибридизированный атома углерода).
• Спирты — соединения алифатического ряда,
содержащие одну или несколько гидроксильных групп.
Общая формула спиртов с
одной гидроксигруппой CnH2n+1OH или R–OH.
3.
• Структура, содержащая ОН-группу у ненасыщенного атомауглерода =С-ОН, является неустойчивой.
• При наличии двух и более ОН-групп они должны находиться у
разных атомов углерода:
так как структура типа
является также неустойчивой
4.
• Предельный одноатомные спирты –кислородсодержащие органические вещества,
производные предельных углеводородов, в
которых один атом водорода замещён на
функциональную группу (-OH).
• Общая формула спиртов СnН2n+1ОН или R–OH, где
R – углеводородный радикал.
Простейшие спирты:
• Метиловый спирт (метанол, древесный спирт) СН3-ОН
Этиловый спирт (этанол, винный спирт) - СН3СН2—
ОН
5.
Классификация спиртов• 1.По числу гидроксильных групп (атомности)
спирты подразделяются на:
• одноатомные (одна группа -ОН), например,
метанол СН3ОН, этанол С2Н5ОН, пропанол
С3Н7ОН.
• многоатомные (две и более групп -ОН).
например,
этиленгликоль HO–СH2–CH2–OH, глицерин HO–
СH2–СН(ОН)–CH2–OH.
6.
7.
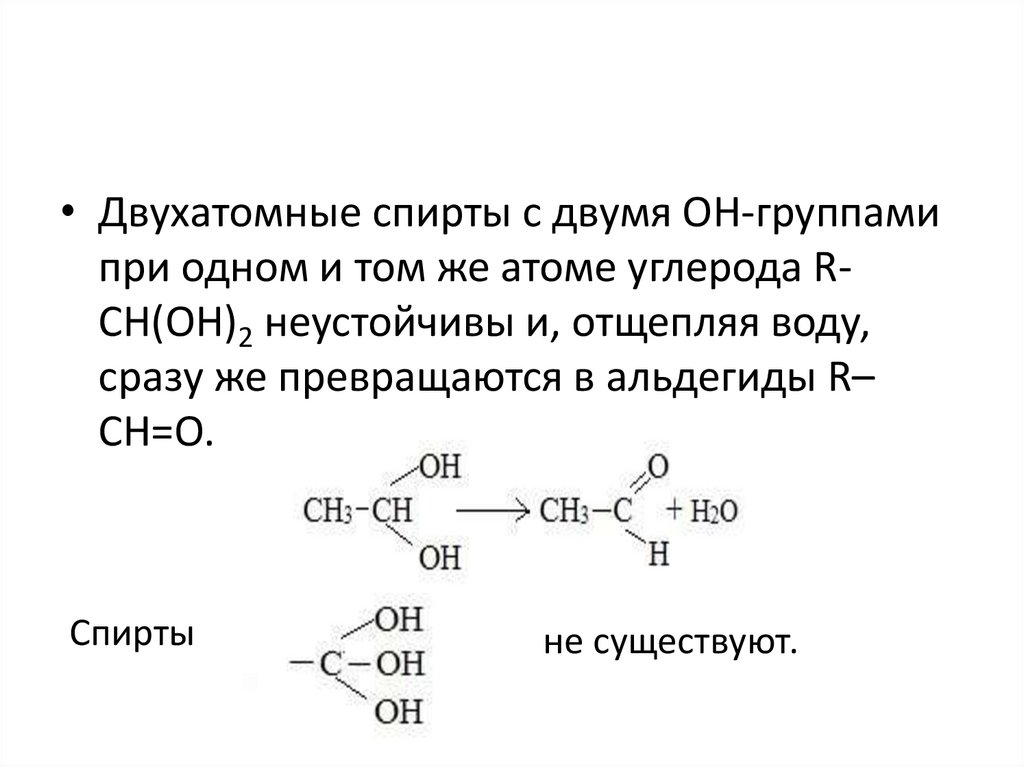
• Двухатомные спирты с двумя ОН-группамипри одном и том же атоме углерода RСН(ОН)2 неустойчивы и, отщепляя воду,
сразу же превращаются в альдегиды R–
CH=O.
Спирты
не существуют.
8.
• Также существуют и другие полиатомные(многоатомные спирты), например:
шестиатомный спирт гексанол (сорбит).
9.
• 2.По характеру атома углерода алифатическиеспирты делятся на первичные, вторичные и
третичные (в зависимости от того, с каким
атомом углерода связана гидроксигруппа:
• первичные R–CH2–OH
• вторичные R2CH–OH
• третичные R3C–OH.
10.
В многоатомных спиртах различают первично- , вторично- итретичноспиртовые группы. Например, молекула трехатомного
спирта глицерина содержит две первичноспиртовые (HO–СH2–)
и одну вторичноспиртовую (–СН(ОН)–) группы.
11.
• 3. По строению углеводородного радикала,связанного с атомом кислорода, спирты
подразделяются на:
• предельные или алканолы (СН3ОН, СH3CH2–OH)
• непредельные, или алкенолы (CH2=CH–CH2–OH)
и алкинолы (СН≡С-СН2ОН)
• ароматические (C6H5CH2–OH) - не путать с фенолами!
Ar-OH.
• У ароматических спиртов гидроксильная группа не
связана с атомом углерода бензольного кольца.
Соединения, у которых гидроксильная группа связана
с бензольным кольцом, называются фенолами.
12.
Непредельные спирты с ОН-группой при атоме углерода, соединенном сдругим атомом двойной связью, очень неустойчивы и сразу же
изомеризуются в альдегиды или кетоны. Например, виниловый спирт
CH2=CH–OH превращается в уксусный альдегид CH3–CH=O:
13.
Гомологический ряд алканолов• Первым членом гомологического ряда спиртов является
метанол Н3С–ОН, каждый последующий член
гомологического ряда отличается на группу СН2.
14.
Номенклатура алканолов• Название спиртов по заместительной
номенклатуре ИЮПАК образуется от
названия соответствующих алканов с
добавлением суффикса -ол и цифры,
указывающей положение гидроксигруппы
(если это необходимо).
15.
• Нумерацию цепи начинают с того края, ближе к которомурасположена гидроксильная группа. Цифрами после
суффикса «ол» указывают положение гидроксильной
группы в главной цепи.
По другому способу (радикально-функциональная номенклатура
ИЮПАК) названия спиртов производят от соответствующего
углеводородного радикала с добавлением слова «спирт», например:
СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт, СН3-СН2-СН2-ОН –
н-пропиловый спирт, СН3-СН(ОН) -СН3 – изопропиловый спирт.
16.
• В нумерации атомов углерода в главной цепиположение гидроксильной группы имеет приоритет
перед положением кратных связей
Непредельные спирты, содержащие гидроксильную группу у
атома углерода, связанного двойной связью,
называются енолами. Название этого класса соединений
образовано из суффиксов -ен и -ол, указывающих на
присутствие в молекулах двойной связи и гидроксильной
группы.
Енолы, как правило, неустойчивы и самопроизвольно
превращаются (изомеризуются) в карбонильные соединения
— альдегиды и кетоны. Эта реакция обратима, а сам процесс
называют кето-енольной таутомерией.
17.
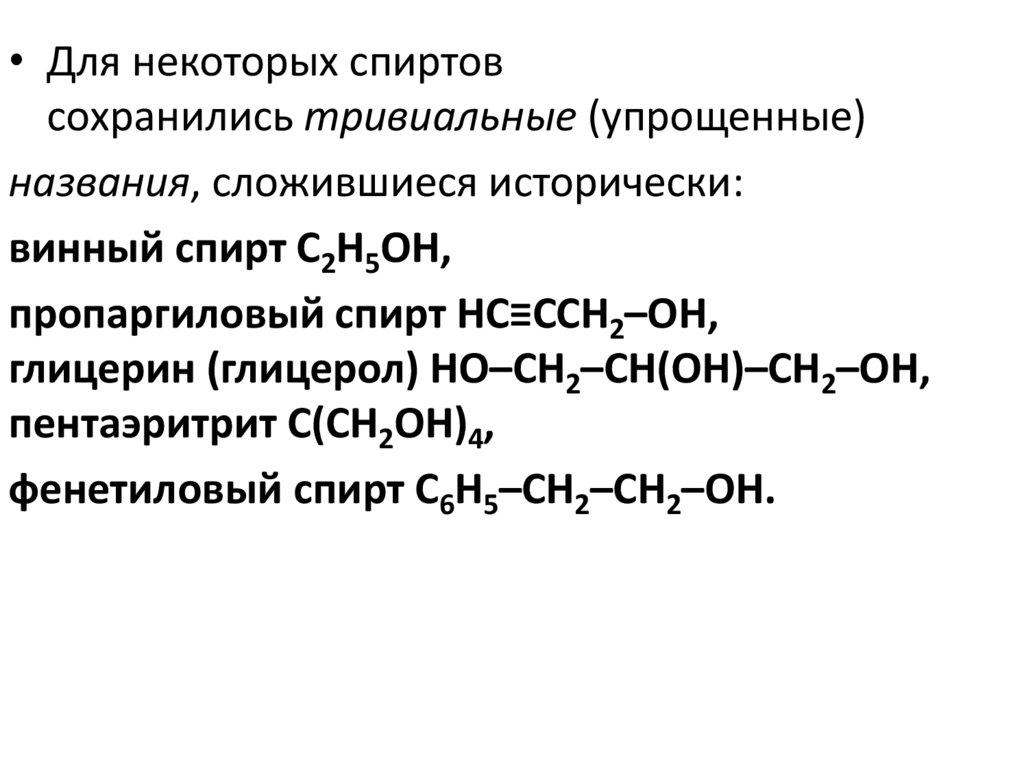
• Для некоторых спиртовсохранились тривиальные (упрощенные)
названия, сложившиеся исторически:
винный спирт С2Н5ОН,
пропаргиловый спирт НС≡ССН2–ОН,
глицерин (глицерол) HO–СH2–СН(ОН)–CH2–OH,
пентаэритрит С(СН2ОН)4,
фенетиловый спирт С6Н5–CH2–CH2–OH.
18.
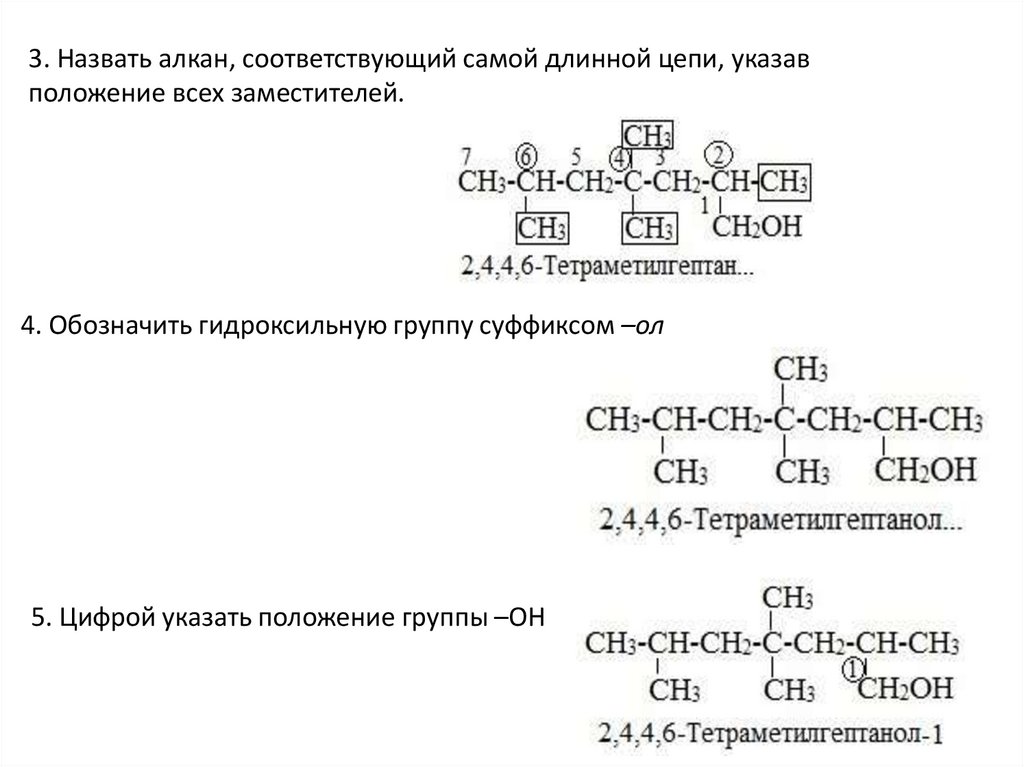
• Правила составления названий алканолов сразветвленной цепью по международной номенклатуре
1. Найти в молекуле самую длинную прямую углеродную цепь, связанную с
гидроксильной группой.
2. Пронумеровать атомы «С» в этой цепи так, чтобы атом «С», связанный с
группой –ОН, имел наименьший номер
19.
3. Назвать алкан, соответствующий самой длинной цепи, указавположение всех заместителей.
4. Обозначить гидроксильную группу суффиксом –ол
5. Цифрой указать положение группы –ОН
20.
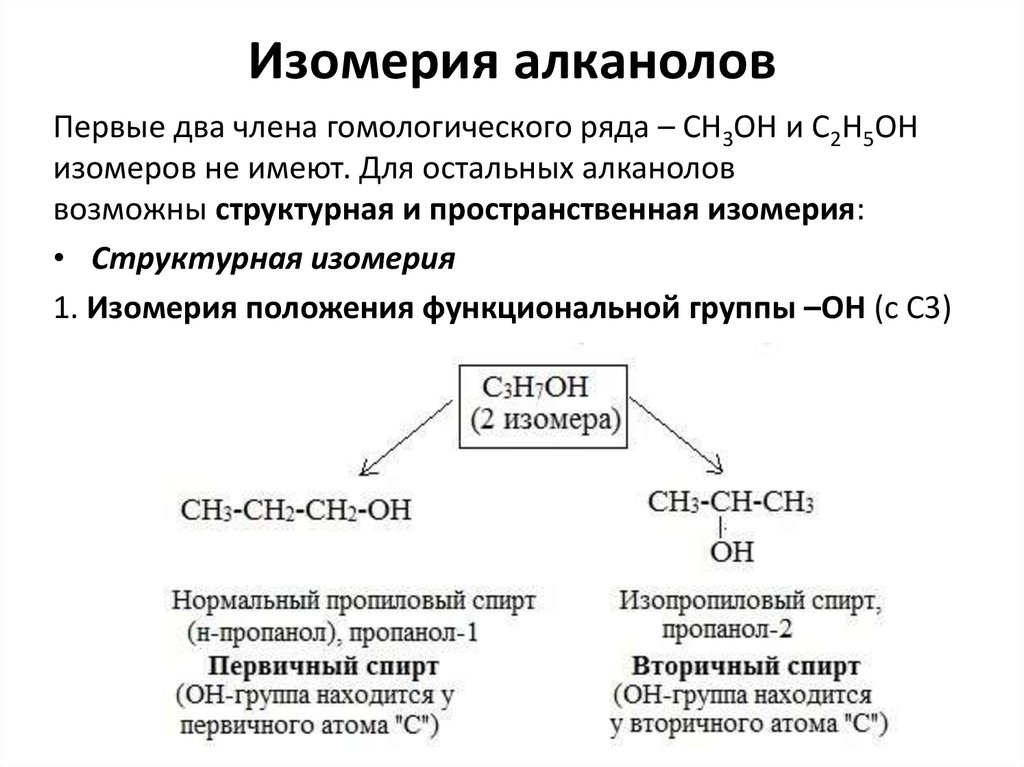
Изомерия алканоловПервые два члена гомологического ряда – СН3ОН и С2Н5ОН
изомеров не имеют. Для остальных алканолов
возможны структурная и пространственная изомерия:
• Структурная изомерия
1. Изомерия положения функциональной группы –ОН (с С3)
21.
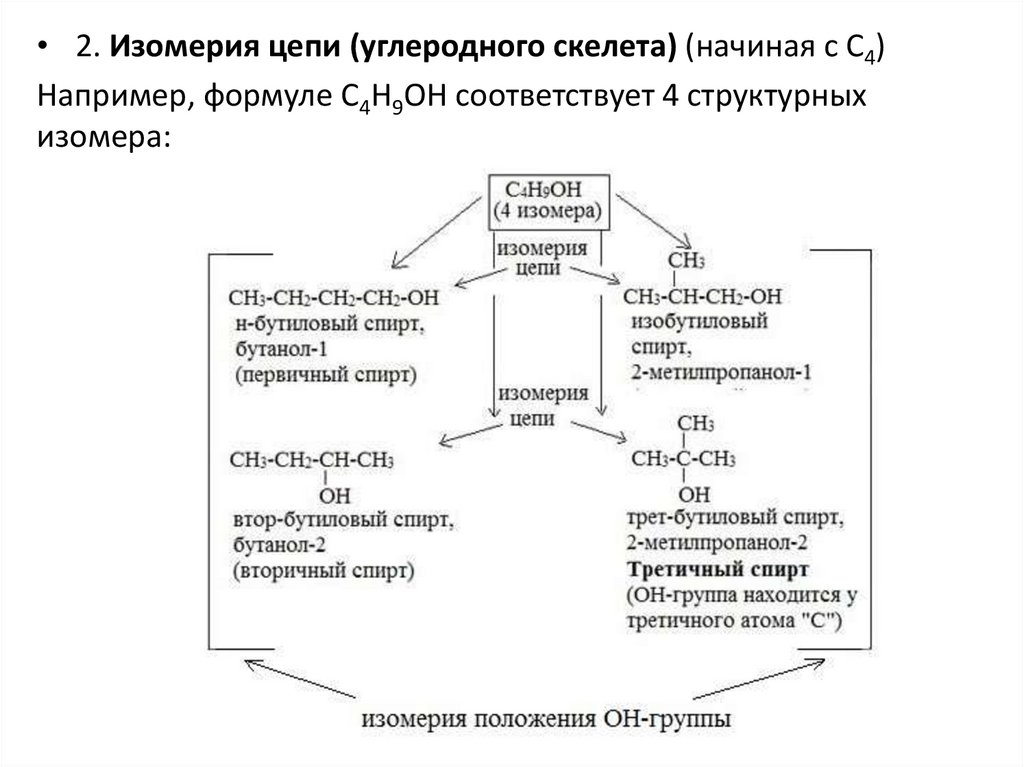
• 2. Изомерия цепи (углеродного скелета) (начиная с С4)Например, формуле C4H9OH соответствует 4 структурных
изомера:
22.
• 3. Межклассовая изомерияСпирты изомерны другому классу
соединений – простым эфирам (R-O-R'):
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH (OH)СH2CH3, в молекуле которого второй атом
углерода (выделен цветом) связан с четырьмя различными заместителями,
существует в форме двух оптических изомеров.
Таким образом, формуле C4H9OH соответствует 5 изомерных спиртов (4
структурных изомера и один из них — бутанол-2 — в виде двух зеркальных
изомеров).
23.
Физические свойства спиртов• Метиловый спирт (метанол, карбинол,
древесный спирт) – простейший одноатомный
спирт, бесцветная жидкость (tкип= 64,5; tпл= 97; ρ= 0,793г/см3), с запахом алкоголя, хорошо
растворяется в воде, горюч. Пары метанола
взрывоопасны. Пары метанола
взрывоопасны. Сильный яд!
• Метанол вызывает слепоту (достаточно 10
мл). При употреблении внутрь 70 мл и более
наступает летальный исход. Смерть наступает
от паралича верхних дыхательных путей.
24.
• Этиловый спирт (этанол, винный спирт) –бесцветная жидкость, с запахом спирта, хорошо
смешивается с водой, ядовитое наркотическое
вещество. Кипит при 78,30С, замерзает при -1140С.
Горит слабо светящимся пламенем. В виде
ректификата (спирта, очищенного перегонкой) он
содержит 95,6 % спирта и 4,4% воды.
• Винный спирт – исторически сложившееся
название, которое отражает, что этанол является
основным компонентом винной продукции.
• Этиловый спирт разрушает кровеносную,
нервную, пищеварительную системы. Вызывает
сильное привыкание и деградацию личности. При
употреблении 300 мл, в перерасчете на чистый
спирт, может вызвать смертельный исход.
25.
А знаете ли вы?• Одноатомным спиртом является и холестерин.
Его еще называют холестеролом. Холестерин –
компонент желчи, играет важную роль в
организме, из него синтезируются многие
биологически активные соединения. Он
участвует в обмене желчных кислот, в синтезе
гормонов коры надпочечников и половых
желез. Отложение холестерина на стенках
сосудов приводит к атеросклерозу, а в
желчном пузыре – к образованию желчных
камней.
26.
Все алканолы легче воды, бесцветны.Низшие спирты имеют характерный
алкогольный запах и жгучий вкус.
27.
Важно!!!!!!!!!!!!!!!!!!• Полярность связи О-Н и наличие
неподеленных пар электронов на атоме
кислорода определяют физические свойства
спиртов.
• Температуры кипения спиртов больше
температуры кипения соответствующих
алканов с тем же числом атомов углерода. Это
объясняется ассоциацией молекул спиртов
вследствие образования межмолекулярных
водородных связей.
28.
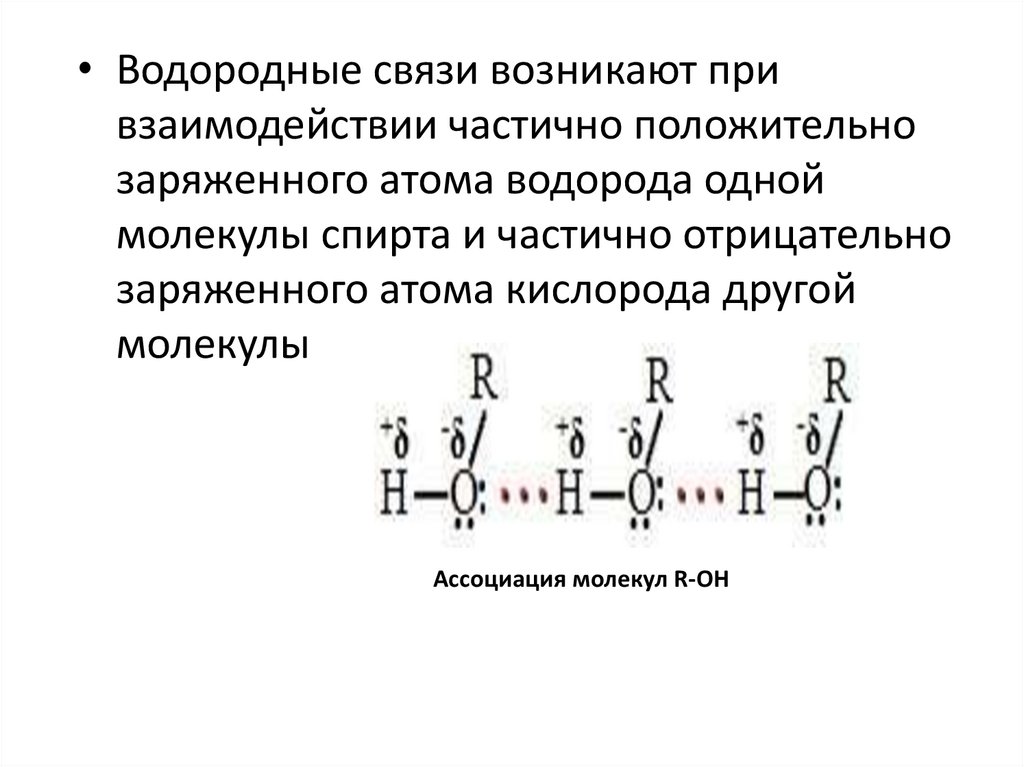
• Водородные связи возникают привзаимодействии частично положительно
заряженного атома водорода одной
молекулы спирта и частично отрицательно
заряженного атома кислорода другой
молекулы
Ассоциация молекул R-OH
29.
• В водных растворах водородные связиобразуются не только между молекулами
спиртов, но также между молекулами
спиртов и воды. Образованием водородных
связей между молекулами спирта и воды
объясняется их хорошая растворимость в
воде.
Гидратация молекул R-OH
Водородные связи не прочны и при испарении
спиртов легко разрываются!!!!
Видеоопыт «Физические свойства спиртов»
30.
• С увеличением углеводородного радикаларастворимость спиртов в воде уменьшается.
• Высшие спирты практически нерастворимы в
воде. Метиловый, этиловый, н-пропиловый,
изопропиловый спирты, а также
этиленгликоль и глицерин смешиваются с
водой в любых отношениях.
• Растворимость фенола в воде ограничена.
31.
Строение. Химические свойствапредельных одноатомных спиртов
• Химические свойства
спиртов ROH определяются наличием
полярных связей,
и неподеленных
электронных пар на атоме кислорода.
32.
В химических реакцияхгидроксисоединений возможно
разрушение одной из двух связей:
С–ОН с отщеплением ОН-группы
О–Н с отщеплением водорода
Это могут быть реакции замещения, в
которых происходит замена ОН или Н, или
реакция отщепления (элиминирования),
когда образуется двойная связь.
33.
• Полярный характер связей С–О и О–Нспособствует гетеролитическому их
разрыву и протеканию реакций
по ионному механизму. При разрыве
связи О–Н с отщеплением протона (Н+)
проявляются кислотные свойства
гидроксисоединения, а при разрыве
связи С–О – свойства основания и
нуклеофильного реагента.
34.
• С разрывом связи О–Н идут реакцииокисления, а по связи С–О –
восстановления.
35.
• Спирты отличаются разнообразнымипревращениями.
• Реакции спиртов имеют некоторые общие
закономерности: реакционная способность
первичных одноатомных спиртов выше, чем
вторичных, в свою очередь, вторичные спирты
химически более активны, чем третичные.
• Для двухатомных спиртов, в том случае, когда ОНгруппы находятся у соседних атомов углерода,
наблюдается повышенная (в сравнении с
одноатомными спиртами) реакционная способность
из-за взаимного влияния этих групп.
• Для спиртов возможны реакции, проходящие с
разрывом как С–О, так и О–Н – связей.
36.
Различают два основных типа реакцийспиртов с участием функциональной группы –
ОН:
• 1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с
образованием алкоголятов;
б) реакции спиртов с органическими и минеральными
кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или
перманганата калия до карбонильных соединений.
37.
• 2) Реакции сопровождающиеся разрывомсвязи С-О:
• а) каталитическая дегидратация с
образованием алкенов (внутримолекулярная
дегидратация) или простых эфиров
(межмолекулярная дегидратация);
• б) замещение группы –ОН галогеном,
например при действии галогеноводородов с
образованием алкилгалогенидов.
38.
Спирты – амфотерные соединения.• Реакции замещения
Кислотно-основные свойства
Кислотные свойства уменьшаются в ряду, а основные
возрастают:
HOH →
R-CH2-OH → R2CH-OH →
R3C-OH
вода
первичный
вторичный
третичный
39.
Кислотные свойства• 1. Взаимодействие со щелочными и
щелочноземельными металлами (Li, Na, K, Ca, Ba,
Sr)
Реакции с разрывом связи О-Н
• При действии на спирты активных металлов в
безводной среде атом водорода гидроксильной
группы замещается на металл:
Образующиеся соединения (соли спиртов) называются
алкоголятами — производные метилового спирта –
метилатами, производные этилового спирта – этилатами.
40.
Видеоопыт «Взаимодействие спиртов с металлическимнатрием»
• Алкоголяты химически не стабильны и при действии
воды они полностью гидролизуются с образованием
исходного спирта и щелочи:
• Эта реакция показывает, что спирты по сравнению с
водой являются более слабыми кислотами (сильная
кислота вытесняет слабую). При взаимодействии с
растворами щелочей спирты не образуют алкоголяты.
Спирты не взаимодействуют с водными растворами
щелочей!!!!!!!!
41.
2. Спирты вступают в реакции с минеральными иорганическими кислотами, образуя сложные
эфиры. (Реакции этерификации)
Реакция обратима (обратный процесс – гидролиз
сложных эфиров).
• Отличительной особенностью этой реакции
является то, что атом Н отщепляется от спирта, а
группа ОН – от кислоты:
42.
Реакционная способность одноатомных спиртов в этихреакциях убывает от первичных к третичным.
43.
3. Окисление спиртов под действием дихромата илиперманганата калия до карбонильных соединений.
В присутствии окислителей [O] –
K2Cr2O7 или KMnO4 спирты окисляются до
карбонильных соединений:
Первичные спирты при окислении образуют альдегиды,
которые затем легко окисляются до карбоновых кислот.
44.
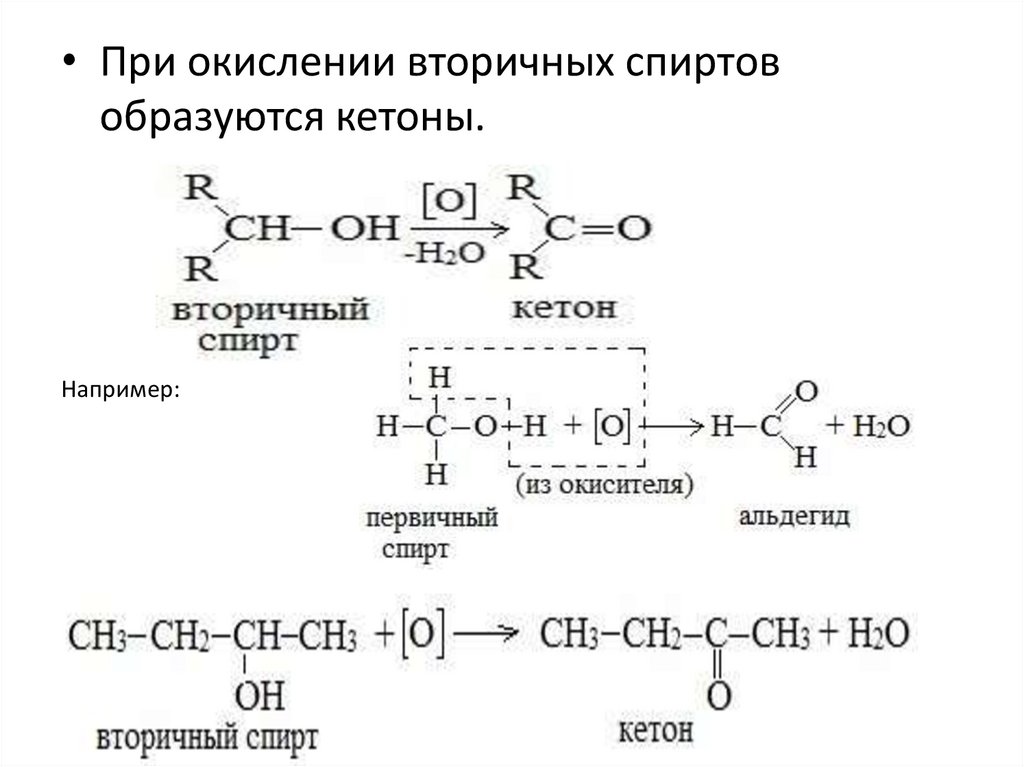
• При окислении вторичных спиртовобразуются кетоны.
Например:
45.
• Видеоопыт «Окисление этилового спирта растворомперманганата калия»
• Видеоопыт «Окисление этилового спирта
кристаллическим перманганатом калия»
• Видеоопыт «Каталитическое окисление этанола»
• Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей.
Они окисляются только в жестких условиях (кислая среда,
повышенная температура), что приводит к разрушению
углеродного скелета молекулы и образованию смеси
продуктов (карбоновых кислот и кетонов с меньшей
молекулярной массой).
46.
Основные свойстваВзаимодействие с галогенводородными кислотами
• Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в
реакции спиртов с галогеноводородами в присутствии
катализатора – сильной минеральной кислоты
(например, конц. H2SO4). При этом спирты проявляют
свойства слабых оснований:
Видеоопыт «Взаимодействие этилового спирта с
бромоводородом»
47.
Дегидратация (отщепление воды)• Реакции с разрывом связи С-О
При действии на спирты водоотнимающих реагентов, например,
концентрированной серной кислоты, происходит отщепление
воды – дегидратация.
Она может протекать по двум направлениям: с участием одной
молекулы спирта (внутримолекулярная дегидратация,
приводящая к образованию алкенов) или с участием двух
молекул спирта (межмолекулярная дегидратация, приводящая
к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается
склонность к отщеплению воды и образованию алкенов и
уменьшается способность образовывать простые эфиры
48.
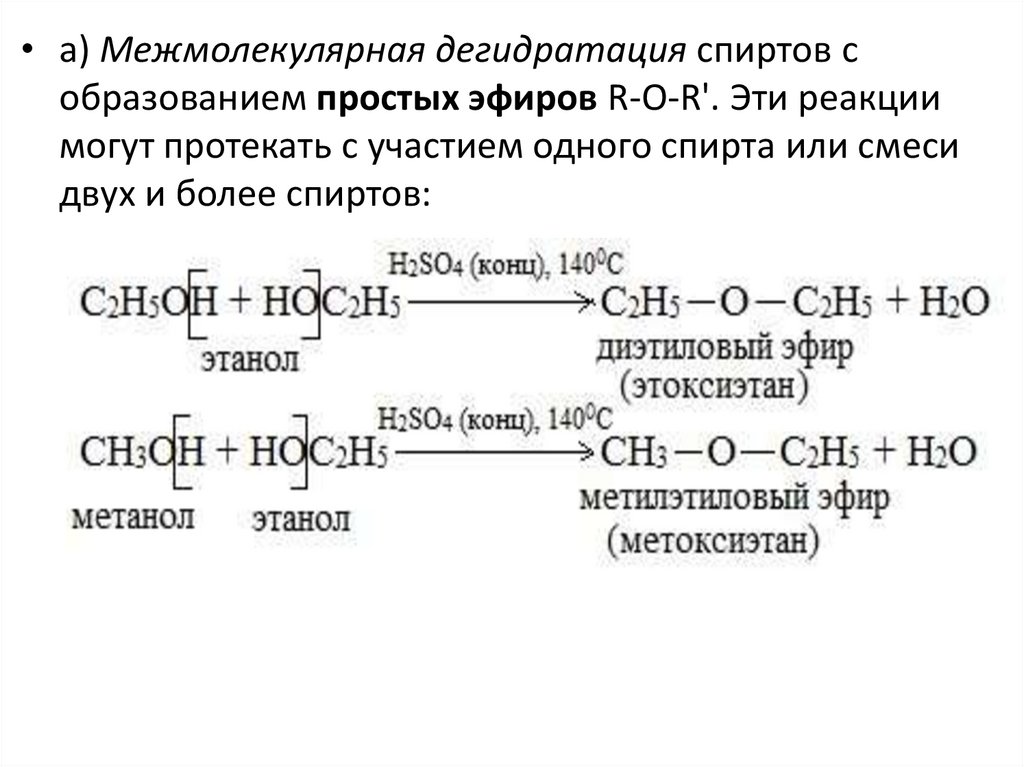
• а) Межмолекулярная дегидратация спиртов собразованием простых эфиров R-O-R'. Эти реакции
могут протекать с участием одного спирта или смеси
двух и более спиртов:
49.
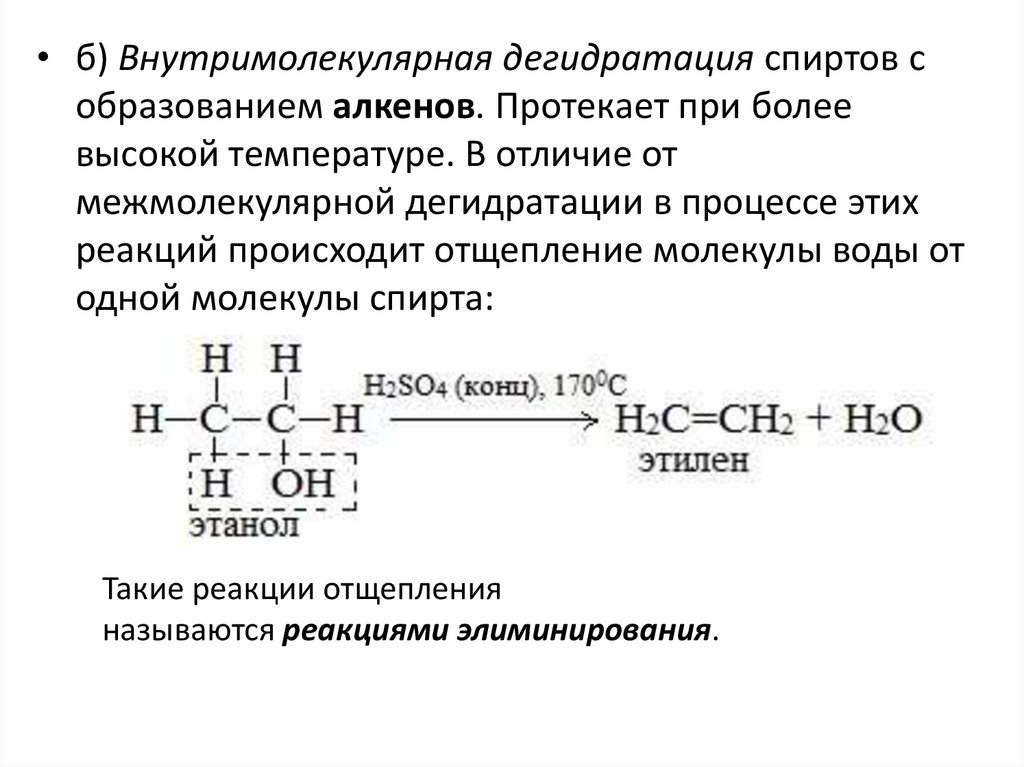
• б) Внутримолекулярная дегидратация спиртов собразованием алкенов. Протекает при более
высокой температуре. В отличие от
межмолекулярной дегидратации в процессе этих
реакций происходит отщепление молекулы воды от
одной молекулы спирта:
Такие реакции отщепления
называются реакциями элиминирования.
50.
• Первый член гомологического ряда алканолов – метанолСН3ОН – не вступает в реакции внутримолекулярной
дегидратации.
• Дегидратация вторичных и третичных спиртов происходит
по правилу Зайцева:
Правило Зайцева — отщепление атома водорода
в реакциях дегидрогалогенирования и
дегидратации происходит преимущественно от
наименее гидрированного (гидрогенизированного)
атома углерода.
51.
В тех случаях, когда возможны 2 направления реакции,например:
дегидратация идет преимущественно в направлении I, т.е.
по правилу Зайцева – с образованием более замещенного
алкена. Правило Зайцева: Водород отщепляется от наименее
гидрированного атома углерода соседствующего с углеродом,
несущим гидроксил.
52.
Реакции с разрывом связей О-Н и С-Н• Дегидрирование
а) При дегидрировании первичных спиртов
образуются альдегиды:
Реакция происходит при пропускании нагретых до 3000С паров спирта без
доступа воздуха над металлическими катализаторами (Cu или металлы
платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором
дегидрирования или гидрирования, т.е. отщепления или присоединения
водорода.
В организме человека этот процесс происходит под действием
(алкогольдегидрогеназы).
53.
• б) При дегидрировании вторичных спиртовобразуются кетоны:
Третичные спирты не подвергаются дегидрированию.
54.
Горение (полное окисление)• Спирты горят на воздухе с выделением
большого количества тепла. С увеличением
массы углеводородного радикала –
пламя становится всё более коптящим.
При сгорании спиртов выделяется большое
количество тепла:
55.
Качественные реакции на спирты• 1. Окисление спиртов дихроматом (Na2Cr2O7) или
перманганатом (КMnО4)
Первичные спирты окисляются дихроматом натрия
до альдегидов. Вторичные спирты окисляются
дихроматом натрия до кетонов.
56.
• Окисление KМnO457.
• 2. Окисление спиртов оксидом меди (II)Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди
(II) до альдегидов.
• Видеоопыт «Окисление этилового спирта
оксидом меди (II)»
58.
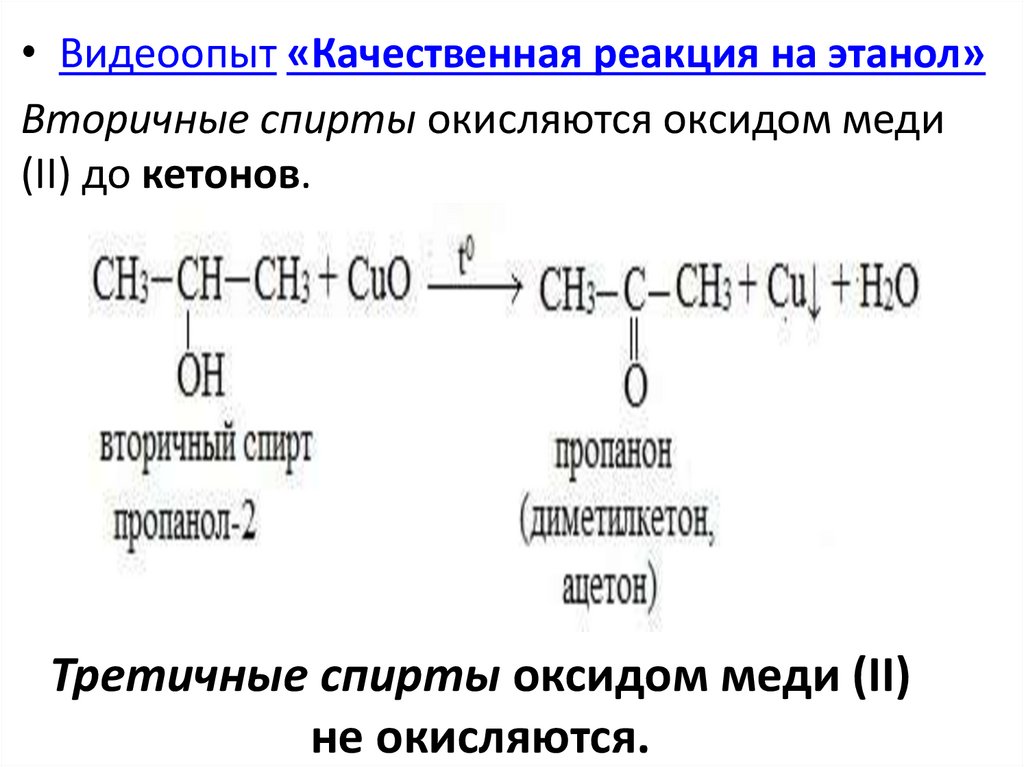
• Видеоопыт «Качественная реакция на этанол»Вторичные спирты окисляются оксидом меди
(II) до кетонов.
Третичные спирты оксидом меди (II)
не окисляются.
59.
Получение алканолов• К наиболее часто используемым химическим способам получения
спиртов относятся:
• 1.Гидратация алкенов (промышленный способ получения этанола для
технических целей)
(t, Р, кислая среда (катализатор))
• 2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
• 3.Восстановление альдегидов и кетонов (лабораторный способ
получения) (t, катализатор –Ni)
Особые способы получения метанола и этанола
• 1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
• 2.Получение этанола ферментативным брожением глюкозы (получение
этилового спирта для пищевых и медицинских целей) (ферменты —
дрожжи)
60.
1. Гидратация алкенов• Гидратация алкенов используется в
промышленности для получения спиртов из
продуктов нефтепереработки.
• Присоединение воды к алкенам происходит в
присутствии разбавленной серной или
фосфорной кислот.
Эта реакция протекает в соответствии с
правилом Марковникова, поэтому первичный
спирт можно получить только из этилена, а
остальные алкены дают вторичные или
третичные спирты:
61.
62.
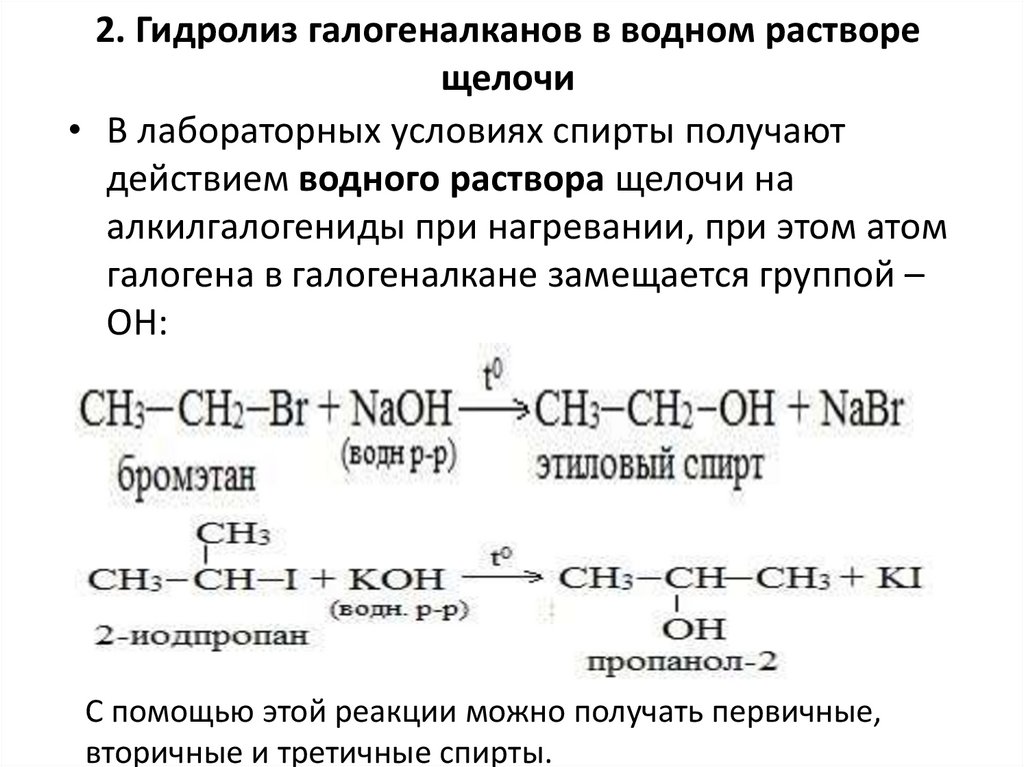
2. Гидролиз галогеналканов в водном растворещелочи
• В лабораторных условиях спирты получают
действием водного раствора щелочи на
алкилгалогениды при нагревании, при этом атом
галогена в галогеналкане замещается группой –
ОН:
С помощью этой реакции можно получать первичные,
вторичные и третичные спирты.
63.
3. Восстановление карбонильных соединений (альдегидов икетонов)
• Дегидрирование спиртов по своей
химической сущности является
окислением. Обратная реакция –
гидрирование альдегидов, кетонов и
эфиров карбоновых кислот – является,
таким образом, их восстановлением.
64.
• При действии водорода в присутствиикатализаторов (Ni, Pt, Pd) альдегиды
восстанавливаются до первичных спиртов,
а кетоны – до вторичных спиртов:
65.
4. Восстановление эфиров карбоновых кислот• Гидрирование сложных эфиров проходит
через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот
получают высшие первичные спирты, например:
66.
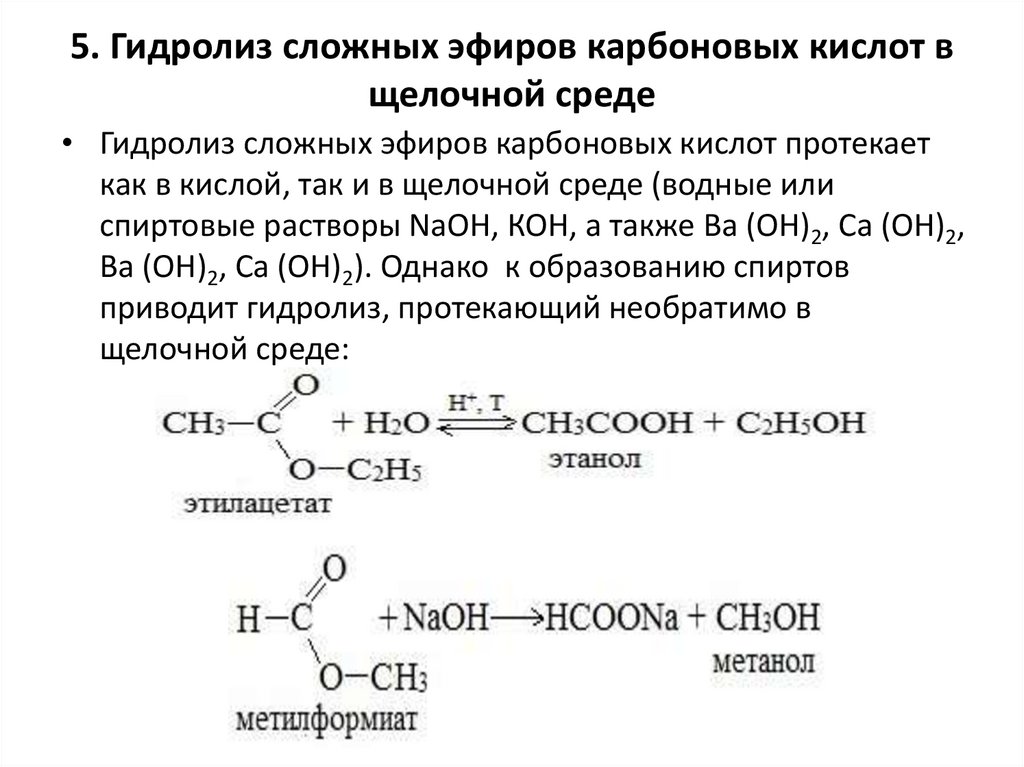
5. Гидролиз сложных эфиров карбоновых кислот вщелочной среде
• Гидролиз сложных эфиров карбоновых кислот протекает
как в кислой, так и в щелочной среде (водные или
спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2,
Ba (OH)2, Ca (OH)2). Однако к образованию спиртов
приводит гидролиз, протекающий необратимо в
щелочной среде:
67.
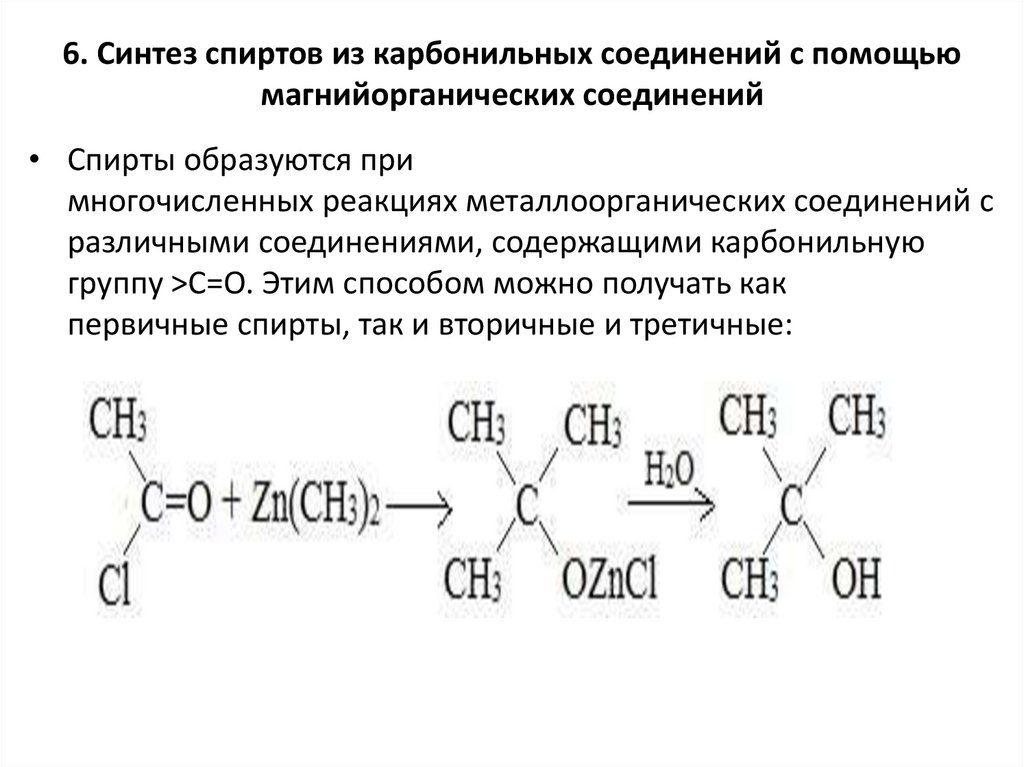
6. Синтез спиртов из карбонильных соединений с помощьюмагнийорганических соединений
• Спирты образуются при
многочисленных реакциях металлоорганических соединений с
различными соединениями, содержащими карбонильную
группу >С=О. Этим способом можно получать как
первичные спирты, так и вторичные и третичные:
68.
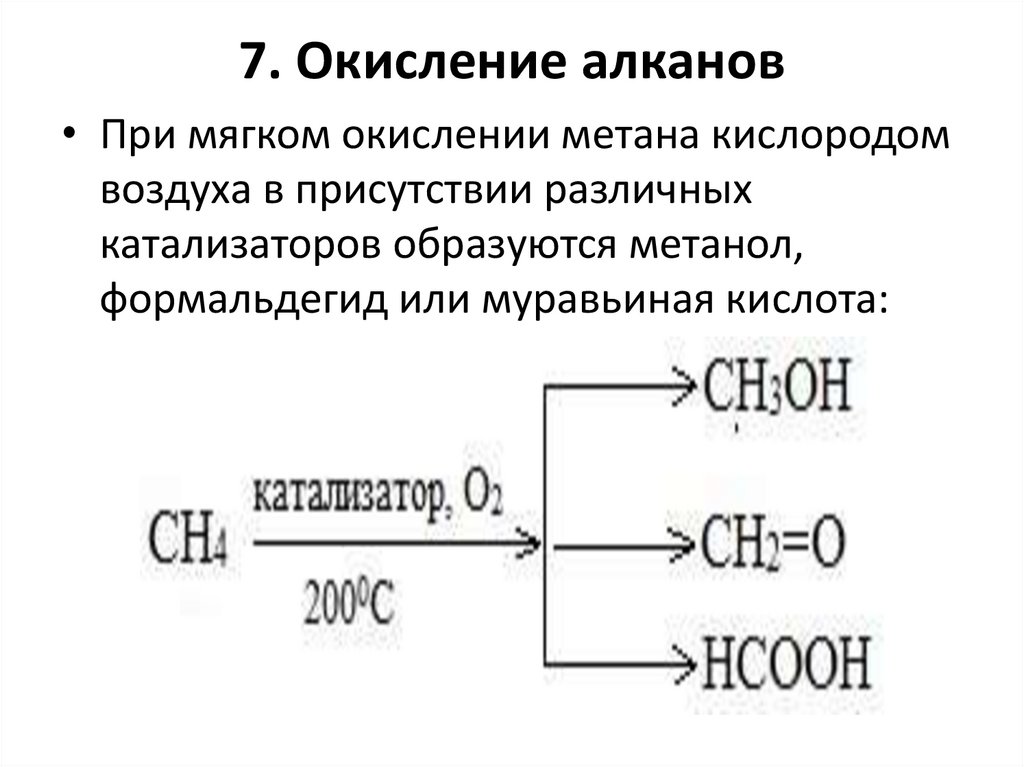
7. Окисление алканов• При мягком окислении метана кислородом
воздуха в присутствии различных
катализаторов образуются метанол,
формальдегид или муравьиная кислота:
69.
• Специфические способы получения метанола и этанола• Производство метанола крупнотоннажное, т.к. метиловый
спирт является исходным веществом для получения
других продуктов органического синтеза.
В промышленности
• 1. Получение метанола из синтез-газа (водяной газ,
генераторный газ)
• а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома,
температуру поддерживают в интервале 200-300 оС, а давление – от 40 до
150 атм
70.
• Ранее метанол получали сухой перегонкойдревесины без доступа воздуха (отсюда его
название «древесный спирт»).
2. Получение этанола спиртовым брожением
глюкозы
Ферментативный гидролиз крахмала – наиболее
древний синтетический процесс, используемый
человеком – до сих пор имеет огромное значение
для получения этилового спирта.
71.
• Протекает только в присутствии ферментов,которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные
опилки):


























































 chemistry
chemistry








