Similar presentations:
Убиквитин-зависимая система регуляции транспортных процессов. Везикулярный транспорт (лекция 5)
1.
Убиквитин-зависимая системарегуляции транспортных
процессов
Убиквитин
Глобулярный пептид (76 а.o)
Lys11
Lys29
Lys48
Lys63
GlyGly
изопептидная связь
Lys
Белок-мишень
2.
Убиквитинконъюгирующая системаЕ1
. . .
……..
?
Uba (убиквитинактивирующий фермент)
Е2 . . . Ubc (убиквитинконъюгирующий фермент)
Е3
E4
(
. . …... Ubl (yбиквитин-лигаза)
фактор элонгации
удлиняет полиубиквит.
цепочку)
3.
Процесс убиквитинирования идет в 4 стадии1
2
3
4
4.
Классификация убиквитин-лигаз:HECT
Nedd4
мономерные белки
RING
Cbl, Rsp5
5.
Существует также ряддеубиквитинирующих ферментов (DUBs),
как свободных, так и ассоциированных
с протеасомами и эндосомами
6.
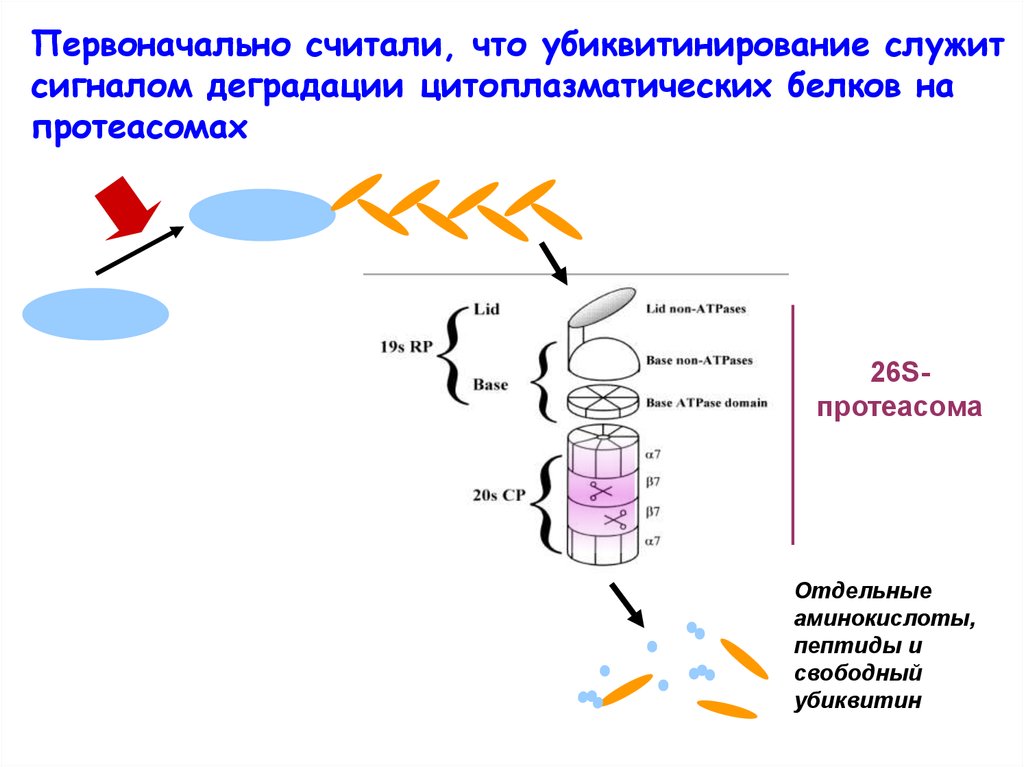
Первоначально считали, что убиквитинирование служитсигналом деградации цитоплазматических белков на
протеасомах
26Sпротеасома
Отдельные
аминокислоты,
пептиды и
свободный
убиквитин
7.
В дальнейшем оказалось,что роль убиквитинирования
гораздо шире
8.
Убиквитин способен образовывать цепи сиспользованием различных лизиновых остатков
Тип цепи определяет реакции, в которых
участвует убиквитинированный белок
Ubc7H
c-Сbl
EGFR
PDGFR
HGFR
……..
9.
Типы убиквитинирования белковAccessory
proteins
Cargo proteins
?
10.
Предположения о полиубиквитинировании тирозинкиназныхрецепторов были основаны на том факте, что их деградация
блокируется ингибиторами протеасом
А протеасомы узнают полиубиквитированные белки
Следовательно,
рецепторы полиубиквитинируются,
а протеасомы участвуют в регуляции
эндоцитоза (опосредуют переход из ранних
эндосом в поздние)
11.
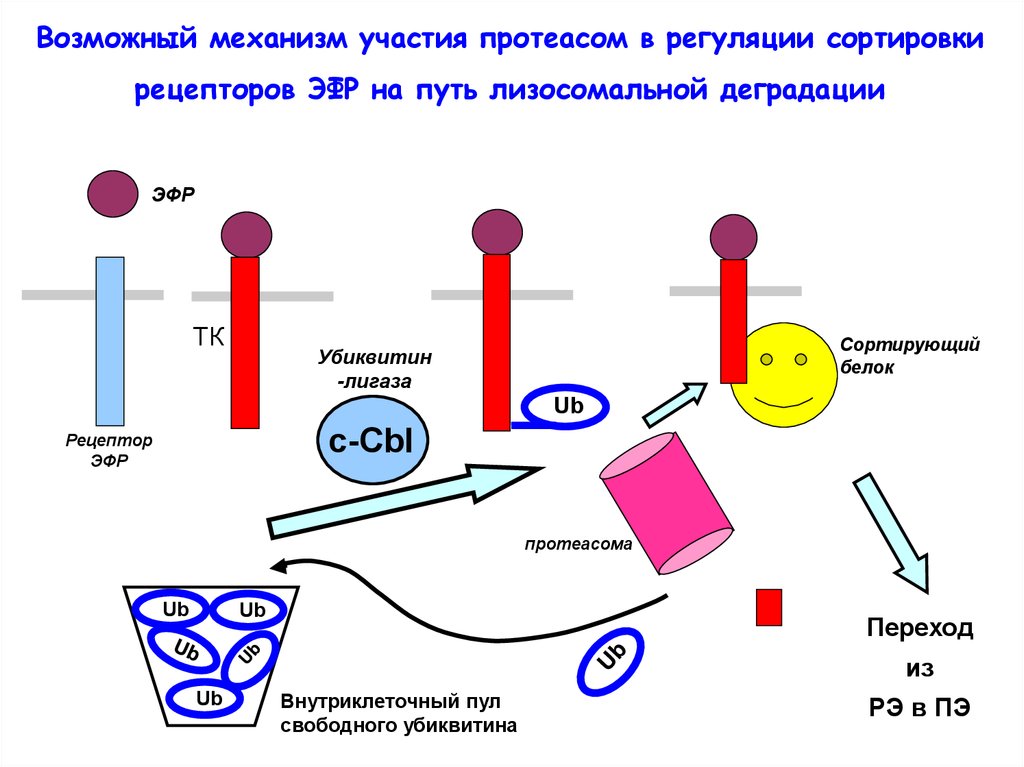
Возможный механизм участия протеасом в регуляции сортировкирецепторов ЭФР на путь лизосомальной деградации
ЭФР
ТК
Сортирующий
белок
Убиквитин
-лигаза
Ub
c-Сbl
Рецептор
ЭФР
протеасома
Ub
Ub
Переход
из
Ub
Внутриклеточный пул
свободного убиквитина
РЭ в ПЭ
12.
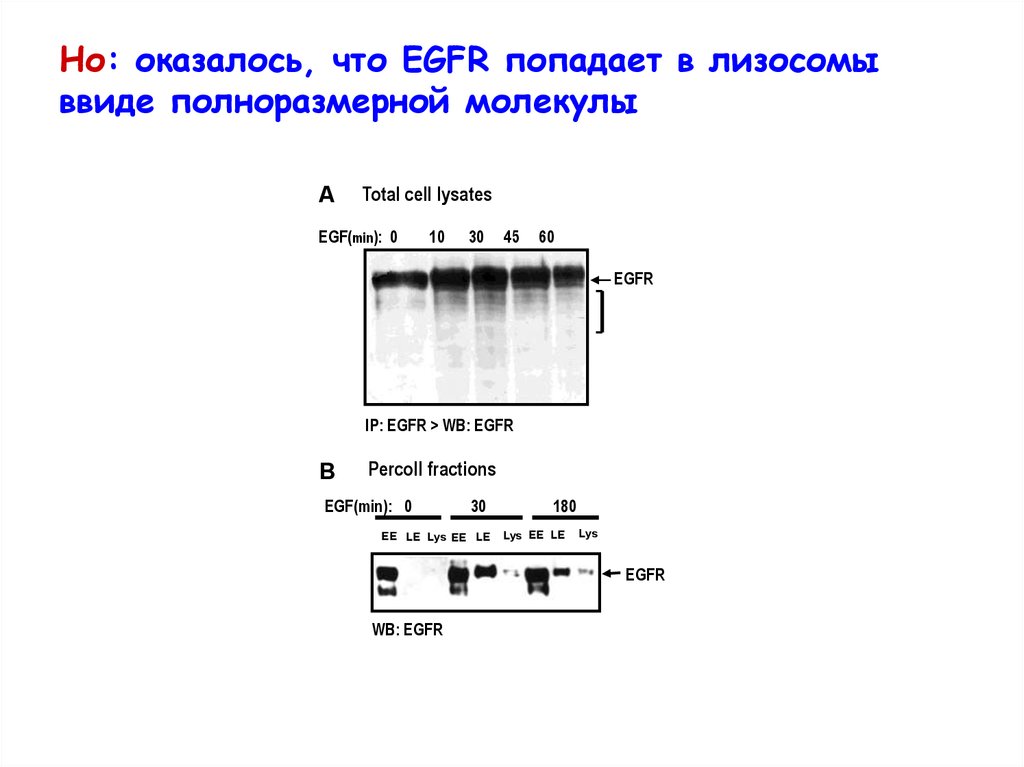
Но: оказалось, что EGFR попадает в лизосомыввиде полноразмерной молекулы
A
Total cell lysates
EGF(min): 0
10
30
45
60
EGFR
IP: EGFR > WB: EGFR
B
Percoll fractions
EGF(min): 0
30
EE LE Lys EE LE
180
Lys EE LE
Lys
EGFR
WB: EGFR
13.
Во-вторых, действие ингибиторов протеасом имеетдва следствия:
A
1. В результате ингибирования
функций протеасом в клетке
накапливаются
высокоубиквитинированные формы
белков, в норме подвергающихся
деградации на протеасомах
control
MG132
LC
Baf A1
EGF(min): 90 0 30 90 180 0 30 90 180 0 30 90 180 0 30 90 180
EGFR
c-Cbl
WB: ubiquitin
B
100
20
C
170
WB: EGFR
120
WB: c-Cbl
in
12
0
m
m
in
90
m
in
60
m
in
30
ro
l
0
co
nt
2. В результате истощается
внутриклеточный пул
свободного убиквитина, и его
становится недостаточно для
нормального убиквитирования
белков в новых раундах
убиквитин-зависимых
процессов
O 80
D, 60
% 40
14.
Таким образом, протеасомы напрямую неучаствуют в регуляции эндоцитоза
В дальнейшем было показано, что рецепторы
(также как и другие трансмембранные белки,
деградирующие в лизосомах) подвергаются
мультиубиквитированию;
Моноубиквитирования трансмембранных белков
достаточно для интернализации, по крайней мере в
искусственных системах
15.
16.
Многие мембранные белки,подвергающиеся эндоцитозу,
и белки, регулирующие разные стадии
эндоцитозного пути,
либо сами убиквитинированы,
либо имеют домены, способные узнавать
убиквитинированные белки
17.
Белки с доменами, узнающими убиквитин,участвующие в регуляции эндоцитозного пути EGFR
Убиквитин-лигаза,
убиквитинирует рецептор
Регулирует рекрутирование
EGFR в ОЯ и его
интернализацию
Участвуют в сортировке
рецепторов из РЭ в ПЭ
18.
Белки с этими доменами сами моноубиквитинируются19.
Какова же роль убиквитинированиятрансмембранных белков в их эндоцитозе?
20.
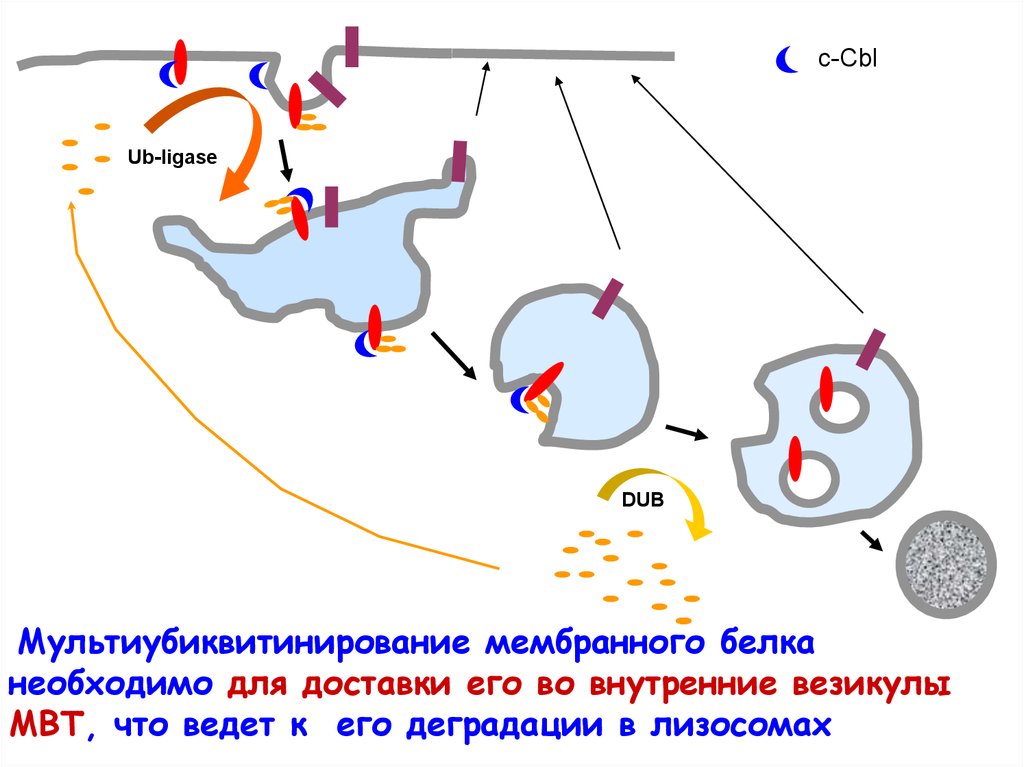
c-CblUb-ligase
DUB
Мультиубиквитинирование мембранного белка
необходимо для доставки его во внутренние везикулы
МВТ, что ведет к его деградации в лизосомах
21.
CblY1045
Рецептор
ЭФР
Cbl,
Nedd4?
Eps15, epsin
активны
неактивны
HRS
Моноубиквитинирование вспомогательных
белков осуществляет их регуляцию по механизму
обратной связи
22.
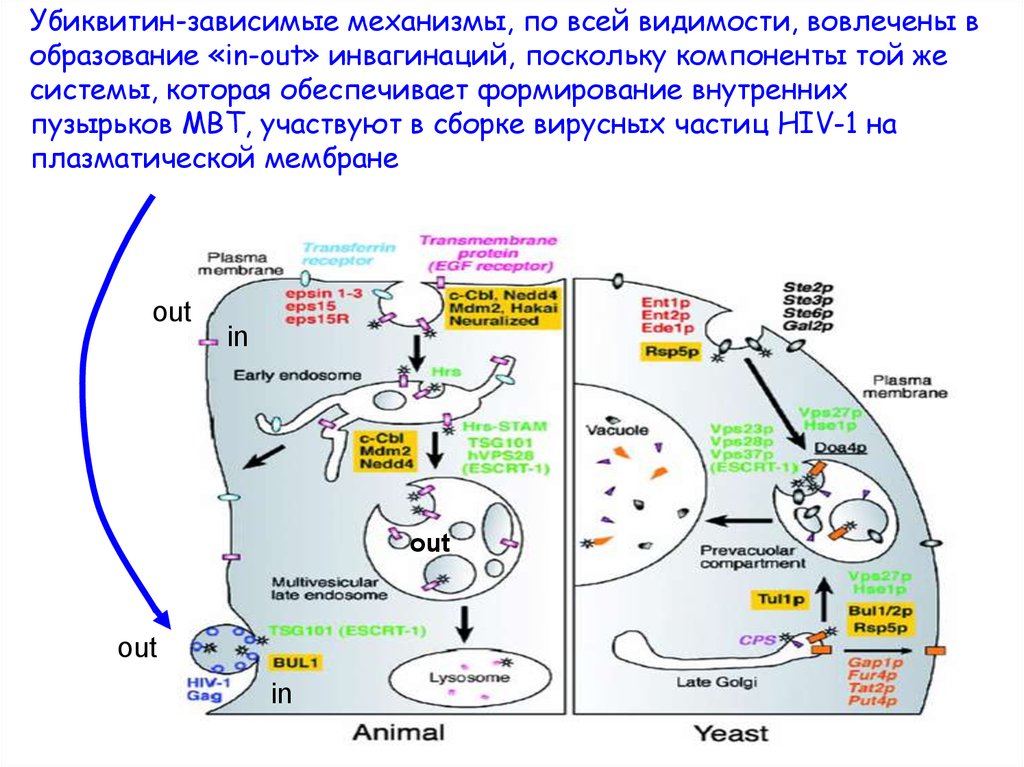
Убиквитин-зависимые механизмы, по всей видимости, вовлечены вобразование «in-out» инвагинаций, поскольку компоненты той же
системы, которая обеспечивает формирование внутренних
пузырьков МВТ, участвуют в сборке вирусных частиц HIV-1 на
плазматической мембране
out
in
out
out
in
23.
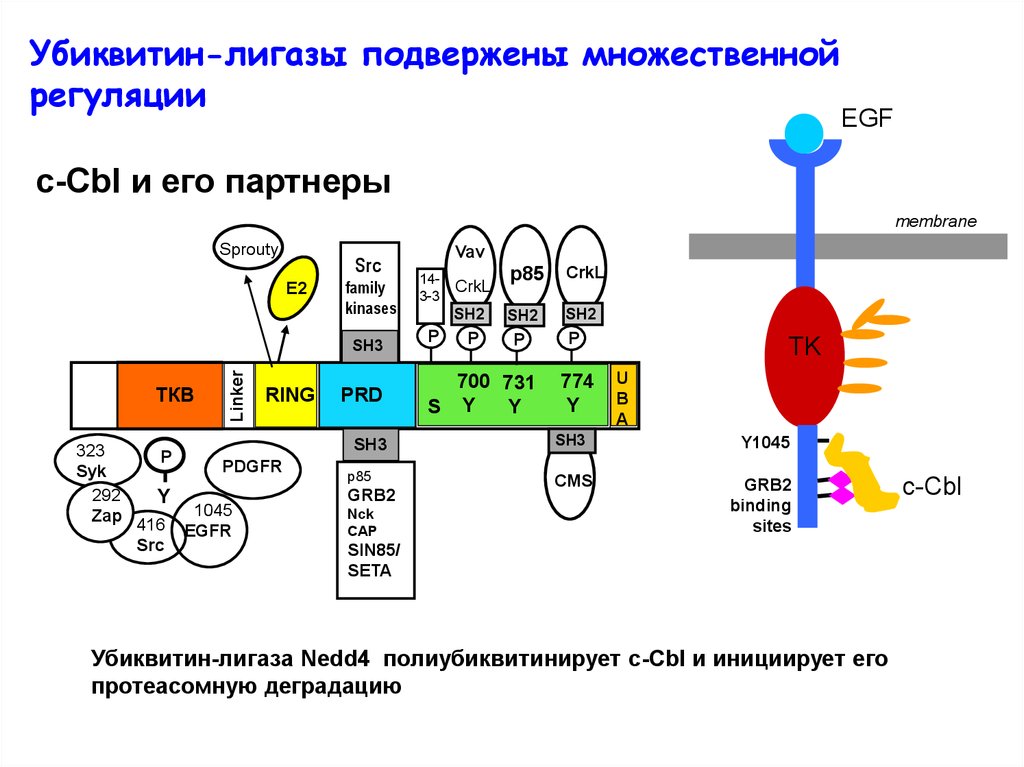
Убиквитин-лигазы подвержены множественнойрегуляции
EGF
c-Cbl и его партнеры
membrane
Sprouty
Src
E2
family
kinases
ТКВ
323
Syk
292
Zap
P
Y
416
Src
Linker
SH3
RING
PRD
SH3
PDGFR
1045
EGFR
p85
GRB2
Nck
CAP
Vav
143-3
P
p85
CrkL
SH2
SH2
SH2
P
P
CrkL
700 731
S Y
Y
P
774
Y
SH3
CMS
TK
U
B
A
Y1045
GRB2
binding
sites
SIN85/
SETA
Убиквитин-лигаза Nedd4 полиубиквитинирует с-Cbl и инициирует его
протеасомную деградацию
c-Cbl
24.
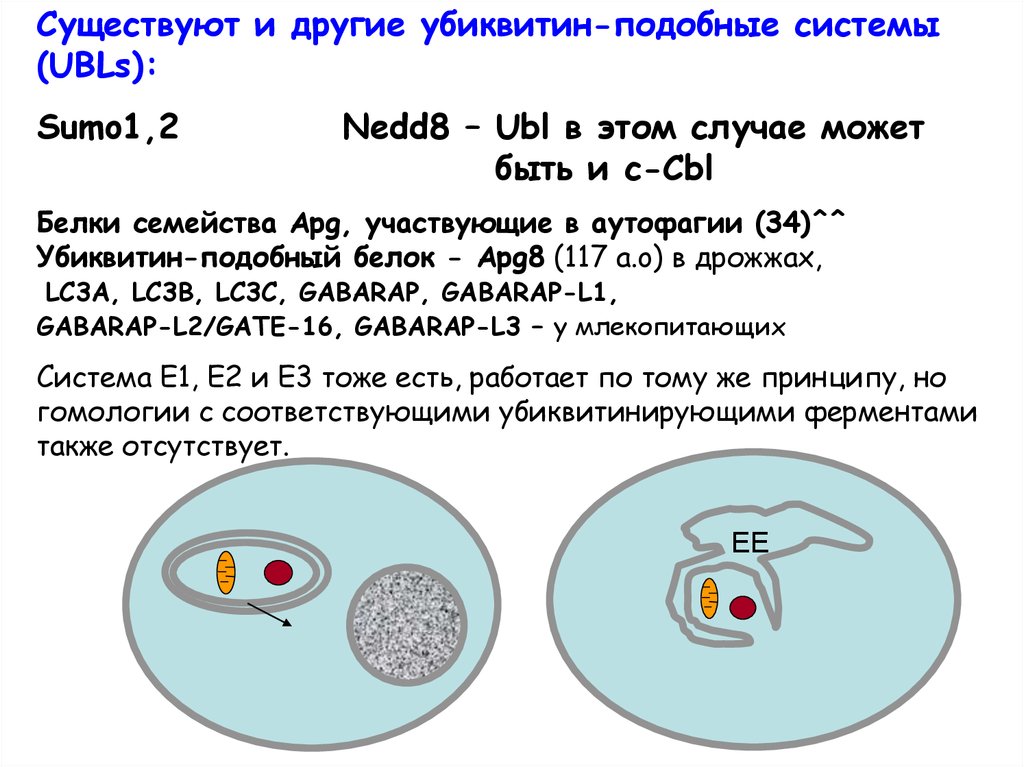
Существуют и другие убиквитин-подобные системы(UBLs):
Sumo1,2
Nedd8 – Ubl в этом случае может
быть и c-Cbl
Белки семейства Apg, участвующие в аутофагии (34)^^
Убиквитин-подобный белок - Apg8 (117 a.o) в дрожжах,
LC3A, LC3B, LC3C, GABARAP, GABARAP-L1,
GABARAP-L2/GATE-16, GABARAP-L3 – у млекопитающих
Система Е1, Е2 и Е3 тоже есть, работает по тому же принципу, но
гомологии с соответствующими убиквитинирующими ферментами
также отсутствует.
ЕЕ
25.
Аутофагия – цитопротекторный процесс, активируется при голодании(недостатке аминокислот), окислительном стрессе, накоплении неправильно
упакованных белков
При стимуляции аутофагии на основе «предшественника» аутофагосомы,
фагофора, формируется т.наз. «изолирующая мембрана» , источником
которой, как предполагают, могут служить мембраны АГ, ЭПР, внешняя
мембрана митохондрий или эндосомы (???)
Ключевые регуляторы процесса – TOR (target of rapamycin) киназа
и PI3-киназа III-его класса VPS34, вовлеченная также в регуляцию
эндоцитозного пути
nutrients
+
active
P
inactive
mTOR
mTOR
P
P Ulk1/2
FIP200
P P P
Atg13
P
P
Ulk1/2
FIP200
P
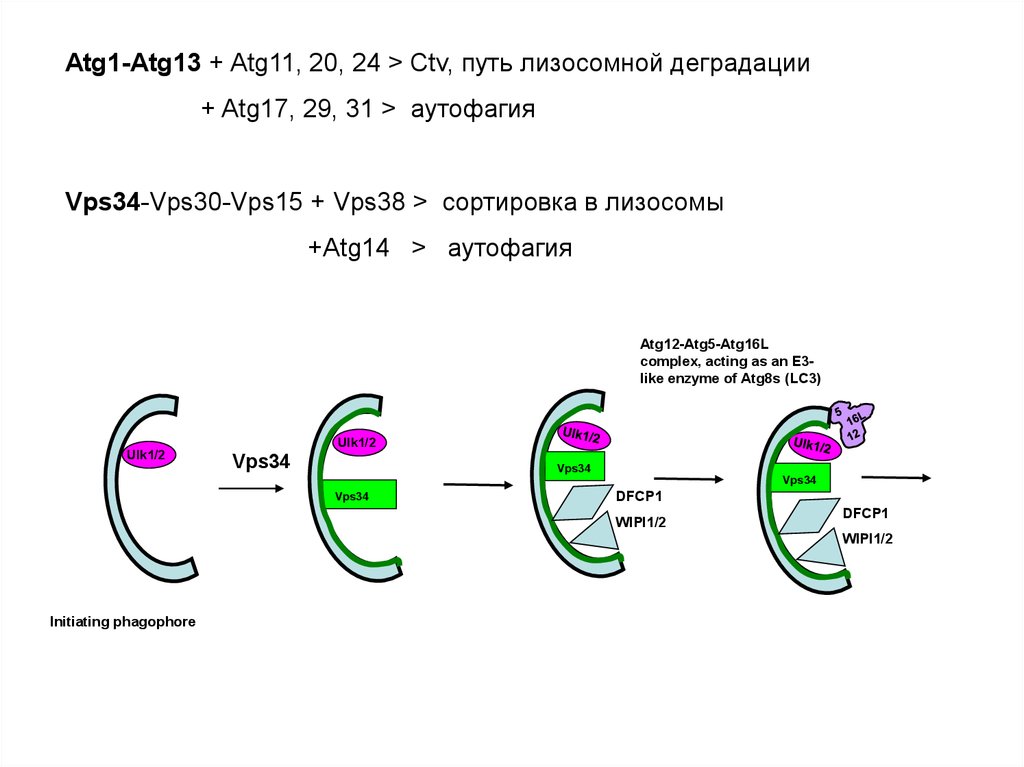
Atg1-copmlex ( Atg1= Ulk1/2 in mammals)
Atg13
26.
Atg1-Atg13 + Atg11, 20, 24 > Ctv, путь лизосомной деградации+ Atg17, 29, 31 > аутофагия
Vps34-Vps30-Vps15 + Vps38 > сортировка в лизосомы
+Atg14 > аутофагия
Atg12-Atg5-Atg16L
complex, acting as an E3like enzyme of Atg8s (LC3)
Ulk1/2
Ulk1/2
Vps34
Vps34
Vps34
Vps34
DFCP1
WIPI1/2
DFCP1
WIPI1/2
Initiating phagophore
27.
LC3LC3
GATE-16?
LC3
Atg8s {LC3 (microtubule-associated protein 1 light chain 3)}
и GATE-16 (Golgi-associated ATPase enhancer)] рекрутируются и
конъюгируются с фосфатидилэтаноламином (PE) на мембране фагофора.
LC3-PE опосредует элонгацию мембраны фагофора.
GATE-16 работает после LC3 на стадии, связанной с диссоциацией
«лигирующего комплекса» Atg12-Atg5-Atg16L.
28.
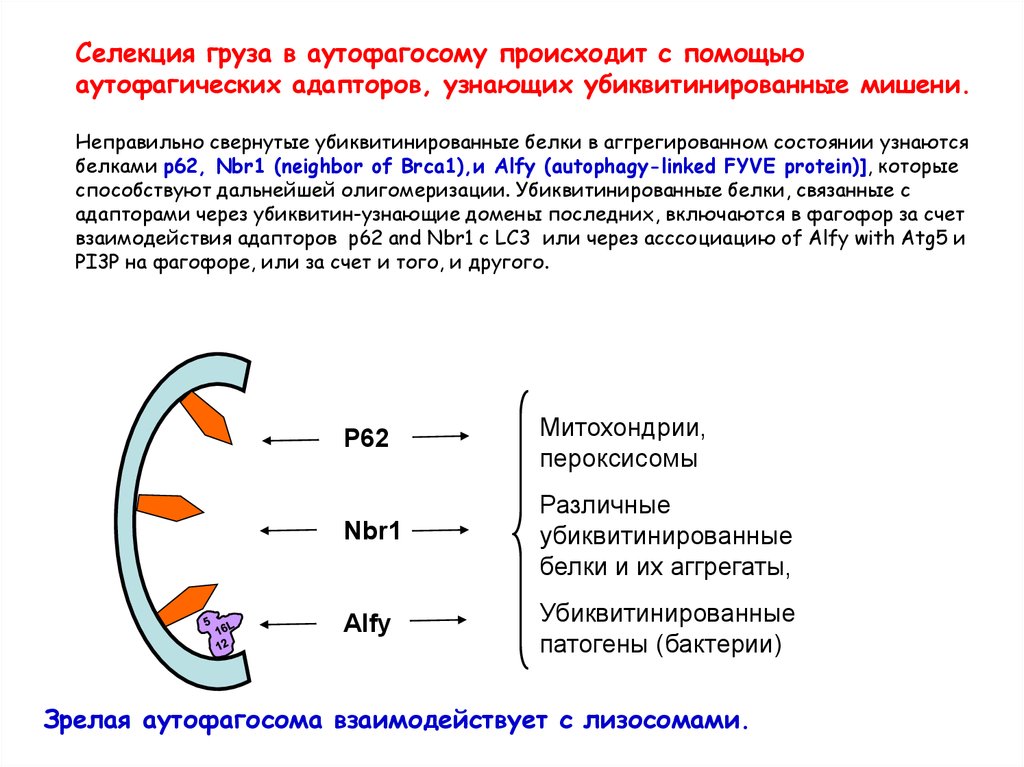
Селекция груза в аутофагосому происходит с помощьюаутофагических адапторов, узнающих убиквитинированные мишени.
Неправильно свернутые убиквитинированные белки в аггрегированном состоянии узнаются
белками p62, Nbr1 (neighbor of Brca1),и Alfy (autophagy-linked FYVE protein)], которые
способствуют дальнейшей олигомеризации. Убиквитинированные белки, связанные с
адапторами через убиквитин-узнающие домены последних, включаются в фагофор за счет
взаимодействия адапторов p62 and Nbr1 с LC3 или через асссоциацию of Alfy with Atg5 и
PI3P на фагофоре, или за счет и того, и другого.
P62
Митохондрии,
пероксисомы
Nbr1
Различные
убиквитинированные
белки и их аггрегаты,
Alfy
Убиквитинированные
патогены (бактерии)
Зрелая аутофагосома взаимодействует с лизосомами.
29.
Но:Возможен и убиквитин-независимый
механизм доставки белков в лизосомы: в
дрожжах найдено несколько белков, которые
деградируют в лизосомах, не подвергаясь
убиквитированию
30. Вопросы без ответа
1. Каковы молекулярные механизмы, с помощью которых клетка «чувствует « недостаток аминокислот,
индуцирующий аутофагию?
2. Как формируются фагосомы? Существует ли специфическое окаймление, участвующее в искривлении
мембраны при формировании аутофагосомы?
Каким образом различные аутофагические комплексы рекрутируются к специфическим сайтам
формирования аутофагосом? Участвует ли в процессе увеличения мембраны секреторная машинерия?
3. Действительно ли аутофагосомы формируются из различных источников? Отличаются ли фагосомы,
сформированные из мембран ЭПР, от фагосом, возникших из митохондрии или плазматической
мембраны?
Есть ли разница между аутофагосомами, сфорированными в обычных условиях роста и при воздействии
стресса?
4. Как элонгируются АФ: за счет синтеза новых фосфолипидов или за счет слияния уже существующих
везикул? Каков механизм замыкания АФ? Является ли этот процесс спонтанным, или результатом
увеличения мембраны, или опосредуется специальными молекулами? Что стимулирует диссоциацию
комплекса Atg12-Atg5-Atg16 с фагофора перед замыканием мембраны?
5. Как транспортная машинерия ( например, белки слияния SNAREs) доставляются к фагофору перед его
слиянием с лизосомами? Участвует ли в этом процессе амфисомы ( гибридные органеллы аутофагосомы и
эндосомы)?
6. Насколько селективно включается в АФ груз при стрессе? Действительно ли ЭПР и АГ подвержены
неселективной аутофагии?
31.
АДФ-рибозилирование32.
Brefeldin A – fungal macrocyclic lactoneПриводит к полной разборке аппарата Гольджи за счет растворения
его мембраны в ЭПР
ER
+ BFA
5 min
15 min
G
В первых работах с BFA обнаружили, что он блокирует ARF1 в
ГДФ-связанной форме, что препятствует сборке СОРI-окаймления
Сделали вывод, что роль окаймления заключается, в
частности, в препятствовании неконтролируемой тубуляции
мембран
33.
Дальнейшие исследования эффекта BFA показали:1. эндосомы и транс-Гольджи коллапсируют в области ЦОМТ
2. Лизосомы медленно (в течение часов) тубулируются
Но на лизосомах нет ARF1 и COPI !!!
3. Кроме того, были обнаружены клетки Ptk1, в которых Гольджи
не разбирается в ответ на добавление BFA, хотя COPI снимается с
мембран
Следовательно,
поведение ARF1 и COPI
не являются причиной эффекта BFA
34.
Оказалось, что в клетках, истощенных по NAD+(источнику АДФ-рибозы), ARF1 и COPI уходят с
мембран при действии BFA, а Гольджи остается
интактным
Обнаружили, что BFA стимулирует АДФ-рибозилирование двух
белков – BARS50 и глицерофосфатдегидрогеназы GAPDH
В норме они блокируют тубуляцию, а после АДФрибозилирования эта их функция нарушается
Механизм : BARS способен ацилировать LPA, т.е. модифицировать
мембранные липиды,
У него есть Bar-домен, способный поддерживать высокую кривизну
мембраны в тубуле
а GAPDH способна взаимодействовать с микротрубочками

























 biology
biology