Similar presentations:
Везикулярный транспорт (лекция 3)
1.
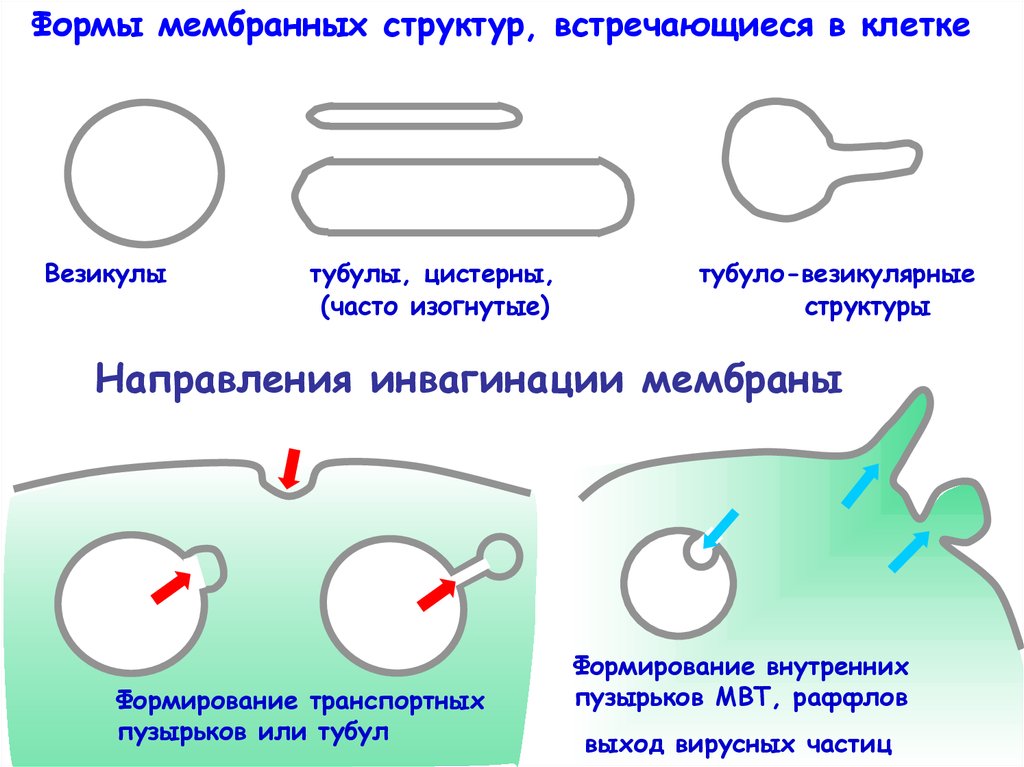
Формы мембранных структур, встречающиеся в клеткеВезикулы
тубулы, цистерны,
(часто изогнутые)
тубуло-везикулярные
структуры
Направления инвагинации мембраны
Формирование транспортных
пузырьков или тубул
Формирование внутренних
пузырьков МВТ, раффлов
выход вирусных частиц
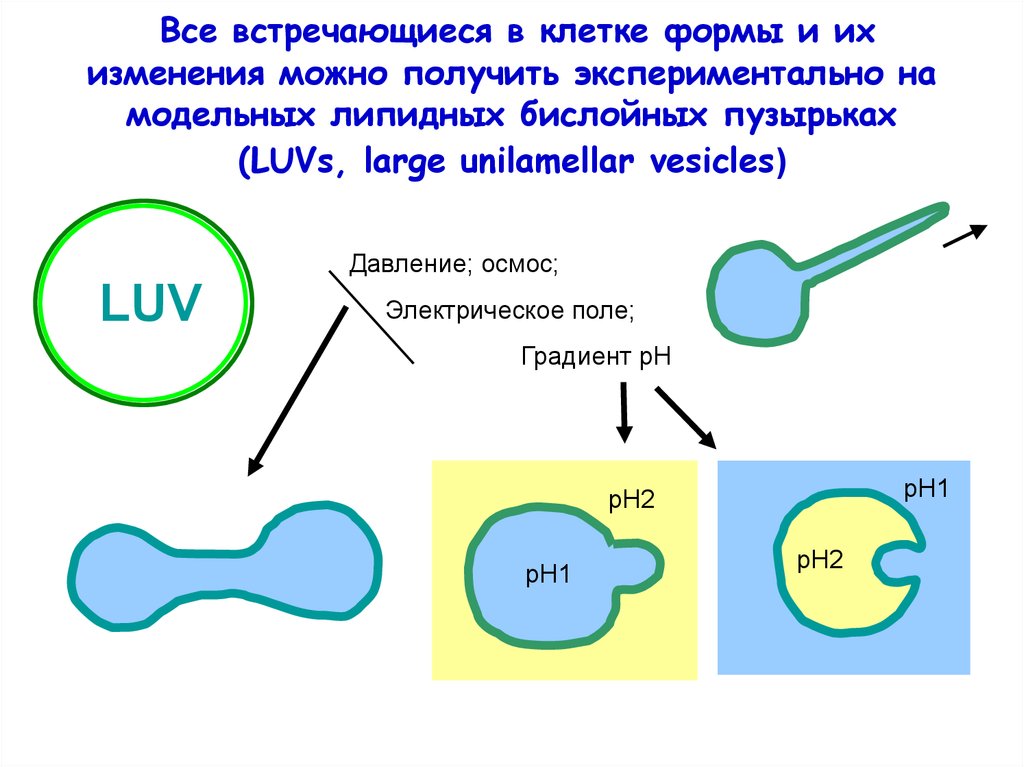
2. Все встречающиеся в клетке формы и их изменения можно получить экспериментально на модельных липидных бислойных пузырьках (LUVs, large unilamellar ve
Все встречающиеся в клетке формы и ихизменения можно получить экспериментально на
модельных липидных бислойных пузырьках
(LUVs, large unilamellar vesicles)
Давление; осмос;
LUV
Электрическое поле;
Градиент рН
pH1
pH2
pH1
pH2
3.
изменения формы мембраны определяются их физикохимическими свойствами
Формирование транспортных везикул может происходить и без
участия белков
Но:
Белковые окаймления определяют
место и время формирования
пузырька,
селективный выбор груза и
точки конечного назначения (мишень)
4. Окаймления (coats)
• COPI и COPII –окаймления• “клатриновые” окаймления:
АР1, АР2, АР3, АР4
GGA1, GGA2, GGA3
???
5.
COP (Coat Proteins)-окаймления обслуживаютбиосинтетический путь:
COPI: intraGolgi , Golgi > ER
COPII: ER > Golgi (ERGIC ?)
6.
COPI:Минимальная система in vitro:
ARF1* + коутомер (coatomer) + липосома (из кислых липидов)
коутомер
ARF1 (ADF-ribosylation factor1) - малая
ГТФаза,
Миристилирована (несет остаток миристиловой
кислоты)
ARF1-GDP – в цитозоле;
ARF1-GTP (ARF1*) – ассоциирована с мембраной
7.
ФосфатидилхолинARF1
cyt
GEF
GEF
ARF1* PLD
Golgi
Холин
фосфатидная к-та ( - )
ARF1
Регуляторы
нацеливания и
слияния
*
коутомер
ARF1
ARF1
*
8.
Грузы селектируются за счет взаимодействия сосвоими мембранными рецепторами, узнающими
определенные последовательности в молекулах
грузов (напр., KDEL, KKXX etc.)
На роль мембранных рецепторов претендуют белки
семейства
р24:
ARF1*
9.
В жизненном цикле COPI-везикулы присутствуют2 GAP-активности
Медленная – циклы гидролиза ГТФ на ARF1 под ее
действием необходимы для накопления груза;
Она создает временное окно, в течение которого пузырек
заполняется грузом
Быстрая - после полной сборки окаймления следует
быстрый гидролиз ГТФ на ARF1, отделение пузырька и
разборка окаймления; коутомер не является ARFGAP, тем
не менее его ассоциация с везикулой значительно ускоряет
гидролиз ГТФ.
10.
COPI на других органеллахCOPI на эндосомах:
1. Нет - и -субъединиц
2. -COP посттрансляционно модифицирован (фосфорилирован?)
3. COPI на эндосомах мало по сравнению с мембранами АГ
4. Дефекты по -COP препятствуют образованию
мультивезикулярных тел
5. Ассоциация с мембраной зависит от Rab-белков , а не ARF1
ARF6-GTP - локализован на ПМ
ARF6-GDP – локализован на рециклирующих эндосомах
ARF 6 взаимодействует с Rac1 и участвует в реорганизации
кортикального актинового цитоскелета
11.
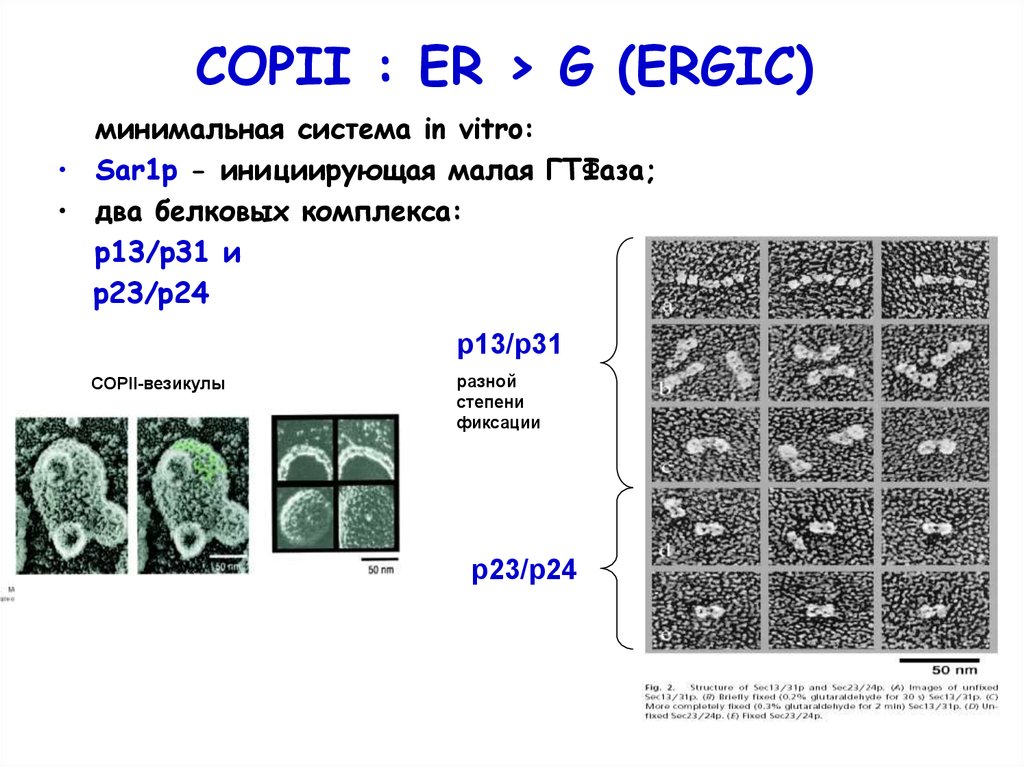
12. COPII : ER > G (ERGIC)
COPII : ER > G (ERGIC)минимальная система in vitro:
• Sar1p - инициирующая малая ГТФаза;
• два белковых комплекса:
р13/р31 и
р23/р24
р13/p31
СOPII-везикулы
разной
степени
фиксации
p23/p24
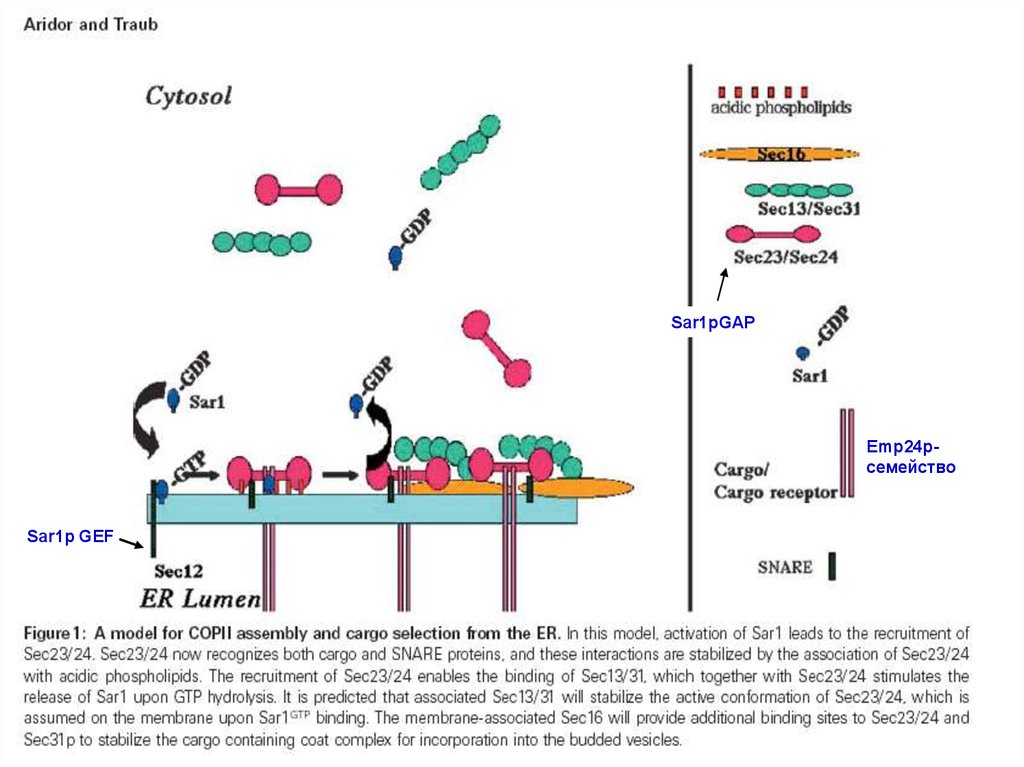
13.
Sar1pGAPEmp24pсемейство
Sar1p GEF
14.
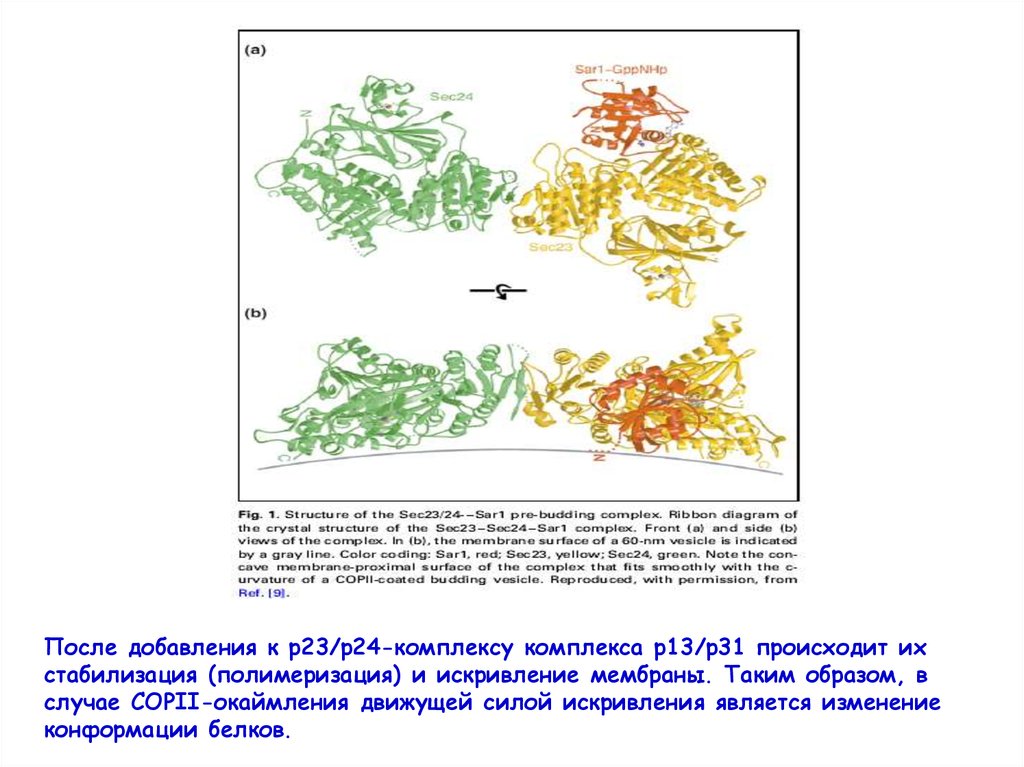
После добавления к р23/р24-комплексу комплекса р13/р31 происходит ихстабилизация (полимеризация) и искривление мембраны. Таким образом, в
случае COPII-окаймления движущей силой искривления является изменение
конформации белков.
15.
16.
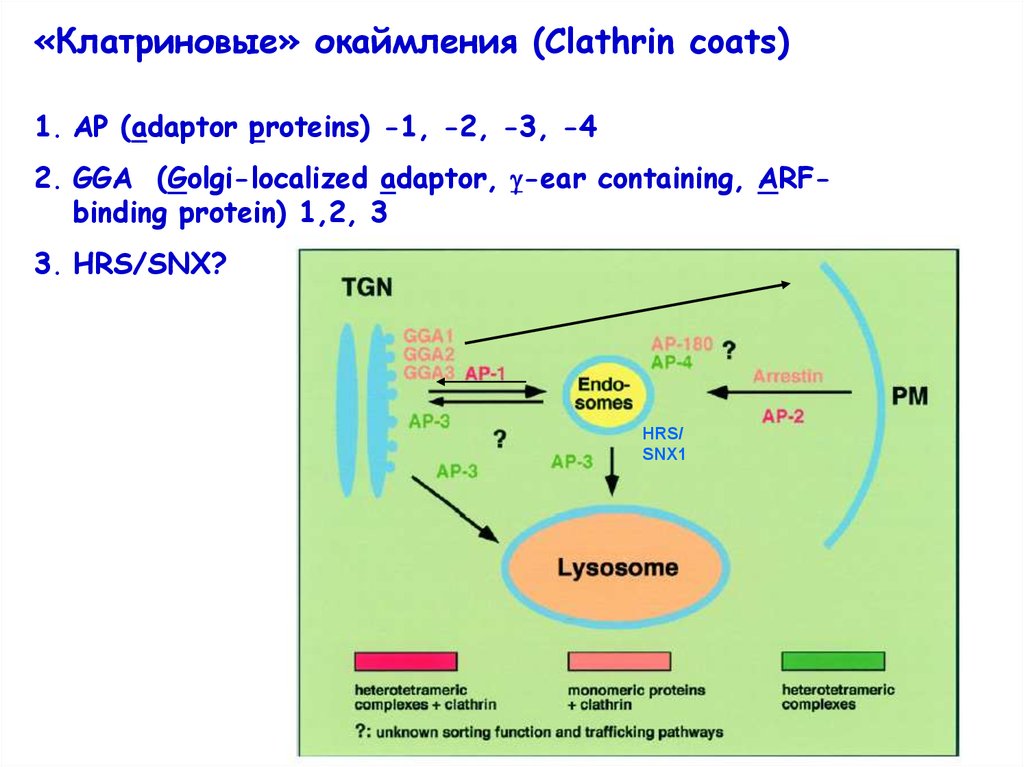
«Клатриновые» окаймления (Clathrin coats)1. АР (adaptor proteins) -1, -2, -3, -4
2. GGA (Golgi-localized adaptor, -ear containing, ARFbinding protein) 1,2, 3
3. HRS/SNX?
HRS/
SNX1
17.
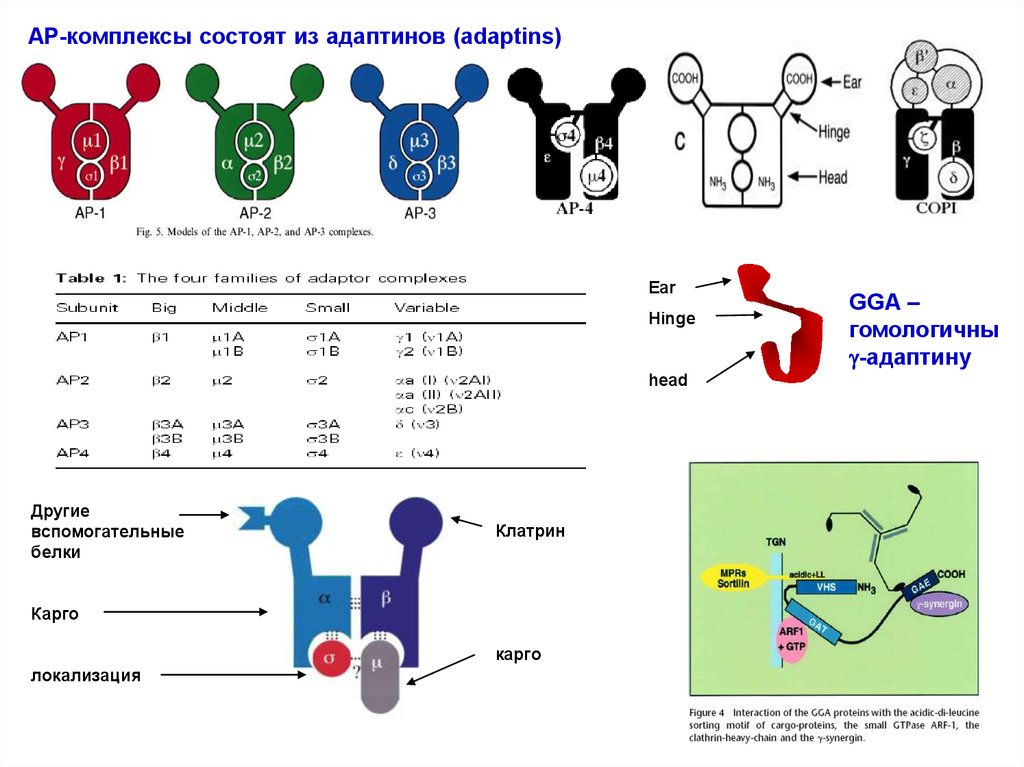
AP-комплексы состоят из адаптинов (adaptins)Клатриновые окаймления
Ear
Hinge
head
Другие
вспомогательные
белки
Клатрин
Карго
карго
локализация
GGA –
гомологичны
-адаптину
18.
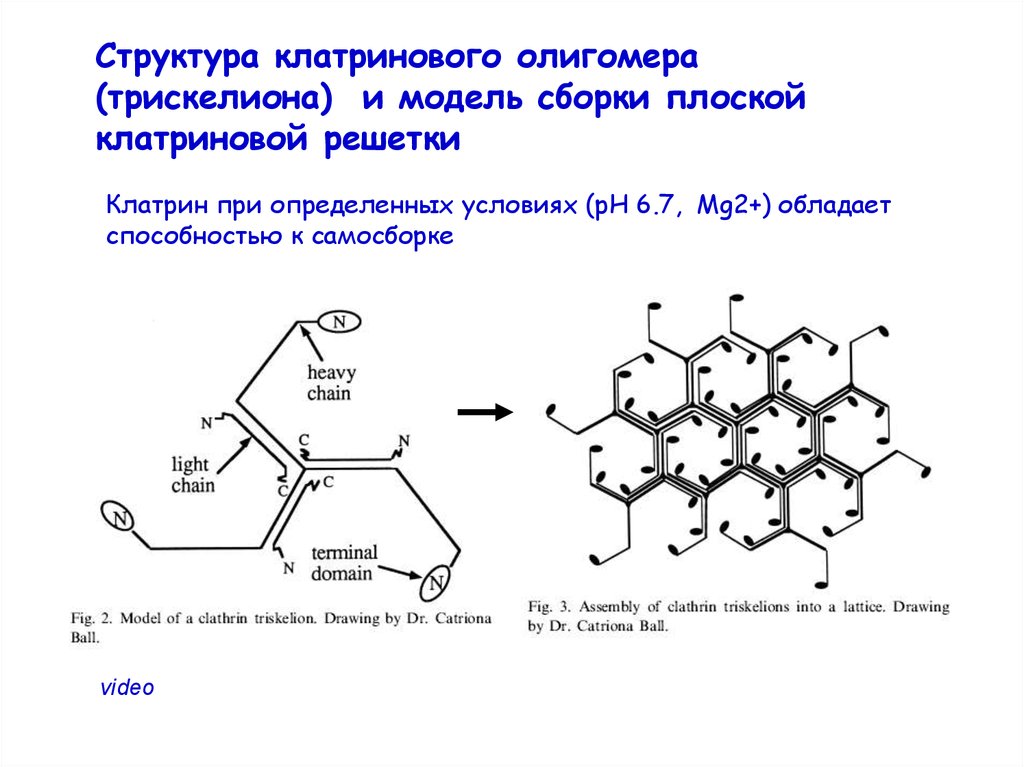
Структура клатринового олигомера(трискелиона) и модель сборки плоской
клатриновой решетки
Клатрин при определенных условиях (рН 6.7, Mg2+) обладает
способностью к самосборке
video
19.
Плоские решетки, повсей видимости, играютроль сортирующих
платформ в эндосомах и
ассоциируются с
мембраной через
HRS/SNX
Cемейство SNX (sorting
nexins) сод. около 30
членов,
способны взаимодействовать
с клатрином и с
определенными рецепторами
HRS –взаимодействует с
клатрином и с PI3фосфатом на мембране,
узнает ТК рецепторы
Окаймленные
ямки
20.
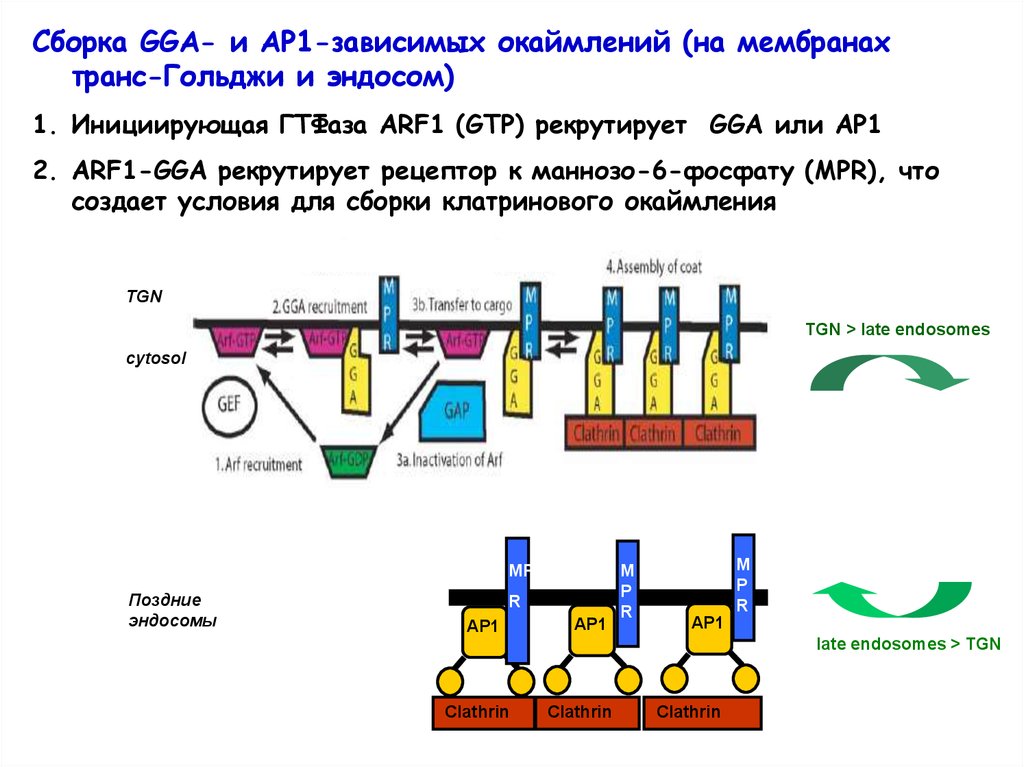
Сборка GGA- и AP1-зависимых окаймлений (на мембранахтранс-Гольджи и эндосом)
1. Инициирующая ГТФаза ARF1 (GTP) рекрутирует GGA или АР1
2. ARF1-GGA рекрутирует рецептор к маннозо-6-фосфату (MPR), что
создает условия для сборки клатринового окаймления
TGN
TGN > late endosomes
cytosol
MP
Поздние
эндосомы
R
AP1
AP1
M
P
R
M
P
R
AP1
late endosomes > TGN
Clathrin
Clathrin
Clathrin
21.
AP3 - гомологичен другим АР-окаймлениям, ноработает без клатрина
Осуществляет непосредственный транспорт лизосомных белков из
TGN в вакуоль (лизосомы). Эндосомы?
1. ARF1 инициирует сборку
2. Нуклеация – казеин-киназа1 (csk1) фосфорилирует 3субъединицу АР3
3. Сборка окаймления, рекрутирование груза
GEF
AP3
ARF1
csk1
AP3
AP3
AP3
AP3
22.
AP-2 окаймление работает на ПМ, с егопомощью идет рецептор-опосредованный
эндоцитоз
Наиболее сложно организовано:
через него осуществляется контакт клетки с
внешней средой
под ПМ имеется слой кортикального актина,
затрудняющий инвагинирование мембраны
1.Основные компоненты: АР2+клатрин
2.Неизвестна инициирующая малая ГТФаза
3.Несколько способов селектирования груза (поскольку груз
весьма разнообразен)
23.
Как инициируется сборка АР-2 окаймления?1. Сборку инициируют рецепторы-грузы
Но: в одни и те же ямки могут попадать рецепторы
различной природы (метаболические и сигнальные)
2. Сборка идет конститутивно
Фибробласты : 2-3 тыс ОЯ/мин
Оказалось, что на мембране существуют области, «разрешенные» для
формирования окаймленных ямок, именно в пределах такой области и
может инициироваться сборка новых окаймлений
Большую роль в стабилизации «зон эндоцитоза» играет актиновый
цитоскелет
На роль инициаторов претендуют PI(4,5) P2 и
синаптотагмин
24.
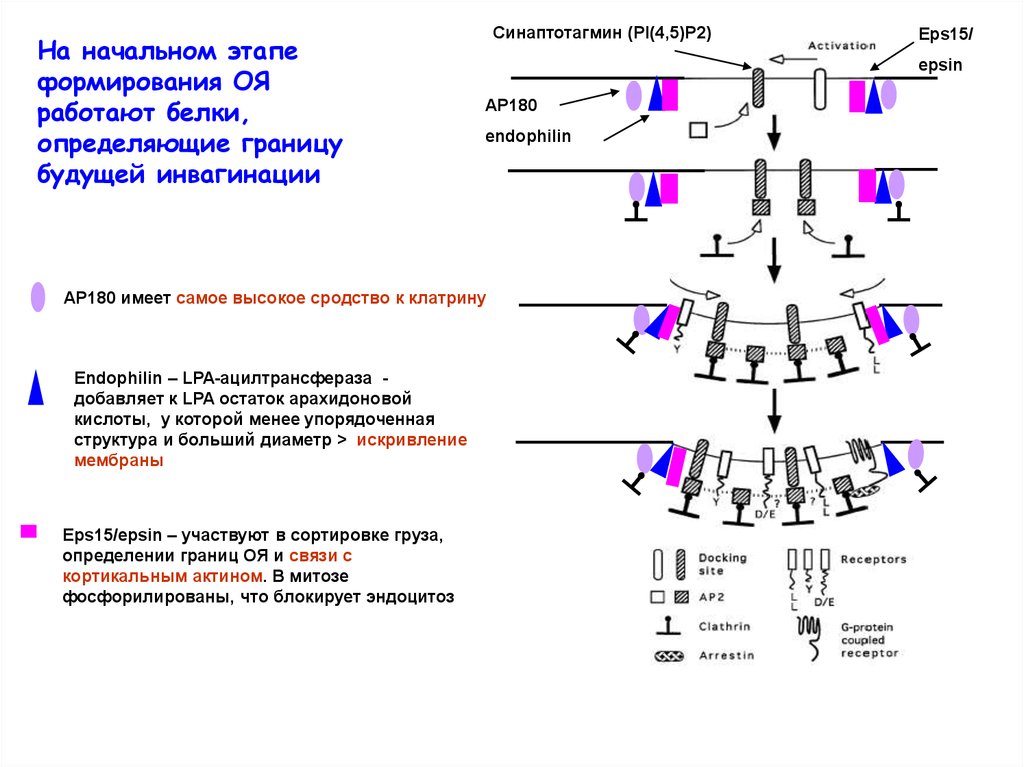
На начальном этапеформирования ОЯ
работают белки,
определяющие границу
будущей инвагинации
Синаптотагмин (PI(4,5)P2)
epsin
AP180
endophilin
AP180 имеет самое высокое сродство к клатрину
Endophilin – LPA-ацилтрансфераза добавляет к LPA остаток арахидоновой
кислоты, у которой менее упорядоченная
структура и больший диаметр > искривление
мембраны
Eps15/epsin – участвуют в сортировке груза,
определении границ ОЯ и связи с
кортикальным актином. В митозе
фосфорилированы, что блокирует эндоцитоз
Eps15/
25.
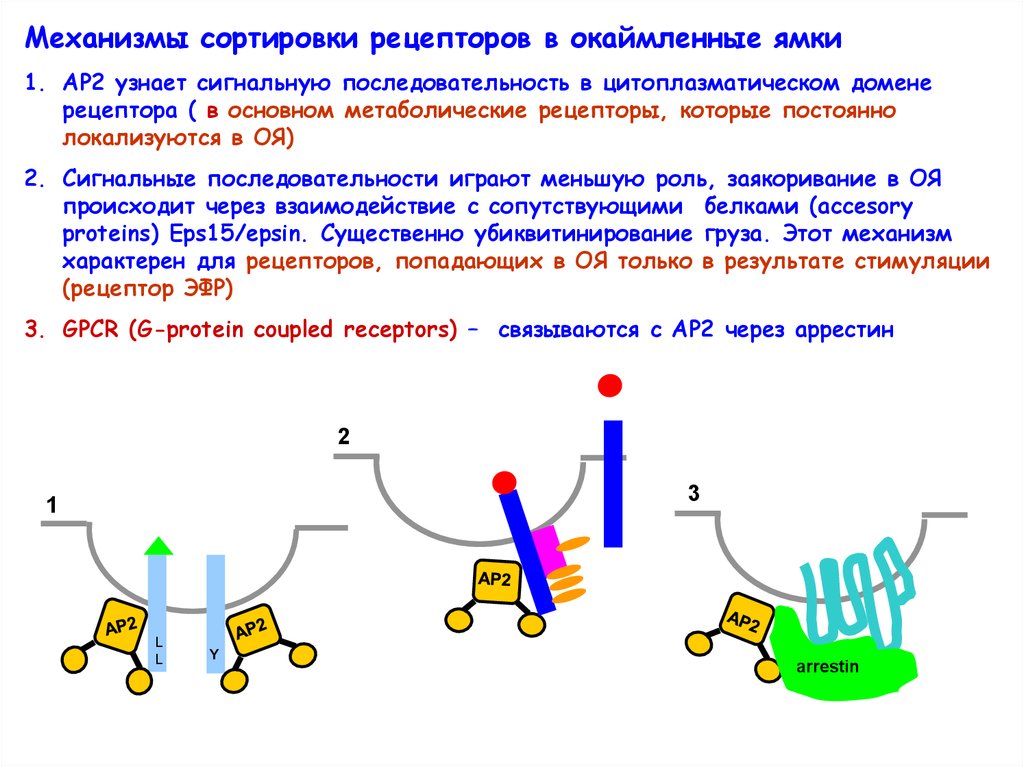
Механизмы сортировки рецепторов в окаймленные ямки1. АР2 узнает сигнальную последовательность в цитоплазматическом домене
рецептора ( в основном метаболические рецепторы, которые постоянно
локализуются в ОЯ)
2. Сигнальные последовательности играют меньшую роль, заякоривание в ОЯ
происходит через взаимодействие с сопутствующими белками (accesory
proteins) Eps15/epsin. Существенно убиквитинирование груза. Этот механизм
характерен для рецепторов, попадающих в ОЯ только в результате стимуляции
(рецептор ЭФР)
3. GPCR (G-protein coupled receptors) – связываются с АР2 через аррестин
2
3
1
L
L
Y
arrestin
26.
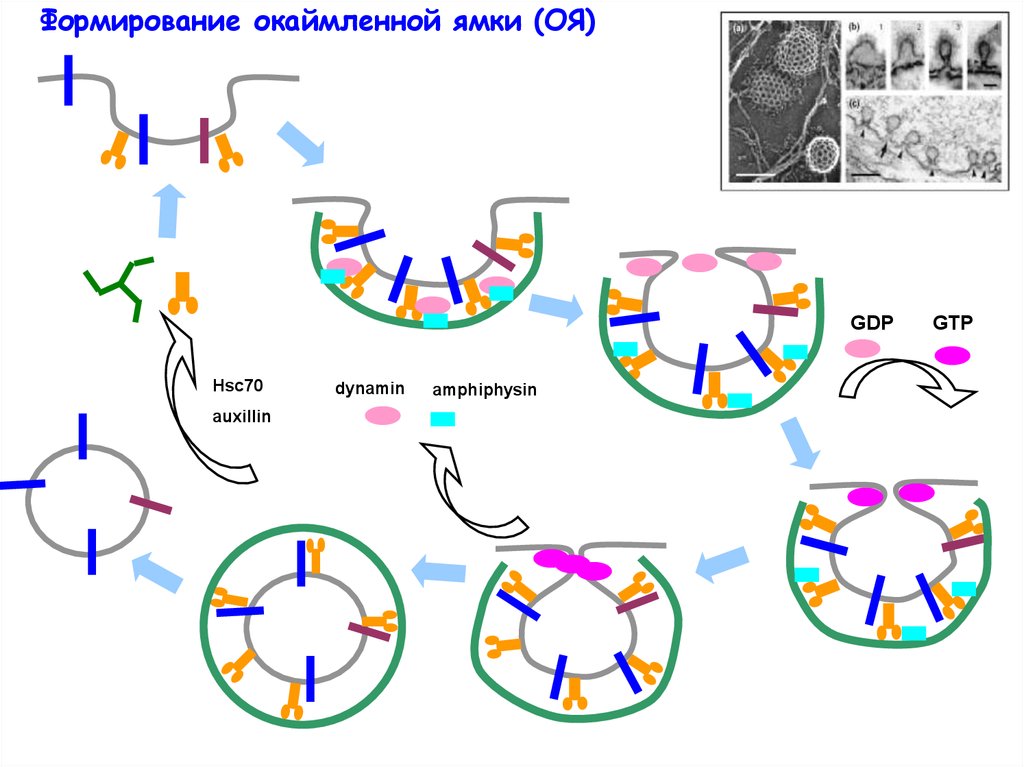
Формирование окаймленной ямки (ОЯ)GDP
Hsc70
auxillin
dynamin
amphiphysin
GTP
27.
Dynamin –атипичная ГТФаза (100 кДа)Обладает высокой скоростью гидролиза ГТФ
Поскольку концентрация
ГТФ в клетке очень
высока (1 mM), то динамин
д.бы в основном
находиться в ГТФ-св.
форме. Но это не так ,
поскольку
осуществляется
регуляция обмена
нуклеотидов на динамине.
GED-домен – это внутренний GEF,
активирующийся при полимеризации
(выстраивании молекул динамина в спираль)
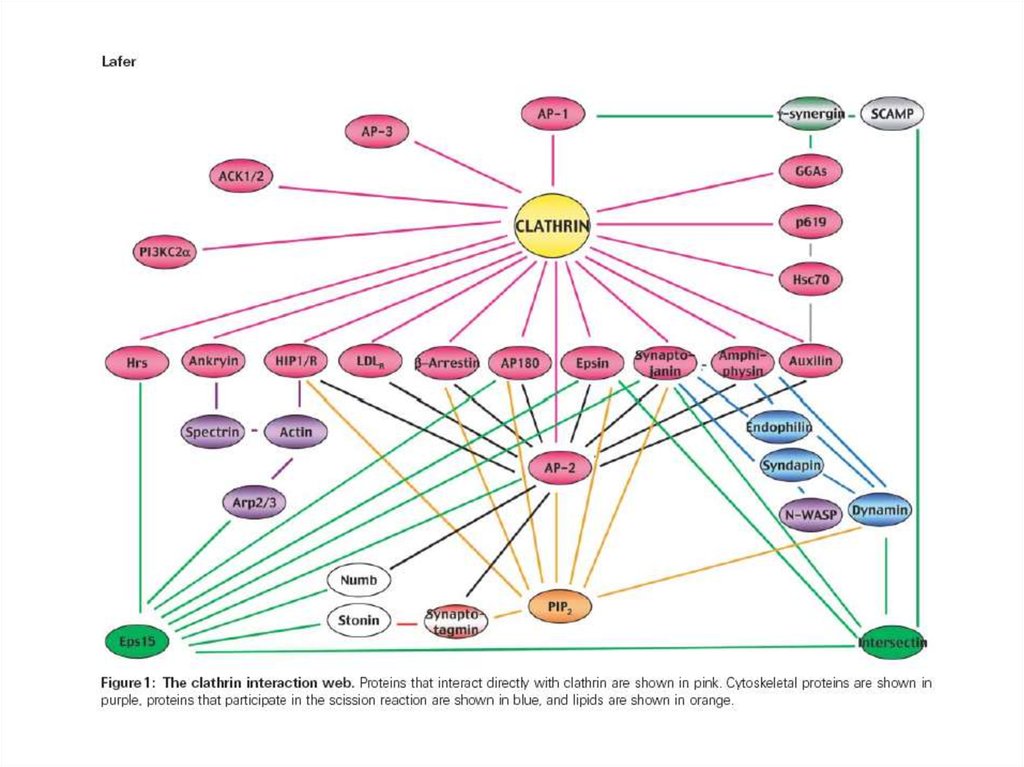
Динамин способен взаимодействовать с множеством белков
28.
Цепочки динамина способны формировать спирали вокруглипидных (и белковых) тубул, шаг спирали зависит от
связанного нуклеотида
GTP S
GDP
29.
Существует несколько изоформдинамина (Dyn 1, 2, 3), Dyn 1 /2
участвуют в работе окаймлений
(клатриновых и кавеолиноых),
Dyn 3 «занимается» тубуляцией
(Т-система скелетных мышц)
30.
Формирование и разборка АР-2 окаймления – процесс, в ходекоторого взаимодействия разных элементов ОЯ друг с другом
происходят в строгой очередности
Как идет его «оркестровка»?
31.
32.
33.
По-видимому, большинство белков в клетках выполняютболее чем одну функцию (уже известную нам),
другая (или другие) может оказаться весьма неожиданной
Nucleocytoplasmic Shuttling of Endocytic Proteins
M. Vecchi, S. Polo, V. Poupon, J.-W. van de Loo, A.Benmerah, P. P. Di Fiore*
The Journal of Cell Biology, Volume 153, Number 7, June 25, 2001 1511–1517
Evidence that dynamin-2 functions as signal-transducing GTPase.
Fish KN, Schmid SL, Damke H:
J Cell Biol 2000, 150:145-154.
Eps15, epsin , -adaptin
накапливаются в ядре, если
блокирован ядерный экспорт.
Ядерный пул этих белков никак
не участвует в эндоцитозе
Динамин участвует в сигналинге:
он способен активировать
транскрипционный фактор р53,
стимулируя апоптоз
The role of dynamin-related protein 1, a mediator of mitochondrial fission, in apoptosis.
Frank S, Gaume B, Bergmann-Leitner ES, Leitner WW, Robert EG,• Catez F, Smith CL, Youle RJ:
Dev Cell 2001,4:515-525.




















 biology
biology