Similar presentations:
Механизмы регуляции пролиферативных процессов клетках
1. ТЕМА 3 МЕХАНИЗМЫ РЕГУЛЯЦИИ ПРОЛИФЕРАТИВНЫХ ПРОЦЕССОВ
2. 1. Общая характеристика системы регуляции
• На деление клеток могут действовать самые разные факторы: биогенныеи абиогенные, химические и физические, непосредственные и
опосредованные, стимуляторы и ингибиторы:
– влияющие на синтез нуклеотидов, ДНК, РНК, белков;
– влияющие на синтез и накопление АТФ (энергетический «резервуар»
митоза), особенно ингибиторы гликолиза и дыхания;
– влияющие на формирование митотического веретена.
• Это могут быть неспецифические факторы, модифицирующие цикл, часто
побочные (температура, оксигенация, токсины и др.).
• Нас интересуют здесь специфические регуляторные факторы, специально
предназначенные для управления клеточным циклом.
Очевидно, что в гистогенезах изменения параметров
цикла, задержки в G0, выход в дифференцировку –
это отражение действия каких-то регулирующих
факторов.
• Действие таких регуляторов возможно в точках
повышенной чувствительности (точка r, check points)
клеточного цикла.
3.
• Механизм регуляции клеточного размножения – системный.Он состоит из многих параллельных и, в то же время, иерархичных звеньев
регуляции. У многоклеточных животных (наиболее сложная система) он
включает следующие уровни регуляции:
1) Клеточные регуляторы: ядерные (генетические), цитоплазматические
(вторичные мессенджеры), мембранные (рецепторы);
2) Организменные регуляторы: гуморальные местные, тканеспецифические
(факторы роста, ингибиторы), гуморальные дистантные, ткане- и видонеспецифические (гормоны – стимуляторы и ингибиторы), нервные, от
ЦНС через гипоталамус на аденогипофиз и далее на местные
эндокринные железы;
3) Средовые регуляторы: через ЦНС, непосредственные абиотические,
модифицирующие (тепло и др.).
4.
• NB: На разных уровнях регуляции есть как стимуляторы (+), так иингибиторы (-).
Давно существовало 2 противоположных взгляда на сам принцип
регуляции митозов:
• Митогенная регуляция:
нормальное состояние клетки – покоящееся, а для деления
необходимы стимуляторы, митогены.
• Ингибиторная регуляция:
нормальное состояние клетки – непрерывная пролиферация, которая
ограничивается ингибиторами.
• Что верно? Или все сложнее?
5. 2. Доказательства генетического контроля цикла
• Установлено, что последовательность фаз митотического цикла (-G1-SG2-M-) контролируется периодической активностью определенныхгенов.
В крайнем выражении эта закономерность известна как принцип
домино: очередной ген включается продуктами предыдущего гена.
• Доказательства генетического контроля цикла складывались из
разных фактов, экспериментов: цитологических, биохимических,
генетических.
2.1. Опыты по слиянию клеток HeLa
Разработаны методы гибридизации (слияния) клеток. Получение
гетерокарионов – клеток с различающимися ядрами.
Объединяли гомологичные однолинейные клетки (культура HeLa), но
находящиеся в разных фазах митотического цикла (гетерофазные
клетки).
• Показали наличие фазово-специфических индукторов и ингибиторов
митотического цикла.
6.
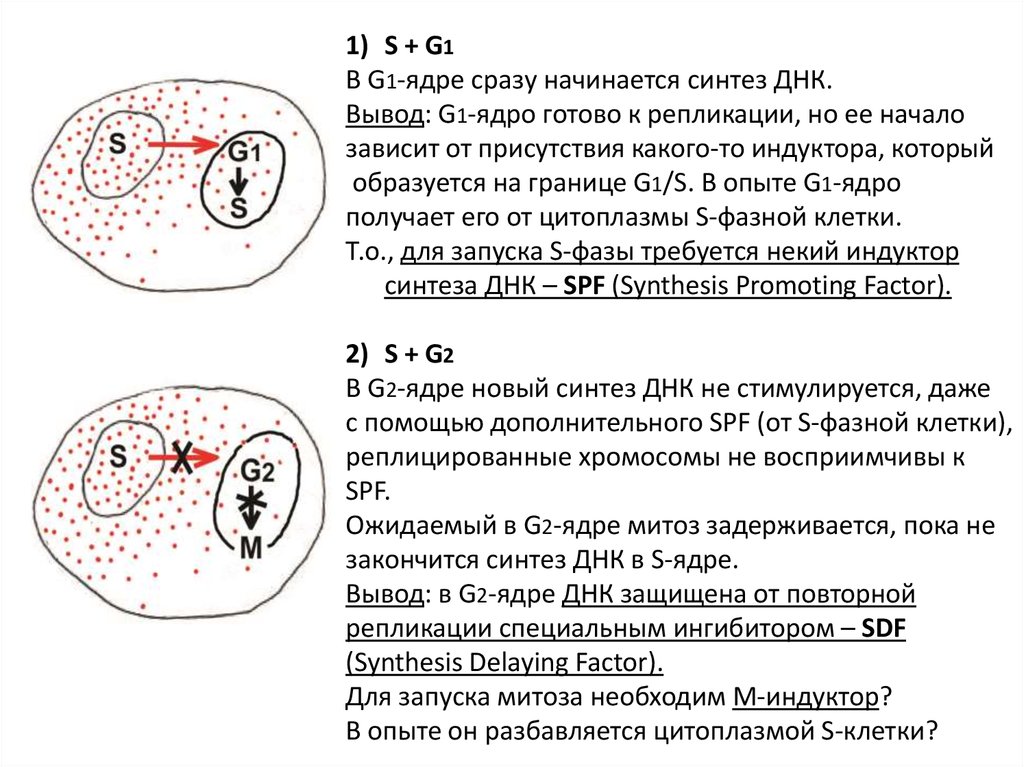
1) S + G1В G1-ядре сразу начинается синтез ДНК.
Вывод: G1-ядро готово к репликации, но ее начало
зависит от присутствия какого-то индуктора, который
образуется на границе G1/S. В опыте G1-ядро
получает его от цитоплазмы S-фазной клетки.
Т.о., для запуска S-фазы требуется некий индуктор
синтеза ДНК – SPF (Synthesis Promoting Factor).
2) S + G2
В G2-ядре новый синтез ДНК не стимулируется, даже
с помощью дополнительного SPF (от S-фазной клетки),
реплицированные хромосомы не восприимчивы к
SPF.
Ожидаемый в G2-ядре митоз задерживается, пока не
закончится синтез ДНК в S-ядре.
Вывод: в G2-ядре ДНК защищена от повторной
репликации специальным ингибитором – SDF
(Synthesis Delaying Factor).
Для запуска митоза необходим М-индуктор?
В опыте он разбавляется цитоплазмой S-клетки?
7.
3) G1, S, G2 + MВ интерфазном ядре начинается
преждевременное разрушение ядерной
оболочки и конденсация хромосом (инициация
митоза, наиболее полная в G2-ядре).
Вывод: в цитоплазме М-клетки присутствует в
высокой концентрации некий индуктор митоза –
MPF (Mitosis Promoting Factor).
(по: Ченцов, 2004)
8.
4) G1 + G2G1-ядро проходит цикл по графику,
в G2-ядре блокируется начало митоза.
Вывод: митоз начинается лишь при критическом
уровне MPF (в опыте он разбавляется G1-клетой).
Возможно также присутствие в цитоплазме
сигнала задержки митоза – MDF (Mitosis Delaying
Factor). (Показана задержка митоза избытком
одноцепочечной ДНК).
Т.о., смена периодов митотического цикла контролируется выработкой и
накоплением в определенных концентрациях специальных индукторов
и ингибиторов цикла:
- SPF – активатор синтеза ДНК,
- SDF – S-задерживающий фактор,
- MPF – М-стимулирующий фактор,
- MDF – М-задерживающий фактор.
• Регулярная смена этих факторов в цитоплазме и кариоплазме
разграничивает ряд событий хромосомного цикла, предотвращая
неувязки (вроде конденсации хромосом посреди S-фазы или повторной
репликации перед митозом).
• Каковы же природа и происхождение этих факторов?
9.
2.2. Опыты по ингибированию синтезов РНК и белка в цикле –ингибиторный анализ для выявления возможной роли РНК и белков в
регуляции митотического цикла (Епифанова, 1973).
Опыты на клеточных культурах, синхронизированных по циклу.
Синтезы РНК и белков блокировали соответствующими ингибиторами:
- ингибитор синтеза РНК – антибиотик актиномицин D (связывается с
ДНК и блокирует транскрипцию).
- ингибитор синтеза белка – пуромицин (блокировка связи мРНКтРНК) или циклогексимид (блок мРНК-рибосома).
Ингибиторы добавляли в культуру в точно известное время до
ожидаемого наступления S-периода или митоза и регистрировали
время наступления их задержки.
10.
Результат 1. Запуск S-периода.Если перед самым началом ожидаемого S-периода блокировать синтез
белков, то репликация ДНК не наступает (даже кратковременная
блокада задерживает начало S). Блокада синтеза РНК эффективна на
более ранних сроках (1 ч до начала S и раньше).
Следовательно, для инициации репликации ДНК необходимо:
(1) перед самым началом S-периода – синтез какого-то белка, это SPF;
(2) мРНК для этого синтезируется за 1-2 ч до начала S;
(3) рРНК для рибосом, обеспечивающих этот синтез белка, образуется
раньше, в G2-периоде предыдущего цикла.
11.
Результат 2. Запуск митоза.Аналогично, блокада синтезов белка и РНК в G2-периоде, перед митозом,
приводила к его задержке или полной остановке.
Т.о., показано, что для инициации митоза необходимы:
синтез белка – MPF, который происходит в G2-периоде за 10-30 мин
до митоза;
синтез мРНК для этого MPF – за 1-2 ч до митоза;
синтез рРНК – за 2-3 ч до митоза.
12.
Т.о., ингибиторный анализ показал, что:1) индукторы SPF и MPF вырабатываются самой клеткой, это
собственные, внутриклеточные регуляторы митотического цикла;
2) это белки, а значит – продукты определенных генов – регуляторов
цикла;
3) активация и экспрессия регуляторных генов цикла происходит
непосредственно перед началом контролируемого процесса –
S-фазы или митоза.
NB:
Начало S-периода и запуск митоза – две важнейшие контрольные точки
(check points), имеющие генетическое управление.
Существуют ли другие контрольные точки и контролирующие их гены?
Существует ли «система домино», управляющая клеточным циклом?
13.
2.3. Генетические доказательства генной регуляции цикла. Генноесемейство Сdc
Лучшее доказательство генной регуляции того или иного процесса (или
структуры) – найти в природе мутации этого процесса (структуры).
У различных эукариот обнаружены циклоспецифические мутанты.
Дрожжи.
На дрожжах началось систематическое изучение генетики размножения
клеток. Большой вклад внесли исследования лаборатории Hartwell’а
(1968 – 1978, 1995 гг.).
Дрожжи имеют продолжительную гаплоидную стадию в жизненном
цикле (связано с мейозом, образованием спор), что способствует
выявлению рецессивных мутаций.
У дрожжей выявлено около 50 фенотипических мутаций по дефектам
клеточного (митотического) цикла. Это значит, что не менее 50 генов
управляют циклом.
Это семейство генов обозначено как гены cdc – cell division cycle.
14.
В делении дрожжей различимы 3 относительно независимых цикла (как и удругих эукариот), и каждый из них имеет несколько мутаций (значит,
управляется несколькими генами). Ниже показаны только некоторые из них.
Стартовую точку и следующий митоз запускает ген cdc 28 (у почкующихся
дрожжей) или его гомолог cdc 2 (у делящихся дрожжей).
Синтез ДНК инициирует ген cdc 8 (в хромосомном цикле).
Репродукция центриолей (у дрожжей – внутриядерные ЦОМТы) зависит от
гена cdc 31 (в центросомном цикле).
При подготовке деления (почкования) ядра активен cdc 24, телофазу и
цитокинез контролирует cdc 15 (в цитокинетическом цикле) и т.д..
15.
Клетки млекопитающих.В различных клеточных культурах выявлены циклоспецифические
мутации, гомологичные cdc-мутациям дрожжей.
При нормальной температуре (37°) клетки делятся нормально. Но при
пониженной (34°) или повышенной (39°) температуре клетки
останавливаются в той или иной стадии цикла: возможны блок
цитокинеза, блок анафазы, блок распада ядерной оболочки, блок
перехода G1/S и другие. Значит, все эти процессы контролируются
определенными генами.
Известно более 30 циклоспецифических мутантных
(температурочувствительных) линий клеток млекопитающих. Всего,
включая протоонкогены, определено более 100 генов, управляющих
клеточным (митотическим) циклом.
16. 3. Гены компетентности к циклу (раннего ответа)
Гены myc, fos, myb и др.Это ключевые гены пролиферации.
Под действием внешних факторов роста и гормонов (см. ниже), через
соответствующие цитоплазматические мессенджеры, эти гены
активируются и экспрессируют белки Myc, Fos, Myb, которые
активируют клетку к переходу G0/G1.
Клетка становится компетентной (способной) к митотическому циклу.
Т.о., гены компетентности работают в раннем пререпликативном
периоде. Соответствующие, белки Myc, Fos, Myb после синтеза
поступают из цитоплазмы (с рибосом) в ядро, где взаимодействуют с
хроматином и ядерным матриксом.
NB: англоязычные навания генов и белков принято писать по-разному:
гены – со строчной буквы курсивом (myc, fos, myb, cdc 8, cyclin D);
белки – с прописной буквы прямым шрифтом (Myc, Fos, Myb, Cyclin D), а
для многословных названий – аббревиатурой (семейство киназ CDK, киназы
Cdk1, Cdk2 …). Безымянные белки обозначают строчной буквой «p» (protein)
и массой в kD (p21, p34, p53 …)
17.
• В частности:• Семейство генов myc – кодирует белки,
ядерные фосфопротеиды (ок. 65 кД),
способные связываться с точками
«origin» ДНК и соединять их с ядерным
матриксом для подготовки ДНК к
репликации.
Транскрипция этих генов резко
активируется (в 20-30 раз!) через 1 ч
после стимуляции (из G0-состояния),
достигает пика через 3 ч и вскоре
снижается, задолго до начала S-периода.
(В опыте, под действием колоние-стимулирующего фактора (КСФ)
происходит быстрая экспрессия генов myc с угнетением цАМФ. Это
условие для выхода из G0 в цикл или дифференцировку).
• Ген fos продуцирует белок – тоже ядерный фосфопротеид (55 кД),
который еще раньше (через 15-20 мин после стимуляции)
связывается с ДНК и активирует гены типа myc, продукты которых
необходимы для запуска предстоящей репликации.
18.
• Т.о., работает каскад:ФР → Рецептор → Мессенджеры → fos →Fos → myc → Myc … → Origin
ДНК + матрикс.
Действие генов fos и myc кратковременно, это гены раннего
пререпликативного периода (раннего ответа), факторы приобретения
клеткой митотической компетентности.
• Далее, в клеточном ядре белки этого каскада принимают участие в
активации генов отложенного ответа – ранних G1-киназ и циклинов,
ответственных за переход из G1 в S-период (см. ниже).
NB: Ранний ответ генов fos, myc и др.
соответствует первому пику транскрипции
в реакции плейотипического ответа
покоящихся клеток (см. выше о периоде
покоя).
NB: Действие генов myc и fos, т.е. белков
Myc и Fos, кроме прочего, направлено на
инактивацию и разрушение белка покоя
р27. Но об этом ниже.
19. 4. Гены прогрессии цикла. Циклины и циклинзависимые киназы
• Для других генов – регуляторов митотического цикла установленовремя активности по ходу самого цикла. Мутации этих генов
останавливают соответствующие стадии цикла.
Это гены двух больших семейств – cdc (cell division cycle) и cyclin.
• Открытие генов семейства cdc связано с изучением
циклоспецифических мутантов дрожжей и культур клеток
млекопитающих (см. выше). Позже эти работы были сопоставлены с
открытием белкового фактора MPF в процессах созревания ооцитов и
дробления зиготы лягушки.
• Это интересная и драматичная история в изучении проблем
репродукции и дифференцировки клеток.
20.
В 1971 г. у лягушки выявлен MPF (maturation/mitotic promotion factor),запускающий в ооцитах деления созревания (мейоз), а также и митозы
первых делений дробления. В ооцитах MPF появлялся под действием
гормонального сигнала (прогестерона), так что это типичный эндогенный
регулятор, вырабатываемый самими ооцитами.
В дробящихся бластомерах активность MPF пульсирует: он появляется в
митозе и исчезает в интерфазе. При этом клетка совершает ритмические
сокращения, не зависящие от активности ядра. Сокращения сохранялись
при блокировании митоза, блокировании веретена, даже при удалении
ядра. Стало ясно, что в цитоплазме ооцита, зиготы, бластомеров работает
автономный осциллятор, колебательный цикл химических реакций
веществ, накопленных заранее (запас MPF или его мРНК).
21.
Так сформировались два конкурирующих (казалось – взаимоисключающих)представления о механизмах регуляции цикла:
• Механизм генного «домино», представляющий конвейер генетических
активностей семейства cdc, в котором каждый отработавший ген
включает следующий ген митотического цикла (на основе работ с
мутантными по циклу дрожжами и клеточными культурами).
• Механизм цитоплазматического осциллятора («часовой механизм»),
который заложен заранее и периодически включает весь комплекс
биохимических и структурных реакций митоза (на основе работ с
ооцитами лягушки и морских ежей).
Вскоре состоялся неожиданный синтез этих двух идей.
22.
• В 1980-х годах была установлена идентичность белков,инициирующих митоз в этих двух моделях:
(1) белка-продукта гена cdc-2, запускающего митоз у дрожжей, и
(2) одной из субъединиц MPF лягушки – белка p34, а также аналогичных
белков и генов у других животных, включая человека.
• Это оказалась одна и та же протеинкиназа – p34cdc-2 – фермент,
фосфорилирующий (при расщеплении АТФ) разнообразные белки,
участвующие в организации и течении митоза (см. ниже).
[Этим «золотым гвоздем» соединились две линии исследований, две,
казалось, альтернативные теории регуляции митотического цикла.]
• Вторая субъединица MPF была определена как белок-активатор
киназы и названа Cyclin B (циклин Б). То есть, киназа p34 работает
только в связке с циклином Б (гетеродимерная форма белка). Поэтому
безымянный до тех пор фермент класса протеинкиназ - p34 - получил
имя – Cdk1 (cyclin dependent kinaze 1 – циклин-зависимая киназа 1).
Cdk1 + Cyclin B = Cdk1/Cyclin B
Неактивные формы киназы и циклина = Активная димерная форма
23.
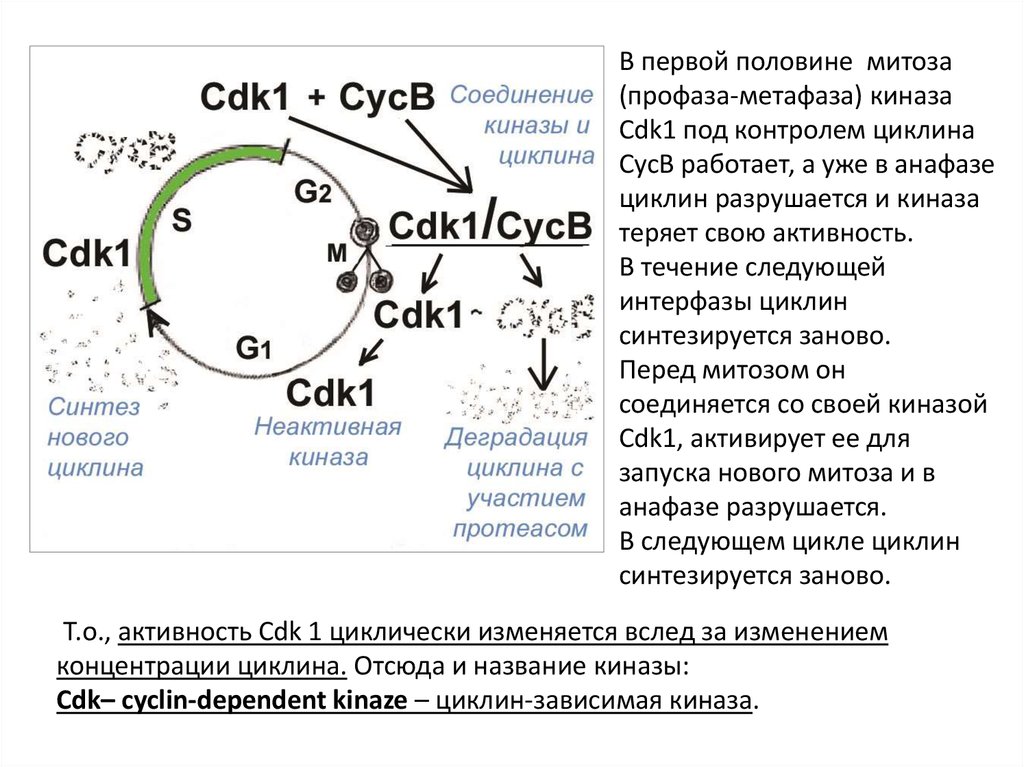
В первой половине митоза(профаза-метафаза) киназа
Cdk1 под контролем циклина
CycB работает, а уже в анафазе
циклин разрушается и киназа
теряет свою активность.
В течение следующей
интерфазы циклин
синтезируется заново.
Перед митозом он
соединяется со своей киназой
Cdk1, активирует ее для
запуска нового митоза и в
анафазе разрушается.
В следующем цикле циклин
синтезируется заново.
Т.о., активность Cdk 1 циклически изменяется вслед за изменением
концентрации циклина. Отсюда и название киназы:
Cdk– cyclin-dependent kinaze – циклин-зависимая киназа.
24.
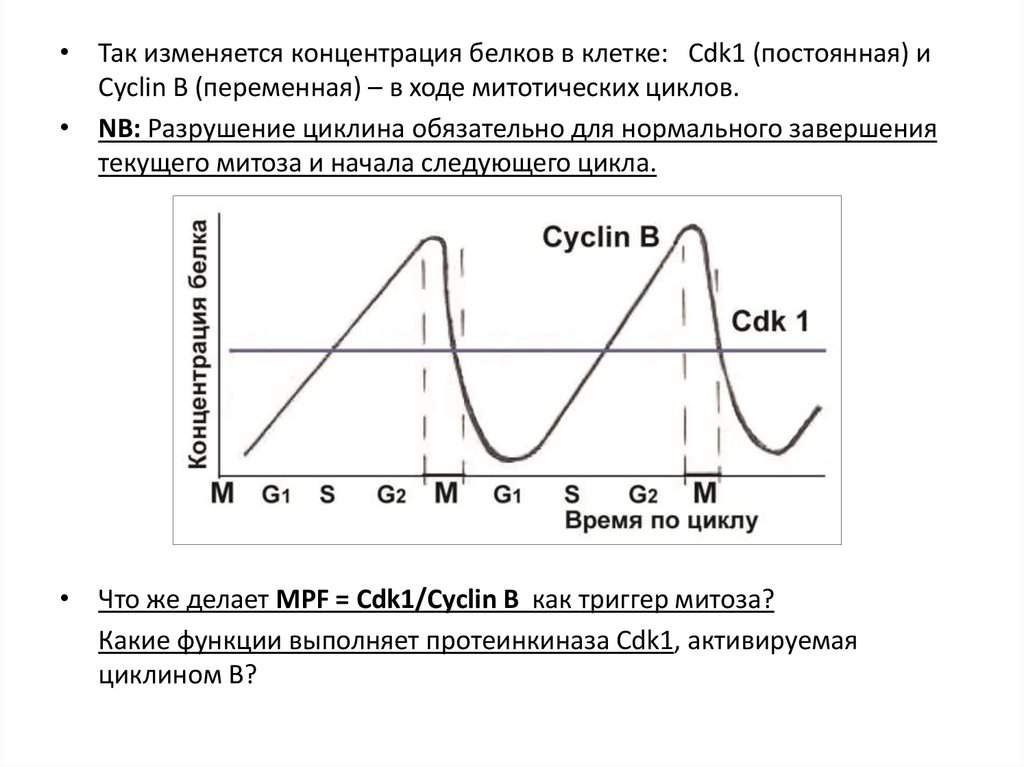
• Так изменяется концентрация белков в клетке: Cdk1 (постоянная) иCyclin B (переменная) – в ходе митотических циклов.
• NB: Разрушение циклина обязательно для нормального завершения
текущего митоза и начала следующего цикла.
• Что же делает MPF = Cdk1/Cyclin B как триггер митоза?
Какие функции выполняет протеинкиназа Cdk1, активируемая
циклином В?
25.
• Функции (активности) протеинкиназы Cdk1 в организации митоза:1) фосфорилирует ламины ядерной оболочки и, тем самым, инициирует
ее распад;
2) фосфорилирует белки конденсины и гистон Н1, способствуя
конденсации хромосом;
3) фосфорилирует центросомный белок р225, способствуя сборке
веретена;
4) активирует APC (anaphase promoting complex) – ферментная система,
которая
- разрушает белок когезин хромосомных связок, делая возможным
расхождение сестринских хроматид,
- запускает протеолитическую деградацию собственного циклина В
(убиквитинация и расщепление ферментами протеасом).
• Т.о., протеинкиназа Cdk1, активированная циклином В, после
выполнения работы по запуску митоза сама же инициирует распад
своего циклина и становится неактивной.
Эта реакция обеспечивает кратковременность действия MPF.
• Так был расшифрован митотический осциллятор – MPF.
26.
• Но, как и следовало ожидать, вскоре были открыты и другиеосцилляторы, стимулирующие переходы G1/S (SPF), S/G2 и всю
прогрессию интерфазы.
• Это тоже протеинкиназы, белки-ферменты семейства CDK (2, 4, 6…) –
продукты генов cdc, активируемые своими циклинами (A, C, D, E…).
Особенно важен SPF – комплекс Cdk2/Cyclin E,
обеспечивающий переход G1/S. Его функция –
фосфорилирование регуляторного белка pRb
(открыт как супрессор опухоли ретинобластомы,
но оказался универсальным супрессором любого
митотического цикла в точке перехода G1/S).
В активной (дефосфорилированной) форме pRb
блокирует фактор транскрипции E2F,
необходимый для синтеза белков, запускающих
и поддерживающих репликацию ДНК.
Т.о., фосфорилирование pRb с помощью киназы Cdk2 освобождает и
активирует фактор транскрипции E2F, разрешая начало синтеза ДНК.
• Транскрипционный фактор E2F поддерживает также синтез самого
циклина Е, обеспечивая поддержку репликации по всему S-периоду.
27.
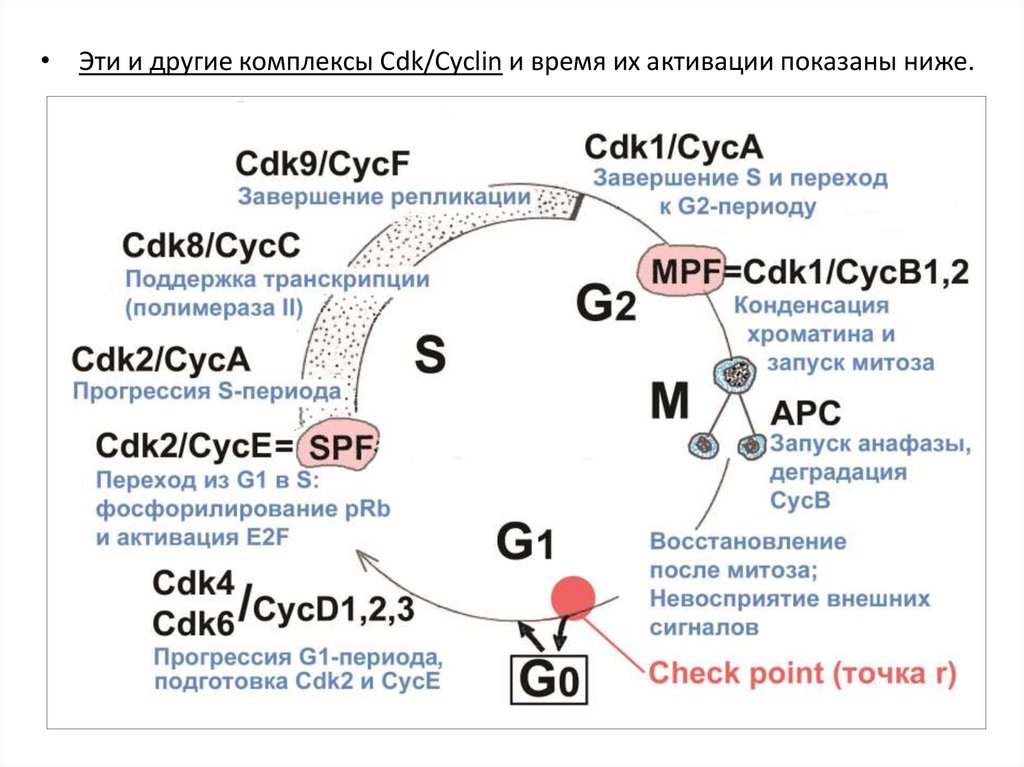
• Эти и другие комплексы Cdk/Cyclin и время их активации показаны ниже.28.
• NB:В раннем эмбриогенезе (дробление зиготы, бластула) работают в
чистом виде только 2 осциллятора: Cdk1/CycB (MPF) и Cdk2/CycE (SPF).
Работают независимо от ядра, без транскрипции, так как они (или их
иРНК) накоплены в цитоплазме в периоде роста ооцита, как и многие
другие регуляторы раннего эмбриогенеза.
Это простейший митотический цикл – без G1-периода, часто и без G2.
• В соматических клетках, начиная с гаструлы, включается
морфогенетическая (транскрипционная) функция ядер, начинает
работать вся система генетического контроля цикла.
У млекопитающих, по разным данным, это 7-12 видов Cdk и 9-14 видов
циклинов.
При этом одна киназа может работать с несколькими циклинами и
наоборот, так что регуляторный пул очень велик и многообразен.
Цикл удлиняется, появляются G1- и G0-периоды, необходимые для
исправления возникающих мутаций и ошибок репликации, а также для
ожидания сигналов к дифференцировке.
29. 5. Система контрольных точек и ингибиторы митотического цикла
• Т.о., события митотического цикла представляют взаимосвязаннуюцепь шагов: репликация ДНК, удвоение центросом и формирование
веретена, разрушение ядерной оболочки, компактизация и
разделение хромосом, цитокинез …
• При этом в нормальном цикле нарушение одной стадии обычно
приводит к задержке следующих стадий, хотя далее возможно
продолжение цикла с перескоком через стадию.
Например, если в температурочувствительных (ts) мутантах по ДНКполимеразе остановлена репликация ДНК, то и митоз, и цитокинез
останавливаются.
• Почему в этих условиях не активируется Cdk1/CyclinB, не собирается
веретено, не расходятся хромосомы?
• В начале 1990-х годов выдвинута гипотеза (Хартвел и др., 1989-92),
которая объясняло этот феномен.
30.
Гипотеза Хартвела:• В клетке существует контрольный механизм – система надзора за
митотическим циклом. Должны быть специальные ингибиторы
митотических киназ – CKI (cyclin kinaze inhibitor), которые
останавливают цикл, если предыдущий шаг не пройден.
• Это система контрольных точек (check point) – короткие остановки на
переходных стадиях цикла, в которых клетка с помощью специальных
молекулярных сенсоров оценивает состояние своих структур,
ферментов, ДНК на их готовность к дальнейшим шагам по циклу. Если
обнаруживаются нарушения, вырабатывается негативный сигнал и
цикл приостанавливается.
• Число контрольных точек, по-видимому, равно числу промоторов
Cdk/Cyclin. Сначала (дробление зиготы) активны 2 из них – для SPF и
MPF. Позже (гаструляция) включаются остальные (у Xenopus от стадии
800-клеточного зародыша). Включение контрольных точек и есть
реальная причина замедления циклов, появления G0-, G1-, G2задержек.
31.
• Наиболее важен и сложен р53-р21/Waf1-pRb–зависимый путь(опухолевой супрессии), который останавливает клетки на границе
G2/M и G1/S в случае нарушений репликации ДНК.
• При неполной или неправильной репликации, при повреждениях ДНК
(например радиацией) с помощью специальных сигнальных белков
(р19 и др.) активируется главный «сторож цикла» - белок р53 (фактор
транскрипции), который активирует промотор и запускает ген для
синтеза белка р21/Waf1 из семейства INK4 (от Inhibitor of Cdk). Этот р21
является универсальным ингибитором различных СD-киназ – подавляет
активность Cdk1 (=блок митоза) или Cdk2,4,6 (=блок G1/S) до устранения
разрывов и завершения репаративных синтезов ДНК.
Если ДНК не репарируется, р53 при достижении критической
концентрации стимулирует синтез каспаз и запускает апоптоз.
• Другой универсальный ингибитор CD-киназ – белок р27/Kip1 –
обеспечивает более стойкое и глубокое блокирование Cdk2,4,6 и
перевод клетки в период покоя G0. Преодоление этого блока,
разрушение р27, возможно с участием белков/генов компетентности
Mycmyc, Fosfos… (см. выше) под влиянием факторов роста и гормонов (см.
далее).
• Прочие ингибиторы цикла (CKI): из семейства KIP – р57; из семейства
INK4 – р15, р16, р18, р19.
32.
• NB: Транскрипционный фактор р53 участвует также в запуске синтезовмРНК (и, соответственно, белков), направляющих клетку в
дифференцировку. Так увязаны выход клеток из митотического цикла
и начало их тканевой специализации.
33.
• И еще одно важное NB:Все гены белков-стимуляторов и промоторов цикла (гены
компетентности, гены cdc, производящие киназы семейства CDK, гены
циклинов, гены соответствующих сигнальных путей и прочие)
являются протоонкогенами. Их повышенная экспрессия, например,
при случайной активации их промоторов или в результате
привнесения их мутированных форм вирусами, превращает эти
нормальные гены пролиферации в онкогены и ведет к постепенно
нарастающему, избыточному, опухолевому росту ткани.
• Соответственно, все гены белков-ингибиторов цикла (белков CKI,
особенно р53 – сторож цикла, pRb и др.) должны быть обозначены
как антионкогены, в онкологии это опухолевые супрессоры. Однако
их мутации, недостача, утрата в результате неправильного митоза –
тоже путь к опухолевой трансформации клеток, причем гораздо более
короткий и радикальный, чем накопление мутаций протоонкогенов.
Достаточно одной р53-дефицитной клетки, чтобы породить
мутантный клеточный клон и быстро растущую раковую опухоль.
• Но это отдельная большая тема, можно сказать, специальная медикобиологическая наука – онкобиология. Ее изучение за пределами
нашего спецкурса.
34. 6. Факторы роста
Сколько бы генов не было задействовано в обеспечении цикла даннойклетки, их регуляция идет извне.
Исторически идея стимуляции митозов развивалась через ряд теорий.
1. Теория митогенетических лучей (полей), испускаемых яйцеклеткой,
зиготой, зародышем (Гурвич, 1930-е годы).
2. Теория некрогормонов (1950-е годы), согласно которой поврежденные
клетки освобождают активные митогенные вещества – стимуляторы
пролиферации (некрогормоны, раневые гормоны). Это – продукты
распада белков или НК.
3. Современное представление о «факторах роста», которые совместно с
гормонами управляют размножением и дифференцировкой клеток.
Сегодня этой системе отводится центральная роль в организации роста
и морфогенезов.
35.
• Действие ФР в чистом виде можно изучать на клеточных культурах invitro, так как в организме (in vivo) это действие опосредовано и
скооперировано со всей системой регуляции.
• Давно известно, что для роста клеточных культур в искусственную
питательную среду необходимо добавлять 5-10% сыворотки крови,
лучше фетальной (эмбриональной, плодной). В ней содержатся
различные биогенные стимуляторы, которые и были названы
факторами роста. Для растительных культур это – соответствующие
гормоны роста (ауксины и др.).
Без этих факторов клетки не размножаются, переходят в G0-, реже в
G2-период.
36.
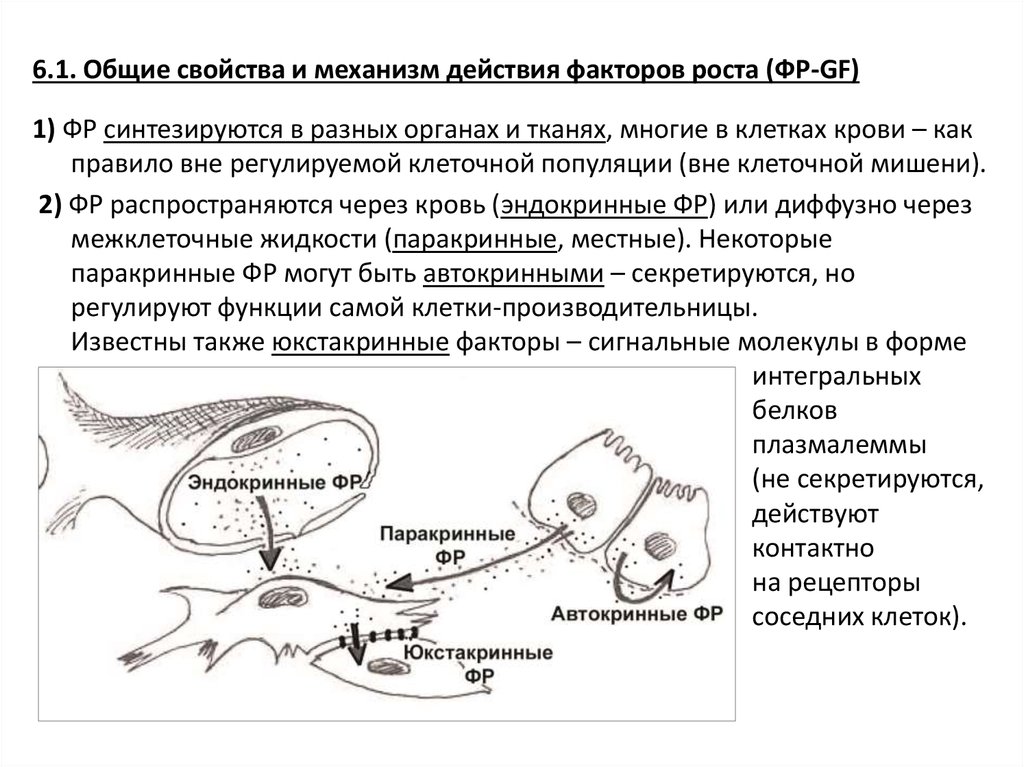
6.1. Общие свойства и механизм действия факторов роста (ФР-GF)1) ФР синтезируются в разных органах и тканях, многие в клетках крови – как
правило вне регулируемой клеточной популяции (вне клеточной мишени).
2) ФР распространяются через кровь (эндокринные ФР) или диффузно через
межклеточные жидкости (паракринные, местные). Некоторые
паракринные ФР могут быть автокринными – секретируются, но
регулируют функции самой клетки-производительницы.
Известны также юкстакринные факторы – сигнальные молекулы в форме
интегральных
белков
плазмалеммы
(не секретируются,
действуют
контактно
на рецепторы
соседних клеток).
37.
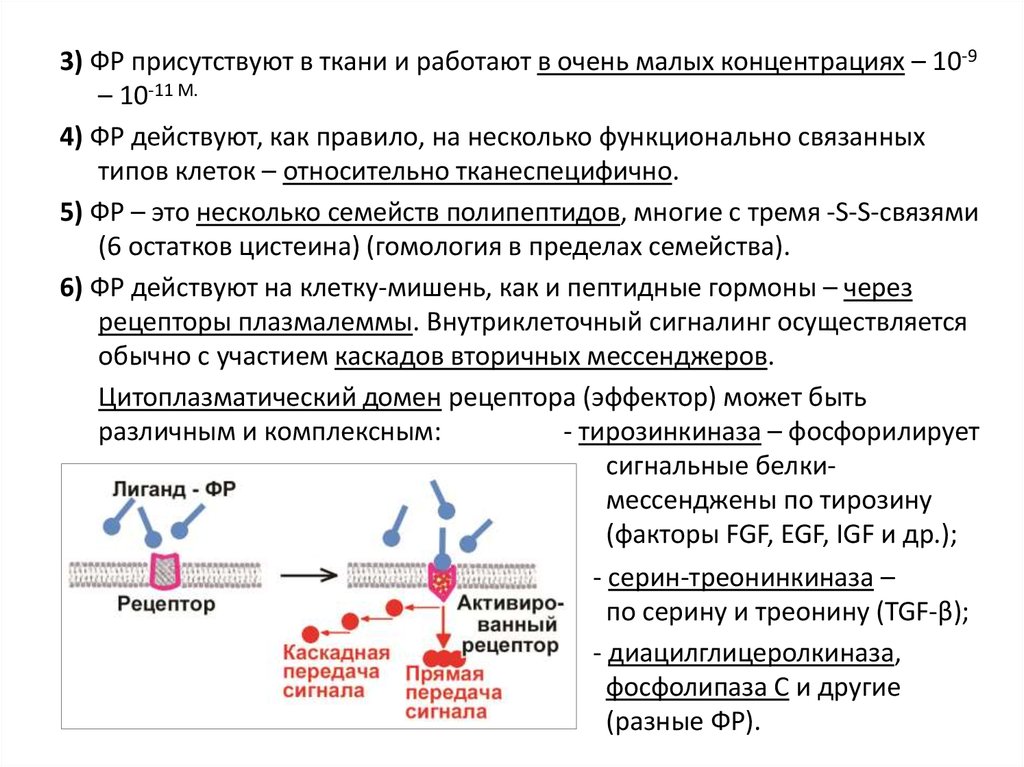
3) ФР присутствуют в ткани и работают в очень малых концентрациях – 10-9– 10-11 М.
4) ФР действуют, как правило, на несколько функционально связанных
типов клеток – относительно тканеспецифично.
5) ФР – это несколько семейств полипептидов, многие с тремя -S-S-связями
(6 остатков цистеина) (гомология в пределах семейства).
6) ФР действуют на клетку-мишень, как и пептидные гормоны – через
рецепторы плазмалеммы. Внутриклеточный сигналинг осуществляется
обычно с участием каскадов вторичных мессенджеров.
Цитоплазматический домен рецептора (эффектор) может быть
различным и комплексным:
- тирозинкиназа – фосфорилирует
сигнальные белкимессенджены по тирозину
(факторы FGF, EGF, IGF и др.);
- серин-треонинкиназа –
по серину и треонину (TGF-β);
- диацилглицеролкиназа,
фосфолипаза С и другие
(разные ФР).
38.
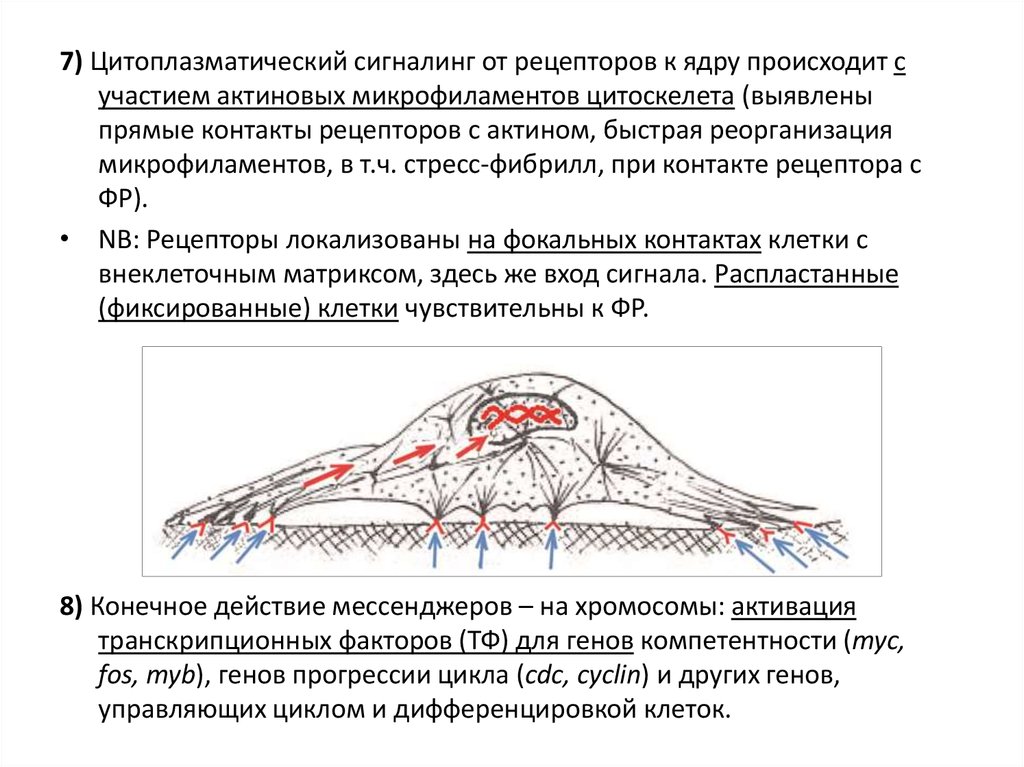
7) Цитоплазматический сигналинг от рецепторов к ядру происходит сучастием актиновых микрофиламентов цитоскелета (выявлены
прямые контакты рецепторов с актином, быстрая реорганизация
микрофиламентов, в т.ч. стресс-фибрилл, при контакте рецептора с
ФР).
• NB: Рецепторы локализованы на фокальных контактах клетки с
внеклеточным матриксом, здесь же вход сигнала. Распластанные
(фиксированные) клетки чувствительны к ФР.
8) Конечное действие мессенджеров – на хромосомы: активация
транскрипционных факторов (ТФ) для генов компетентности (myc,
fos, myb), генов прогрессии цикла (cdc, cyclin) и других генов,
управляющих циклом и дифференцировкой клеток.
39.
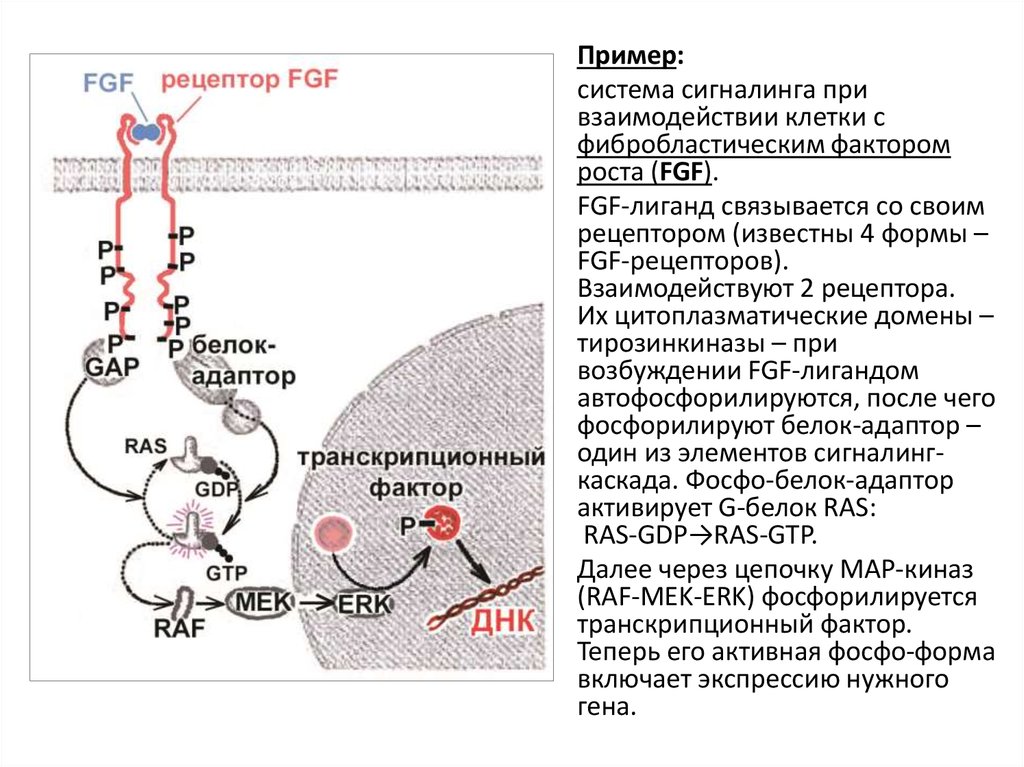
Пример:система сигналинга при
взаимодействии клетки с
фибробластическим фактором
роста (FGF).
FGF-лиганд связывается со своим
рецептором (известны 4 формы –
FGF-рецепторов).
Взаимодействуют 2 рецептора.
Их цитоплазматические домены –
тирозинкиназы – при
возбуждении FGF-лигандом
автофосфорилируются, после чего
фосфорилируют белок-адаптор –
один из элементов сигналингкаскада. Фосфо-белок-адаптор
активирует G-белок RAS:
RAS-GDP→RAS-GTP.
Далее через цепочку MAP-киназ
(RAF-MEK-ERK) фосфорилируется
транскрипционный фактор.
Теперь его активная фосфо-форма
включает экспрессию нужного
гена.
40.
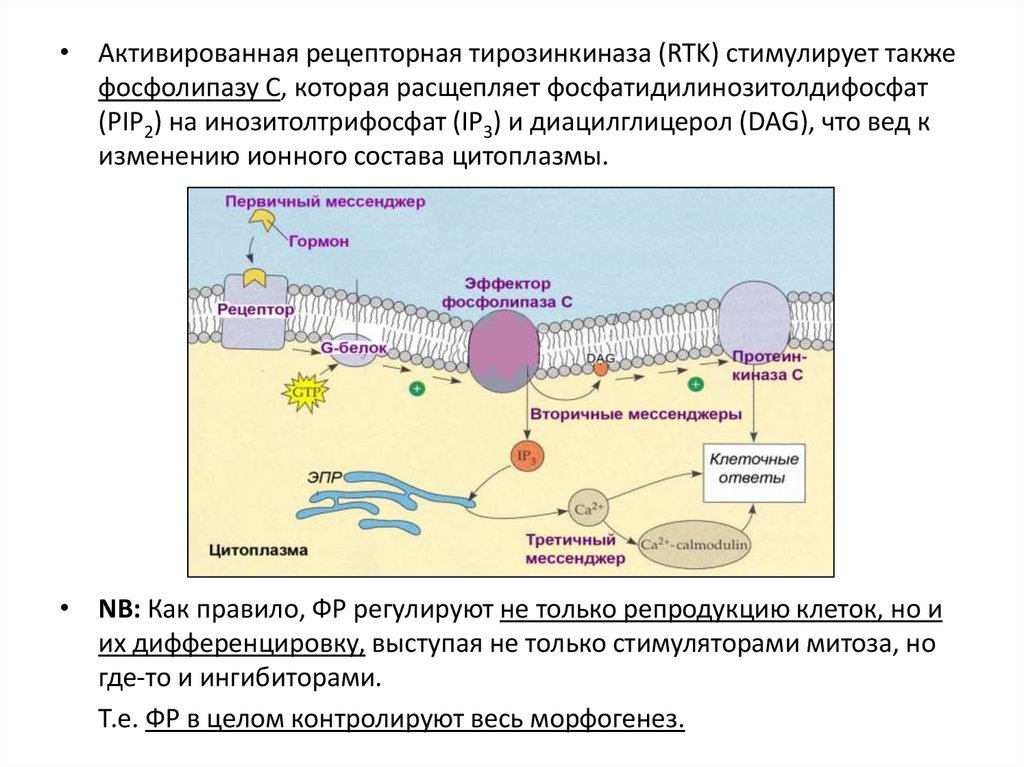
• Активированная рецепторная тирозинкиназа (RTK) стимулирует такжефосфолипазу С, которая расщепляет фосфатидилинозитолдифосфат
(PIP2) на инозитолтрифосфат (IP3) и диацилглицерол (DAG), что вед к
изменению ионного состава цитоплазмы.
• NB: Как правило, ФР регулируют не только репродукцию клеток, но и
их дифференцировку, выступая не только стимуляторами митоза, но
где-то и ингибиторами.
Т.е. ФР в целом контролируют весь морфогенез.
41.
6.2. Разнообразие факторов ростаИзвестны десятки семейств ФР (GF). Рассмотрим некоторые, наиболее
изученные у млекопитающих животных и человека.
1. EGF – Epidermal Growth Factor; = ЭФР – Эпидермальные ФР.
Полипептид из 53 аминокислот, включающий 6 остатков цистеина, т.е. 3 S-Sмостика. Сигналинг через тирозинкиназный эффектор, белок-адаптор и
цепочку киназ (как показано выше).
Основной источник: синтезируется и выделяется в кровь клетками протока
подчелюстной слюнной железы (здесь же ФРН – фактор роста нервов).
Мишени: деление эпидермоцитов, фибробластов дермы и др. клеток.
Дополнительный источник: клетки стромы
и теки яичника.
Мишень: клетки гранулёзы фолликулов.
Хороший пример взаимодействия
эпителия и соединительной ткани.
NB: ЭФР уже используется при
выращивании in vitro кожных пластов для
имплантации в заместительной терапии.
42.
2. PDGF – Plate Dependent Growth Factor; = ТФР – Тромбоцитарные ФР.Разновидности из 2 цепей по 125 (А) и 160 (В) аминокислот: АА, АВ, ВВ.
Источник: кровяные пластинки (тромбоциты).
Мишени: стимулируют размножение гладкомышечных клеток
поврежденных сосудов, а также фибробластов и нейроглии в очаге
повреждения (и в культуре).
NB: регулирует комплекс функционально связанных клеток.
3. FGF – Fibroblast Growth Factor; = ФРФ – Фибробластные ФР.
Название возникло от первого обнаруженного фактора этого семейства,
который стимулировал размножение культуры клеток фибробластов.
Это – обширное семейство FGF-белков, синтезируемых с соответствующих
генов fgf, насчитывающее много представителей (до 19 у
млекопитающих) и сотни изоформ от альтернативного сплайсинга.
Основные формы: FGF-1 – кислый, 140 аминокислот. FGF-2 – основный
(щелочной), 146 аминокислот.
Мишени: стимулируют размножение многих типов клеток, в основном из
мезенхимного ряда: фибробластов, эндотелия, миобластов,
мезенхимы, но также клеток тимуса, печени.
43.
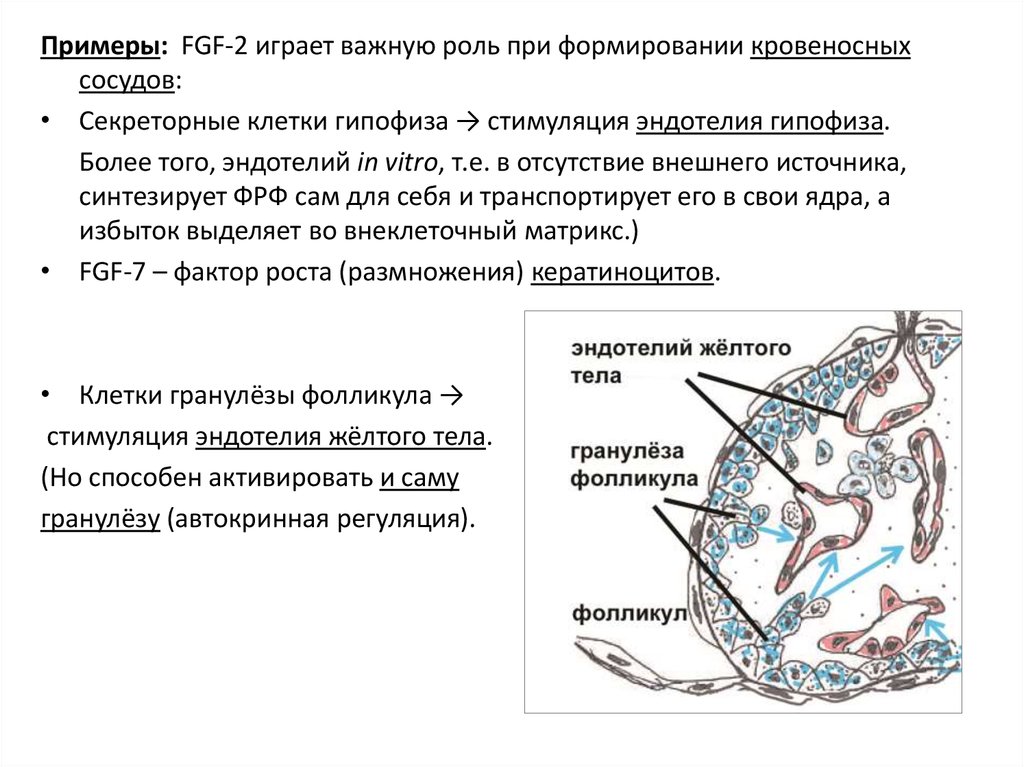
Примеры: FGF-2 играет важную роль при формировании кровеносныхсосудов:
• Секреторные клетки гипофиза → стимуляция эндотелия гипофиза.
Более того, эндотелий in vitro, т.е. в отсутствие внешнего источника,
синтезирует ФРФ сам для себя и транспортирует его в свои ядра, а
избыток выделяет во внеклеточный матрикс.)
• FGF-7 – фактор роста (размножения) кератиноцитов.
• Клетки гранулёзы фолликула →
стимуляция эндотелия жёлтого тела.
(Но способен активировать и саму
гранулёзу (автокринная регуляция).
44.
4. SDGF-1 – Spleen Dependent Growth Factor; = ФР из селезенки.Гомологичен с ФРФ.
Источник: клетки селезенки.
Мишени: стимулирует пролиферацию гепатоцитов, фибробластов,
эндотелия.
В целом стимулирует рост печени.
5. IGF-I, IGF-II – Insulin-like Growth Factor; = ИФР – Инсулиноподобный ФР.
2 основные формы – 70 и 73 аминокислот.
Действует совместно с ТФР и ЭФР.
Стимулирует размножение соединительно-тканных и жировых клеток.
6. Остеопоэтин.
Из клеток красного костного мозга.
Стимулирует пролиферацию остеобластов.
45.
7. Гемопоэтические ФР.Эритропоэтин.
Источник: юкстагломерулярные клетки почек. Мишень: эритробласты
(эритропоэз).
Гранулоцитопоэтин.
Источник: строма костного мозга. Мишень: миелоидные бласты (миелопоэз).
Тимопоэтин.
Источник: строма тимуса. Мишень: лимфобласты в тимусе.
Интерлейкины (цитокины) и лимфокины (колониестимулирующие факторы).
Участвуют в реакциях клеточного иммунитета, стимулируют размножение и
дифференцировку лимфоцитов.
8. TGF-α – Transforming Growth Factor-α; = ТФР-α – Трансформирующий ФР-α.
30% гомологии с ЭФР, содержит 6 остатков цистеина. Взаимодействует с теми
же рецепторами.
Выделен из раковых опухолей (т.е. из трансформированных клеток).
Но работает и в нормальном эмбриональном развитии: в клетках
плаценты, печени (стимулирует овальные стволовые клетки печени).
Т.е., TGF-α – нормальный ФР раннего развития и регенерации. В опухолях
активируется вторично.
46.
9. TGF-β – Transforming Growth Factor-β; = ТФР-β – Трансформирующий ФР-β.Большое семейство ФР. По свойствам близки к настоящим гормонам
(оказывают двойной эффект).
Усиливают или подавляют (для разных клеток по-разному) реакцию на другие
ростовые факторы, регулирует дифференцировку многих клеток.
В эмбриогенезе контролируют не только репродукцию, но также апоптоз и
миграцию клеток, дифференциацию мезодермы, нейронов, кишки.
Примеры:
- активирует рост ранне-эмбриональных фибробластов, но в позднеэмбриональных фибробластах и многих эпителиях ингибирует G0-G1переход и способствует их дифференцировке;
- в фолликулах яичника ТФР-β
синтезируется клетками теки и
ингибирует пролиферацию клеток
гранулёзы, одновременно усиливая
ее чувствительность к ФСГ и
способствует дифференцировке в
желтое тело (паракринный механизм
регуляции).
47.
10. SDGF – Shwannomous Dependent Growth Factor – ФР из шванномы.Еще один пример гормоноподобного (двойственного) действия ФР.
Является митогеном (стимулятором размножения) нейроглии и
фибробластов оболочек нервов. Но одновременно индуцирует
дифференцировку нейронов и образование их аксонов (индуцирует
синтез мРНК и специальных белков для роста аксонов).
…………………………………
• В целом, факторы роста в разных условиях, концентрациях и
комбинациях могут работать и как стимуляторы, и как ингибиторы
пролиферации, управляя ростом и специализацией зачатков, тканей,
органов.
• Тканеспецифичность факторов роста тоже относительна, как и у
гормонов. Клетки реагируют, как правило, не на один ФР, а на
специфическую комбинацию ФР и гормонов.
• Разнообразие ФР не так велико, но комбинаций очень много – на
разные типы клеточной спецификации (дифференцировки).
48.
6.3. Факторы роста препятствуют старению и гибели клетокДля многих клеток в культуре установлен «лимит Хэйфлика» (Hayflick,
1965) – ограничение на максимальное число делений, после которого
культура отмирает (= репликативное старение клеток).
• Фибробласты от плода человека переживают до 50 пассажей, т.е.
удвоений популяции;
• Фибробласты от 40-летнего человека –
до 40 пассажей;
• Фибробласты от 80-летнего человека –
до 30 пассажей.
(NB: потенциальный возраст истощения соединительных тканей человека
– 200 лет).
Оказалось, что старение клеток и отмирание культуры ускоряется при
недостатке ФР и, наоборот, замедляется при их избытке.
Примеры:
49.
• Культура эпидермиса ребенка на обычной среде с сывороткой дает 50циклов удвоения, но в присутствии избытка ЭФР – 150 циклов.
• «Бессмертные» клетки перевиваемой линии 3Т3 при недостатке в
среде факторов роста все же проявляют признаки старения.
(ФР поддерживают активность теломеразных генов?)
• Клетки эмбриона мыши на обычной среде с сывороткой тоже дают
ограниченное число поколений, а в присутствии очищенных ФР
(вместо сыворотки) растут без признаков старения. Но при
добавлении сыворотки рост останавливается.
Т.о., старение клеточной популяции (частично) обусловлено какими-то
компонентами сыворотки, которые перевешивают действие ростовых
факторов.
• Фибробласты от больных синдромом Вернера (преждевременное
старении в 40-50 лет, наследуемое) быстро стареют в культуре (дают
мало циклов удвоения). Они оказались не чувствительны к ТФР (PDGF)
и ФРФ (FGF) – мутация с утратой рецепторов?
50.
Т.о., с факторами роста могут быть связаны причиныстарения тканей, органов и организмов
(наряду с другими):
1) утрата клетками рецепторов к ФР (мутации);
2) снижение выработки ФР;
3) снижение выработки гормонов, управляющих синтезом
ФР (эндокринное старение).
51. 7. Гормоны и пролиферация клеток
В отличие от факторов роста настоящие гормоны – продуктыэндокринных желез.
Биохимически различаются три группы гормонов:
• моноамины,
• стероиды,
• пептиды.
Роль гормонов состоит в регуляции роста, развития и функционирования
органов и тканей, включая регуляцию клеточного размножения и
дифференцировки.
52.
7.1. МоноаминыМоноаминовые гормоны образуются из аминокислот путем небольшой
перестройки. Это – неспецифические регуляторы роста и
дифференцировки клеток разных тканей.
Тирозин → норадреналин, адреналин (катехоламины мозгового
вещества надпочечников), тироксин (гормон щитовидной железы).
• Норадреналин – стимулятор, сокращает клеточный цикл в различных
тканях.
• Адреналин – действует на другие рецепторы и подавляет клеточное
размножение, работает как универсальный ингибитор пролиферации.
При этом запускает в организме комплексную стрессовую реакцию.
53.
Согласно теории кейлонов –тканеспецифичных ингибиторов
пролиферации, выделяемых
зрелыми клетками против своего
же камбия, адреналин является
«орудием» в действии кейлонов.
Кейлон обеспечивает
тканеспецифич-ность реакции, а
адреналин – ингибирование.
На основе тирозина образуются также
ингибиторы у гидроидов: гомарин и
тригонеллин.
Это нейросекреты нейронов головы и
подошвы гидры. Задерживают
метаморфоз, регенерацию головы и
столона. В межклеточном веществе
создают градиенты вместе с
пептидными активаторами.
54.
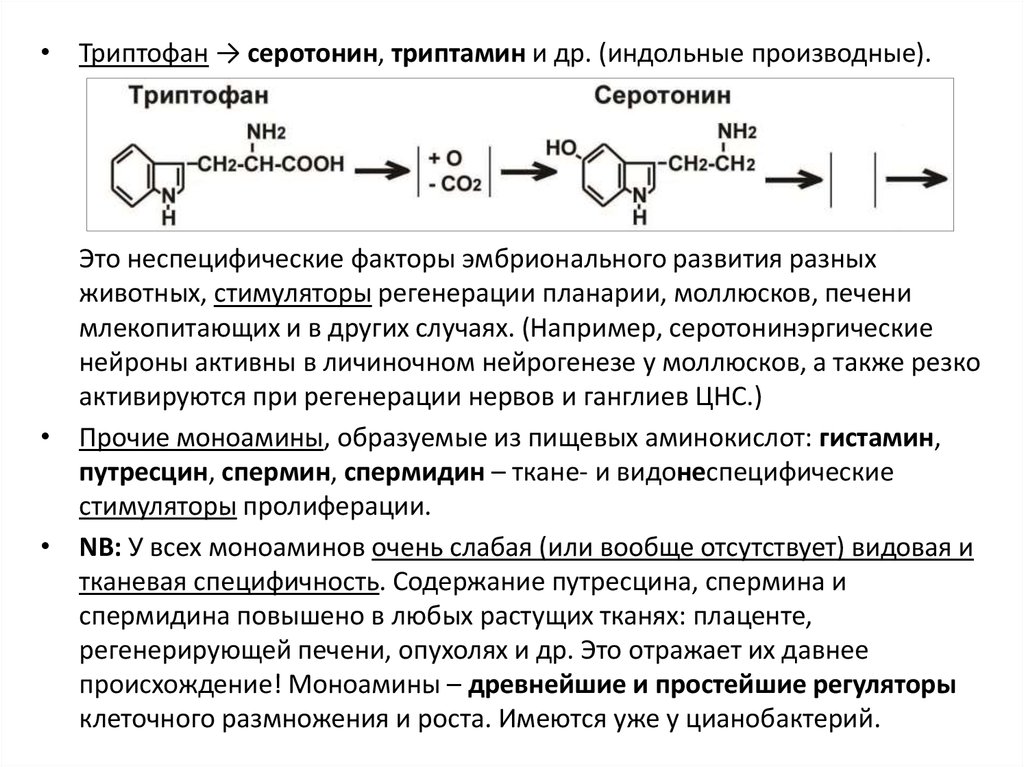
• Триптофан → серотонин, триптамин и др. (индольные производные).Это неспецифические факторы эмбрионального развития разных
животных, стимуляторы регенерации планарии, моллюсков, печени
млекопитающих и в других случаях. (Например, серотонинэргические
нейроны активны в личиночном нейрогенезе у моллюсков, а также резко
активируются при регенерации нервов и ганглиев ЦНС.)
• Прочие моноамины, образуемые из пищевых аминокислот: гистамин,
путресцин, спермин, спермидин – ткане- и видонеспецифические
стимуляторы пролиферации.
• NB: У всех моноаминов очень слабая (или вообще отсутствует) видовая и
тканевая специфичность. Содержание путресцина, спермина и
спермидина повышено в любых растущих тканях: плаценте,
регенерирующей печени, опухолях и др. Это отражает их давнее
происхождение! Моноамины – древнейшие и простейшие регуляторы
клеточного размножения и роста. Имеются уже у цианобактерий.
55.
Образование более сложных гормонов шло посредством реакцийполиконденсации – в направлении стероидов и полипептидов.
7.2. Стероидные гормоны
Реакция поликонденсации: терпены → стероиды:
Терпен (С5Н8)2 – димер углеводорода изопрена
↓
Сесквитерпены (С5Н8)3 → Фарнезол → Ювенильный гормон членистых
(стимулирует размножение клеток и рост, препятствует линьке).
↓
Дитерпены (С5Н8)4
↓
Тритерпены (С5Н8)6 → (циклизация) → циклопентанопергидрофенантрен
→ холестерин → разнообразные стероидные гормоны.
(Перестройки за счет кетонирования (=О), окисления (-ОН),
метилирования (-СН3), ацетилирования и других радикалов, а также
двойных связей в кольцах).
• Экдизон – гормон линьки у Ecdysozoa (нематоды, приапулиды,
членистоногие).
Антагонист ювенильного гормона, а значит, ингибитор пролиферации.
56.
• Кортикостероиды – гормоны коры надпочечников позвоночных.Функционально различаются: глюкокортикоиды (кортикостерон, кортизон,
гидрокортизон), минералкортикоиды (альдостерон и др.).
Характерен двойственный эффект (±) в зависимости от дополнительных
факторов.
Например, гидрокортизон в чистом виде (без сыворотки) усиливает
действие EGF на клетки HeLa (способствует связыванию ФР с
клеточными рецепторами), но в присутствии сыворотки (т.е. в сумме с
другими ФР) ингибирует размножение тех же клеток.
Тот же гидрокортизон на фибробластах 3Т3 усиливает действие EGF
(работает как синергист ФР), но ингибирует действие FGF (антагонист
ФР). Дексаметазон вместе с сывороткой стимулирует миобласты, но
ингибирует фибробласты.
• Половые гормоны.
Мужские половые гормоны семенников (частично коры надпочечников,
яичников): тестостерон, андростерон и др.
Женские гормоны яичников (частично семенников, коры надпочечников):
прогестерон, эстрадиол, эстрон и др.
Кроме прочего, стимулируют мейоз – запускают сигнальный путь на синтез
MPF.
57.
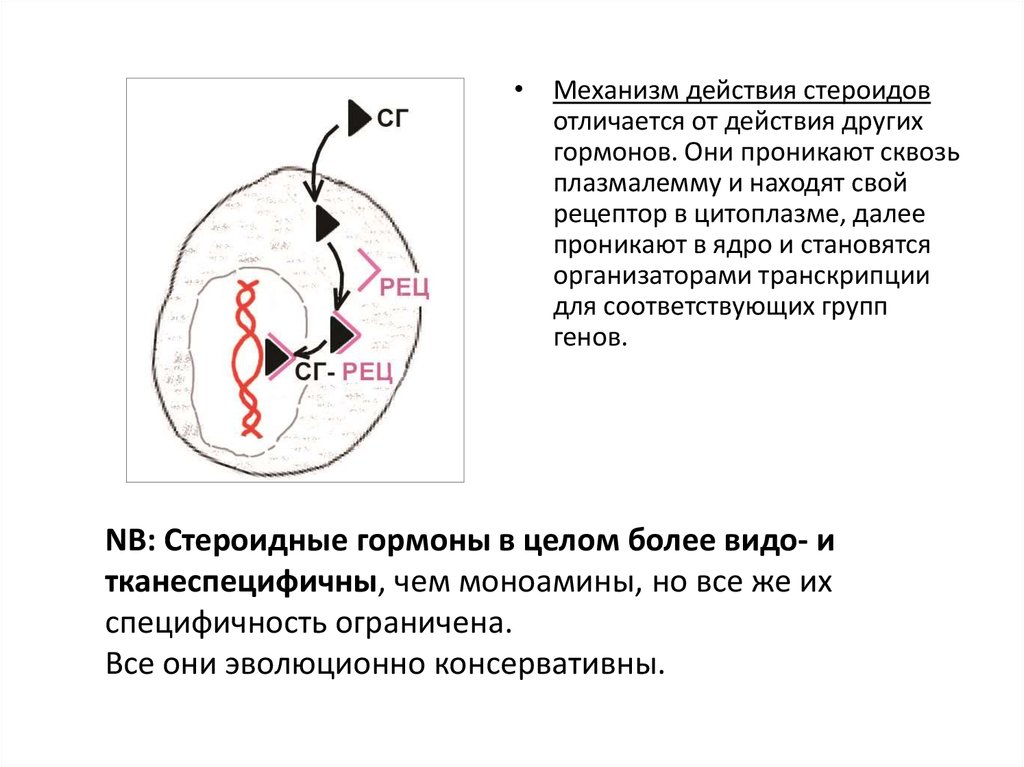
• Механизм действия стероидовотличается от действия других
гормонов. Они проникают сквозь
плазмалемму и находят свой
рецептор в цитоплазме, далее
проникают в ядро и становятся
организаторами транскрипции
для соответствующих групп
генов.
NB: Стероидные гормоны в целом более видо- и
тканеспецифичны, чем моноамины, но все же их
специфичность ограничена.
Все они эволюционно консервативны.
58.
7.3. Пептидные гормоныИмеются уже у низших многоклеточных.
• ПМГ – пептидный морфоген гидры –
нейропептид из 11 аминокислот.
Секретируется нейронами «головы» и
стимулирует деление стволовых (i) клеток,
которые дают в первую очередь новые нейроны,
потом эпителий (ПМГ – активатор головы).
Вместе с активатором подошвы, а также
моноаминовыми ингибиторами (см. выше)
создает морфогенетические градиенты (поля)
вдоль тела гидры, направляющие векторный
рост и регенерацию: от подошвы растет голова,
от головы – подошва.
• NB: ПМГ еще малоспецифичен, его гомологи есть у других животных.
ПМГ активен даже в отношении клеток млекопитающих. Используется
в медицине для стимуляции роста легочного, кожного и других
эпителиев.
59.
У позвоночных полипептидные гормоны очень разнообразны, более тканеи видоспецифичные. Хорошо выражена иерархия источников:• - Нейропептиды гипоталамуса (рилизингпептиды):
соматолиберин, кортиколиберин,
тиролиберин и др. либерины (всего 7);
соматостатин и др. статины (всего 3).
• - Тропные гормоны аденогипофиза
(передней доли гипофиза): соматотропин
(СТГ), кортикотропин (АКТГ), тиреотропин
(ТТГ), гонадотропины (ФСГ, ЛГ), пролактин
и др.
• - Гормоны периферических эндокринных
желез – большей частью моноамины и
стероиды. Среди пептидных гормонов
малоспецифичные инсулин, кальцитонин
(паратгормон) – вовлечены в регуляцию
размножения клеток в красном костном
мозге, тимусе, печени и др.
60.
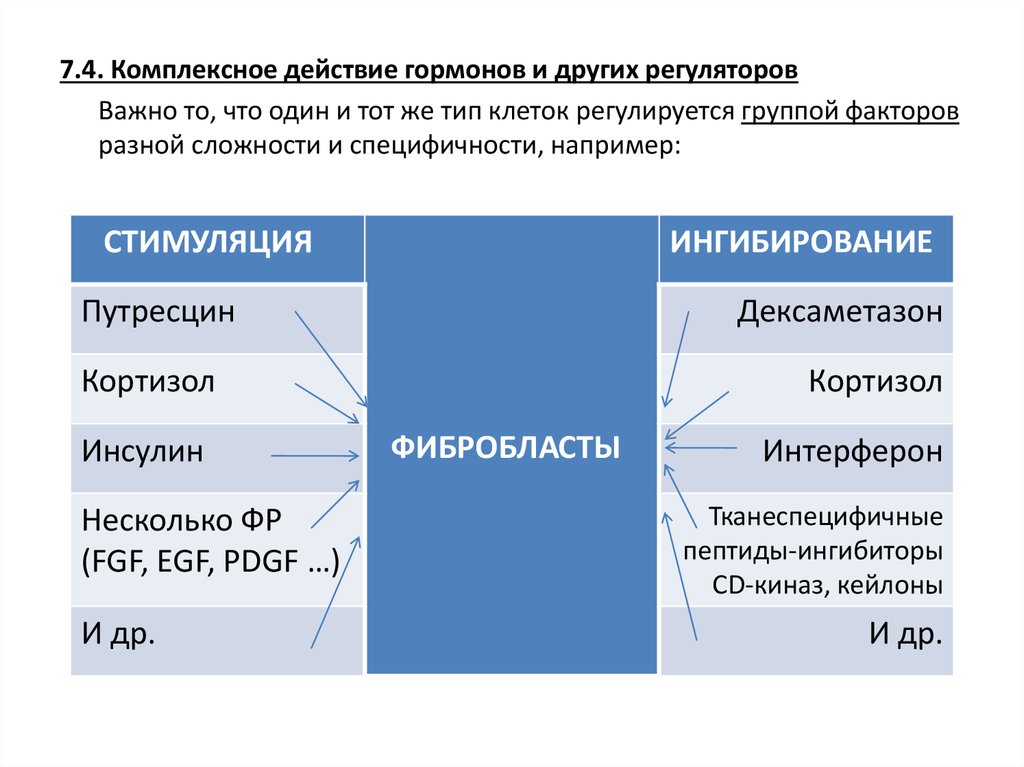
7.4. Комплексное действие гормонов и других регуляторовВажно то, что один и тот же тип клеток регулируется группой факторов
разной сложности и специфичности, например:
СТИМУЛЯЦИЯ
ИНГИБИРОВАНИЕ
Путресцин
Дексаметазон
Кортизол
Инсулин
Несколько ФР
(FGF, EGF, PDGF …)
И др.
Кортизол
ФИБРОБЛАСТЫ
Интерферон
Тканеспецифичные
пептиды-ингибиторы
CD-киназ, кейлоны
И др.
61.
При этом сами регуляторы встроены в сложные иерархические цепи(сети) управления с возможностью изменения уровня активности.
Например, сеть управления через СТГ (соматотропный гормон) включает:
ГИПОТАЛАМУС
ЭПИФИЗ
↓
↓
↓
рилизинг-пептиды
↓
↓соматолиберин – (стимуляция) → (+) ГИПОФИЗ (+) ← серотонин – (стимуляция)
соматостатин – (угнетение) →→→ (–) ↓ ↓ ↓
СТГ ТТГ АКТГ и др.
↓↓↓
Пролиферация гепатоцитов, энтероцитов и др.
Стимулирует выделение печенью соматомедина - ускоряет рост костной и др. тканей.
Стимулирует образование в тканях полиаминов –
- неспецифическая стимуляция…
Причем в сетях возможны каскадные реакции превращения неактивных
форм регулятора в активные и наоборот, с участием разнообразных
ферментов, например:
кортизон → кортизол (= гораздо более сильный стимулятор);
норадреналин → адреналин (= смена стимуляции на угнетение).
62.
• Таким образом, гормоны включены в кооперативное действие всехрегуляторов пролиферации и дифференцировки, в комбинации с
несколькими факторами роста, специфическими и неспецифическими
ингибиторами. Поэтому для гормонов, как и для некоторых факторов
роста (см. выше) характерны двойственные (стимулятор-ингибитор)
эффекты.
• Система экзогенной регуляции пролиферативных процессов и
дифференцировки клеток многоклеточных организмов усложнялась в
ходе биологической эволюции.
У высших животных клеточная пролиферация в тканях регулируется
сочетанием филогенетически древних факторов – видо- и
тканенеспецифических (амины, стероиды) и более молодых –
специфичных (полипептидные гормоны и факторы роста). При этом
действие древних неспецифических факторов становилось
подчиненным, они использовались как усилители сигналов от новых,
более ткане- и видоспецифичных регуляторов. Т.е. специфические
регуляторы (полипептидные гормоны и ФР) в ходе эволюции дополняли
систему регуляции, которая изначально (у одноклеточных) была
довольно примитивной – неспецифической. Появлялись и
соответствующие наборы клеточных рецепторов, усложнялись
межклеточные и межтканевые взаимодействия.
63. Заключение
В целом получается такая система регуляции клеточного размножения.1) Клетка генетически запрограммирована на пролиферацию.
Синтез белков – стимуляторов клеточного цикла (Cdk) идет постоянно, и
вместе с соответствующими циклинами они задают график течения
цикла. Главные из них (и минимально достаточные) – белки SPF
(Cdk2/Cyclin E) и MPF (Cdk1/Cyclin B).
2) Но в клетке есть и гены негативного контроля цикла, экспрессирующие
белки-ингибиторы циклинзависимых киназ (CKI): p19, p21, p27,…p53,
p57, pRb, а также TGF β, интерферон и другие ингибиторы.
В G1-периоде каждого очередного цикла (в точке r, check point) эти
белки подавляют гены подготовки нового синтеза ДНК (cdk 6, 4, 2, cyclin
D, E) и направляют клетку в период покоя G0.
64.
3) У одноклеточных переход через точку r в новый цикл регулируетсяналичием или отсутствием пищи, феромонов и других активаторов
цикла.
У первых многоклеточных экзогенные индукторы – моноамины,
стероиды, олигопептиды – дополнили систему регуляции, и далее она
усложнялась с участием нейросекреторных, эндокринных (гормоны) и
паракринных (факторы роста) полипептидов.
Факторы роста через рецепторы и внутриклеточные мессенджеры
активируют транскрипционные факторы (ТФ) генов компетентности
(myc, fos, myb и др.); экспрессируемые этими генами белки блокируют
белки-ингибиторы (прежде всего p27), изменяют структуру хроматина
и выводят клетку из состояния покоя G0.
65.
4) Другие факторы роста аналогичными путями повышают экспрессиюгенов прогрессии цикла (сdk/cyclin); продуцируемые белки семейств
Cdk и Cyclin обеспечивают продвижение клетки по циклу: G1-S-G2-M,
до нового G0-периода (позитивный контроль цикла). Негативный
контроль с помощью белков CKI создает паузы для исправления
ошибок репликации.
5) Гормоны и пептидные ингибиторы модифицируют (подавляют или
усиливают) действие факторов роста, регулируя переходы к
дифференцировке клеток и апоптозу.
Т.о., у высших многоклеточных животных, с их сложной органнотканевой структурой, в экзогенной регуляции клеточного
размножения факторы роста специализируют действие гормонов и
других неспецифических регуляторов. Центральная нервная система
(через гипоталамус) и факторы внешней среды выступают как еще
более удаленные эпигенетические регуляторы роста и развития.




















































 biology
biology








