Similar presentations:
Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів
1.
Явище ізомерії. Структурна ізомерія,номенклатура насичених вуглеводнів.
L/O/G/O
2.
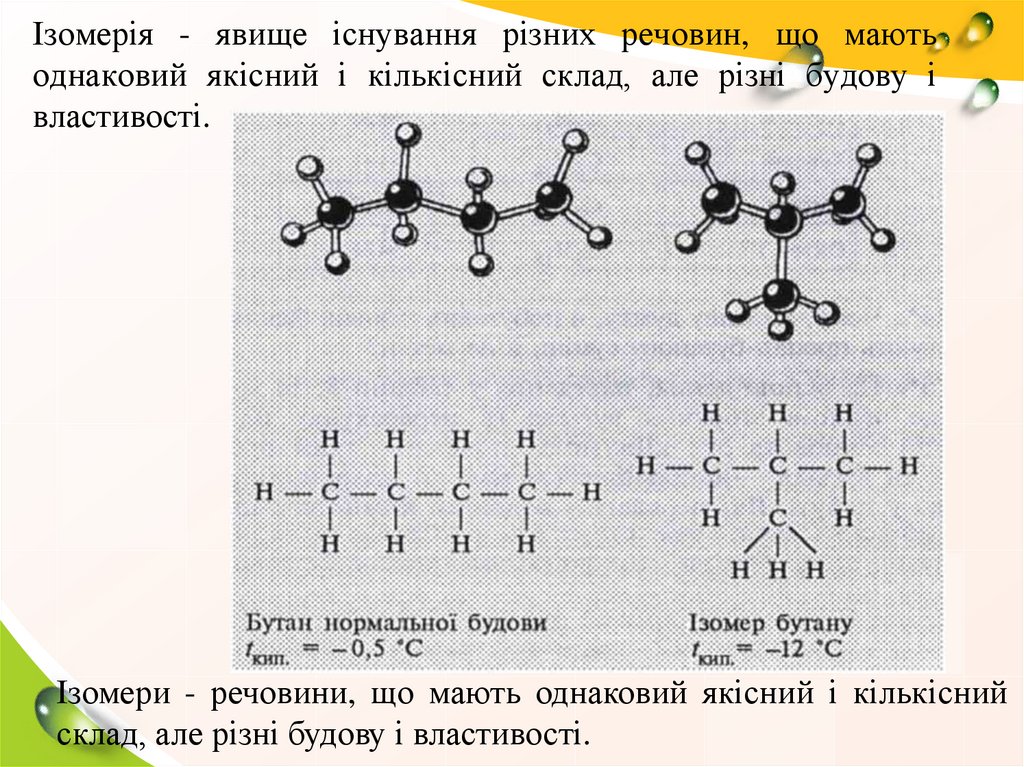
Ізомерія - явище існування різних речовин, що маютьоднаковий якісний і кількісний склад, але різні будову і
властивості.
Ізомери - речовини, що мають однаковий якісний і кількісний
склад, але різні будову і властивості.
3.
Структурна ізомерія — вид ізомерії, що зумовлений різноюпослідовністю сполучення атомів Карбону в молекулі
1. Ізомерія
карбонового скелету
4.
2. Ізомерія положення зв’язкуСН3―СН=СН―СН2―СН3 - ПЕНТЕН
ІЗОПЕНТЕН - СН2=СН―СН―СН2―СН3
3. Ізомерія положення функціональної групи
СН3―СНОН―СН2―СН2―СН3 – ПЕНТАНОЛ -2
СН3―СН2―СНОН―СН2―СН3 – ПЕНТАНОЛ -3
4. Міжкласова ізомерія
С3Н7ОН або С3Н8О
СН3―СН2―СНОН - ПРОПАНОЛ
С3Н8О
СН3―О―С2Н5 – ЕТЕР (ЕФІР)
5.
Транс-ізомерЦис-,транс-ізомерія
Цис-ізомер
6.
7.
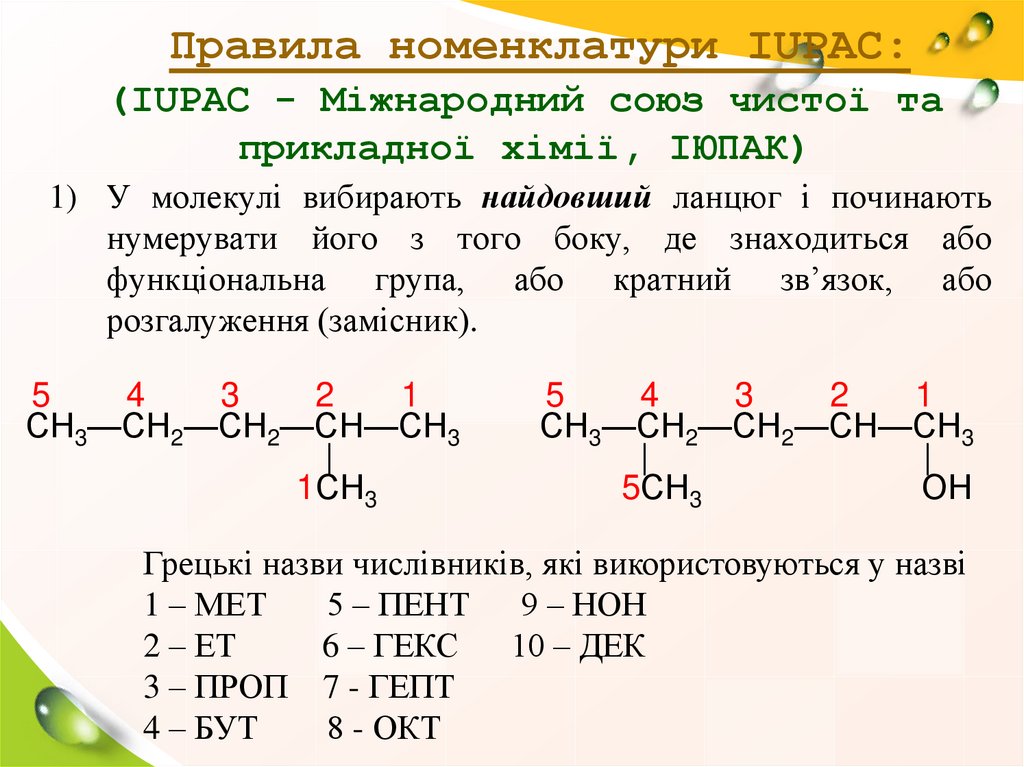
Правила номенклатури IUPAC:(IUPAC - Міжнародний союз чистої та
прикладної хімії, ІЮПАК)
1) У молекулі вибирають найдовший ланцюг і починають
нумерувати його з того боку, де знаходиться або
функціональна група, або кратний зв’язок, або
розгалуження (замісник).
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
|
1СН3
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
|
|
5СН3
ОН
Грецькі назви числівників, які використовуються у назві
1 – МЕТ
5 – ПЕНТ
9 – НОН
2 – ЕТ
6 – ГЕКС
10 – ДЕК
3 – ПРОП 7 - ГЕПТ
4 – БУТ
8 - ОКТ
8.
Правила номенклатури IUPAC:(IUPAC - Міжнародний союз чистої та
прикладної хімії, ІЮПАК)
2. Визначаємо клас речовини, до назви додаємо класове
закінчення, за потребою префікс
5
4
3
2
1
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
СН3—СН2—СН2—СН—СН3
|
|
|
1СН3
5СН3
ОН
Пент+ан
Пент+ан+ол
Класові закінчення
Алкани – ан
Алкени, Арени – ен
Алкіни – ин, ін
Циклоалкани – Цикло+…+ ан
Класові закінчення
Спирти – ол
Альдегіди – аль
Карбонові кислоти – ова
Амінокислоти – Аміно+…+ова
9.
Головний ланцюг не обов’язково прямий,можливий вигин головного ланцюга:
СН3— СН—СН2—СН3
|
головний ланцюг
СН2—СН3
10.
Замісник не може бути прикріплений до кінцяланцюга, це буде тільки загин ланцюга:
СН2—СН2—СН2—СН3
|
СН3
н-пентан
СН3—СН2—СН2—СН2—СН3
Якщо вуглеводень не має розгалужень карбонового ланцюга, у його
назву додають букву «н», тобто пентан нормальної будови.
11.
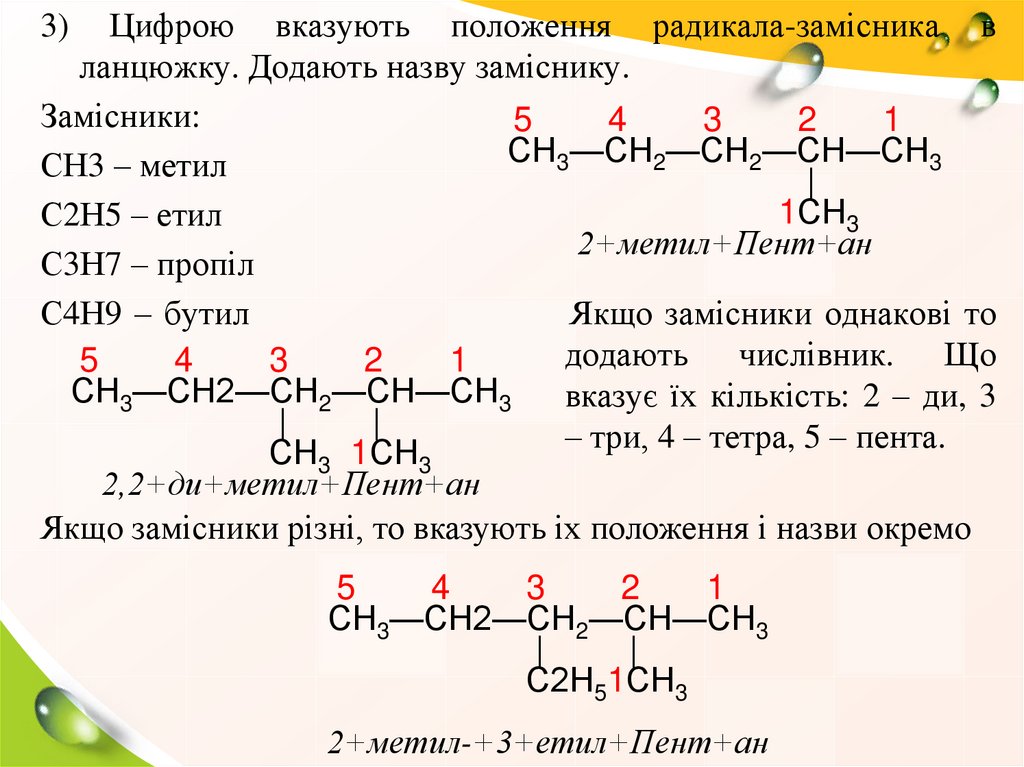
Цифрою вказують положення радикала-замісника вланцюжку. Додають назву заміснику.
Замісники:
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
СН3 – метил
|
1СН3
С2Н5 – етил
2+метил+Пент+ан
С3Н7 – пропіл
С4Н9 – бутил
Якщо замісники однакові то
додають числівник. Що
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
вказує їх кількість: 2 – ди, 3
|
|
– три, 4 – тетра, 5 – пента.
СН3 1СН3
2,2+ди+метил+Пент+ан
Якщо замісники різні, то вказують іх положення і назви окремо
3)
5
4
3
2
1
СН3—СН2—СН2—СН—СН3
|
|
С2Н51СН3
2+метил-+3+етил+Пент+ан
12.
Наприклад:8
7
6
CH3
5
4
3
2
1
CH3 CH2 CH2 CH CH2 C CH2 CH3
CH3
CH2
3-етил-3,5-диметил....
6
5
4
3
2
CH3
1
СН3–СН–СН–СН–СН–СН3
│ │ │ │
СН3 СН3 Сl СН3
2,4,5-триметил-3-хлор....
13.
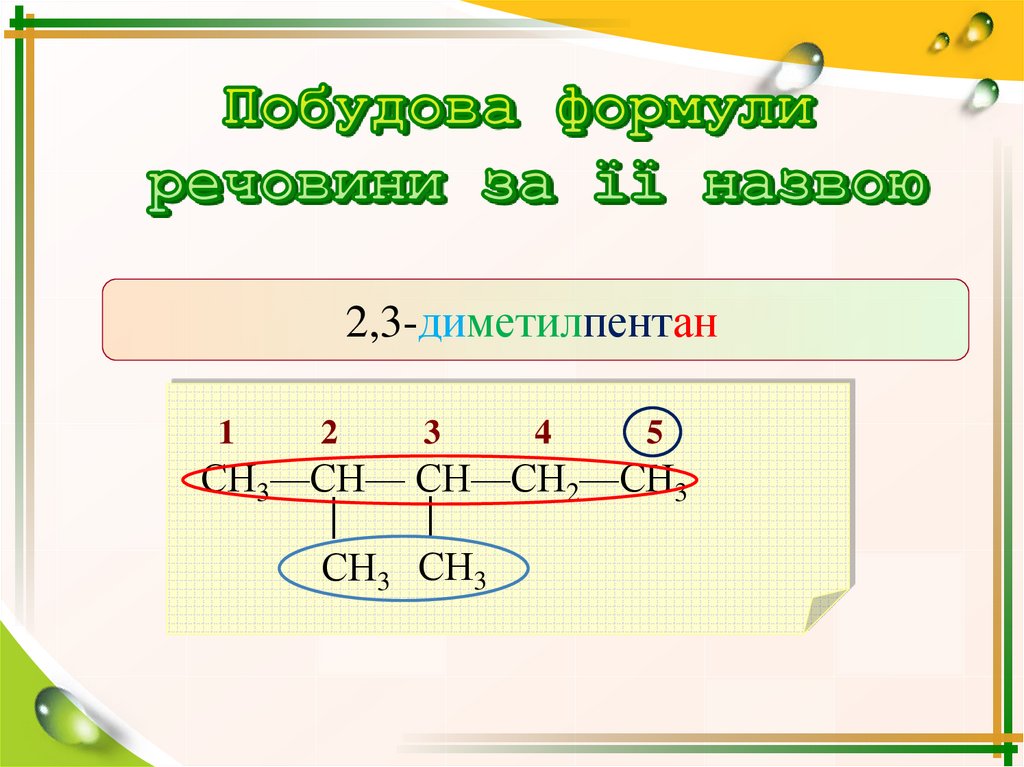
2,3-диметилпентан1
2
3
4
5
СН3—СН— СН—СН2—СН3
│
│
СН3 СН3









 chemistry
chemistry








