Similar presentations:
Равновесие твердое тело ↔ пар
1.
Равновесие твердое тело ↔ парУравнение Клаузиуса - Клапейрона можно записать
o3
k
h
dp
o3
o3
dT Т Vk
1
2.
Vk o 3 Vkn Vkmo3
Vk
0
- большое значение
Vk o 3 Vkn
dp
dp
dT
dT
o3
ucn
2
3.
o3dlnp hk
2
dT
RT
p2
h 1 1
ln
p1
R T2 T1
o3
h o 3
p2 p1exp
R
1 1
T2 T1
3
4.
Решение уравнения Клаузиуса - Клапейрона имеетследующий вид
o3
h
ln p
R
1
const
T
Мольная энтальпия возгонки обычно больше, чем
мольная энтальпия испарения
o3
hk
h
ucn
k
4
5.
Энтальпия функция состояния, и ее изменение входе процесса не зависит от пути процесса, а
определяется лишь изменением значений в начальном
и конечном состоянии. Значит в тройной точке
справедливо следующее соотношение
o3
hk
h h
nl
k
ucn
k
5
6.
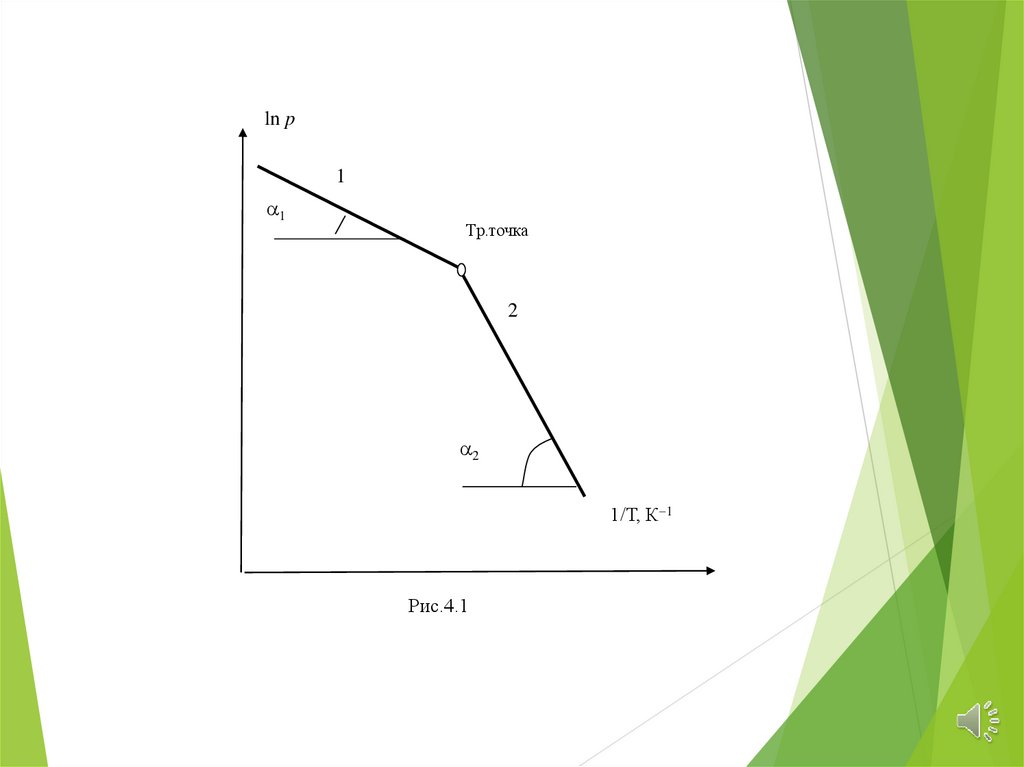
ln p1
1
Тр.точка
2
2
1/Т, К 1
Рис.4.1
7.
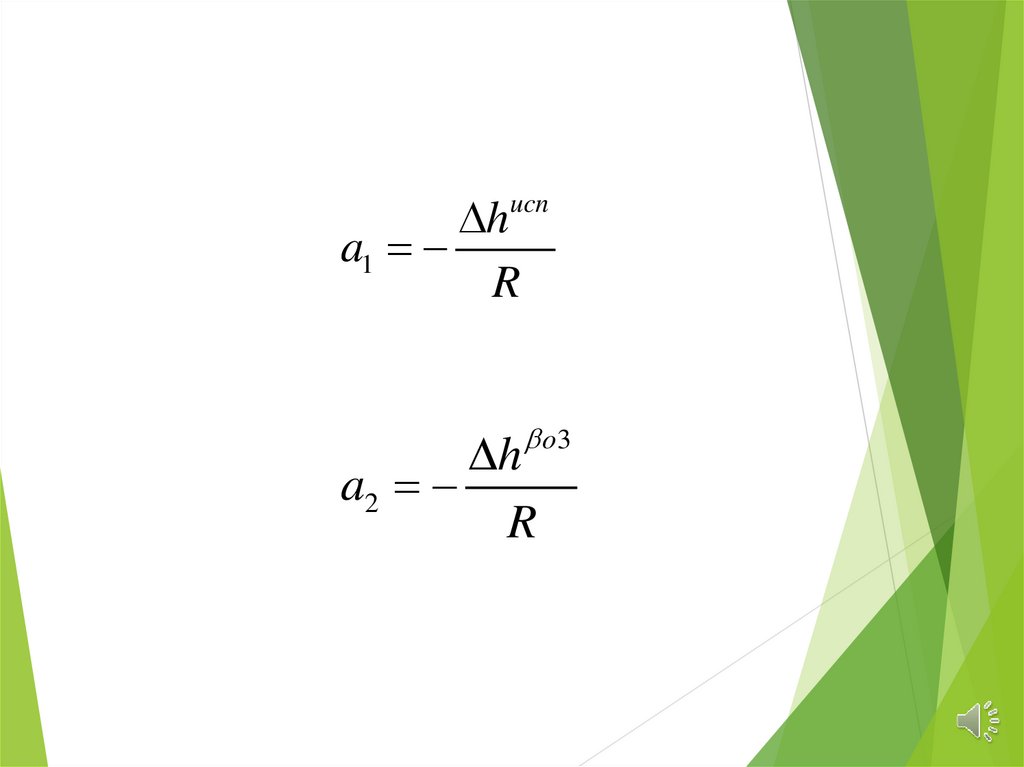
ha1
R
ucn
o3
h
a2
R
8.
Условия равновесия фаз вдвухкомпонентных системах
9.
Условия фазового равновесия «жидкость-пар» вдвухкомпонентной системе с присутствием каждого
компонента в каждой фазе следующие
T
nap
μ
nap
1
T
μ
ж
ж
1
p nap p ж
μ
nap
2
μ
ж
2
10.
В общем виде вариантность системы будет равнаω 2 f 2 4- f
Т. е. в равновесной двухкомпонентной системе не
может быть более четырех фаз, так как по
физическому смыслу вариантность ω ≥ 0
10
11.
Диаграмма состояния в этом случае являетсятрехмерной, что неудобно для построения и анализа,
поэтому часто используют условную вариантность
ωp 2 f 1 3 f
ωT 2 f 1 3 - f
т.е. проводят опыт в условиях постоянства одного
из параметров: давления или температуры
11
12.
парциальное давление пара компонента надраствором пропорционально мольной доле его в
жидкой фазе
pk p N
o
k
где
ж
k
pk − парциальное давление компонента k над
раствором
o
k
p
− давление пара чистого вещества k
N kж − мольная доля компонента k в
растворе
12
13.
В случае идеальных растворов закон выполняетсядля всех компонентов и для всех концентраций.
Закон Рауля представляет собой прямолинейную
зависимость давления пара любого компонента
раствора от его мольной доли
13
14.
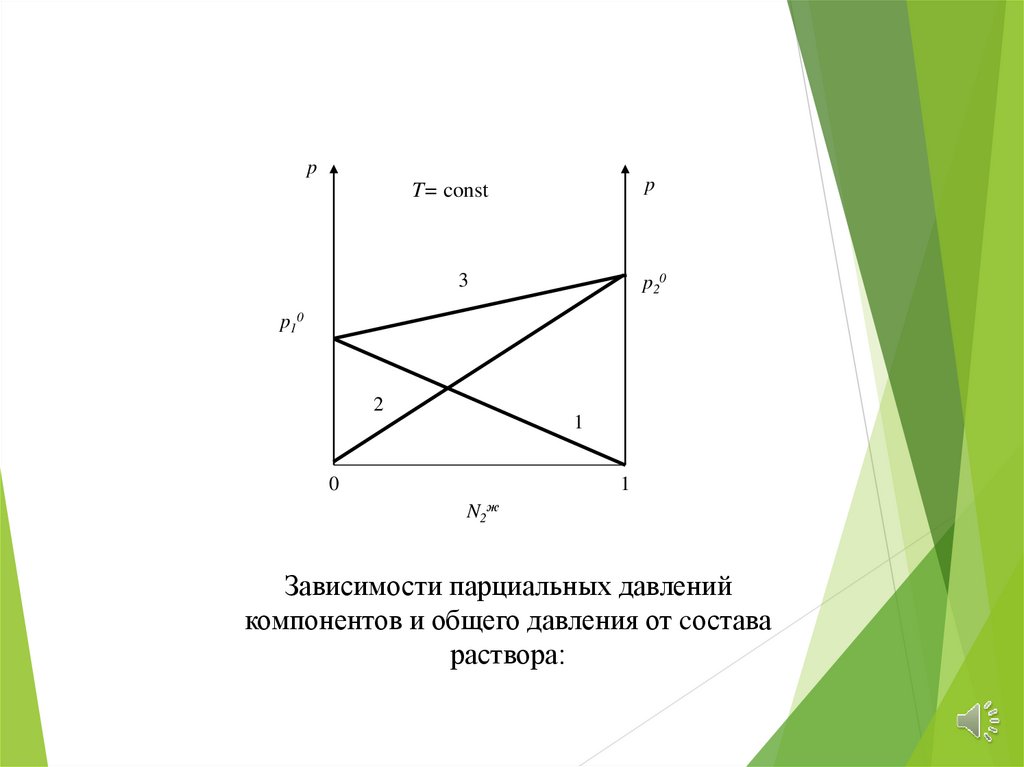
pp
T= const
3
p20
p10
2
1
0
1
N2
ж
Зависимости парциальных давлений
компонентов и общего давления от cостава
раствора:
15.
Принято подразделять на отклонениянезначительные и значительные. Знак и величина
отклонения зависят от природы растворителя и
растворенного вещества. Отклонения от
идеальности обусловлены как физическими, так и
химическими причинами (дипольное
взаимодействие, поляризация, образование
водородных связей, ассоциация, диссоциация и т.д.)
15
16.
а)б)
p
p
0
1
0
1
Незначительные отклонения от закона Рауля:
а − положительные; б − отрицательные
17.
Если разнородные молекулы притягиваютсяслабее однородных. Давление пара будет больше,
чем следует из закона Рауля, т.е. наблюдается
положительное отклонение
p1 p N1
0
1
p2 p N 2
0
2
18.
В случае значительного взаимного притяженияразнородных молекул по сравнению с однородными
в растворе (сольватация, образование химических
соединений), наблюдается отрицательное
отклонение от закона Рауля.
p1 p N1
0
1
p2 p N 2
0
2
19.
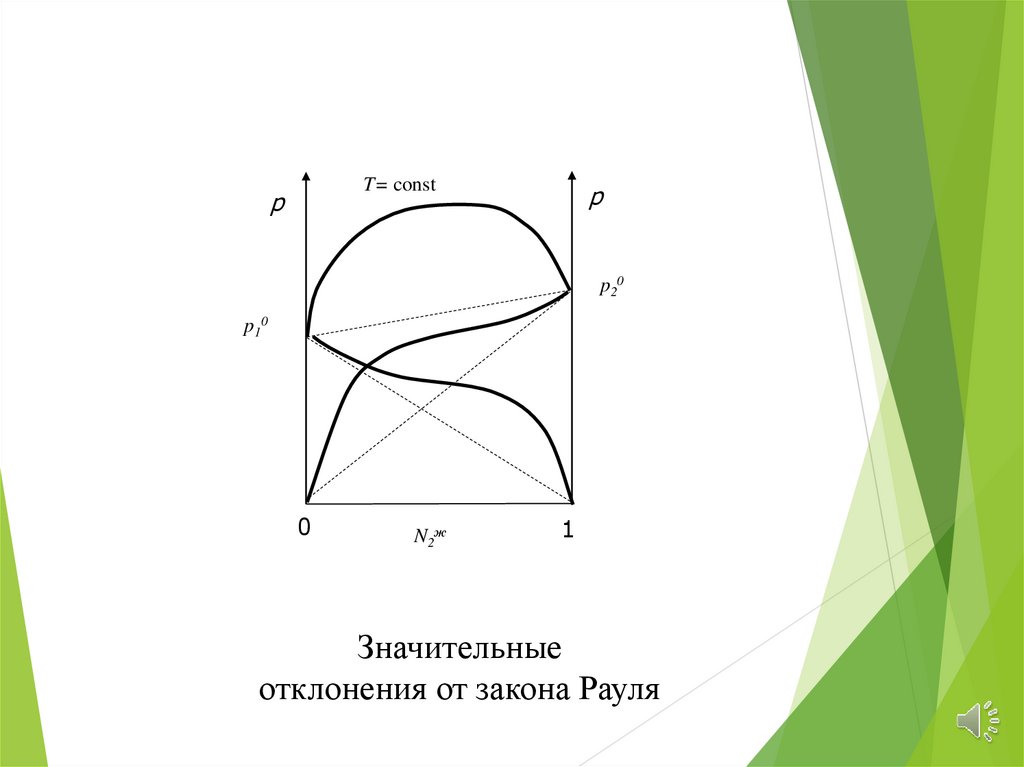
T= constp
p
p20
p10
0
N2ж
1
Значительные
отклонения от закона Рауля















 physics
physics








