Similar presentations:
Карбоновые кислоты
1.
Тема: Карбоновые кислотыВопросы:
1. Строение, изомерия, номенклатура карбоновых кислот.
2. Получение карбоновых кислот.
3. Химические свойства карбоновых кислот.
4. Основные представители, свойства и применение.
5. Непредельные одноосновные карбоновые кислоты: основные представители.
6. Предельные двухосновные кислоты: основные представители.
2.
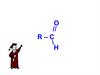
Вопрос 1. Строение, изомерия, номенклатура карбоновых кислотКарбоновыми кислотами называются соединения, в молекуле которых содержится одна
или несколько функциональных групп:
Эта группа состоит из карбонильной и гидроксильной группы и поэтому называется
карбоксильной группой.
Число карбоксильных групп характеризует основность кислоты. По числу
карбоксильных групп различают монокарбоновые, дикарбоновые, поликарбоновые кислоты.
Строение и изомерия кислот напоминает строение и изомерию альдегидов. Кислоты с
четырьмя и более атомами углерода в цепи имеют пространственные изомеры.
Для простейших кислот применяют тривиальные названия, связанные с природными
продуктами, из которых они были впервые получены. Например, муравьиная кислота
(получена из выделений муравьев). По номенклатуре ИЮПАК название карбоновых кислот
составляют добавлением к названию соответствующего углеводорода окончания «–овая» и
слова «кислота».
3.
Монокарбоновые кислоты:Формула
HCOOH –
CH3COOH –
CH3CH2COOH –
CH3CH2CH2COOH –
CH3CH(CH3)COOH –
CH3CH2CH2CH2COOH –
CH3CH(CH3)CH2COOH –
название
название по ИЮПАК
муравьиная
метановая
уксусная
этановая
пропионовая
пропановая
масляная
бутановая
изомасляная
2-метилпропановая
валерьяновая
пентановая)
изовалерьяновая 3-метилбутановая
4.
Вопрос 2. Получение карбоновых кислот1. Окисление алканов при высоких температурах в
присутствии катализаторов. Образуется смесь
кислородсодержащих соединений, в том числе и кислоты.
2. Окисление спиртов, альдегидов, кетонов.
3. Гидролиз тригалогенпроизводных углеводородов:
R–CCl3+2H2O→RCOOH+3HCl.
5.
Вопрос 3. Химические свойства карбоновых кислот1. Образование солей, например:
2CH3COOH+2Na→2CH3COONa+H2;
2CH3COOH+MgO→(CH3COO)2Mg+H2O;
CH3COOH+KOH→CH3COOK+H2O.
2. Взаимодействие с пентахлоридом фосфора (PCl5):
CH3CH2COOH+PCl5→CH3CH2CO(Cl)+POCl3+HCl.
3. Галогенирование (Сl2, Br2) с замещением водорода у атома углерода ближайшего к кислотной
группе:
CH3CH2COOH+Cl2→CH3CH(Сl)COOH+HCl далее
CH3CH(Сl)COOH+Cl2→CH3C(Сl)2COOH+HCl.
4. Действие водорода (AlH3) реагирует с трудом
RCOOH + 2H2 → R–CH2–OH + H2O.
5. Действие кислорода. Реагирует с трудом по схеме:
RCOOH + O2 → CO2 + H2О.
6.
Вопрос 4. Основные представители, свойства и применениеМуравьиная кислота НСООН – бесцветная жидкость с резким запахом.
Растворяется в спирте, воде. Наиболее сильная из карбоновых кислот.
Содержится в выделениях муравьев, соке крапивы, в поте животных.
Применяют в медицине, при крашении и отделке тканей и бумаги, при выделке
кожи, в спиртовом и пивоваренном производстве.
Уксусная кислота СН3СООН бесцветная жидкость с резким запахом.
Хорошо растворяется в спирте и воде. Широко распространена в природе.
Содержится в листьях растений, в выделениях животных. Применяют в
пищевой промышленности (70-60% уксусная эссенция) и 5% раствор
(столовый уксус). Используется в синтезе различных солей, эфиров,
красителей, лекарственных и душистых веществ, для консервирования и
придания вкуса продуктам.
7.
Вопрос 5. Непредельные одноосновные карбоновые кислоты: основные представителиАкриловая (пропеновая) СН2═СHCOOH;
Метакриловая (2-метил-2-пропеновая) СН2═С(CH3)COOH;
Олеиновая (C17H33COOH): CH3–(CH2)7–СH═CH–(CH2)7–COOH;
Линолевая (C17H31COOH):
CH3–(CH2)4–СH═CH–(CH2)4–СH═CH–(CH2)7–COOH;
Линоленовая (C17H29COOH):
CH3–CH2–СH═CH–CH2–СH═CH–CH2–СH═CH–(CH2)7–COOH.
Сорбиновая кислота CH3–CH═CH–CH═CH–COOH.
Акриловая кислота используется в производстве акрилонитрила, из которого изготавливают пластмассу, каучук,
синтетическое волокно нитрон (заменитель шерсти).
Метакриловая кислота используется для получения органического стекла (полиметилметакрилат), каучуков, клеев,
ионообменных смол.
Олеиновая кислота входит в состав всех животных жиров и растительных масел в виде сложных эфиров с глицерином
(глицериды). Применяется в качестве пластификатора в пластмассах, при производстве мыл и кремов.
Сорбиновая кислота применяется в качестве пищевой добавки, как консервант для соков, кондитерских изделий,
зернистой икры, сыров, колбас, при производстве сгущенного молока для предотвращения его потемнения.
8.
Жирные кислоты вступают в реакцию взаимодействия со спиртами (реакция этерификации),образуя сложные эфиры. При этерификации жирных кислот с глицерином образуются сложные
эфиры, которые называются жирами или глицеридами.
9.
Жиры способны вступать в реакцию гидролиза, образуя жирные кислоты и глицерин:Образовавшиеся после гидролиза жирные кислоты обрабатывают гидроксидом натрия или
гидроксидом калия. Соли жирных кислот с натрием и калием используются в качестве твердого и
жидкого мыла соответственно.
С17Н33СООН + NaOH С17Н33СООNa + H2O.
В процессе стирки мыло, т.е. соли жирных кислот, подвергаются гидролизу, образуя щелочь и
жирные кислоты. Эти кислоты являются поверхностно-активными веществами. Они способствуют
отстириванию.
Линолевая и линоленовая кислоты содержатся в виде глицидов во всех животных жирах и
растительных маслах. В льняном масле содержится до 25% линолевой кислоты и до 58% линоленовой
кислоты. Пищевые масла, богатые этими кислотами, рекомендуются для профилактики и лечения
склероза сосудов и гипертонической болезни.
10.
Вопрос 6. Предельные двухосновные кислоты: основные представителиHOOC–COOH – щавелевая (этандиовая);
HOOC–СH2–COOH – малоновая (пропандиовая);
HOOC–(СH2)2–COOH – янтарная (бутандиовая);
HOOC–(СH2)3–COOH – глутаровая (пентандиовая);
HOOC–(СH2)4–COOH – адипиновая (гександиовая).
Щавелевая кислота наиболее сильная из двухосновных кислот. Кристаллическое вещество,
хорошо растворяется в воде, спирте, эфире. Используется в качестве отбеливающего средства, для
очистки металлов от ржавчины, для удаления накипи, в качестве протравы в кожевенном
производстве.
В6.
Малоновая кислота растворяется в воде, спирте, эфире. Применяется для синтеза витаминов В1 и
Янтарная кислота кристаллическое вещество растворяется в воде, спирте, эфире. Применяется в
производстве инсектицидов, красителей, лекарственных средств.
Глутаровая кислота твердое вещество, трудно растворяется в воде, растворима в спирте и эфире.
Применяется для получения синтетического волокна найлон и полиамидных пластмасс. В пищевой
промышленности как заменитель лимонной и винной кислоты.
11.
Непредельные двухосновные кислоты:H––C––COOH
║
малеиновая (цис-бутендиовая);
H––C––COOH
H––C––COOH
║
фумаровая (транс-бутендиовая).
HOOC––C––H
Малеиновая кислота растворяется в воде, спирте, эфире. В живых
организмах не встречается. При нагревании легко переходит в фумаровую
кислоту. Применяется для получения полимеров.
Фумаровая кислота плохо растворяется в воде. Растворяется в спирте и
эфире. Встречается в растениях. Применяется для изготовления высыхающих
масел, пластификаторов. В пищевой промышленности как заменитель винной
и лимонной кислоты.
12.
13.
Ароматические кислоты. Наиболее широко применяются бензойная,салициловая и ацетилсалициловая кислоты. Бензойная кислота (C6H5 –COOH)
встречается в свободном состоянии в некоторых смолах. Получают
окислением толуола (C6H5CH3) азотной кислотой. Применяется в качестве
антисептического и консервирующего средства, в производстве красителей,
лекарственных и душистых веществ. Салициловая кислота:
.
Получают из фенолята натрия и углекислого газа в автоклавах при 1800С
с последующей обработкой соляной кислотой. Применяют для получения
ацетилсалициловой кислоты (аспирина), для лечения ревматизма,
мочекислого диатеза, кожных заболеваний, для консервирования пищевых
продуктов, для производства азокрасителей и душистых веществ.
Ацетилсалициловая кислота:
.
Получают из салициловой кислоты этерификацией уксусной кислотой.
Применяют
в
медицине
в
качестве
противовоспалительного,
жаропонижающего, анальгезирующего средства. Эта кислота препятствует
агрегации тромбоцитов.












 chemistry
chemistry