Similar presentations:
Органические и неорганические основания
1.
Органические инеорганические
основания
2.
ОснованияОснования – это электролиты, при диссоциации которых в качестве
анионов образуются только гидроксид-ионы.
Основные свойства органических
соединений заключаются в том,
что они реагируют с кислотами с
образованием солей.
3.
Протолитическая теория (1923)Кислоты и основания – это
противоположная группа
веществ, характер которой
проявляется при их
взаимодействии между
собой.
Й. Н. Бренстед
Т. М. Лоури
(1879–1947)
(1874–1936)
4.
Протолитическая теорияКислоты – это вещества, характер которых проявляется в том, что они
являются донорами катионов водорода Н+.
Основания – это вещества, которые при взаимодействии с кислотами
будут принимать катионы водорода, причём они являются акцепторами
катионов водорода Н+.
Кислоты – это вещества, группы атомов или ионы, которые являются в
данной реакции донорами катионов, то есть отдают катионы водорода.
Основания – это вещества, группы атомов или ионы, которые являются
акцепторами катионов, то есть принимают протоны водорода.
5.
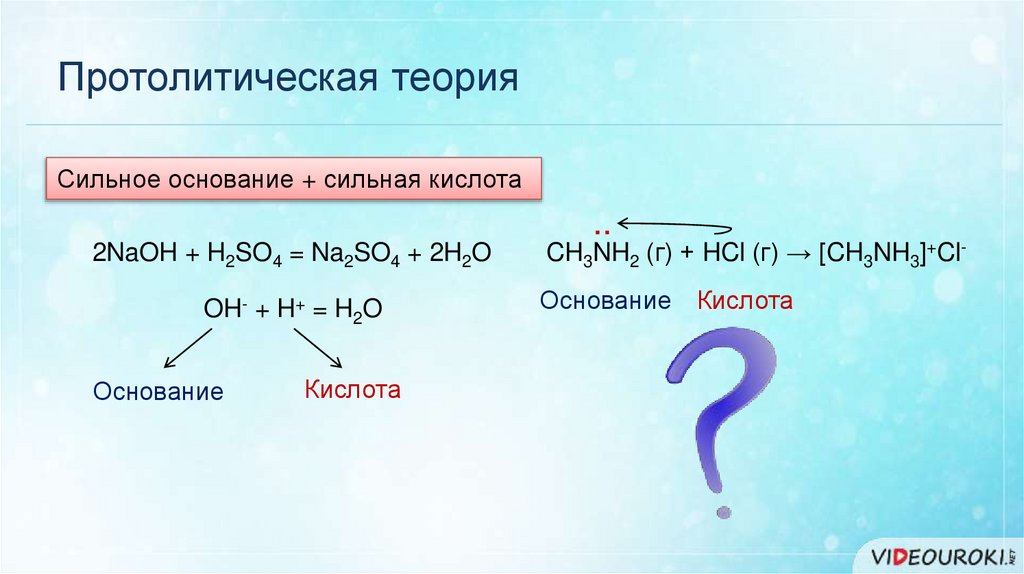
Протолитическая теорияСильное основание + сильная кислота
..
2NaOH + H2SO4 = Na2SO4 + 2H2O
OH- + H+ = H2O
Основание
Кислота
CH3NH2 (г) + HCl (г) → [CH3NH3]+ClОснование Кислота
6.
Протолитическая теорияСильное основание + сильная кислота
..
2NaOH + H2SO4 = Na2SO4 + 2H2O
OH- + H+ = H2O
Основание
Кислота
Основания – акцепторы
катионов водорода.
CH3NH2 (г) + HCl (г) → [CH3NH3]+ClОснование Кислота
NH3 + HCl = NH4Cl
Основание
Кислота
ХЛОРИД АММОНИЯ
7.
Свойства основанийГидроксиды металлов имеют ионную связь, а значит и ионную
кристаллическую решётку, поэтому они являются твёрдыми веществами.
Бескислородные гидроксиды имеют ковалентную связь и молекулярную
кристаллическую решётку, поэтому они являются газами, летучими
жидкостями, легкоплавкими твёрдыми веществами.
8.
Химические свойства основанийХимические свойства щелочей заключаются в их способности
диссоциировать с образованием гидроксид-ионов.
NaOH → Na+ + OHCa(OH)2 → Ca2+ + 2OH-
9.
Химические свойства основанийРеакции с кислотами
Реакции с кислотными оксидами
(нейтрализации)
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
ХЛОРИД КАЛЬЦИЯ
H+ + OH- = H2O
Ca(OH)2 + HCl = CaOHCl + H2O
ГИДРОКСОХЛОРИД
КАЛЬЦИЯ
Ca(OH)2 + CO2 = CaCO3↓ + H2O
КАРБОНАТ КАЛЬЦИЯ
Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O
10.
Химические свойства основанийРеакции с амфотерными соединениями
t
2NaOH + ZnO = Na2ZnO2 + H2O
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
ТЕТРАГИДРОКСОЦИНКАТ
НАТРИЯ
ЦИНКАТ НАТРИЯ
t
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
ЦИНКАТ НАТРИЯ
2OH- + Zn(OH)2 = [Zn(OH)4]2-
11.
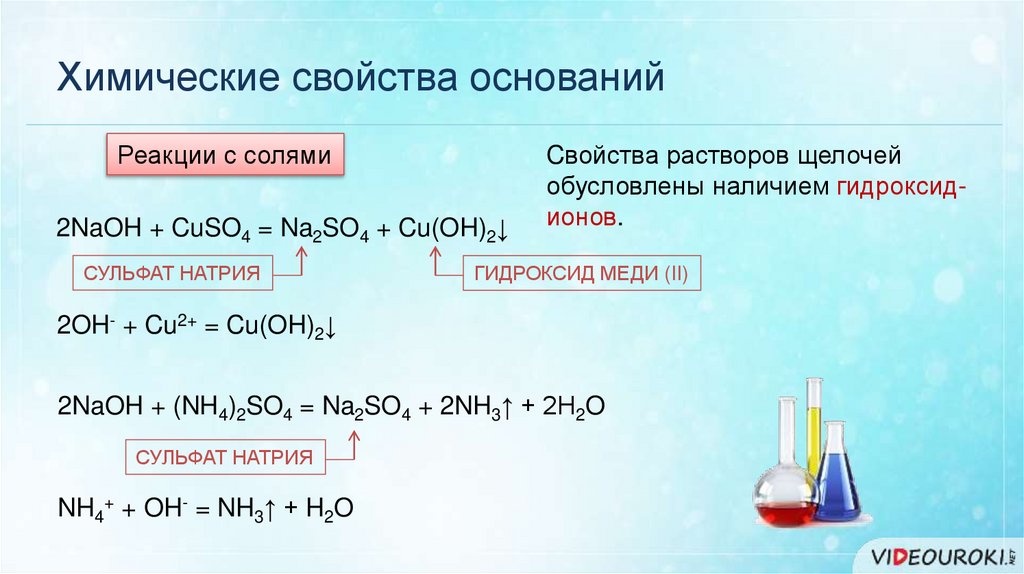
Химические свойства основанийРеакции с солями
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
СУЛЬФАТ НАТРИЯ
Cвойства растворов щелочей
обусловлены наличием гидроксидионов.
ГИДРОКСИД МЕДИ (II)
2OH- + Cu2+ = Cu(OH)2↓
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3↑ + 2H2O
СУЛЬФАТ НАТРИЯ
NH4+ + OH- = NH3↑ + H2O
12.
Химические свойства основанийРеакции с кислотами
Реакции разложения
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Cu(OH)2 = CuO + H2O
ХЛОРИД ЖЕЛЕЗА (II)
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
t
ОКСИД МЕДИ (II)
13.
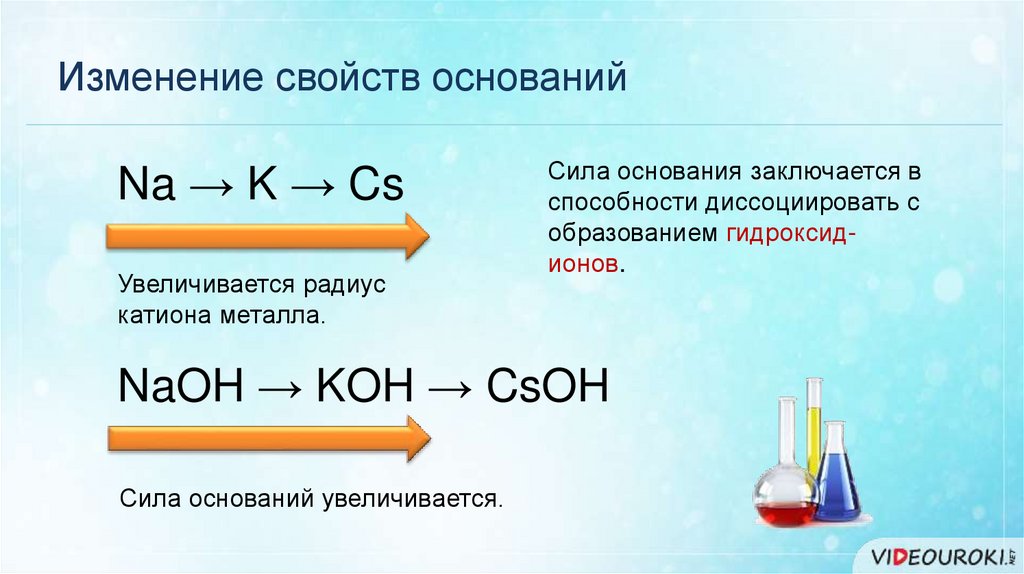
Изменение свойств основанийNa → K → Cs
Увеличивается радиус
катиона металла.
Сила основания заключается в
способности диссоциировать с
образованием гидроксидионов.
NaOH → KOH → CsOH
Сила оснований увеличивается.
14.
Изменение свойств основанийК → Са
Увеличивается
число электронов на
внешнем уровне.
Радиус атома уменьшается.
NaOH → Mg(OH)2
→ Al(OH)3
Увеличивается заряд
катиона металла.
Сила оснований уменьшается.
15.
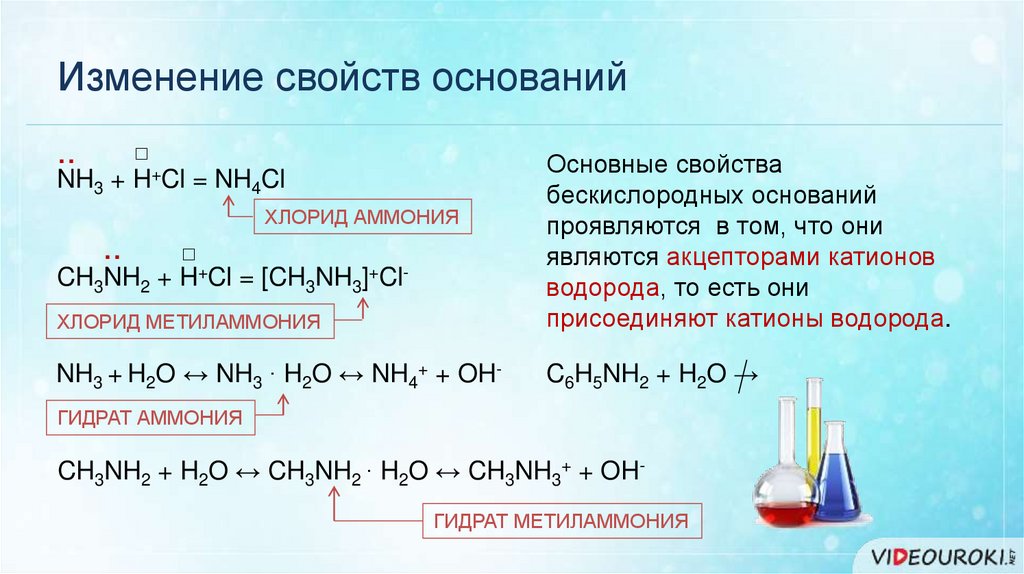
Изменение свойств оснований□
NH3 + H+Cl = NH4Cl
..
ХЛОРИД МЕТИЛАММОНИЯ
Основные свойства
бескислородных оснований
проявляются в том, что они
являются акцепторами катионов
водорода, то есть они
присоединяют катионы водорода.
NH3 + H2O ↔ NH3 ∙ H2O ↔ NH4+ + OH-
C6H5NH2 + H2O →
ХЛОРИД АММОНИЯ
..
□
CH3NH2 + H+Cl = [CH3NH3]+Cl-
ГИДРАТ АММОНИЯ
CH3NH2 + H2O ↔ CH3NH2 ∙ H2O ↔ CH3NH3+ + OHГИДРАТ МЕТИЛАММОНИЯ
16.
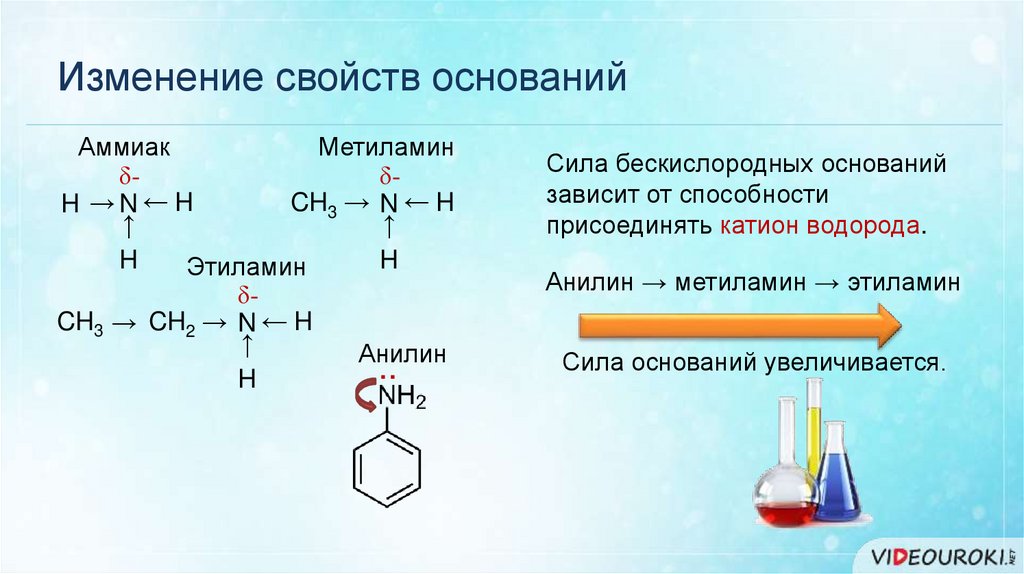
Изменение свойств основанийМетиламин
δCH3 → N H
H
H
→
→
H
Сила бескислородных оснований
зависит от способности
присоединять катион водорода.
Анилин → метиламин → этиламин
→
→
Этиламин
δCH3 → CH2 → N H
→
→
Аммиак
δH →N H
Анилин
..
Сила оснований увеличивается.
17.
Получение оснований2Na + 2H2O = 2NaOH + H2↑
Na2O + H2O = 2NaOH
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓
18.
Свойства кислородсодержащихоснований заключается в наличии
гидроксид-ионов.
Свойства бескислородных
оснований заключаются в
способности присоединять
катионы водорода.
К неорганическим основаниям
относятся щёлочи и
нерастворимые в воде основания,
к органическим – амины.













 chemistry
chemistry








