Similar presentations:
Неорганические и органические основания. 11 класс
1.
Неорганические иорганические
основания
2. Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований.
3. Основания - это…
По структурной теории—это сложныевещества, в состав которых входят
атомы металла, связанные с одной
или несколькими гидроксогруппами
(в зависимости от степени окисления
металла)
По теории ТЭД –это электролиты,
которые образуют в качестве
отрицательных ионов только
гидроксид –анионы
индикатор
Кислая среда
Щелочная
среда
Нейтральная
среда
лакмус
красный
синий
фиолетовый
фенолфталеин
бесцветный
малиновый
бесцветный
Метиловый
оранжевый
Краснорозовый
жёлтый
оранжевый
4.
Согласно протолитической теории Брёнстеда-Лоуриоснования-это молекулы или ионы, которые являются
акцепторами катионов водорода Н+ протонов.
Электронная теория Г.Н. Льюиса
основания-это вещества, имеющие неподелённые
электронные пары, донируя которые они могут
образовывать ковалентные связи с каким-либо
атомом, молекулой или ионом
5.
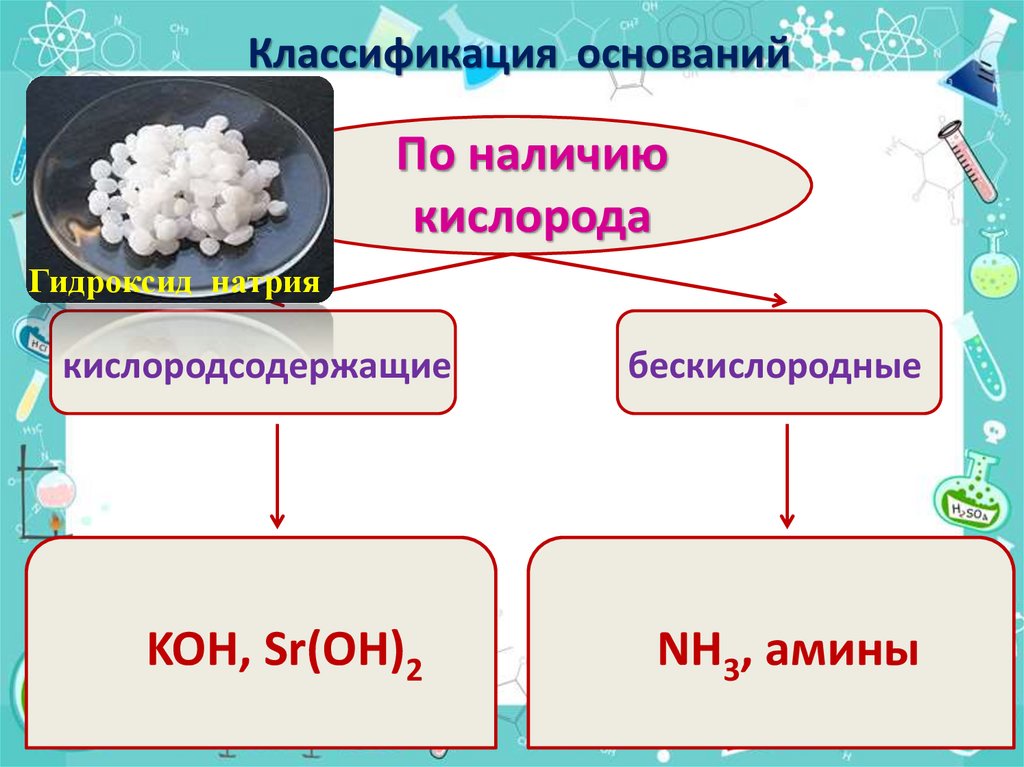
Классификация основанийПо наличию
кислорода
Гидроксид натрия
кислородсодержащие
KOH, Sr(OH)2
бескислородные
NH3, амины
6.
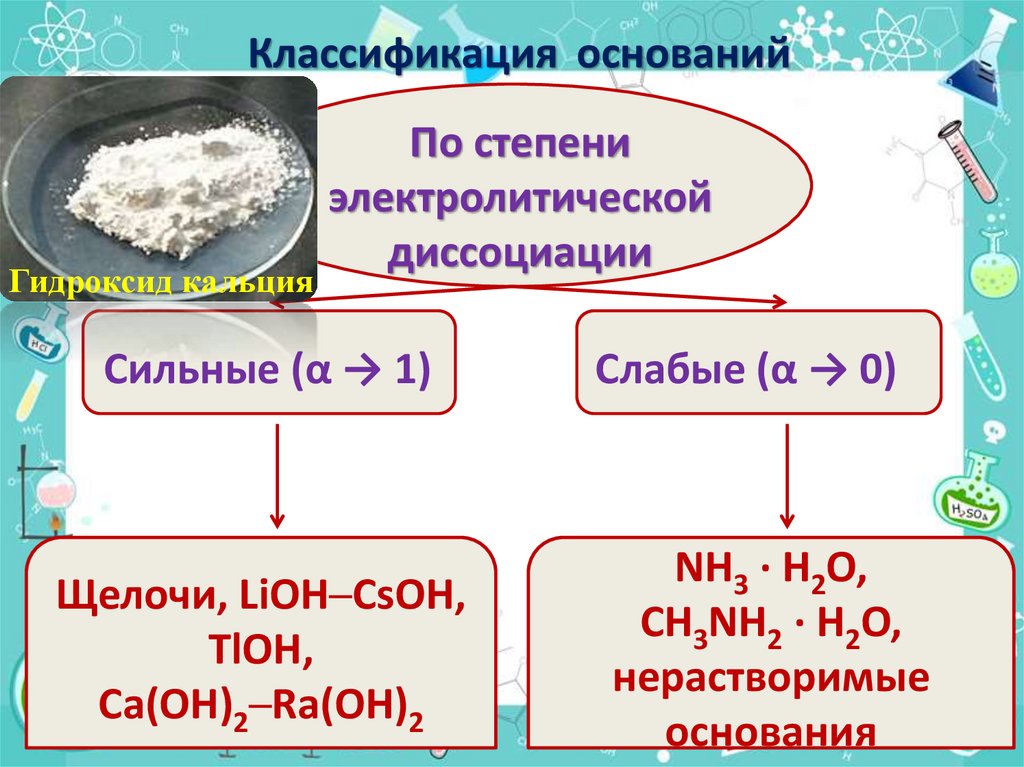
Классификация основанийГидроксид кальция
По степени
электролитической
диссоциации
Сильные (α → 1)
Щелочи, LiOH─CsOH,
TlOH,
Ca(OH)2─Ra(OH)2
Слабые (α → 0)
NH3 · H2O,
CH3NH2 · H2O,
нерастворимые
основания
7.
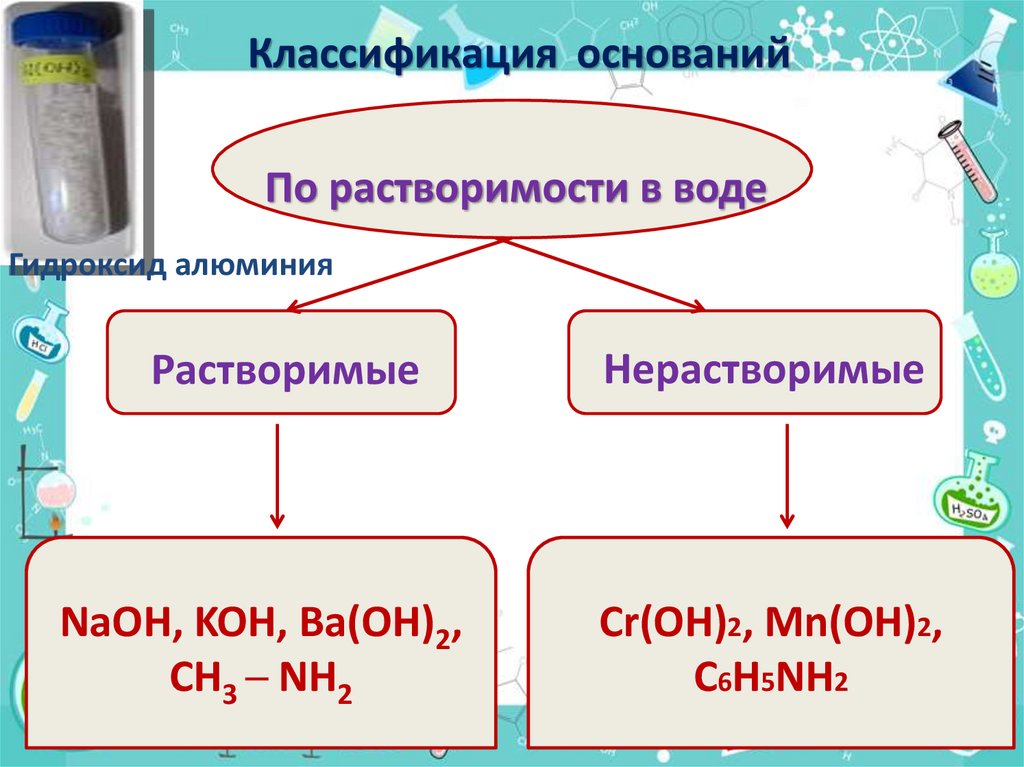
Классификация основанийПо растворимости в воде
Гидроксид алюминия
Растворимые
NaOH, KOH, Ba(OH)2,
CH3 ─ NH2
Нерастворимые
Cr(OH)2, Mn(OH)2,
C6H5NH2
8.
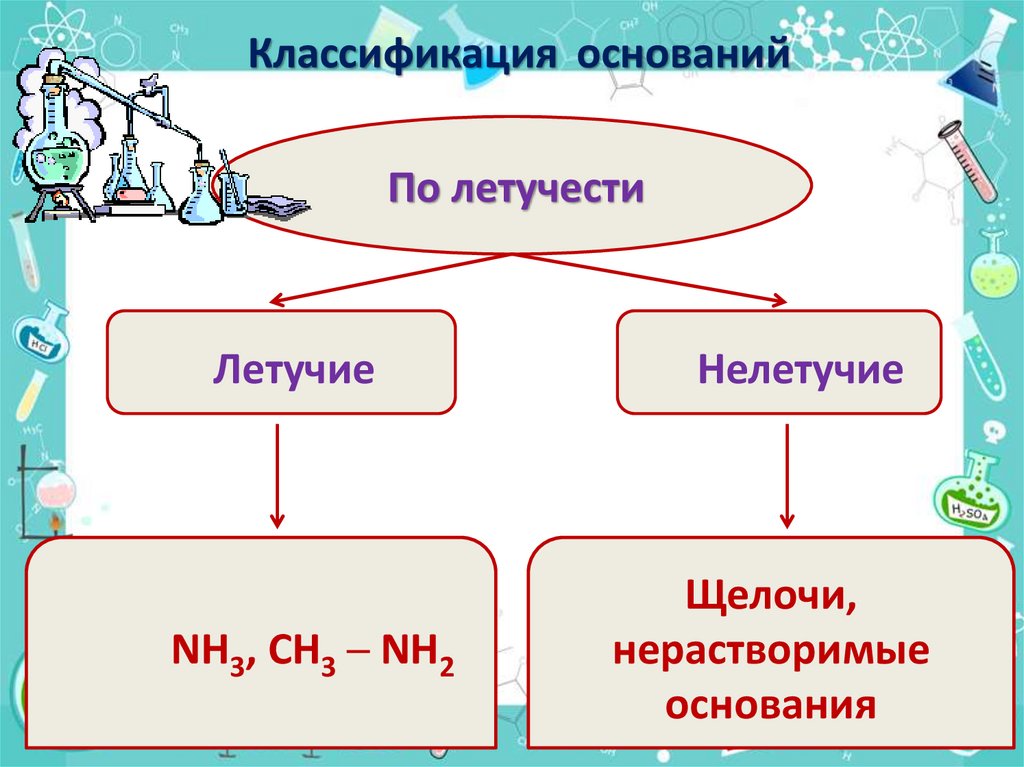
Классификация основанийПо летучести
Летучие
NH3, CH3 ─ NH2
Нелетучие
Щелочи,
нерастворимые
основания
9.
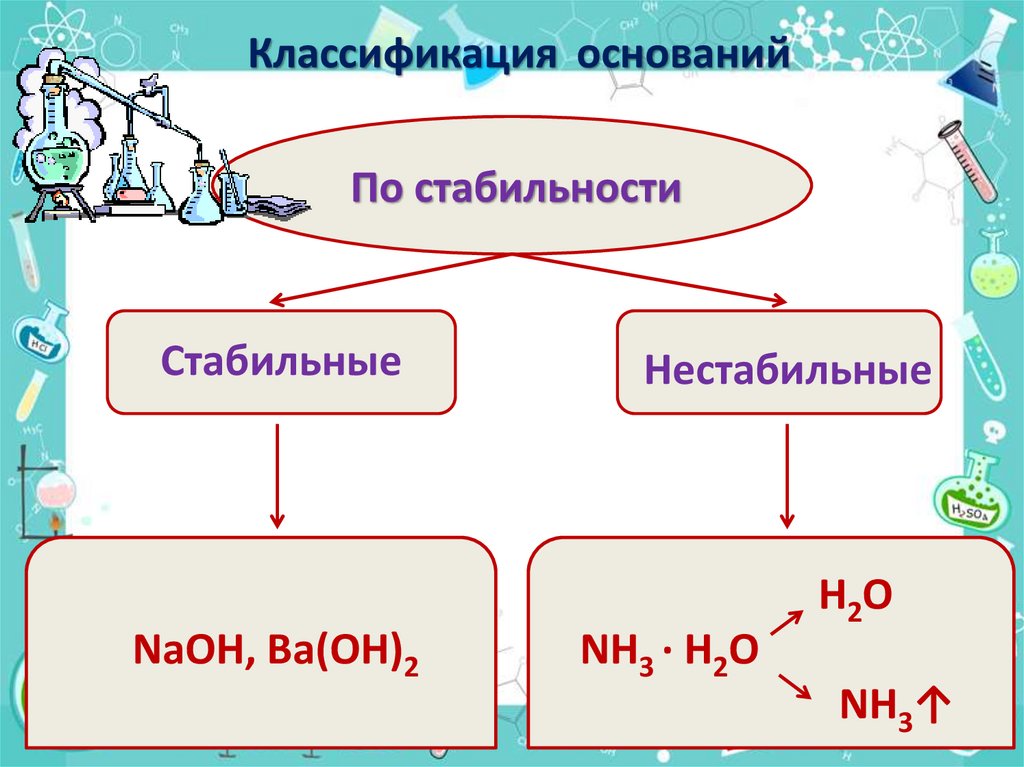
Классификация основанийПо стабильности
Стабильные
NaOH, Ba(OH)2
Нестабильные
NH3 · H2O
H2O
NH3↑
10.
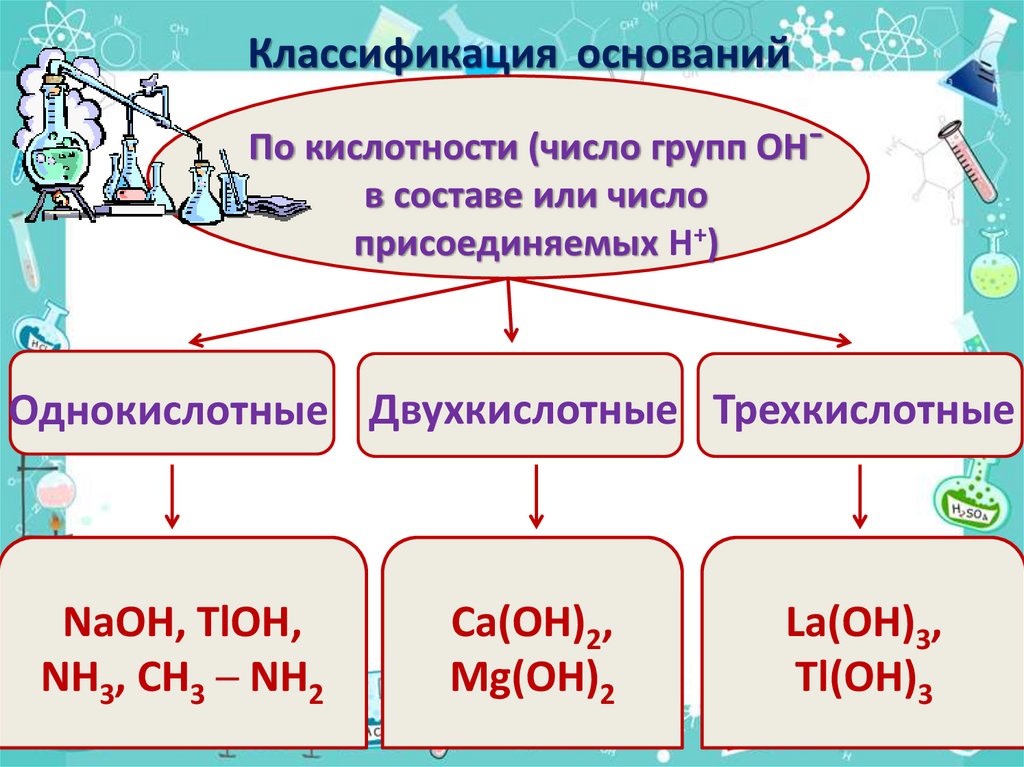
Классификация основанийПо кислотности (число групп ОН¯
в составе или число
присоединяемых H+)
Однокислотные Двухкислотные Трехкислотные
NaOH, TlOH,
NH3, CH3 ─ NH2
Ca(OH)2,
Mg(OH)2
La(OH)3,
Tl(OH)3
11. Свойства щелочей
Химические свойстваСвойства щелочей
1) Водные растворы щелочей мылкие на ощупь,
разъедают кожу, ткань.
Изменяют окраску индикаторов: Лакмус – синий,
фенолфталеин малиновый
2) Диссоциация
КОН = К+ + ОНBa(OH)2 = BaOH+ + OHBaOH+ = Ba2++ 2OH-
NaOH = Na + + OH-
12. Свойства щелочей
3)Взаимодействие с кислотами - реакция нейтрализацииNaOH + HCl = NaCl + H2O
OH- + H+ = H2O
HCOOH + KOH = HCOOK + H2O
OH-+ HCOOH = HCOO- + H2O
NH3 + HCl = NH4Cl
CH3NH2 + HCl → [CH3NH3]+Cl-
хлорид метиламмония
13. Свойства щелочей
Многокислотные основания могут давать втаких реакциях как средние так и основные
соли
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ca(OH)2 + HCl = CaOHCl + H2O
14. Свойства щелочей
4) Взаимодействие с кислотными оксидамиCa(OH)2 + CO2 = CaCO3 + H2O
Са(ОН)2 + СО2(изб) = Са(НСО3)2
5) С растворами солей, если в результате образуется
осадок или газ
FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe3+ + 3OH- = Fe(OH)3↓
2NH4Cl+Ca(OH)2 =CaCl2 +2NH3↑+2H2O
+
NH4 + OH = NH3
+ H2O
15.
Свойства щелочей6) Взаимодействие с амфотерными
гидроксидами и оксидами
а) при сплавлении:
2NaOH + ZnO = Na2ZnO2 + H2O
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
б) в растворах:
2NaOH + H2O + ZnO = Na2[Zn(OH)4]
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
16. Свойства щелочей
7)Вступают
в
реакции
с
некоторыми
органическими веществами, например с фенолом
(карболовой кислотой)
C6H5OH + NaOH = C6H5ONa + H2O
8) Вступают в реакции щелочного гидролиза
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O
CH3Br + NaOH = CH3OH + NaBr
17.
Свойства нерастворимыхоснований
Разложение нерастворимых оснований
при нагревании
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
18. Химические свойства аминов
Основные свойства:а)СН3NH2 + H2O = СН3NH3OH
Этиламин
гидроксид метиламмония
б)(С2Н5)2NH + HСl = (С2Н5)2NH2Cl
Диэтиламин
хлорид диэтиламмония
видеоопыт
19.
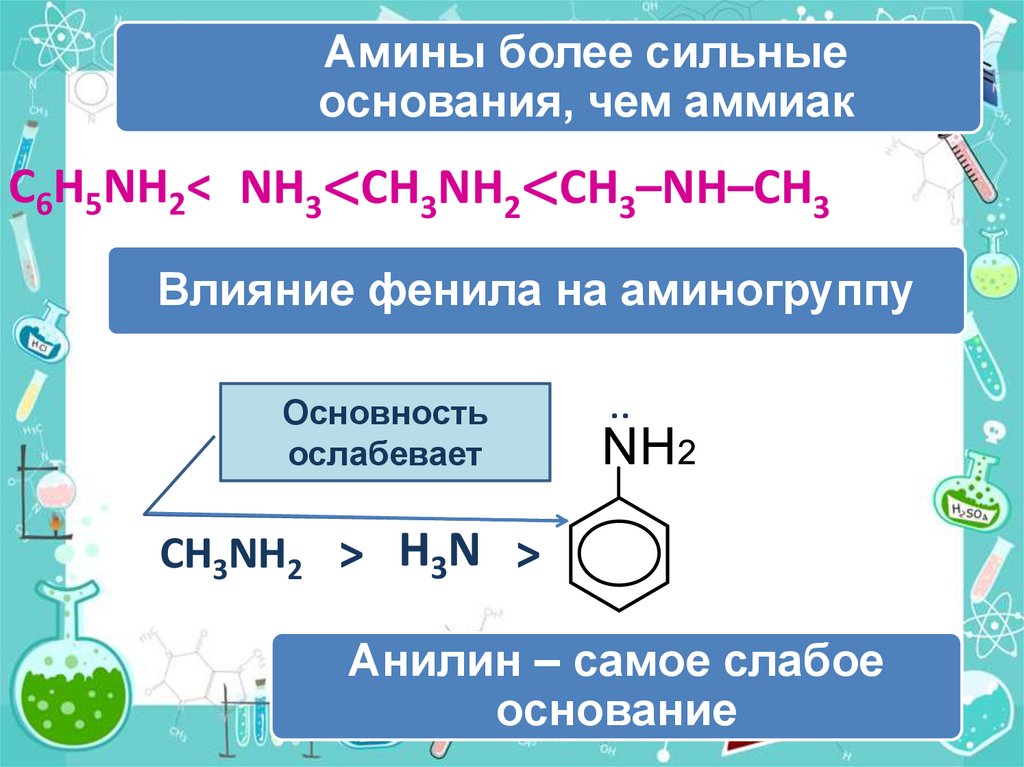
Амины более сильныеоснования, чем аммиак
C6H5NH2< NH3<CH3NH2<CH3–NH–CH3
Основность
ослабевает
:
Влияние фенила на аминогруппу
CH3NH2 > H3N >
Анилин – самое слабое
основание
20.
Химические свойства аминовАнилин
Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях
электрофильного замещения в ароматическом ядре).
Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением pэлектронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект
аминогруппы):
Уменьшение электронной плотности на атоме азота приводит к снижению способности
отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными
кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
21.
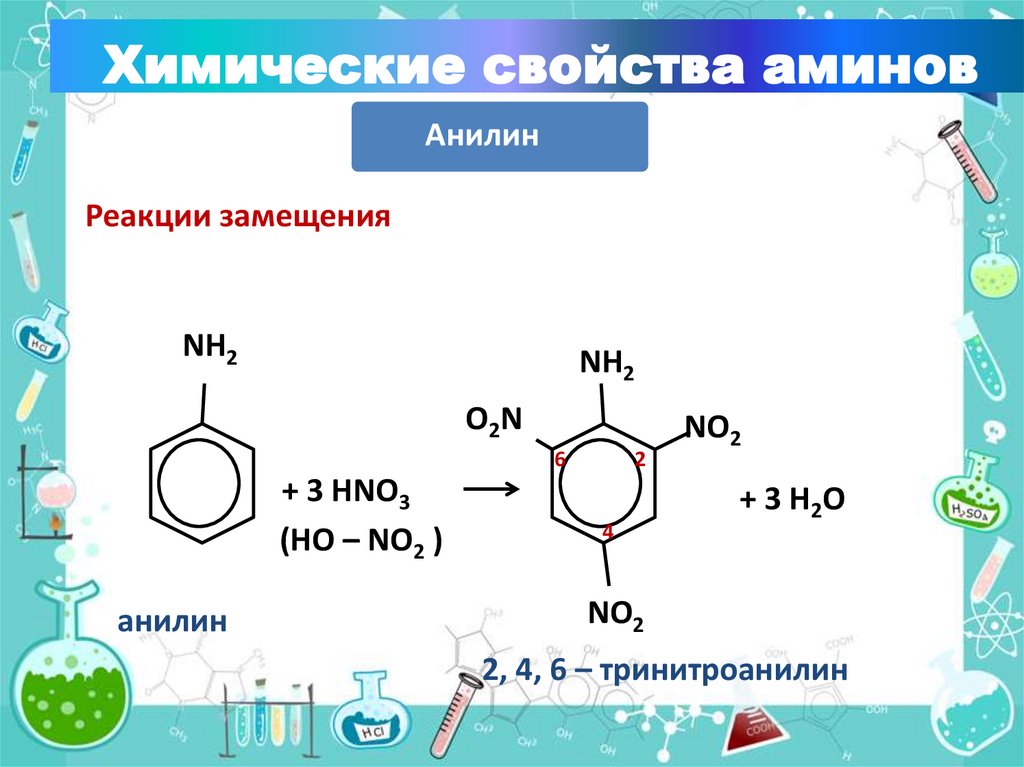
Химические свойства аминовАнилин
Реакции замещения
NH2
NH2
O2N
6
+ 3 HNO3
(HO – NO2 )
анилин
2
4
NO2
+ 3 H2O
NO2
2, 4, 6 – тринитроанилин
22.
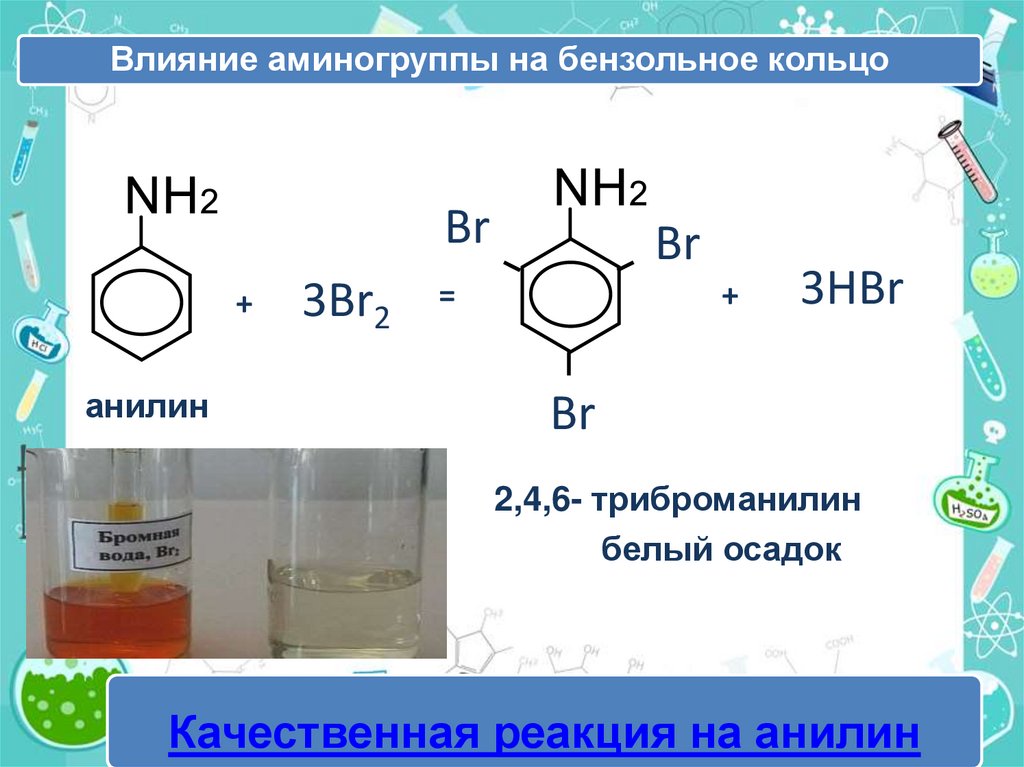
Влияние аминогруппы на бензольное кольцоBr
+
анилин
3Br2
Br
=
+
3HBr
Br
2,4,6- триброманилин
белый осадокбелый
Качественная реакция на анилин














 chemistry
chemistry








