Similar presentations:
Основания
1. Основания
2.
Основания -Гидроксид натрия
сложные вещества, которые состоят
из атомов металла или иона аммония
и гидроксогруппы (-ОН). Хорошо растворимые в воде основания называются
щелочами.
ХОН ⇄ Х+ + ОНГидроксид алюминия
Гидроксид кальция
Метагидроксид железа(III)
3.
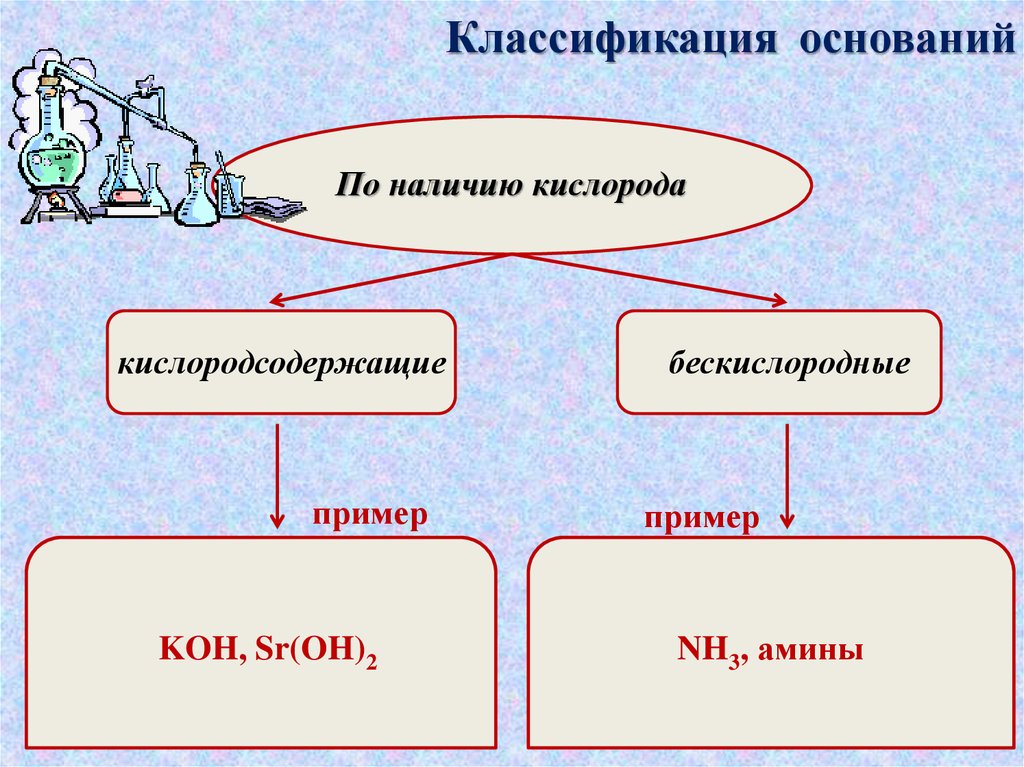
Классификация основанийПо наличию кислорода
кислородсодержащие
пример
KOH, Sr(OH)2
бескислородные
пример
NH3, амины
4.
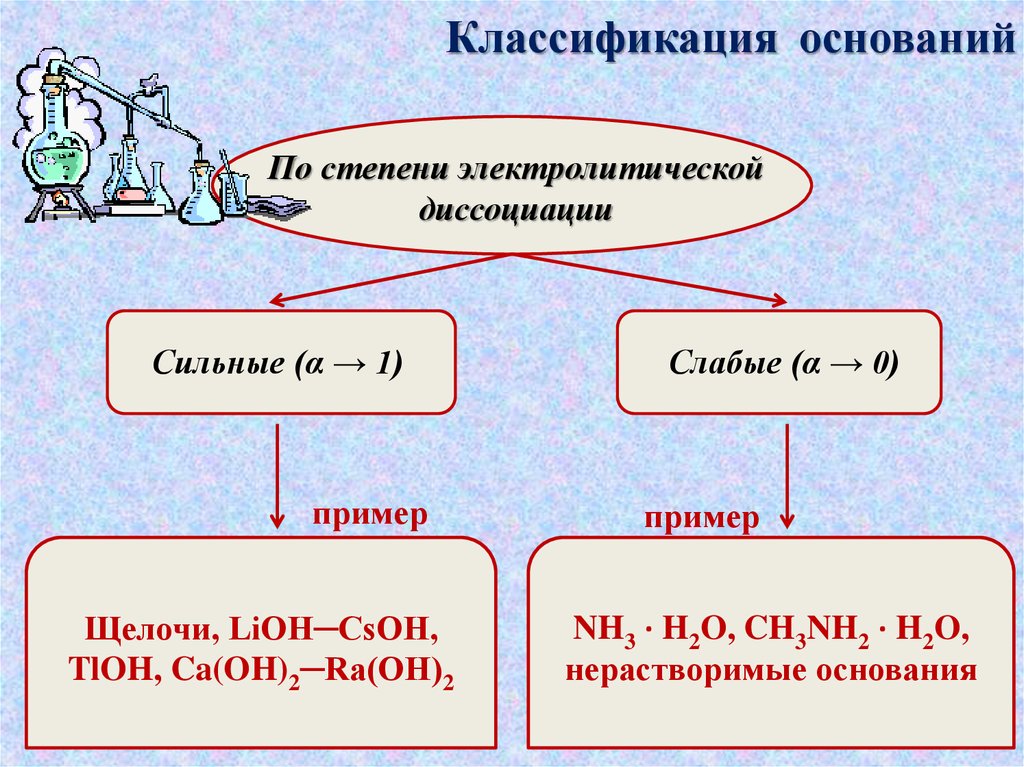
Классификация основанийПо степени электролитической
диссоциации
Сильные (α → 1)
пример
Щелочи, LiOH─CsOH,
TlOH, Ca(OH)2─Ra(OH)2
Слабые (α → 0)
пример
NH3 · H2O, CH3NH2 · H2O,
нерастворимые основания
5.
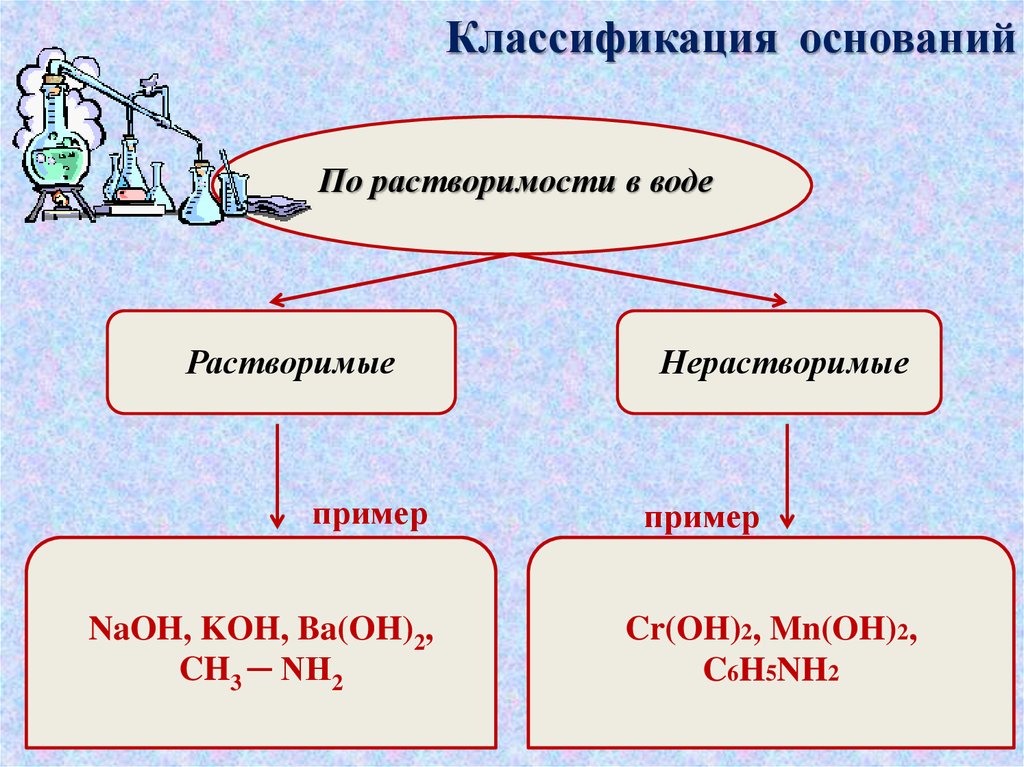
Классификация основанийПо растворимости в воде
Растворимые
пример
NaOH, KOH, Ba(OH)2,
CH3 ─ NH2
Нерастворимые
пример
Cr(OH)2, Mn(OH)2,
C6H5NH2
6.
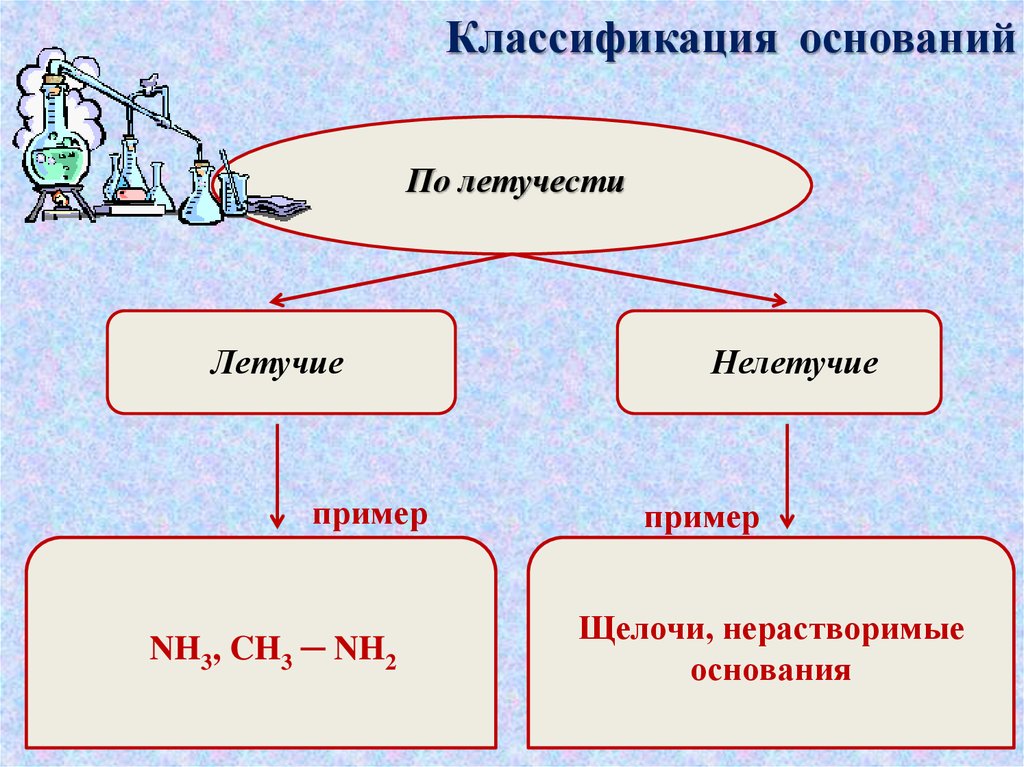
Классификация основанийПо летучести
Летучие
пример
NH3, CH3 ─ NH2
Нелетучие
пример
Щелочи, нерастворимые
основания
7.
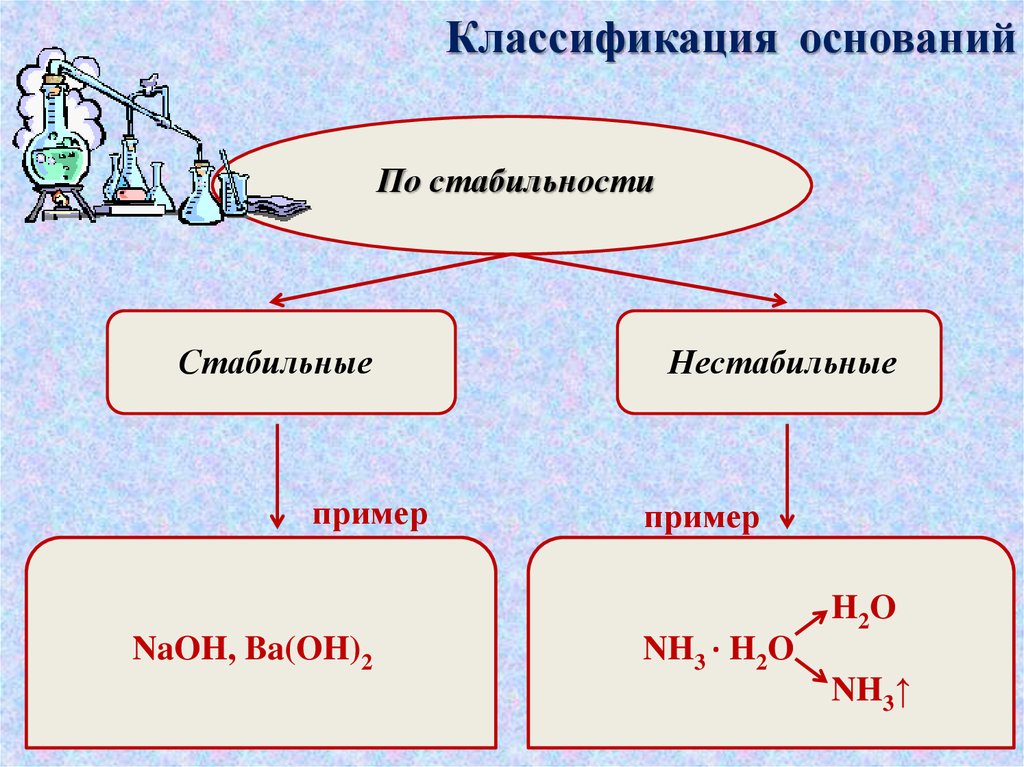
Классификация основанийПо стабильности
Стабильные
пример
Нестабильные
пример
H2O
NaOH, Ba(OH)2
NH3 · H2O
NH3↑
8.
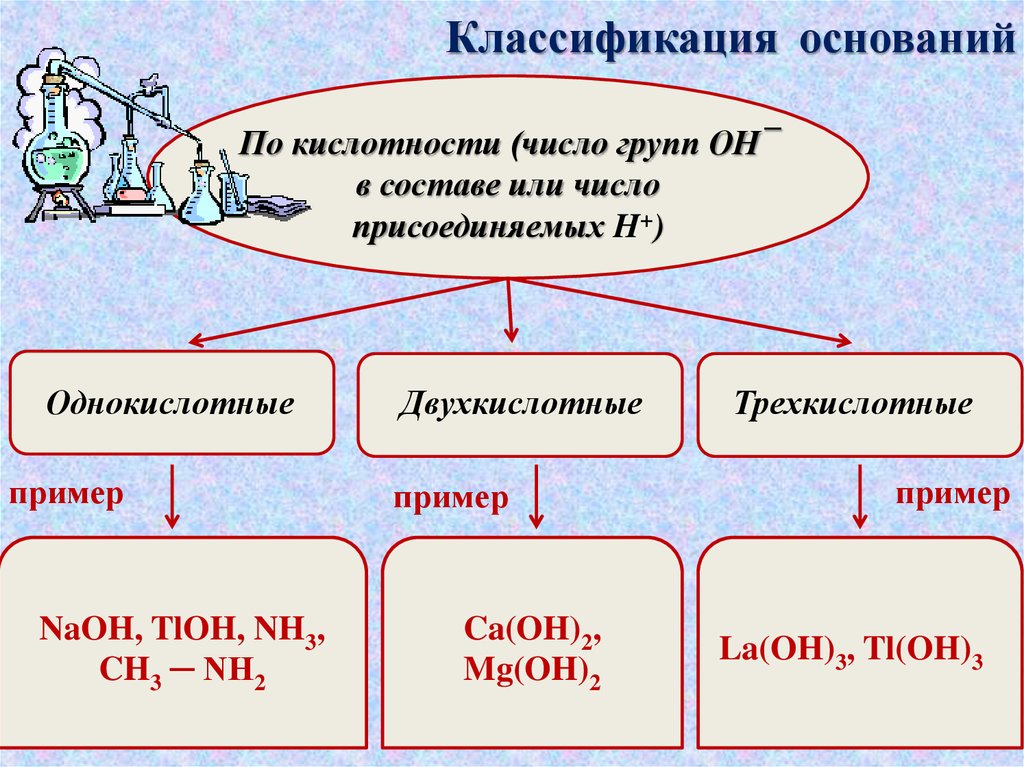
Классификация основанийПо кислотности (число групп ОН¯
в составе или число
присоединяемых H+)
Однокислотные
пример
NaOH, TlOH, NH3,
CH3 ─ NH2
Двухкислотные
пример
Ca(OH)2,
Mg(OH)2
Трехкислотные
пример
La(OH)3, Tl(OH)3
9.
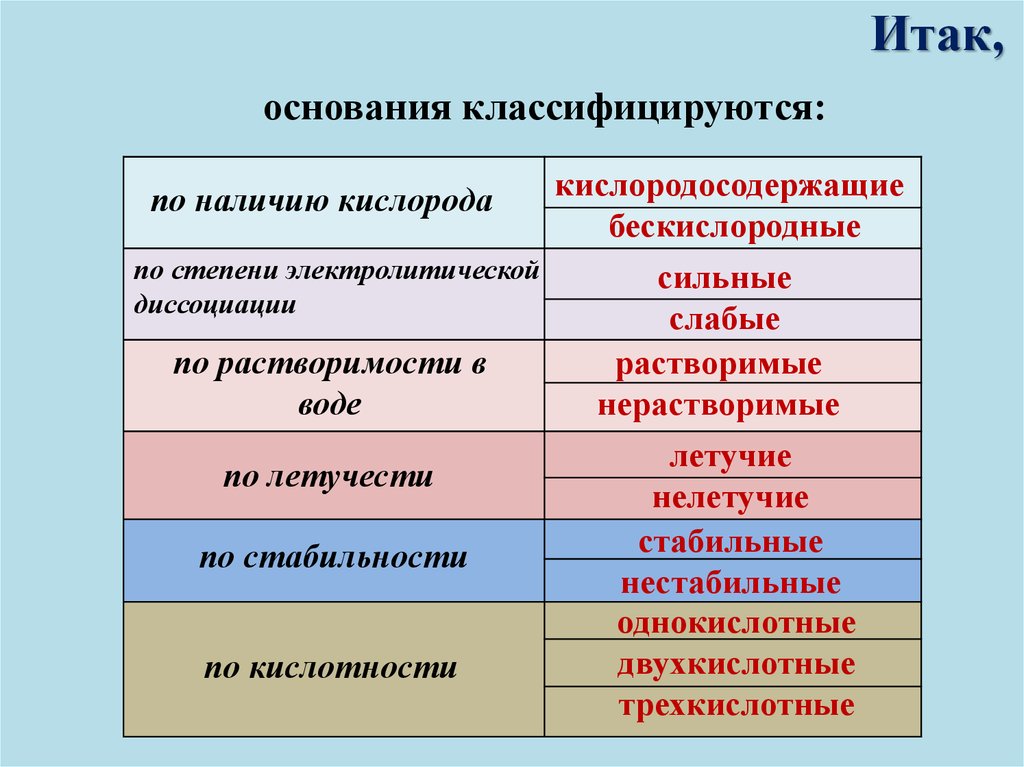
Итак,основания классифицируются:
по наличию кислорода
по степени электролитической
диссоциации
по растворимости в
воде
по летучести
по стабильности
по кислотности
кислородосодержащие
бескислородные
сильные
слабые
растворимые
нерастворимые
летучие
нелетучие
стабильные
нестабильные
однокислотные
двухкислотные
трехкислотные
10.
Химические свойства основанийВзаимодействие с кислотами
Все группы оснований объединяет их общее
свойство - взаимодействие с кислотами с
образованием солей.
Ba(OH)2 + 2CH3COOH → (CH3COO)2Ba + 2H2O
OH¯ + CH3COOH → CH3COO¯ + H2O
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
NH3 + HCl = NH4Cl
CH3NH2 + HCl → [CH3NH3]+Clхлорид метиламмония
11.
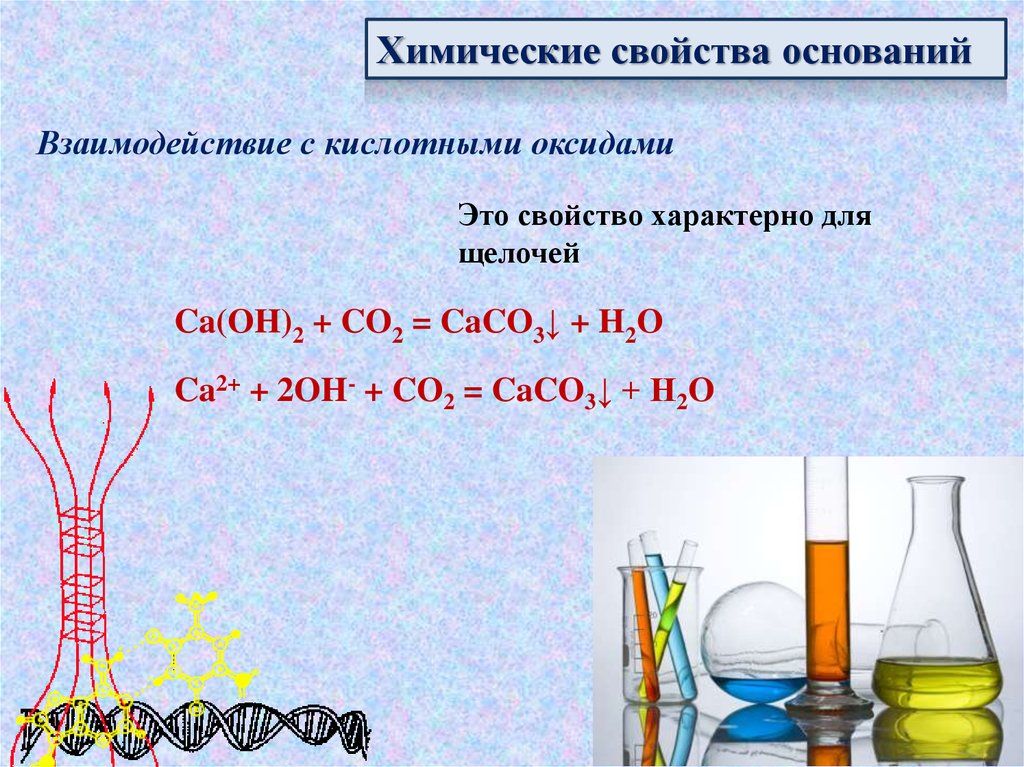
Химические свойства основанийВзаимодействие с кислотными оксидами
Это свойство характерно для
щелочей
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O
12.
Химические свойства основанийВзаимодействие с солями
Эти химические реакции подчиняются
общему правилу условий протекания
реакций между электролитами – должны
образоваться
осадок,
газ
или
малодиссоциирующее вещество
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
Fe3+ + 3OH- = Fe(OH)3↓
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Cu2+ + 2OH- = Cu(OH)2↓
Гидроксид меди
13.
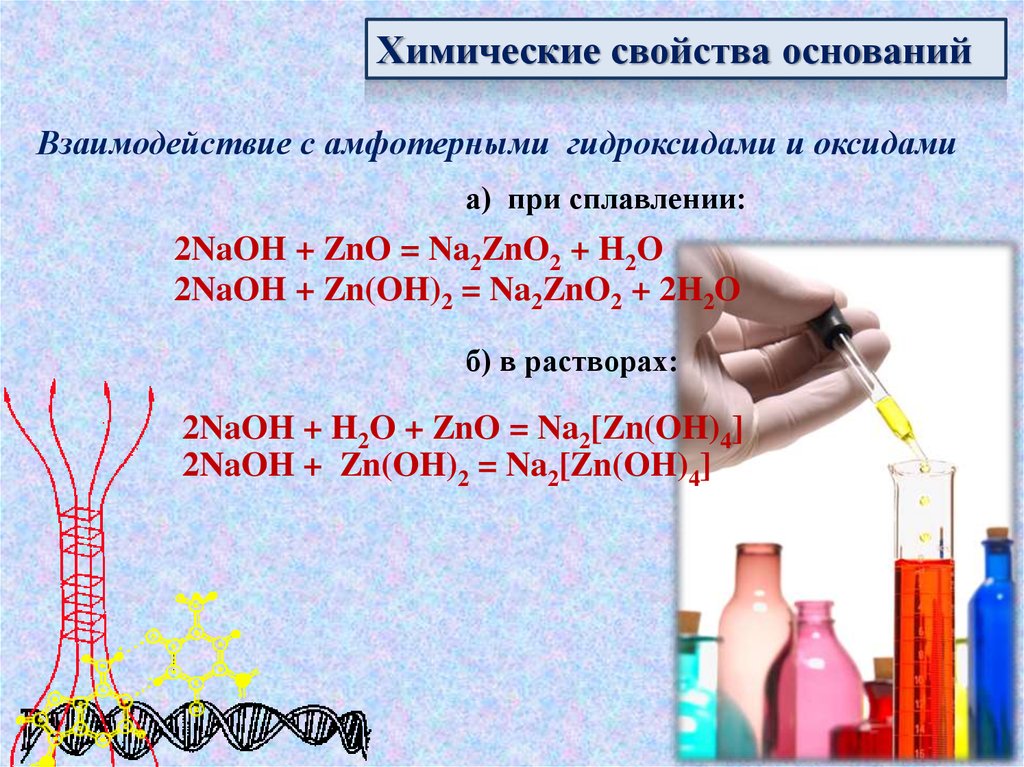
Химические свойства основанийВзаимодействие с амфотерными гидроксидами и оксидами
а) при сплавлении:
2NaOH + ZnO = Na2ZnO2 + H2O
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
б) в растворах:
2NaOH + H2O + ZnO = Na2[Zn(OH)4]
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
14.
Химические свойства основанийРазложение нерастворимых оснований
Cu(OH)2 = CuO + H2O
2Al(OH)3 = Al2O3 + 3H2O
Разложение гидроксида меди (II) при
нагревании
15.
Закрепляем темуВопрос № 1
К реакции нейтрализации можно отнести
взаимодействие
Дальше
16.
Закрепляем темуВопрос № 2
При нагревании будет разлагаться на оксид и
воду
Дальше
17.
Закрепляем темуВопрос № 3
При обычных условиях основания
Дальше
18.
Закрепляем темуВопрос № 4
Соль и вода образуются при взаимодействии
Дальше
19.
Закрепляем темуВопрос № 5
Будет вступать в реакцию с
соляной кислотой
Дальше
20.
Закрепляем темуВопрос № 6
При приливании раствора гидроксида натрия
к раствору сульфата меди (II)
Дальше
21.
Закрепляем темуВопрос № 7
В растворах щелочей лакмус и метилоранж
соответственно изменяют свои цвета на
Дальше
22.
Закрепляем темуВопрос № 8
В уравнении реакции натрия с водой
коэффициент перед водородом равен
Дальше
23.
Закрепляем темуВопрос № 9
В реакцию с гидроксидом бария вступает
Дальше
24.
"Основания" тестыВопрос 1 *
К реакции нейтрализации можно отнести взаимодействие
гидроксида калия с серной кислотой
гидроксида натрия с сульфатом магния
гидроксида натрия с оксидом кремния
хлорида меди (II) с гидроксидом бария
Вопрос 2 *
При нагревании будут разлагаться на оксид и воду
гидроксид натрия
гидроксид натрия
гидроксид калия
гидроксид железа(III)
Вопрос 3 *
При обычных условиях основания
твердые вещества
жидкости
газы
могут быть твердыми, жидкими и газообразными
25.
Вопрос 4 *Соль и вода образуется при взаимодействии
щелочи и кислотного оксида
нерастворимого основания и кислоты
щелочи и растворимой соли
разложении нерастворимого основания
Вопрос 5 *
Будет вступать в реакцию с соляной кислотой
гидроксид натрия
гидроксид кальция
гидроксид хрома (III)
все перечисленные вещества
Вопрос 6 *
При приливании раствора гидроксида натрия к раствору сульфата меди
(II)
образуется белый осадок
образуется синий осадок
выделяется газ
признаков реакции не наблюдается
26.
Вопрос 7 *В растворах щелочей лакмус и метилоранж соответственно изменяют
свой цвет на
красный и синий
синий и малиновый
синий и желтый
фиолетовый и оранжевый
Вопрос 8 *
В уравнении реакции натрия с водой коэффициент перед водородом
равен
1
2
3
4
27.
Вопрос 9 *В реакцию с гидроксидом бария вступает
оксид серы (VI)
фосфат магния
оксид калия
водород
Вопрос 10 *
Массовая доля кислорода в гидроксиде магния
24.1%
36,2%
48,4%
55.2%
Вопрос 11 *
Химические реакции возможны между
K2O и Zn
CaO и NaOH
СuO и H2
SO2 и H2O
Cu и H2S
28.
Создать презентацию и освоить темунам помогли:
О.С.Габриелян, «Химия. 11 класс»,
Дрофа, 2010
Н.Г.Троегубова, «Поурочные разработки
по химии», Вано, 2011
Шумкова Эмма, тесты по химии, 2012
http://iighjgh.blogspot.com



















 chemistry
chemistry