Similar presentations:
Якісні реакції на органічні сполуки
1. Якісні реакції на органічні сполуки
12. Ацетати CH3COO-
Ацетати CH3COO1. Утворення естерів:CH3COOH + C2H5OH
H2SO4
CH3C OC2H5 + H2O
O
2. Реакція з ферум (III) хлоридом - з’являється
червоно-буре забарвлення, яке зникає від додавання
розведених мінеральних кислот:
6CH3COO- + 3Fe3+ + 2H2O [Fe3(CH3COO)6(OH)2]+ +
2H+
2
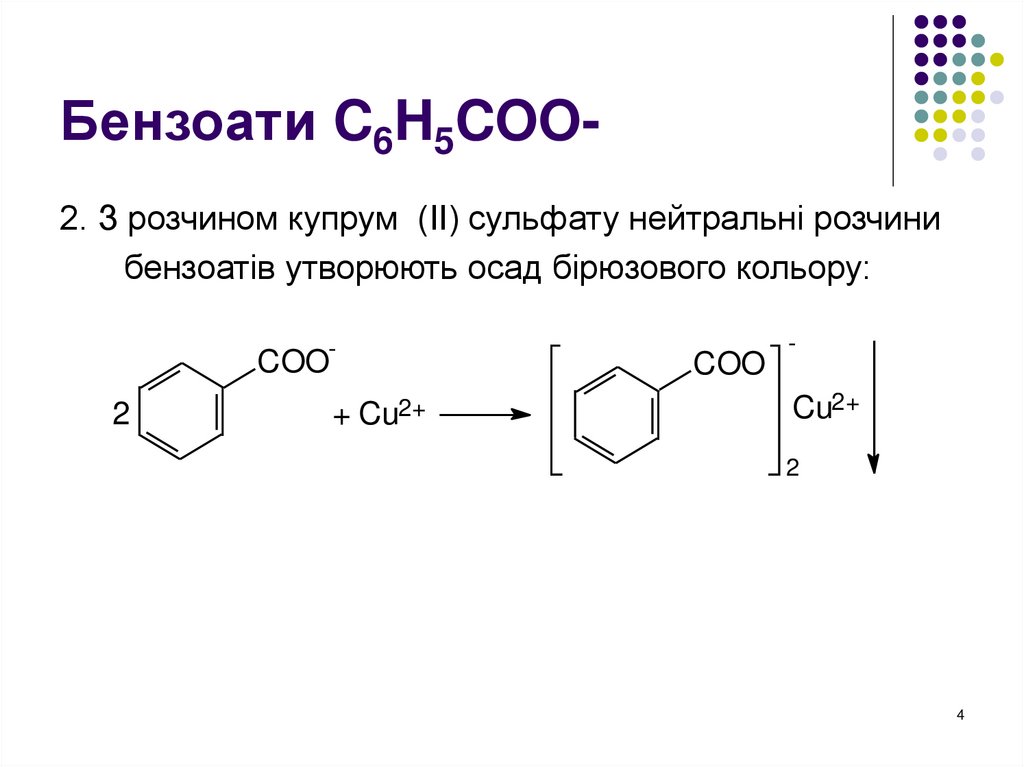
3. Бензоати C6H5COO-
Бензоати C6H5COO1. Реакція з ферум (ІІІ) хлоридом - утворюєтьсярожево-жовтий осад, розчинний в ефірі:
3
O
O
C
C
OH
NaOH
3
ONa
2FeCl3 + 10H2O
pH = 7
O
C
O
Fe *Fe(OH)3 *7H2O
3
3
4. Бензоати C6H5COO-
Бензоати C6H5COO2. З розчином купрум (ІІ) сульфату нейтральні розчинибензоатів утворюють осад бірюзового кольору:
-
COO
2
+ Cu2+
COO
-
Cu2+
2
4
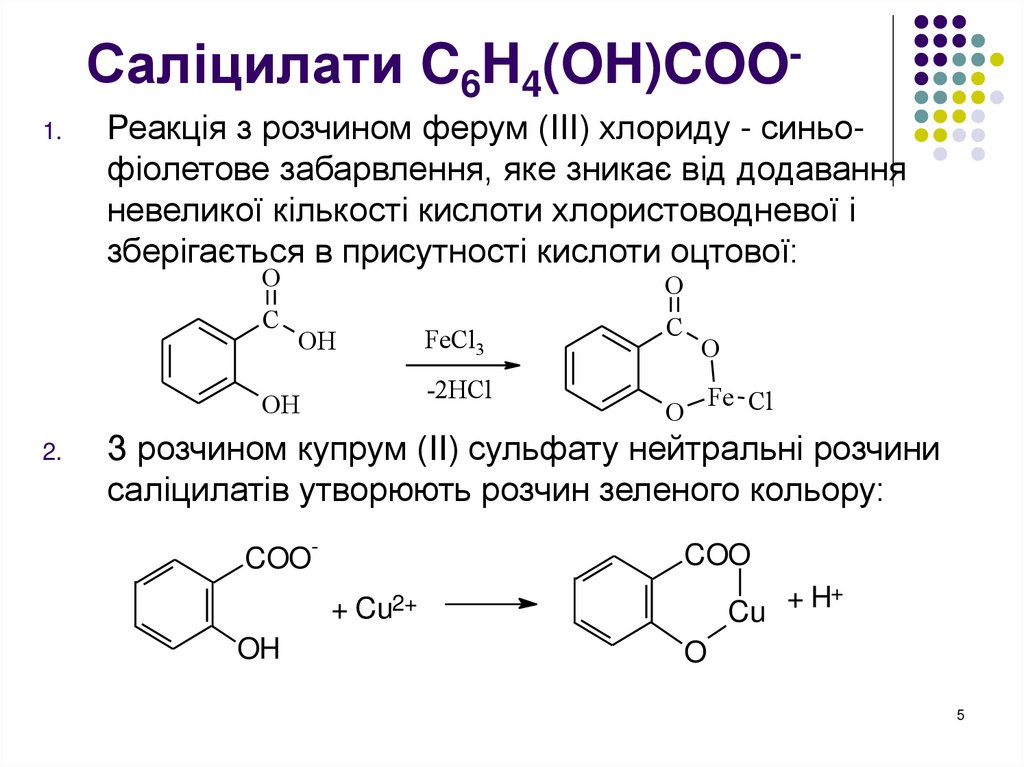
5. Саліцилати C6H4(OH)COO-
Саліцилати C6H4(OH)COO1.Реакція з розчином ферум (III) хлориду - синьофіолетове забарвлення, яке зникає від додавання
невеликої кількості кислоти хлористоводневої і
зберігається в присутності кислоти оцтової:
O
C
O
OH
-2HCl
OH
2.
FeCl3
C
O
O
Fe Cl
З розчином купрум (ІІ) сульфату нейтральні розчини
саліцилатів утворюють розчин зеленого кольору:
-
COO
COO
+ Cu2+
OH
Cu
+ H+
O
5
6. Тартрати (HOCHCOO-)2
1.Винна кислота з солями калію утворює білий
кристалічний осад кислої солі. Реакцію проводять при
охолодженні:
K+ +
HO – CH - COOH
│
→
HO - CH - COOH
HO ─ CH ─ COOK
│
↓ + H+
HO ─ CH ─ COOH
білий
До реакційної суміші додають натрію ацетат:
СН3СООNa + H+ → CH3COOH + Na+
Утворенню осаду сприяє додавання 95% спирту і
струшування пробірки. Осад нерозчинний в оцтовій
кислоті, але розчинний в мінеральних кислотах і розчинах
лугів.
6
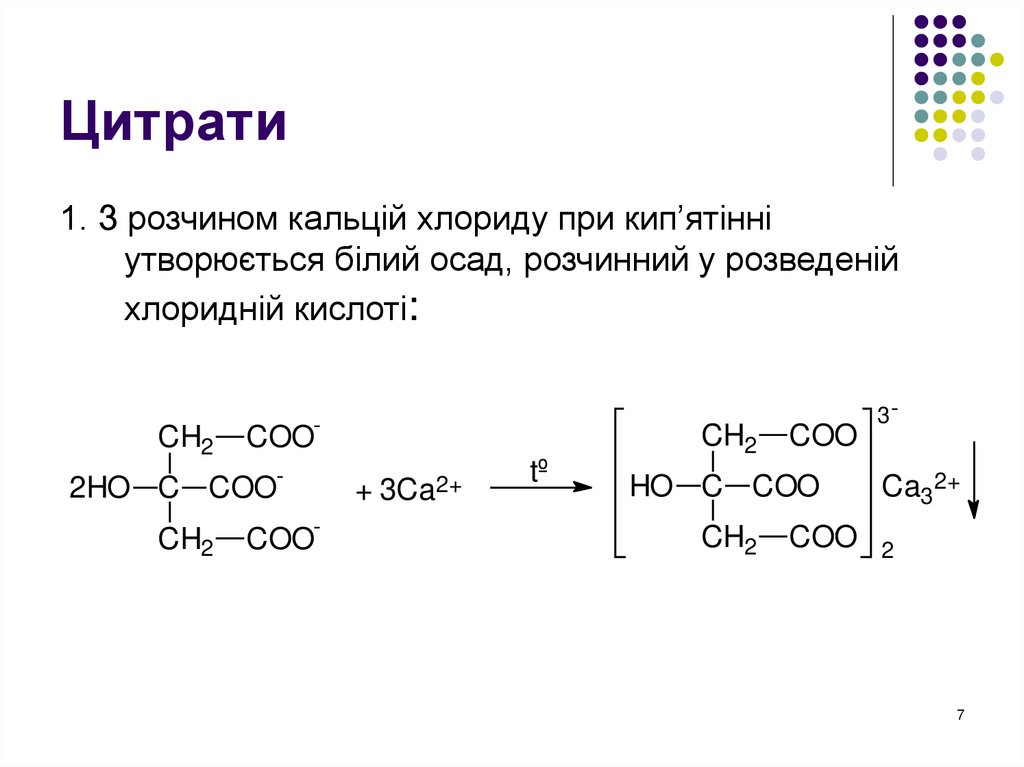
7. Цитрати
1. З розчином кальцій хлориду при кип’ятінніутворюється білий осад, розчинний у розведеній
хлоридній кислоті:
CH2
-
2HO C COOCH2
CH2
COO
COO-
+ 3Ca2+
tº
COO
HO C COO
CH2
COO
3-
Ca32+
2
7
8. Аналіз ненасичених вуглеводнів
Бромування ненасичених вуглеводнівR-CH=CH-R1 + Br2 R -CHBr-CHBr-R1
2. Окиснення ненасичених вуглеводнів (проба
Байєра)
1.
R-CH=CH-R1 + H2O + O R-CH(OH)–CH(OH)-R1
3R-CH=CH-R1 + 2 KMnO4 + 4 H2O
3 RCH(OH)-CH(OH)R1 + 2KOH +2 MnO2
8
9. 3. Положення подвійного зв'язку визначають озонуванням. 4. Дієнові вуглеводні ідентифікують за реакцією Дільса-Альдера –
утворюються кристалічніпродукти у реакції з малеїновим ангідридом.
5. Ацетилен і його похідні утворюють нерозчинні
продукти з солями арґентуму, купруму (І),
меркурію
7.
R-C
CH + [Cu(NH3)2]Cl
2 R-C
CH + K2HgI4 + 2KOH
R-C
(R-C
CCu + NH3 + NH4Cl
C)2Hg + 2H2O + 4KI
9
10. АНАЛІЗ ГАЛОГЕНОВМІСНИХ СПОЛУК
1. Найпростішою попередньою пробою на наявністьгалогену в складі органічної речовини є проба
Бельштейна.
2. Реакція з розчином арґентум нітрату
Щоб довести наявність галогену в молекулі органічної
речовини, треба перевести його в іоногенний стан.
Наприклад, для переведення галогену в іоногенний
стан використовують реакцію лужного гідролізу при
нагріванні з водним розчином натрію гідроксиду. Далі
проводять реакції з арґентум нітратом.
10
11. Виявлення спиртів
Реакція естерифікації. Продукти реакціїідентифікують за характерним запахом або
температурою плавлення.
2. Йодоформна проба
С2Н5ОН+ 4І2+6КОН СНІ3↓+5КІ+НСООК + 5Н2О
3. Реакції окиснення. Утворені при цьому альдегіди
або кетони встановлюють за характерним запахом
або відповідними якісними реакціями. Ця реакція
застосовується, наприклад, для визначення
домішки метилового спирту в етиловому.
1.
5CH3OH + 2KMnO4 + 3H3PO4
O
+ 2MnHPO4 + K2HPO4+8H2O
5 H C Fe
N H H
11
12.
COOH2
OH
O H SO (k) HOOC
2
4
+ H C
H2O
H
OH
HOOC
CH
CH2
COOH
[O]
OH
COOH
2
OH
O
12
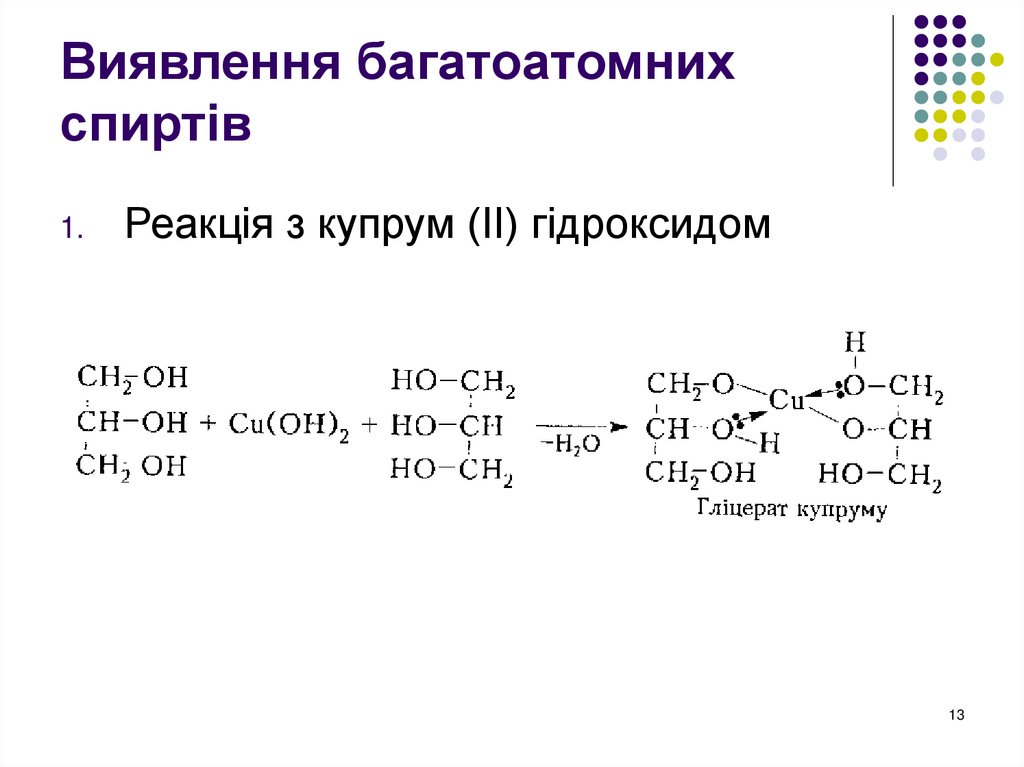
13. Виявлення багатоатомних спиртів
1.Реакція з купрум (ІІ) гідроксидом
13
14. Виявлення фенолів 1. Реакція з ферум (ІІІ) хлоридом
1415.
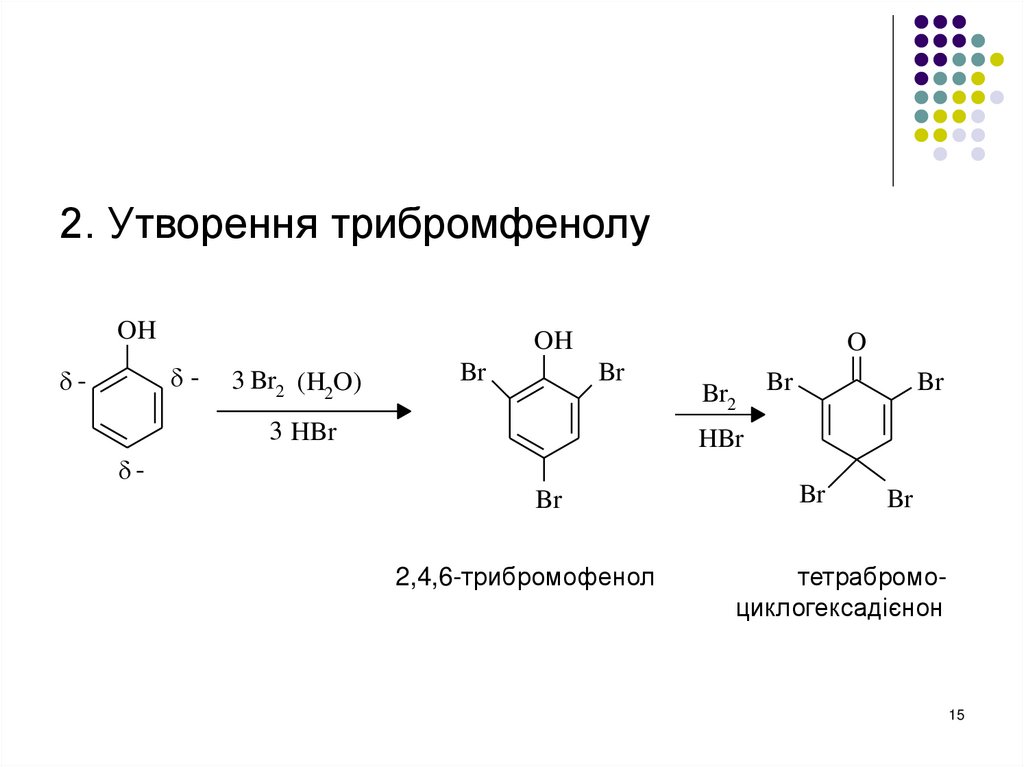
2. Утворення трибромфенолуOH
OH
-
-
3 Br2 (H2O)
Br
O
Br
3 HBr
Br2
Br
Br
HBr
Br
2,4,6-трибромофенол
Br
Br
тетрабромоциклогексадієнон
15
16. Виявлення альдегідів і кетонів
Реакція “срібного дзеркала”AgNO3 + NH4OH AgOH + NH4NO3
AgOH + 2NH4OH [Ag(NH3)2 ]OH + 2H2O
Н-CHO + 2[Ag(NH3)2 ]OH 2 Ag + 4 NH3 + H2O
+ НCOOH
2. Реакція альдегідів з купрум (ІІ) гідроксидом
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
RCHO + 2Cu(OH)2 Cu2O +2H2O+RCOOH
1.
16
17. 3. Якісні реакції на ацетон
А) I2 + 2NaOH → NaOI + NaI + H2OH3CCОCH3 + 3NaOI → H3CCОCI3 + 3NaOH
I3CCОCH3 + NaOH → CHI3+ H3CCОONa
Б) Na2[Fe(CN)5NO] + СН3С(О)СН3 + 2NH4OH →
→(NH4)2Na2[Fe(CN)5–O–N=CHC(O)CH3]
+2H2O
17
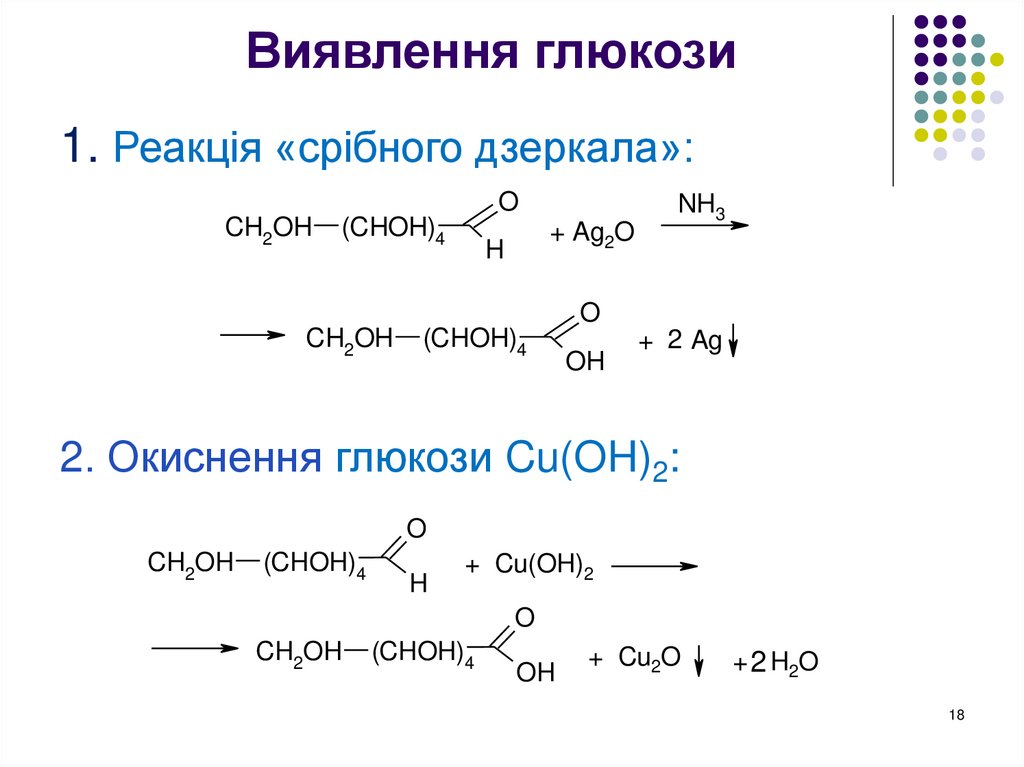
18. Виявлення глюкози
1. Реакція «срібного дзеркала»:O
CH2OH
(CHOH)4
+ Ag2O
H
NH3
O
CH2OH
(CHOH)4
OH
+ 2 Ag
2. Окиснення глюкози Cu(OH)2:
O
CH2OH
(CHOH)4
H
+ Cu(OH)2
O
CH2OH
(CHOH)4
OH
+ Cu2O
+ 2 H2O
18
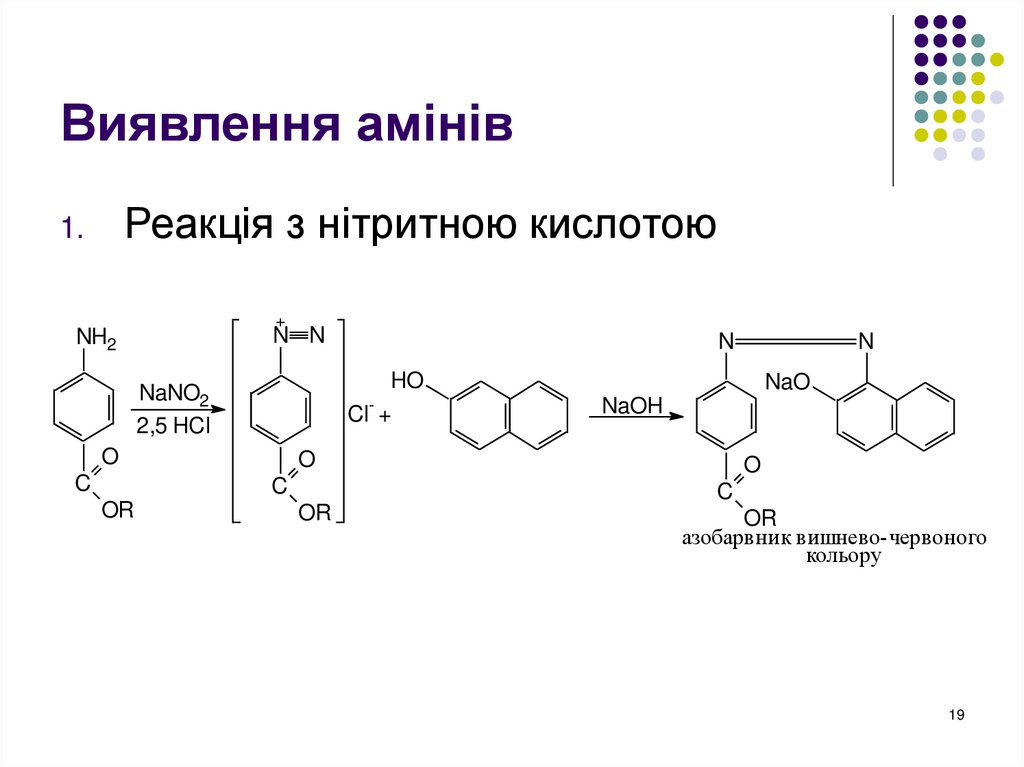
19. Виявлення амінів
Реакція з нітритною кислотою1.
+
N N
NH2
HO
Cl +
NaNO2
2,5 HCl
O
C
N
NaO
NaOH
O
C
OR
N
O
C
OR
OR
азобарвник вишнево-червоного
кольору
19
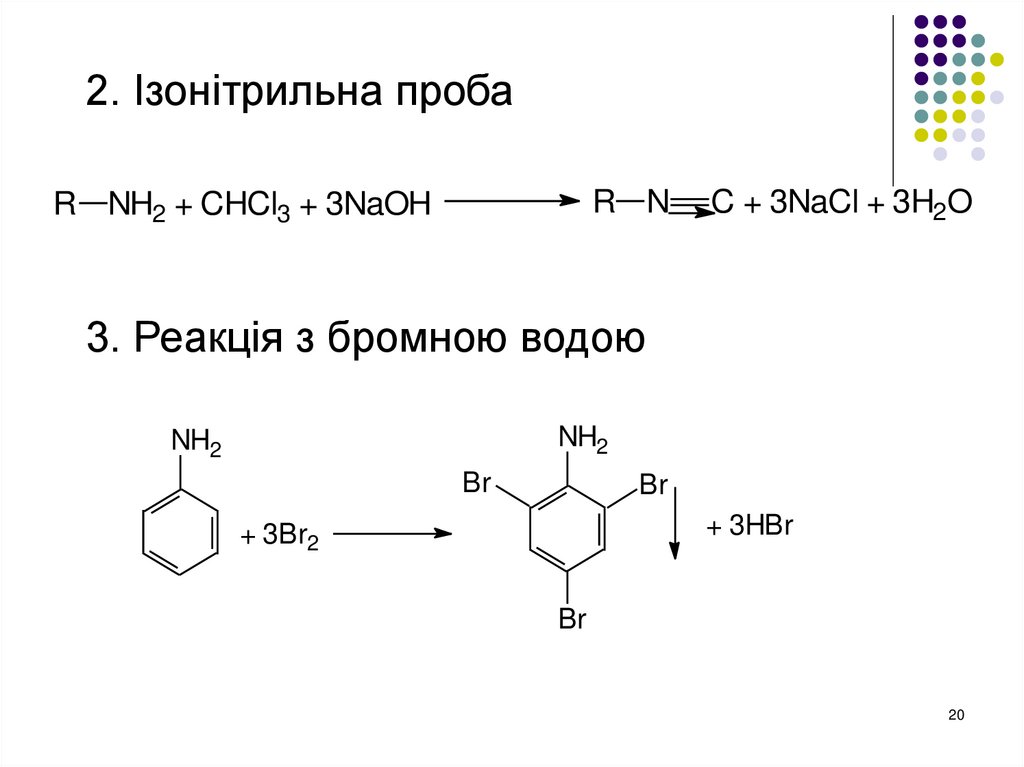
20.
2. Ізонітрильна пробаR N
R NH2 + CHCl3 + 3NaOH
C + 3NaCl + 3H2O
3. Реакція з бромною водою
NH2
NH2
Br
Br
+ 3HBr
+ 3Br2
Br
20
21. Амінокислоти аліфатичного ряду
1. Реакція з солями купруму (ІІ)NH2
OC O
2R CH COOH + CuSO4
2NaOH
R CH
Cu
NH2
NH2
CH R
CO
+ Na2SO4 + 2H2O
O
2. Реакція з нінгідрином
O
O
C
C
C
O
CO . H2O + R CH COOH
NH2
O
+ NH3 + CO2
CHOH + R C
C
H
O
21
22.
OO
O
OH
C
C
C
C
C O + H2 N H + HO HC
C N C
C
C
C
O
O
O
O
ONH4
C
C
NH3
O
C N C
C
O
O
сіль синьо-фіолетового кольру
22















 chemistry
chemistry








