Similar presentations:
Оксигенвмісні органічні сполуки. Лекція 12
1.
Лекція 12ОКСИГЕНВМІСНІ ОРГАНІЧНІ СПОЛУКИ
План
1.Загальна характеристика оксигенвмісних сполук.
2.Фізичні та хімічні властивості спиртів.
3.Властивості фенолів.
4.Властивості альдегідів і кетонів.
5.Вуглеводи.
6.Властивості карбонових кислот та їх похідних.
2.
• Оксигенвмісні сполуки – це похідні вуглеводнів,у молекулах яких один або декілька атомів
гідрогену заміщені на функційні групи, до
складу яких входить один або декілька атомів
оксигену, окрім функційної групи – NO2.
До оксигенвмісних сполук відносяться:
• Спирти – похідні вуглеводнів, у молекулах
яких один або кілька атомів гідрогену заміщені
на відповідну кількість гідроксильних груп –ОН.
Спирти називають ще алкоголями.
• Прості ефіри (етери) – це сполуки, у
молекулах яких два вуглеводневих радикали
сполучені між собою атомом оксигену. Загальна
формула етерів:
R – O – R1
3.
Карбонові кислоти – органічні сполуки, ускладі молекул яких міститься одна або
кілька карбоксильних груп.
Феноли – органічні сполуки, які містять
гідроксильну групу, безпосередньо
сполучену з атомом карбону
бензольного ядра.
Альдегіди і кетони – це клас органічних
полук, молекули яких містять
карбонільну групу >C=O (оксогрупу).
4.
Фізичні та хімічні властивості спиртів тафенолів
Залежно від будови вуглеводневого радикалу,
розрізняють:
а) насичені і
б) ароматичні спирти.
Залежно від кількості гідроксогруп одноатомні,
двоатомні, триатомні і багатоатомні
спирти.
Залежно від атома вуглецю, з яким сполучена
гідроксильна група
а) первинні R – CH2OH
б) вторинні
в) третинні спитри
5.
• За систематичною номенклатурою назвиспиртів утворюють, додаючи до назви
відповідного вуглеводню суфікс – ол. Якщо
молекула містить декілька гідроксильних груп,
то до назви додають суфікси – діол, – триол
• Нумерацію вуглецевого радикалу починають з
атома карбону, який найближче розташований
до гідроксильної групи, а місце розміщення
гідроксилу позначають локантом,
• Найпростіша ароматична сполука, що містить
гідроксил повинна б була мати назву бензенол,
проте її тривіальна назва фенол закріплена
правилами ІUРАС.
6.
• Насичені одноатомні спирти нерозгалуженої будови, якімістять від 1 до 11 вуглецевих атомів, за нормальних умов
– рідини.
• Вищі спирти, починаючи з С12, – тверді речовини.
• Фенол також є твердою речовиною, яка має специфічний
запах.
• Температури кипіння спиртів є значно вищими, ніж
температури кипіння вуглеводнів або галогенпохідних, що
мають таку ж саму кількість вуглецевих атомів.
• Багатоатомні спирти мають високі температури кипіння,
вони порівняно добре розчинюються у воді.
СН2 – СН2
СН2 – СН – СН2
ОН
ОН
ОН
Етиленгліколь
0
Ткип = 197 С
ОН
ОН
Гліцерин
Ткип = 2900С
7.
• Здатність спиртів відщеплювати протон від гідроксильноїгрупи виявляє кислотні властивості спиртів, а здатність
приєднувати протон до неподіленої електронної пари О –
атома виявляє тим самим основні властивості, тобто
спирти мають амфотерні властивості.
1. Спирти реагують з лужними металами з утворенням солей –
алкоголятів:
2 R – OH + 2 Na 2 R – ONa + H2.
Алкоголяти легко розкладаються водою:
H3C – CH2 – ONa + Н2О = CH3 – CH2 – CH2OH + NaOH.
2. Кислотні властивості гліколей (двоатомних спиртів)
більші за кислотні властивості одноатомних спиртів
через те, гліколі взаємодіють не тільки з лужними
металами, але й з лугами з утворенням солей –
гліколятів.
СН2 – ОН
CH2 – OH
+ 2NaOH
CH2 – ONa
+ 2H2O
CH 2 - ONa
8.
Кислотні властивості гліцерину виражені ще сильніше, ніж водно – та двохатомних спиртів. Гліцерин також легко
утворює гліцерати як з лужними металами, так і з лугами
та гідроксидами заліза, міді, кальцію, барію та інш.
3. Спирти реагують з мінеральними та органічними
кислотами. Продуктами такої взаємодії є відповідні
естери:
СН2 – ОН
СН2 – ОН
СН2 – ОNO2
HNO3
2HNO3
- H2O
-2H2O
СН2 – ONO2
СН2 – ОН
СН2 – ONO2
4. За наявності водовіднімаючих засобів спирти реагують з
галогенводнями з утворенням галогенідів:
Н3С – СН2 – ОН + HBr
Z nCl2
Н3С – СН2 – Br + H2O.
9.
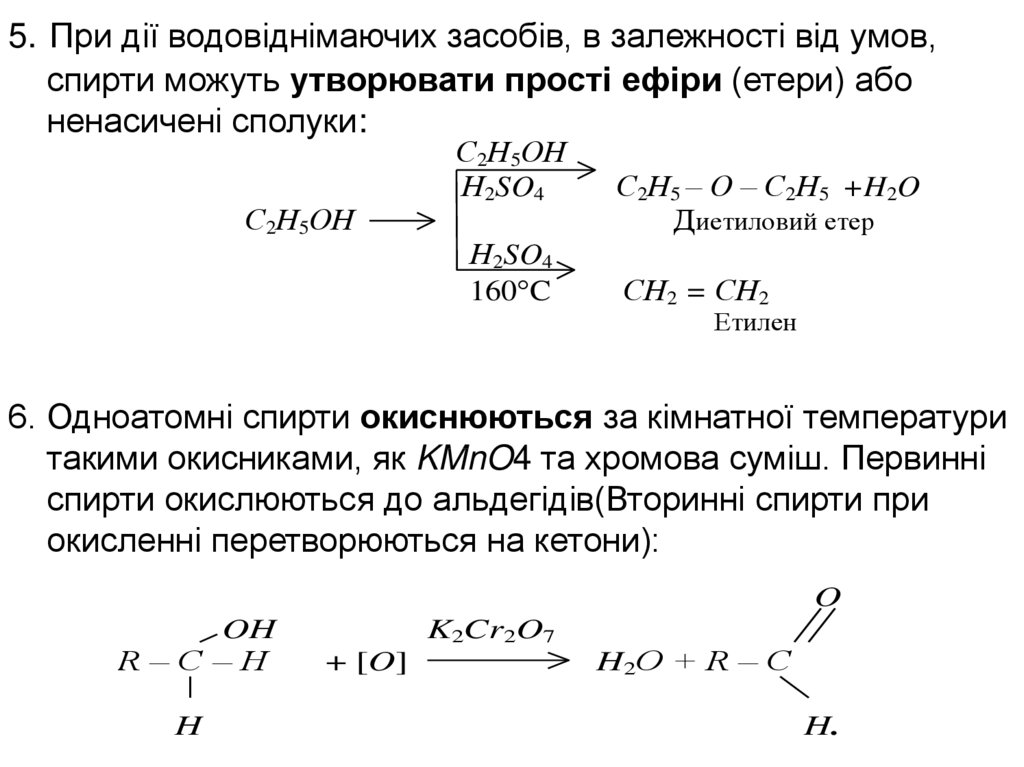
5. При дії водовіднімаючих засобів, в залежності від умов,спирти можуть утворювати прості ефіри (етери) або
ненасичені сполуки:
С2Н5ОН
С2Н5ОН
Н2SO4
Н2SO4
160 C
С2Н5 – O – С2Н5 +H2O
Диетиловий етер
СН2 = СН2
Етилен
6. Одноатомні спирти окиснюються за кімнатної температури
такими окисниками, як KMnO4 та хромова суміш. Первинні
спирти окислюються до альдегідів(Вторинні спирти при
окисленні перетворюються на кетони):
O
OH
R–C–H
H
K2Cr2O7
+ [O]
H 2O + R – C
H.
10.
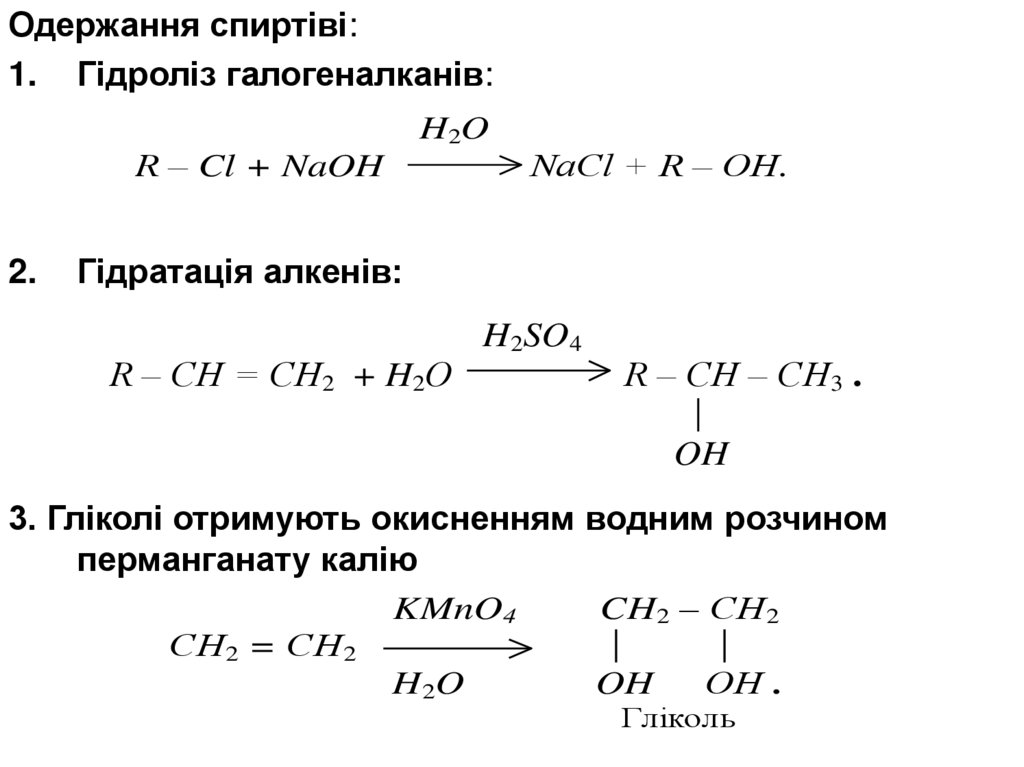
Одержання спиртіві:1. Гідроліз галогеналканів:
H2O
R – Cl + NaOH
2.
NaCl + R – OH.
Гідратація алкенів:
R – CH = CH2 + H2O
H2SO4
R – CH – CH3 .
OH
3. Гліколі отримують окисненням водним розчином
перманганату калію
СН2 = СН2
KMnO4
CH2 – СН2
H 2O
OH
ОН .
Гліколь
11.
4. Гліцерин добувають омиленням жирів –взаємодією естерів гліцеринів з водним розчином
лугу. При цьому утворюється гліцерин і суміш солей
жирних кислот, які називаються милами:
СН2 – О – СО – R1 NaOH
CH – O – CO – R2
СН2 – О – СО – R3
СН2 – ОH
CH – OH
СН2 – ОH
R1COONa
+ R2COONa .
R3COONa
12.
Вастивості фенолівФеноли мають більш виражені кислотні властивості,
ніж дво- та трьохатомні спирти,
Для фенолів характерні реакці електрофільного (Se)
заміщення по бензеновому кільцю, наприклад,
нітрування:
OH
НNO3
o - Нітрофенол
OH
NO2
NO2
- H 2O
+
OH
OH
NO 2
HNO3(к)
- H 2O
NO2
NO2
n - Нітрофенол
Пікринова кислота
( вибухонебезпечна сполука)
13.
Властивості альдегідів і кетонівАльдегіди і кетони утворюють гомологічні ряди.
Мурашиний альдегід (НСОН )– газ, наступні гомологи
альдегідів – рідини, вищі альдегіди – тверді
речовини.
О
О
О
3
2
1
Н – С – Метаналь, СН3 – С - Етаналь, СН3 – СН – С
Н
Н
СН3 Н
2 – Метилпропаноль.
-
Ацетон (пропанон, або диметилкетон) і нижчі кетони –
рідини, вищі кетони – тверді сполуки.
3
2
1
1
2
3
4
СН3 – С – СН3 – Пропанол –2, СН3 – С – СН2 – СН3 – Бутанон-2.
О
О
14.
Методи синтезу альдегідів і кетонів.1.Дегідрування спиртів:
О – H
R–C – H
H
O
Cu
300-400 C
+H 2 ;
R–C
H
Альдегід
R–C–R
O H
H
Cu
300-400 C
R – C – R + H2 .
O
Кетон
15.
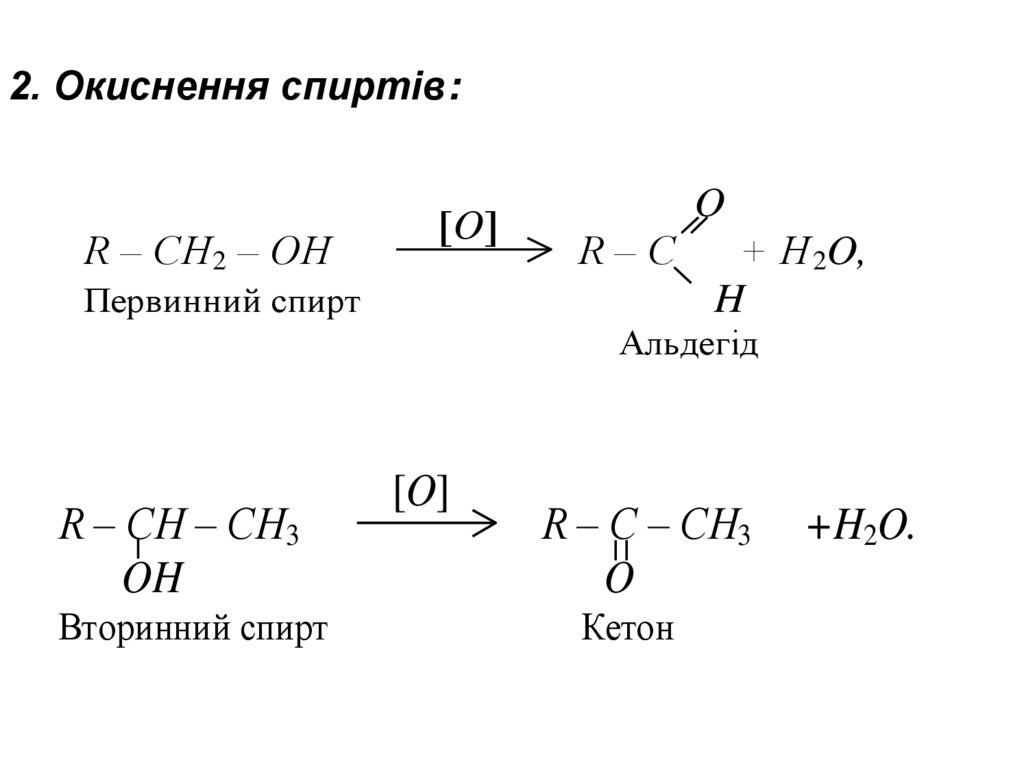
2. Окиснення спиртів:R – CH2 – OH
O
O
R–C
Первинний спирт
+ H 2O,
H
Альдегід
R – CH – CH3
OH
Вторинний спирт
[O]
R – C – CH3
O
Кетон
+H2O.
16.
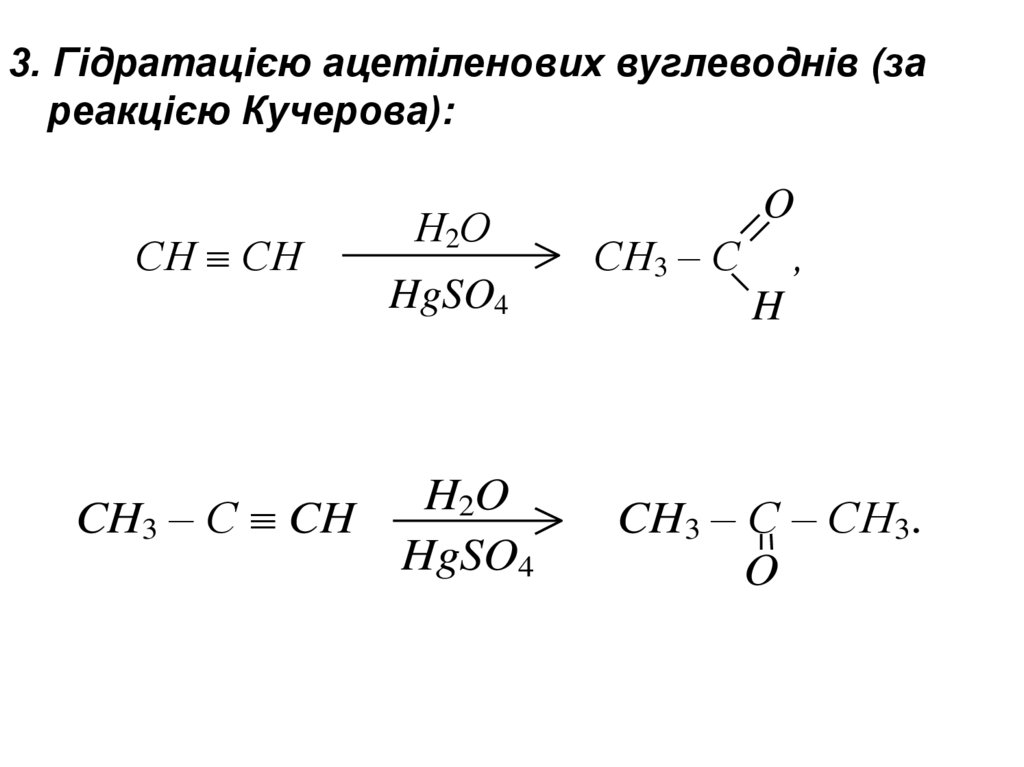
3. Гідратацією ацетіленових вуглеводнів (зареакцією Кучерова):
СН СН
CH3 – C CH
Н2О
HgSO4
H2O
HgSO4
O
CH3 – C ,
H
CH3 – C – CH3.
O
17.
Альдегіди і кетони вступають у численні реакціїприєднання до карбонільної групи, в реакції
заміщення атомів гідрогену, в реакції конденсації
і полімеризації.
1. Приєднують водень і відновлюються до спиртів:
альдегіди – до первинних спиртів, кетони – до
вторинних спиртів:
О
СН3 – СН2 – С + Н2 Pt
Н
СН3 – С – СН3 + Н2
О
Ni
СН3 – СН2 – СН2ОН
Первинний спирт
СН3 – СН – СН3
ОН
Вторинний спирт
18.
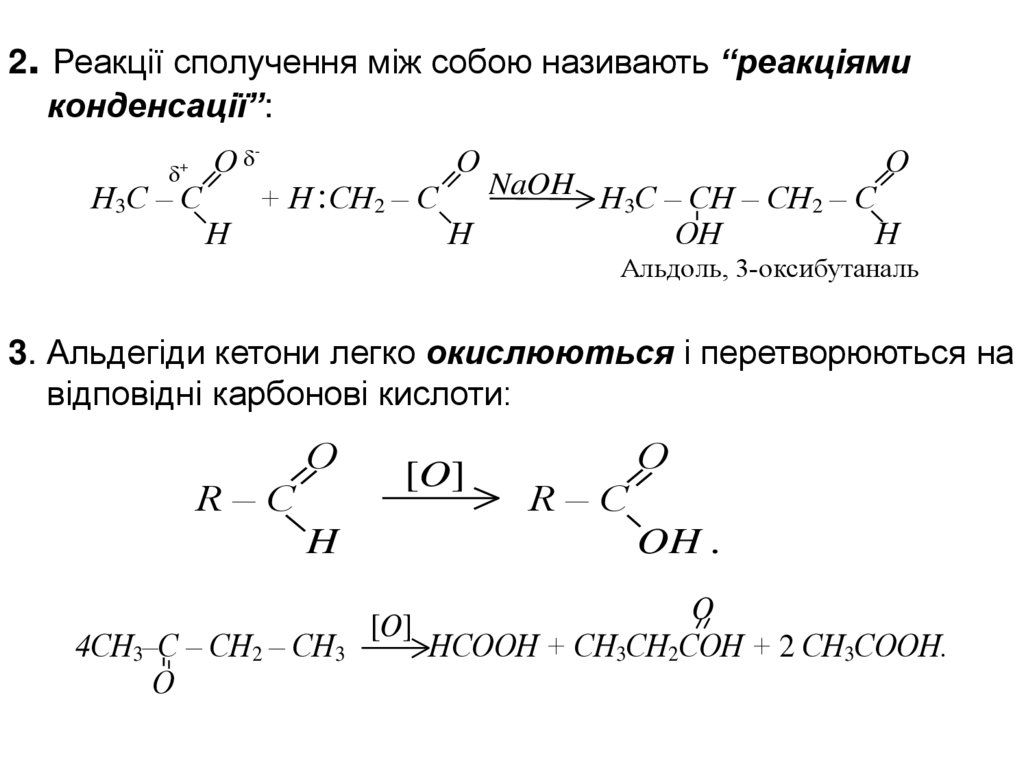
2. Реакції сполучення між собою називають “реакціямиконденсації”:
О
О
-
+
Н3С – С
Н
+ Н СН2 – С
О
NaOH Н С – СН – СН – С
3
2
Н
ОН
Н
Альдоль, 3-оксибутаналь
3. Альдегіди кетони легко окислюються і перетворюються на
відповідні карбонові кислоти:
О
R–C
[O]
H
4СН3–С – СН2 – СН3
О
О
R–C
OH .
[O]
O
НСООН + СН3СН2СОН + 2 СН3СООН.
19.
4. Реакції горіння альдегідів і кетонів відбуваютьсядо утворення диоксиду вуглецю (II) і води:
О
+ O2 nCO2 + mH2O.
R–C
H
20.
Вуглеводів, широко розповсюджені в живій природі(прості вуглеводи або моносахариди, і складні
вуглеводи або полісахариди.
Представниками вуглеводів є
- виноградний цукор (глюкоза) С6H12O6 :
6
5
4
3
2
О
1
СН2 – СН – СН – СН – СН – С
ОН ОН ОН ОН ОН
Н .
- фруктовий цукор (фруктоза) С5H10O5 ,
6
5
4
3
2
1
СН2 – СН – СН – СН – С – СН2
ОН ОН ОН ОН О ОН
- буряковий і тростинний цукор (сахароза),
- крохмаль, целюлоза (молекули целюлози містять від
600 до 6 000 залишків глюкози).
У результаті процесу фотосинтезу рослинами щорічно на
нашій планеті синтезується велика маса вуглеводів.
21.
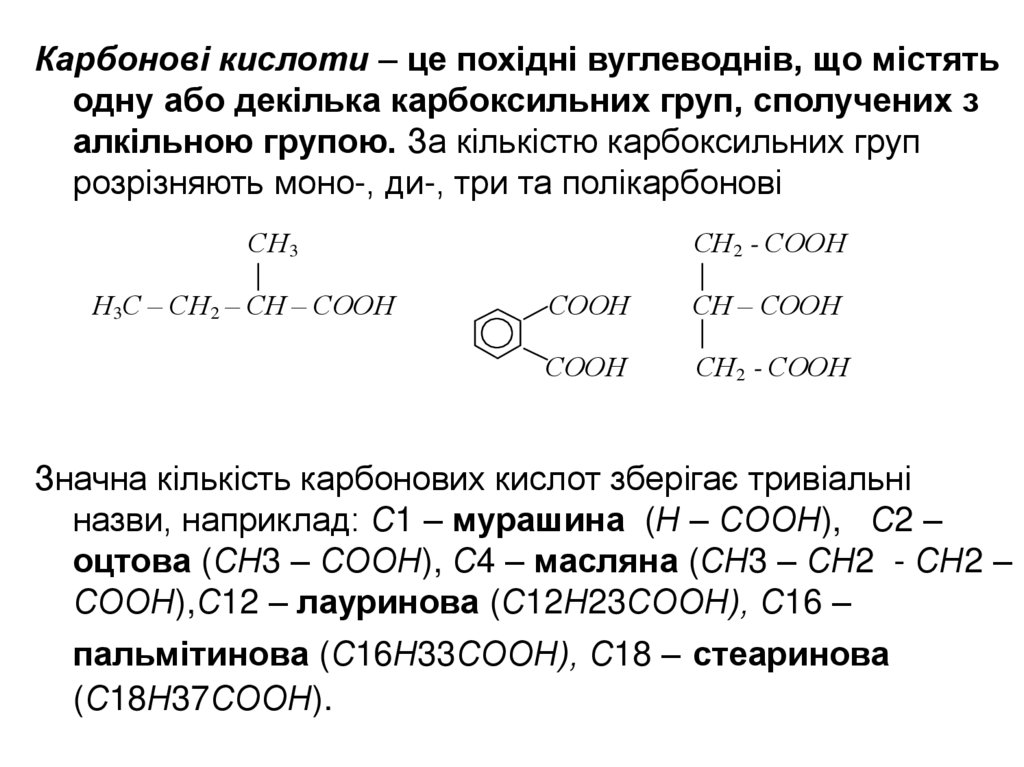
Карбонові кислоти – це похідні вуглеводнів, що містятьодну або декілька карбоксильних груп, сполучених з
алкільною групою. За кількістю карбоксильних груп
розрізняють моно-, ди-, три та полікарбонові
СН3
Н3С – СН2 – СН – СООН
СН2 - СООН
СООН
СН – СООН
СООН
СН2 - СООН
Значна кількість карбонових кислот зберігає тривіальні
назви, наприклад: С1 – мурашина (Н – СООН), С2 –
оцтова (СН3 – СООН), С4 – масляна (СН3 – СН2 - СН2 –
СООН),С12 – лауринова (С12Н23СООН), С16 –
пальмітинова (С16Н33СООН), С18 – стеаринова
(С18Н37СООН).
22.
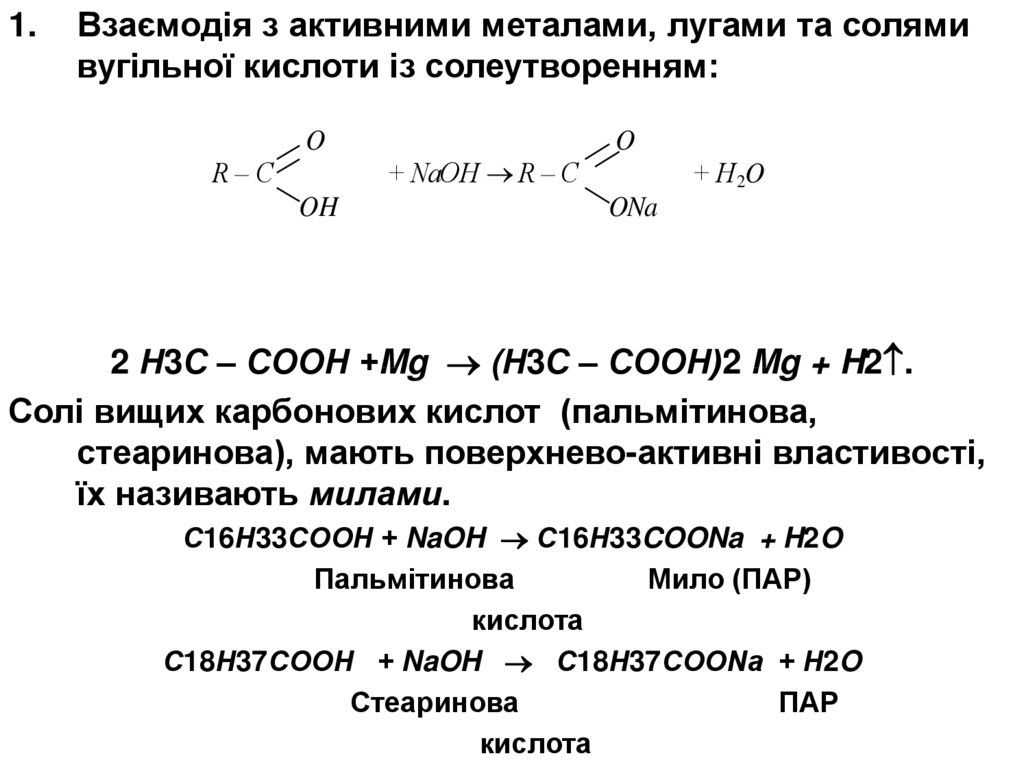
1.Взаємодія з активними металами, лугами та солями
вугільної кислоти із солеутворенням:
O
R–C
OH
+ NaOH R – C
O
+ H 2O
ONa
2 Н3С – СООН +Mg (Н3С – СООН)2 Mg + H2 .
Солі вищих карбонових кислот (пальмітинова,
стеаринова), мають поверхнево-активні властивості,
їх називають милами.
С16Н33СООН + NaOH С16Н33COONa + H2O
Пальмітинова
Мило (ПАР)
кислота
С18Н37СООН + NaOH С18Н37СООNa + H2O
Стеаринова
ПАР
кислота
23.
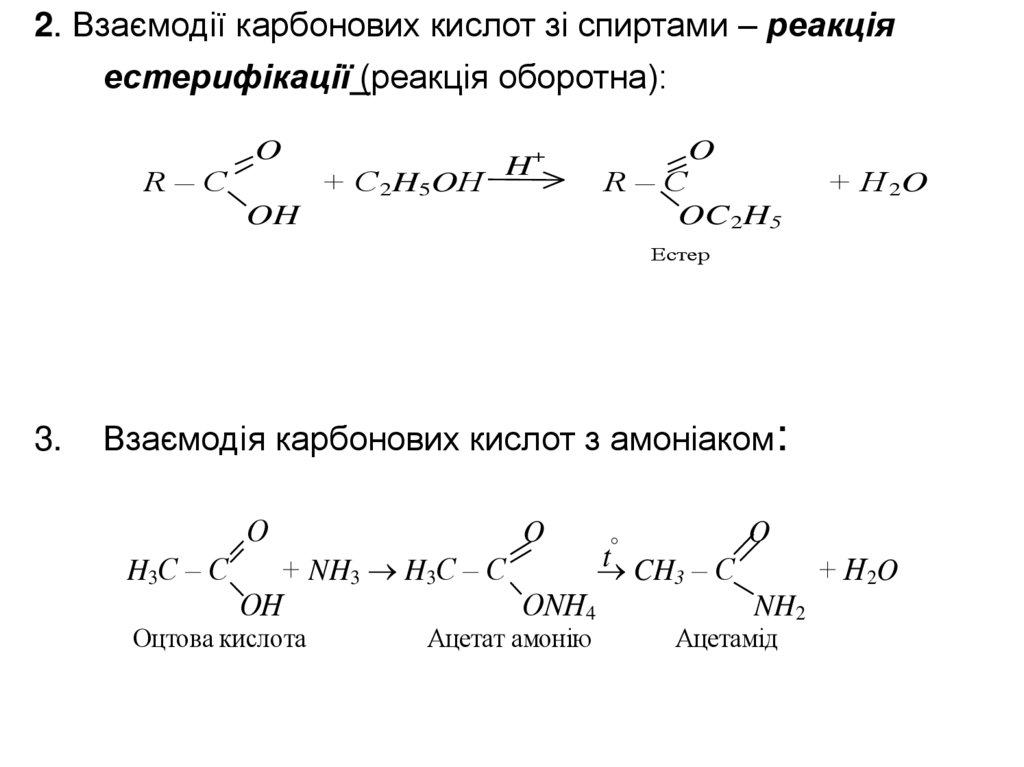
2. Взаємодії карбонових кислот зі спиртами – реакціяестерифікації (реакція оборотна):
O
R–C
+ C2H5OН
H+
OH
O
R–C
OC 2H5
+ H 2O
Естер
3.
Взаємодія карбонових кислот з амоніаком:
О
H3С – С
O
O
t CH – C
+ NH3 H3С – C
+ H2O
3
ОН
ONH4
NH2
Оцтова кислота
Ацетат амонію
Ацетамід
24.
Найважливіші представники карбонових кислот та їхзастосування.
Мурашина (метанова) кислота – НСООН. Використовують при
фарбуванні тканини, у виробництві паперу, обробці шкіри.
Оцтова (етанова) кислота – СН3СООН. Має велике значення в обміні
речовин. Є цінною речовиною у виробництві оцтового ангідриду,
монохлороцтової кислоти, ліків (аспірин, фенацетин) та багатьох
барвників. Водний розчин її (оцет) широко застосовується в харчовій
промисловості.
Адипінова (гександіова) кислота – НООС – (СН2)4 – СООН. 90% її
використовується для виробництва поліамідів, наприклад, найлона.
Метакрилова (2-метилпропенова) кислота – СН2 = С(СН3) – СООН.
Використовують її у виробництві карбоксилатних каучуків, йонообмінних
смол, поліакрилових клеїв, органічного скла та інш.
Вищі монокарбонові кислоти. Пальмітинова С15Н31СООН і стеаринова
С17Н35СООН кислоти. У вигляді складних ефірів з гліцерином вони
входять до складу більшості жирів. Солі вищих карбонових кислот
називають милами. Натрієві і калієві мила добре розчинні у воді.
Суміш пальмітинової і стеаринової кислот називають стеарином і
використовують для різних потреб, наприклад, для виготовлення свічок.
















 chemistry
chemistry








