Similar presentations:
Молекулярная физика. Газовые законы
1. Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы.
НОУ СОШ №38 ОАО «РЖД» учитель физики С. А. ВаловеньМолекулярная физика. Тепловые явления. Уравнение состояния
идеального газа. Газовые законы.
Тема: «Газовые
законы».
2. Повторение
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Перечислите основные положения МКТ.
Дайте определение относительной молекулярной
массы.
Что такое количество вещества?
Что такое молярная масса?
Какое движение называют броуновским?
Какой газ называют идеальным в МКТ?
Дайте определение и приведите примеры
макроскопических параметров.
Дайте определение и приведите примеры
микроскопических параметров.
Запишите основное уравнение МКТ. Чем оно
замечательно?
Что такое температура? В каких единицах она
измеряется?
Какое состояние системы называют тепловым
равновесием?
Запишите уравнение состояния идеального газа. Чьи
имена носит это уравнение и почему?
Какие макроскопические параметры используются в
3. Изопроцессы в газах
Процессы, протекающие при неизменном значенииодного из параметров, называют изопроцессами.
Рассмотрим следующие изопроцессы:
Название
процесса
Изотермический
процесс
Изобарный
процесс
Изохорный
процесс
Постоянная
величина
T = const
p = const
V = const
4. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
5. Изотермический процесс -
Изотермический процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянной температуре.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при T = const
произведение pV = const (закон Бойля – Мариотта).
р, Па
Т2
изотермы
Т2 > Т1
Р. Бойль
0
р, Па
Если T = const, то
при V↓ p↑,
и наоборот V↑ p↓
Э. Мариотт
0
Т1
V, м³
V, м³
Т, К
0
Т, К
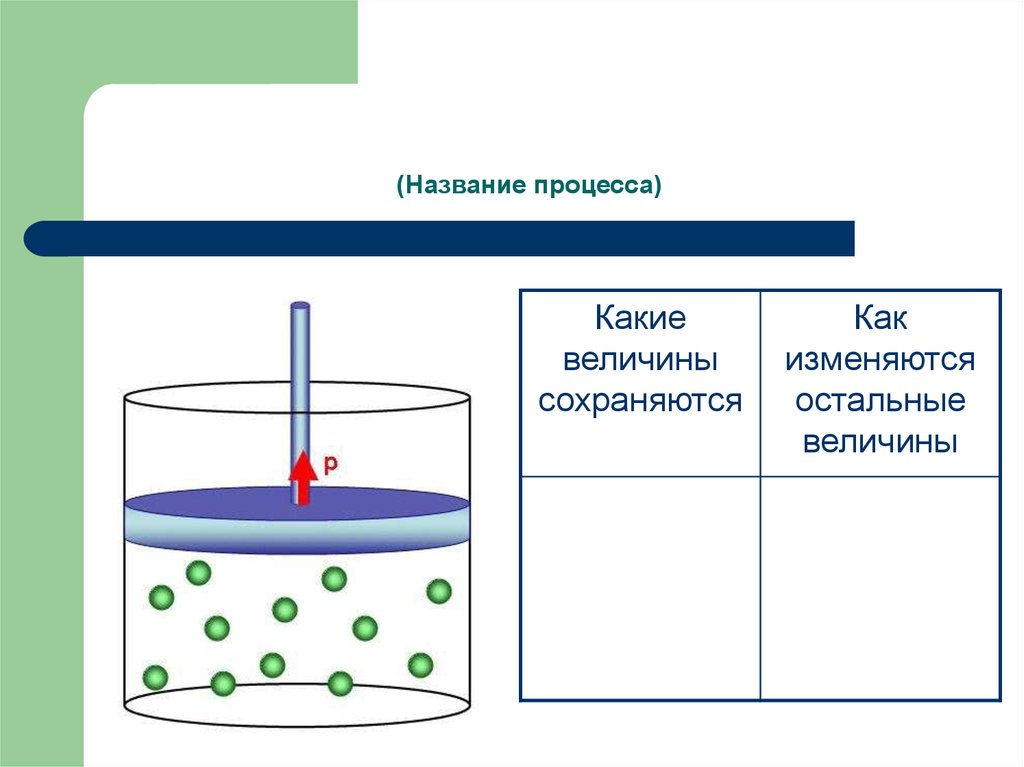
6. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
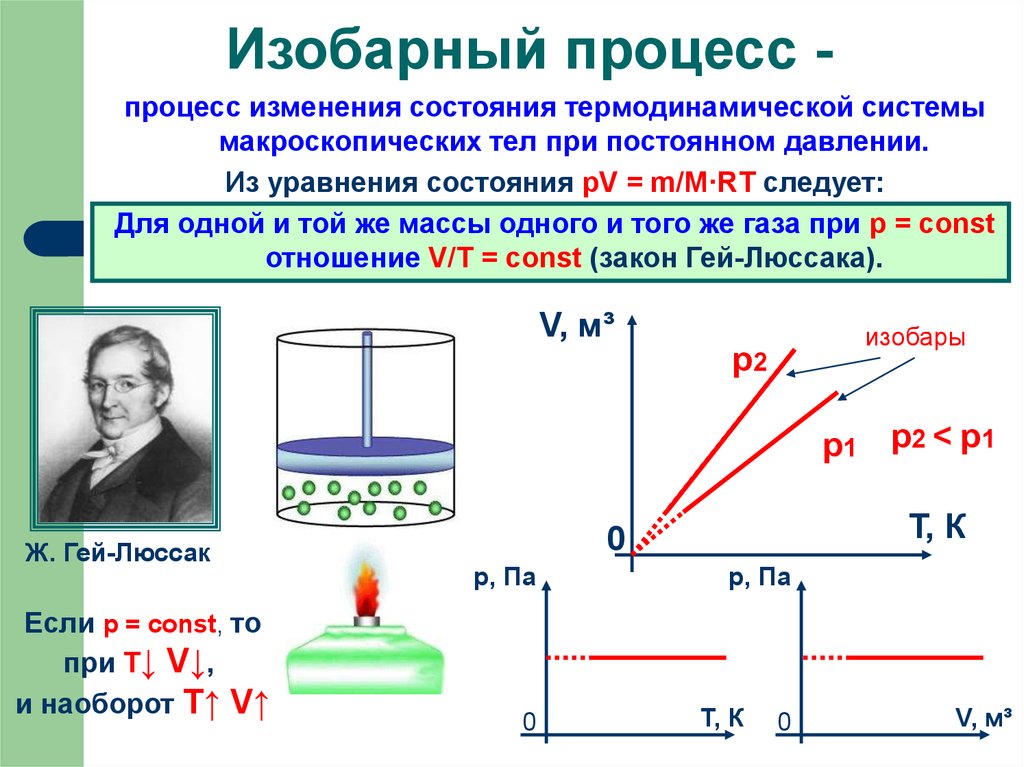
7. Изобарный процесс -
Изобарный процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянном давлении.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при р = const
отношение V/Т = const (закон Гей-Люссака).
V, м³
изобары
р2
р1 р2 < р1
Ж. Гей-Люссак
Если р = const, то
при Т↓ V↓,
и наоборот T↑ V↑
Т, К
0
р, Па
0
р, Па
Т, К
0
V, м³
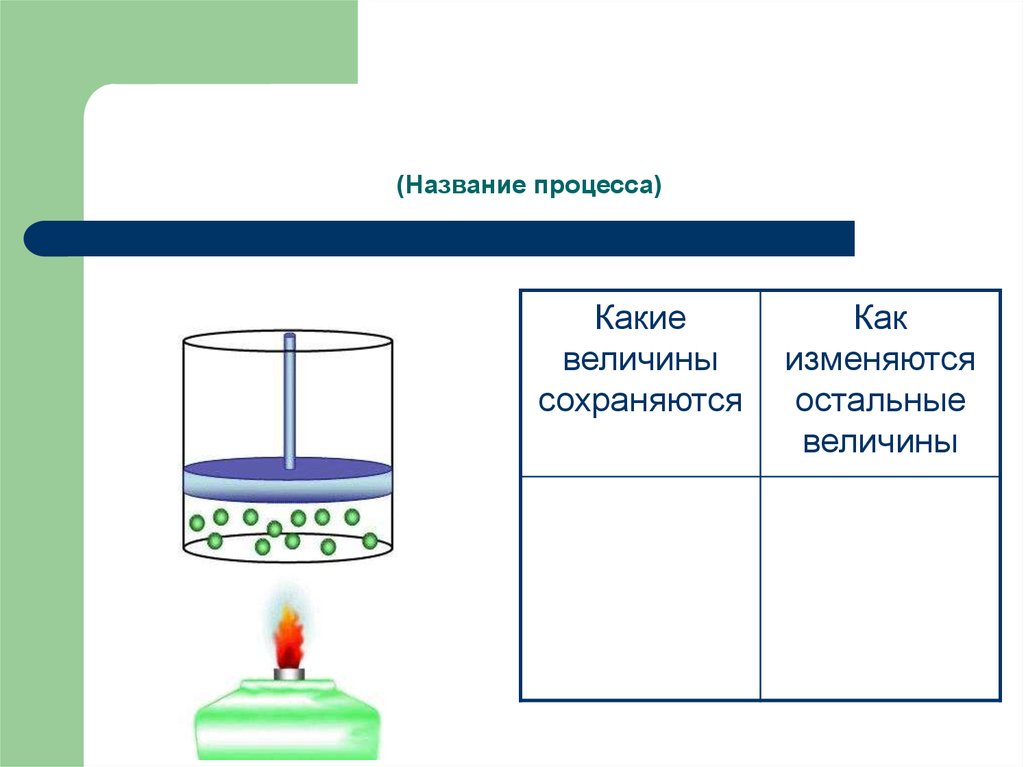
8. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
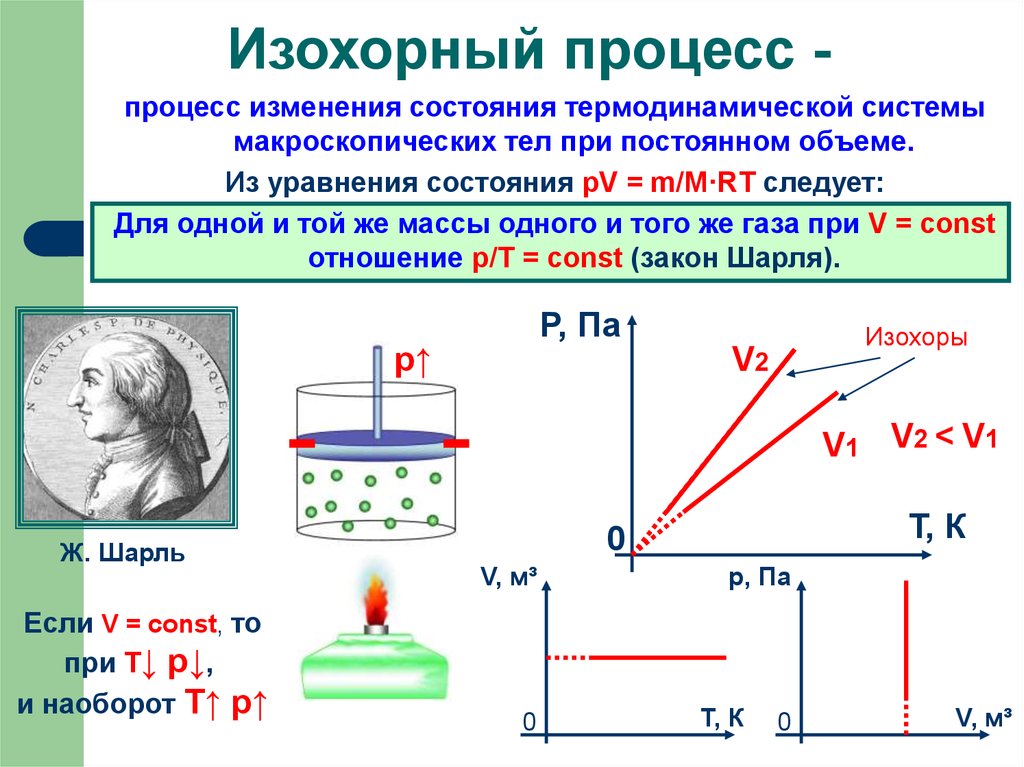
9. Изохорный процесс -
Изохорный процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянном объеме.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при V = const
отношение p/Т = const (закон Шарля).
P, Па
р↑
Изохоры
V2
V1 V2 < V1
Ж. Шарль
Если V = const, то
при Т↓ p↓,
и наоборот T↑ p↑
Т, К
0
V, м³
0
р, Па
Т, К
0
V, м³
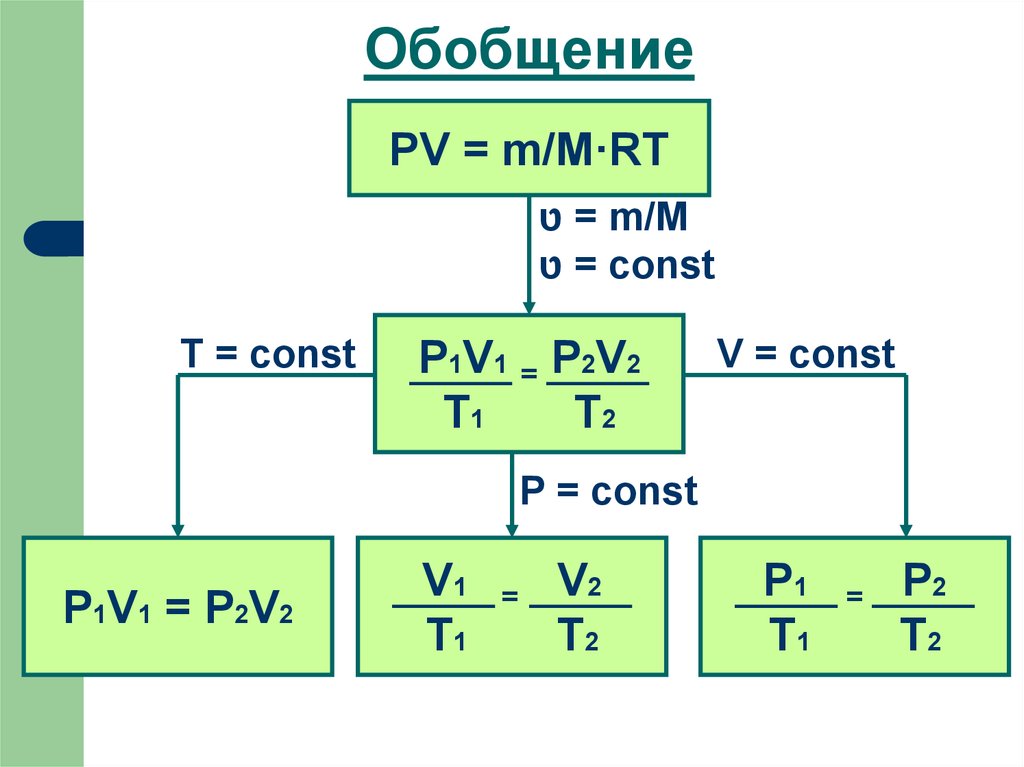
10. Обобщение
PV = m/M·RT = טm/M
= טconst
T = const
P1V1 = P2V2
T1
T2
V = const
P = const
P1V1 = P2V2
V1
T1
=
V2
T2
P1
T1
=
P2
T2





 physics
physics








