Similar presentations:
Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы
1. Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы.
Тема: «Газовыезаконы».
2. Повторение
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Перечислите основные положения МКТ.
Дайте определение относительной молекулярной
массы.
Что такое количество вещества?
Что такое молярная масса?
Какое движение называют броуновским?
Какой газ называют идеальным в МКТ?
Дайте определение и приведите примеры
макроскопических параметров.
Дайте определение и приведите примеры
микроскопических параметров.
Запишите основное уравнение МКТ. Чем оно
замечательно?
Что такое температура? В каких единицах она
измеряется?
Какое состояние системы называют тепловым
равновесием?
Запишите уравнение состояния идеального газа. Чьи
имена носит это уравнение и почему?
Какие макроскопические параметры используются в
3.
p1V1 p2V2const
T1
T2
Уравнение состояния идеального газа.
4. Изопроцессы в газах
Процессы, протекающие при неизменном значенииодного из параметров, называют изопроцессами.
Рассмотрим следующие изопроцессы:
Название
процесса
Изотермический
процесс
Изобарный
процесс
Изохорный
процесс
Постоянная
величина
T = const
p = const
V = const
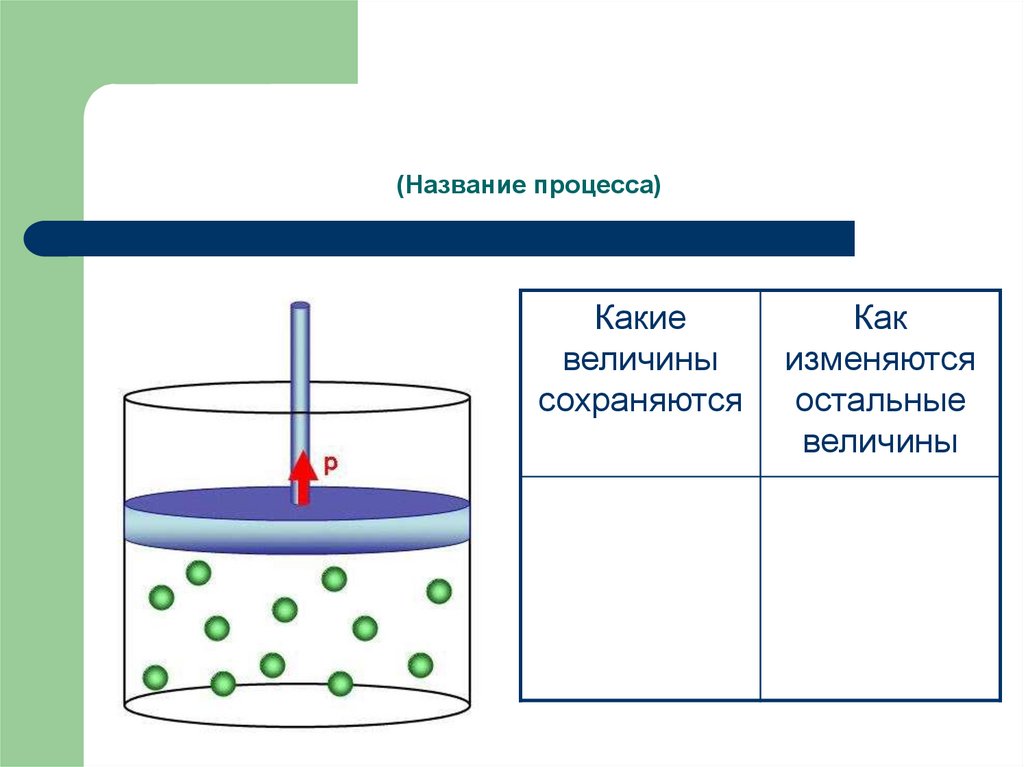
5. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
6.
T constИзотермический процесс
p1V1 p2V2
const
T1
T2
p1V1 p2V2 const
7.
T constДля данной массы данного вещества,
произведение давления газа на его
объем постоянно, если температура газа
не меняется.
Закон Бойля - Мариотта
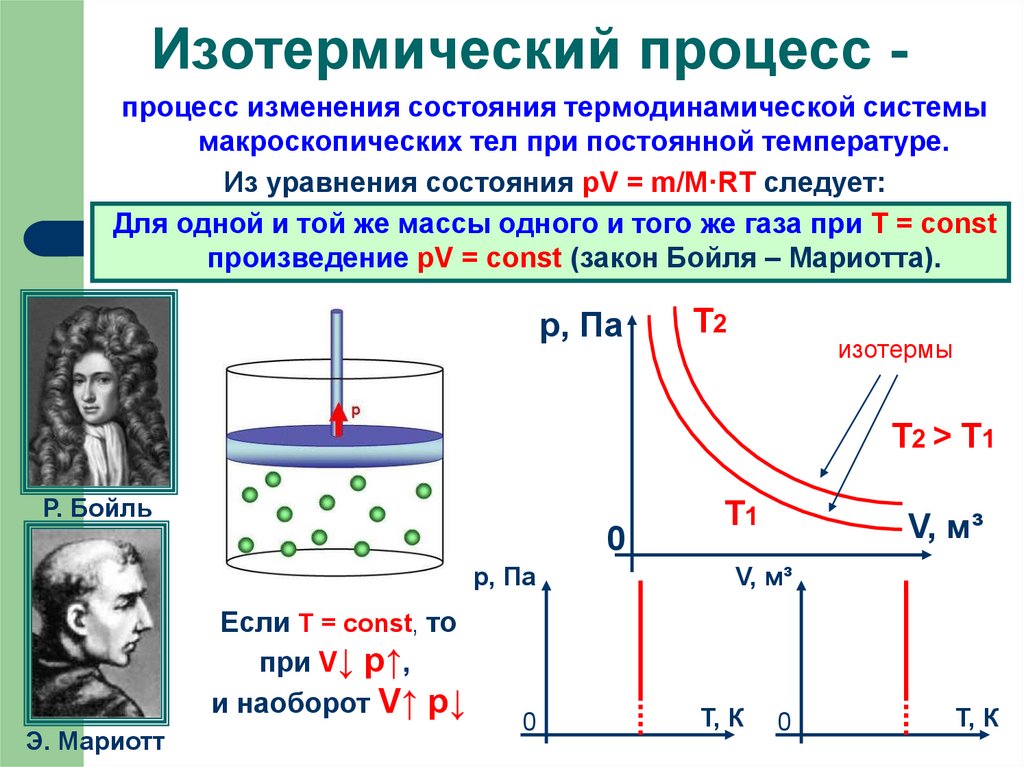
8. Изотермический процесс -
Изотермический процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянной температуре.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при T = const
произведение pV = const (закон Бойля – Мариотта).
р, Па
Т2
изотермы
Т2 > Т1
Р. Бойль
0
р, Па
Если T = const, то
при V↓ p↑,
и наоборот V↑ p↓
Э. Мариотт
0
Т1
V, м³
V, м³
Т, К
0
Т, К
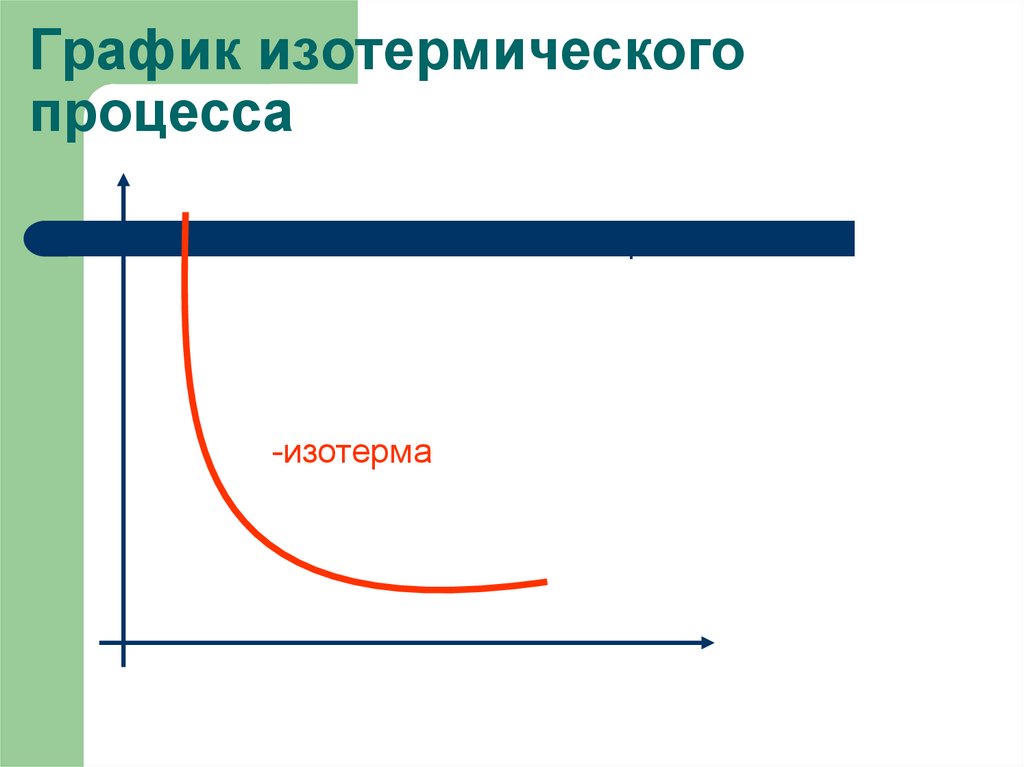
9. График изотермического процесса
pV =const-изотерма
10. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
11.
p constИзобарный процесс
p1V1 p2V2
const
T1
T2
V1
V2
const
T1
T2
12.
p constДля данной массы данного вещества,
отношение объема газа к его температуре
постоянно, если давление не меняется.
Закон Гей - Люссака
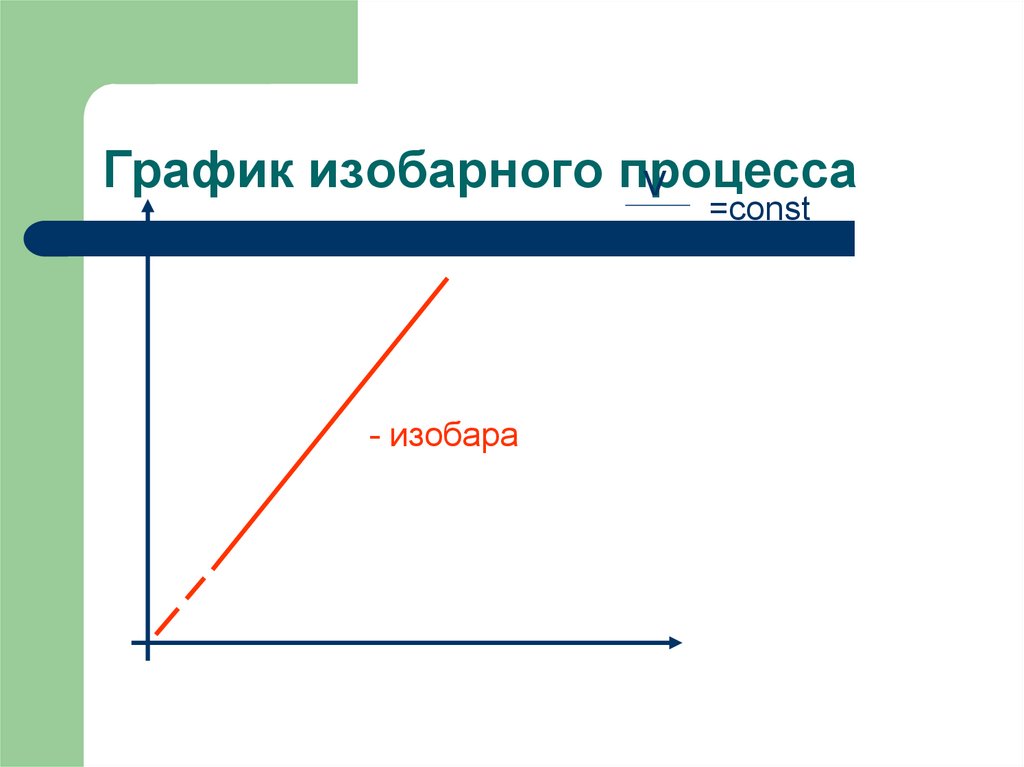
13. График изобарного процесса
V=const
T
- изобара
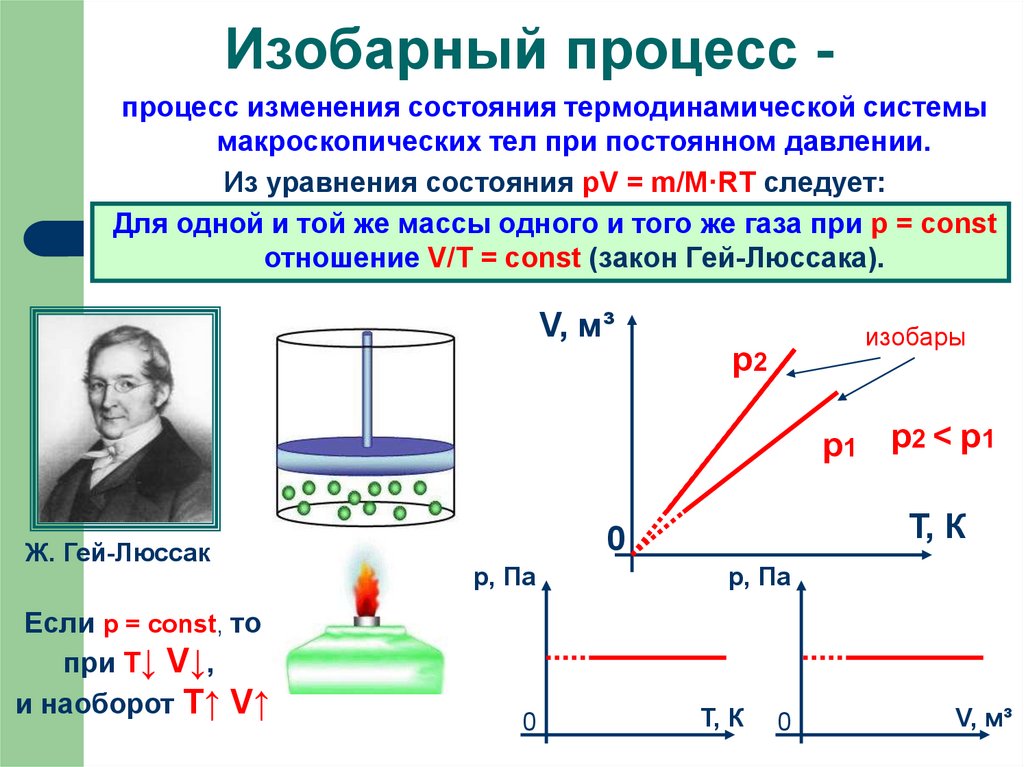
14. Изобарный процесс -
Изобарный процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянном давлении.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при р = const
отношение V/Т = const (закон Гей-Люссака).
V, м³
изобары
р2
р1 р2 < р1
Ж. Гей-Люссак
Если р = const, то
при Т↓ V↓,
и наоборот T↑ V↑
Т, К
0
р, Па
0
р, Па
Т, К
0
V, м³
15. (Название процесса)
Какиевеличины
сохраняются
Как
изменяются
остальные
величины
16.
V constИзохорный процесс
p1V1 p2V2
const
T1
T2
p1
p2
const
T1
T2
17.
V constДля данной массы данного вещества,
отношение давления газа к температуре
постоянно, если объем не меняется.
Закон Шарля
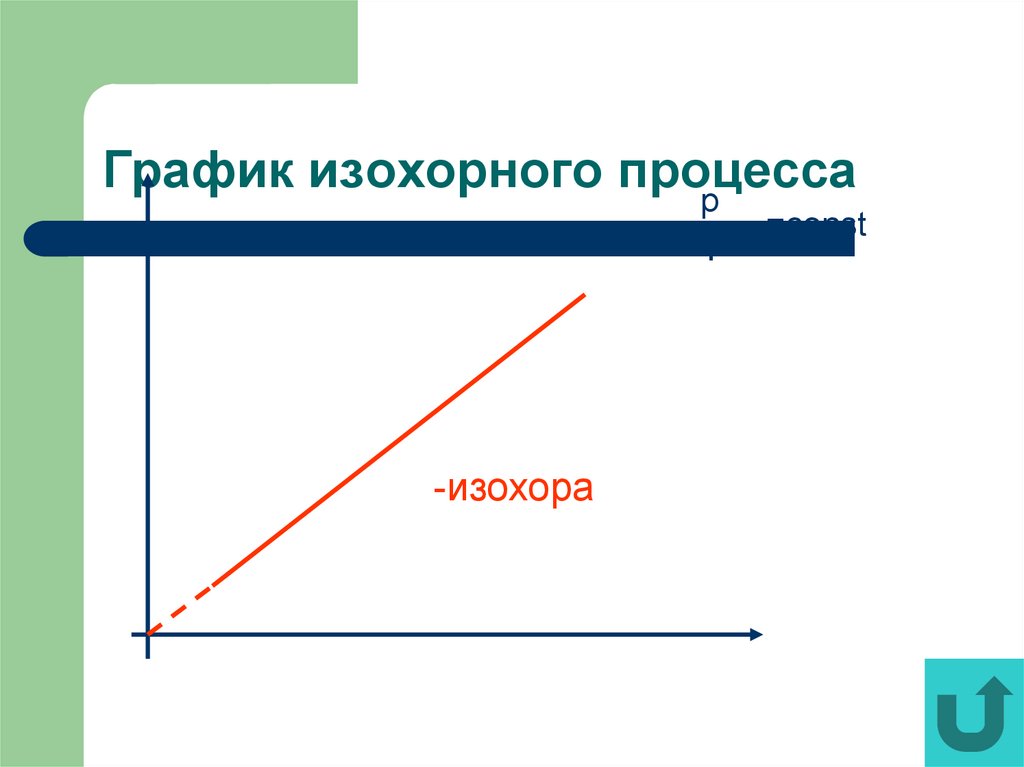
18. График изохорного процесса
pТ
-изохора
=const
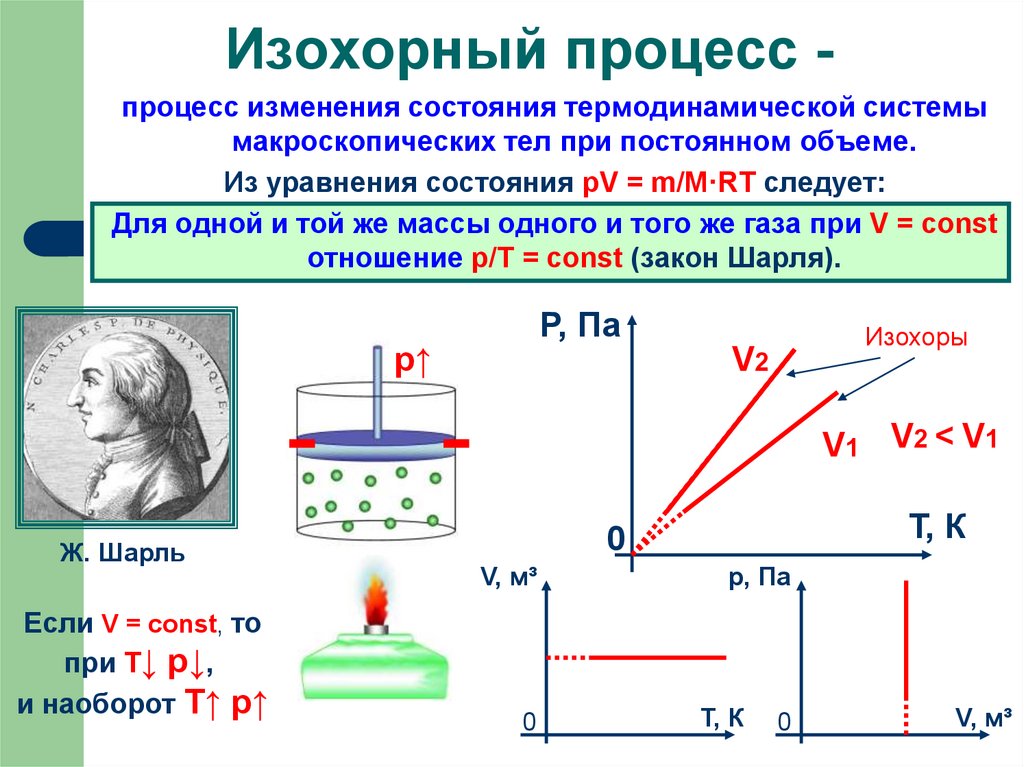
19. Изохорный процесс -
Изохорный процесс процесс изменения состояния термодинамической системымакроскопических тел при постоянном объеме.
Из уравнения состояния pV = m/M·RT следует:
Для одной и той же массы одного и того же газа при V = const
отношение p/Т = const (закон Шарля).
P, Па
р↑
Изохоры
V2
V1 V2 < V1
Ж. Шарль
Если V = const, то
при Т↓ p↓,
и наоборот T↑ p↑
Т, К
0
V, м³
0
р, Па
Т, К
0
V, м³
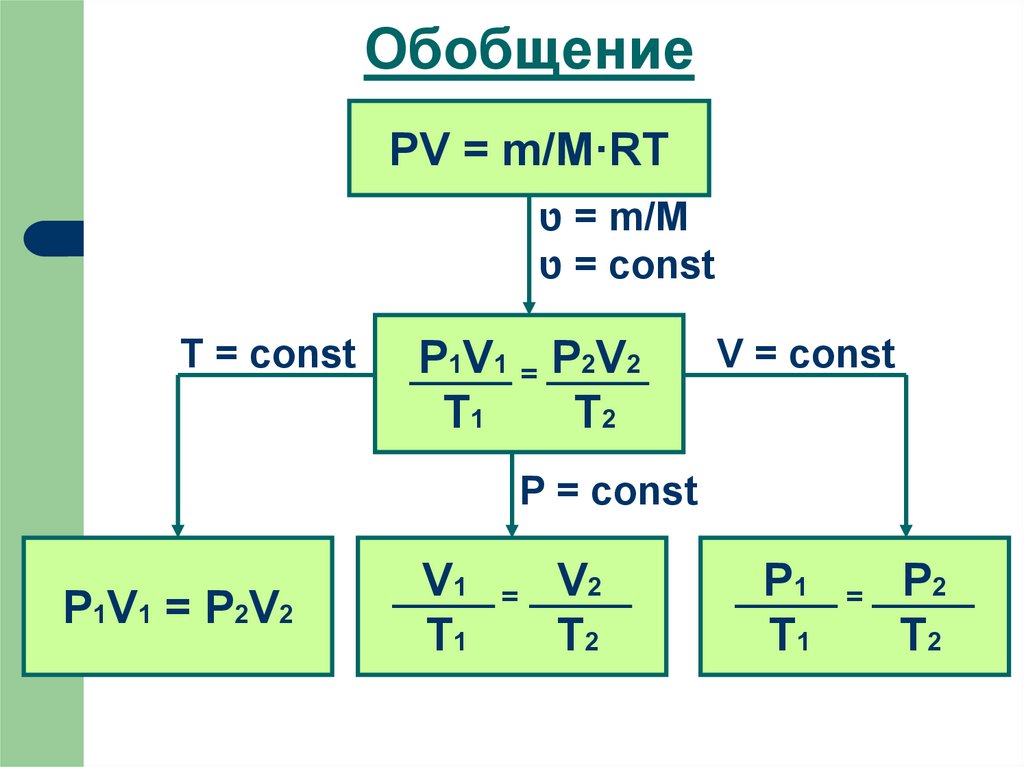
20. Обобщение
PV = m/M·RT = טm/M
= טconst
T = const
P1V1 = P2V2
T1
T2
V = const
P = const
P1V1 = P2V2
V1
T1
=
V2
T2
P1
T1
=
P2
T2
21. Домашнее задание
constФормула
закона
Автор(ы)
закона
график
22.
Любой газовый закон получают изуравнения состояния идеального
газа.
Выучи уравнение - получи закон!
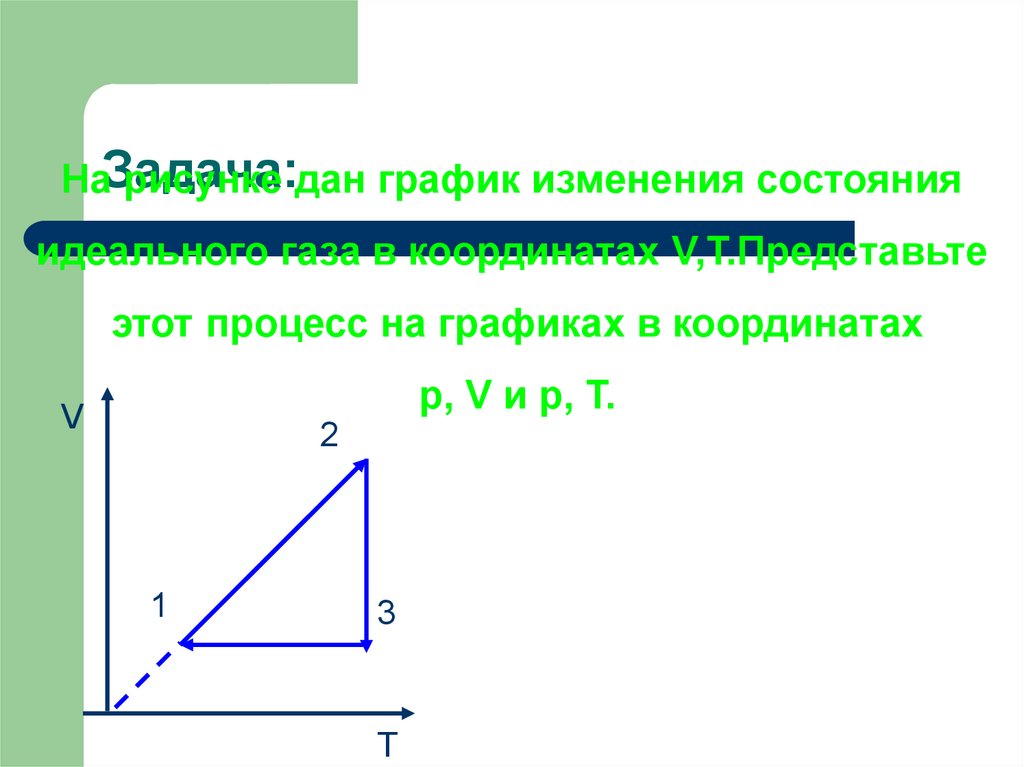
23. Задача:
НаЗадача:рисунке дан график изменения состояния
идеального газа в координатах V,T.Представьте
этот процесс на графиках в координатах
p, V и p, T.
V
2
1
3
T
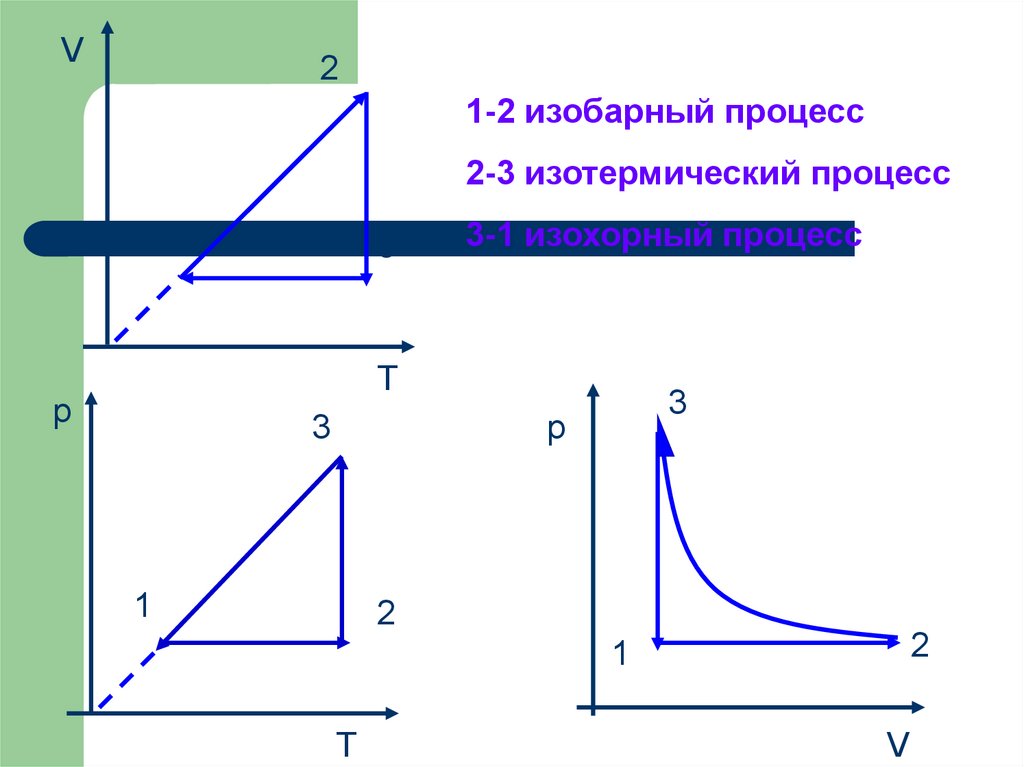
24.
V2
1-2 изобарный процесс
2-3 изотермический процесс
1
3
3-1 изохорный процесс
T
p
3
3
p
1
2
2
1
T
V












 physics
physics








