Similar presentations:
Газовые законы. Уравнение состояния идеального газа
1. Тема: «Газовые законы. Уравнение состояния идеального газа»
Учебная дисциплина: ФизикаТема: «Газовые законы.
Уравнение состояния идеального
газа»
2.
Выберите настроение в настоящий момент инарисуйте на полях своей тетради:
«Хорошее настроение»
«Так себе»
«Хуже не бывает»
3. Решим задачи:
Вариант 1.Какова температура
1,6·10-2 кг кислорода,
находящегося под
давлением 106 Па и
занимающего объем
1,6·10-3 м3? Молярная
масса кислорода
32·10-3 кг/моль.
Вариант 2.
Определите давление
воздуха в сосуде
объемом 2·10-3 м3, если
его масса 1,2 ·10-2 кг,
температура 270С, а
молярная масса 29·10-3
кг/моль.
4.
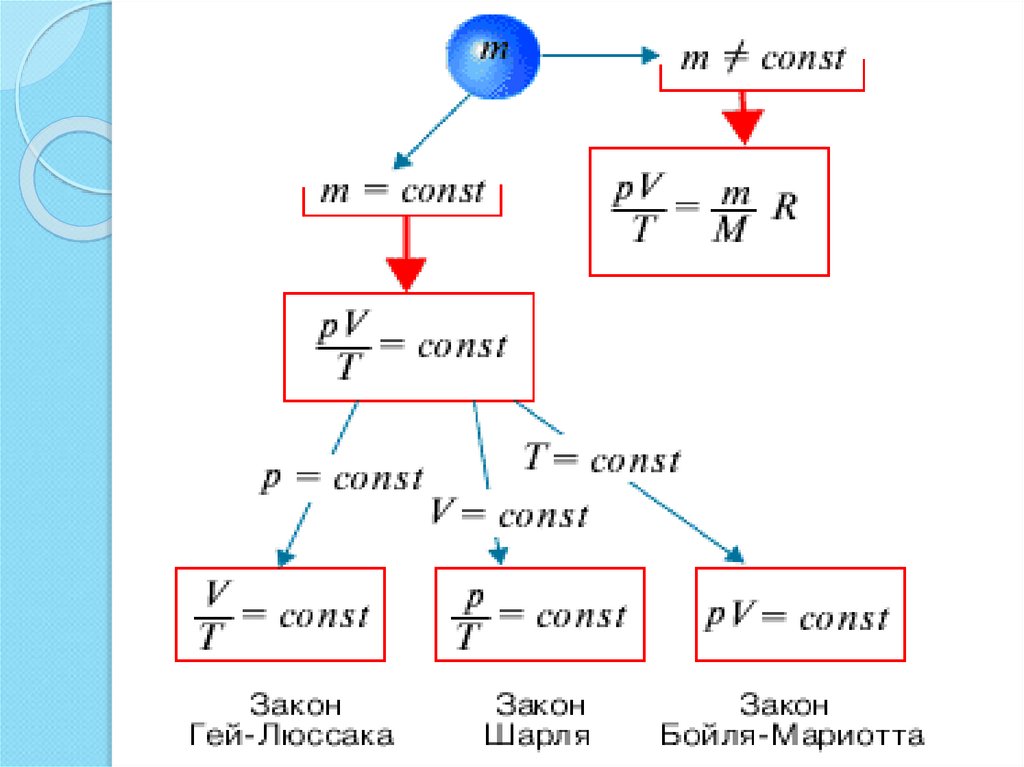
Изопроцесс – это переход газа изодного состояния в другое, при
котором масса газа и один из его
термодинамических параметров
остаются неизменными.
Газовый закон – количественная
зависимость между двумя
термодинамическими параметрами
газа при фиксированном значении
третьего.
5.
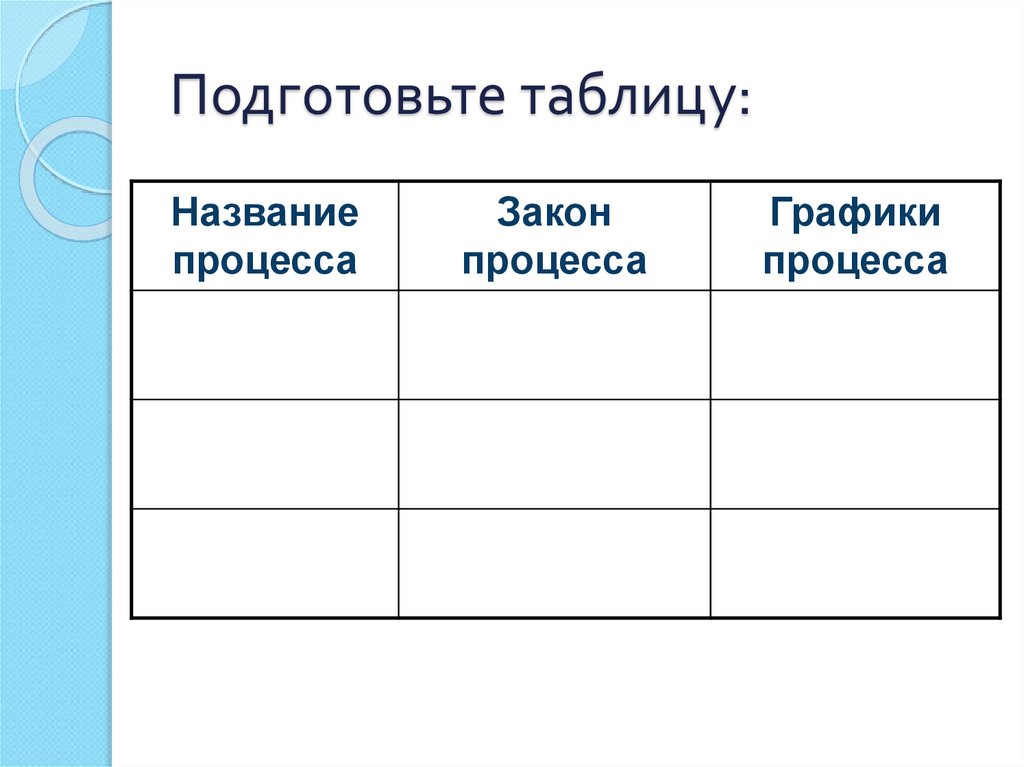
6. Подготовьте таблицу:
Названиепроцесса
Закон
процесса
Графики
процесса
7. Изотермический процесс-
Изотермический процессэто процесс изменениясостояния определенной
массы газа при постоянной
температуре (Т=const)
8. При этих условиях из уравнения Менделеева- Клапейрона:
При этих условиях из уравнения МенделееваКлапейрона:PV m
R const
T
следует закон БойляМариотта
PV const
m
RT
В 1662 году английский ученый Роберт Бойль и в 1667
году независимо от него французский ученый Эдм
Мариотт на основе опытов установили этот закон.
9. Закон Бойля-Мариотта:
Для газа данной массы при постояннойтемпературе произведение давления
газа на его объем постоянно:
P1V1 P2V2
или
P1 V2
P2 V1
10. Экспериментальное исследование справедливости закона:
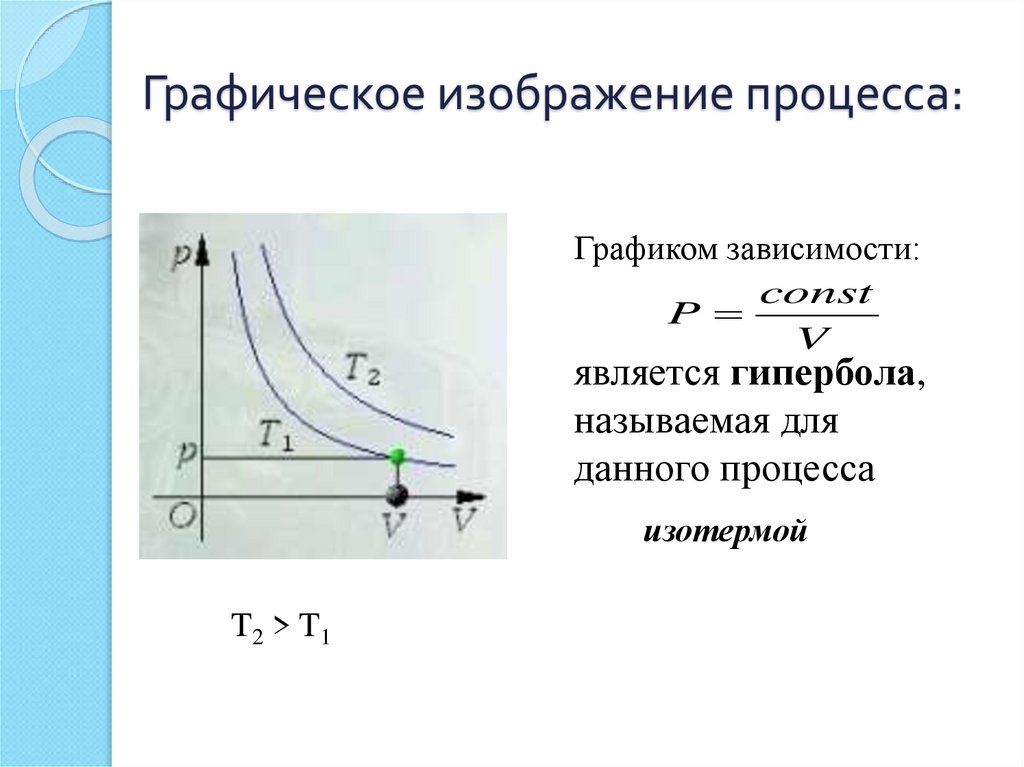
11. Графическое изображение процесса:
Графиком зависимости:const
P
V
является гипербола,
называемая для
данного процесса
изотермой
T2 > T1
12.
Задача 3. Сосуд объемом 12 л, содержащийгаз при давлении 4·105 Па, соединяют с
другим сосудом объемом 3 л, из которого
полностью откачан воздух. Найти конечное
значение давления. Процесс
изотермический.
13. Изобарный процесс-
Изобарный процессэто процесс изменениясостояния определенной
массы газа при постоянном
давлении (P=const)
14. При этих условиях из уравнения Менделеева- Клапейрона
При этих условиях из уравнения МенделееваКлапейронаPV m
R const
T
следует закон ГейЛюссака
V
mR
const
T
P
Изучая поведение газа при изменении температуры,
французский физик Жозеф Луи Гей- Люссак в 1802 году
установил этот закон.
15. Закон Гей- Люссака:
Для газа данной массы при постоянномдавлении отношение объема газа к его
термодинамической температуре
постоянно:
V1 V2
T1 T2
или
V1 T1
V2 T2
16. Экспериментальное исследование справедливости закона:
17. Графическое изображение процесса:
Графиком зависимости:V const T
является прямая,
называемая для
данного процесса
изобарой
P2 > P1
18.
Задача 4. Газ при температуре 300 Кзанимает объем 250 см3. Какой объем
займет та же масса газа, если температура
повысится до 324 К? Давление считать
постоянным.
19. Изохорный процесс-
Изохорный процессэто процесс изменениясостояния определенной
массы газа при постоянном
объеме (V=const)
20. При этих условиях из уравнения Менделеева- Клапейрона
При этих условиях из уравнения МенделееваКлапейронаPV m
R const
T
следует закон Шарля
P
mR
const
T
V
Этот газовый закон установил в 1787 году
французский физик Жак Александр Цезар Шарль.
21. Закон Шарля:
Для газа данной массы при постоянномобъеме отношение давления газа к его
термодинамической температуре
постоянно:
P1 P2
T1 T2
или
P1 T1
P2 T2
22. Экспериментальное исследование справедливости закона:
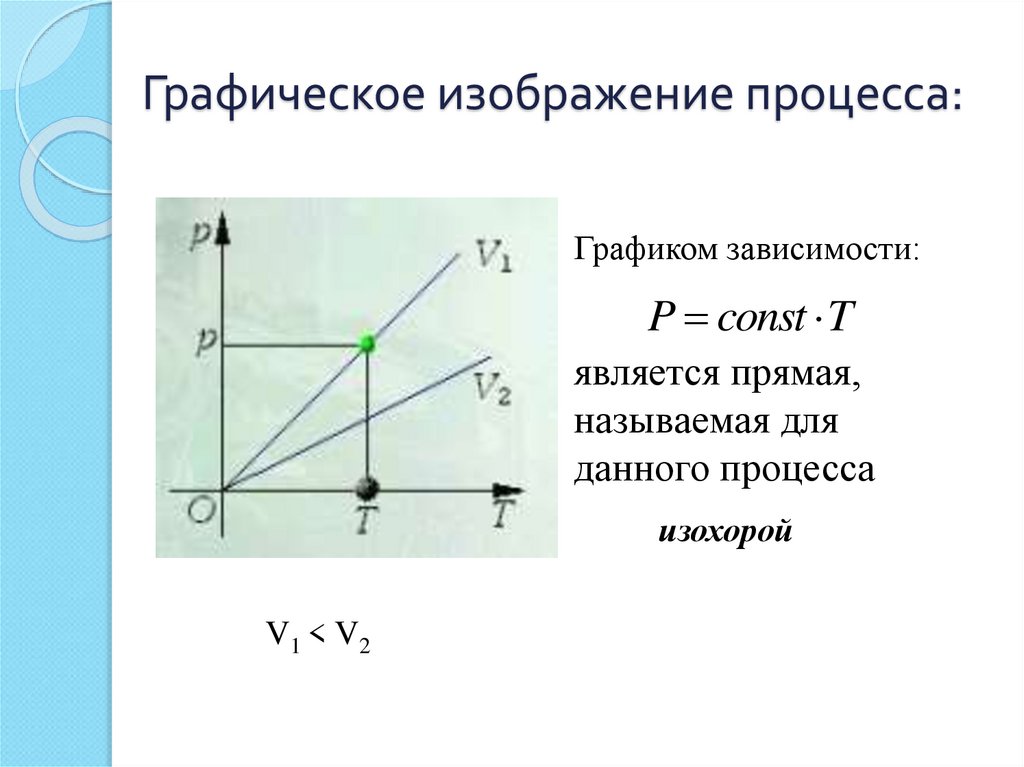
23. Графическое изображение процесса:
Графиком зависимости:P const T
является прямая,
называемая для
данного процесса
изохорой
V1 < V2
24.
Задача 5. Газ находится в баллоне притемпературе 288 К и давлении 18 атм. При
какой температуре давление газа станет
равным 15,6 атм? Объем газа считать
неизменным.
25. 6. Даны графики процессов в различных системах координат:
Найти во всех трех системах координат:Изотермы;
Изохоры;
Изобары.
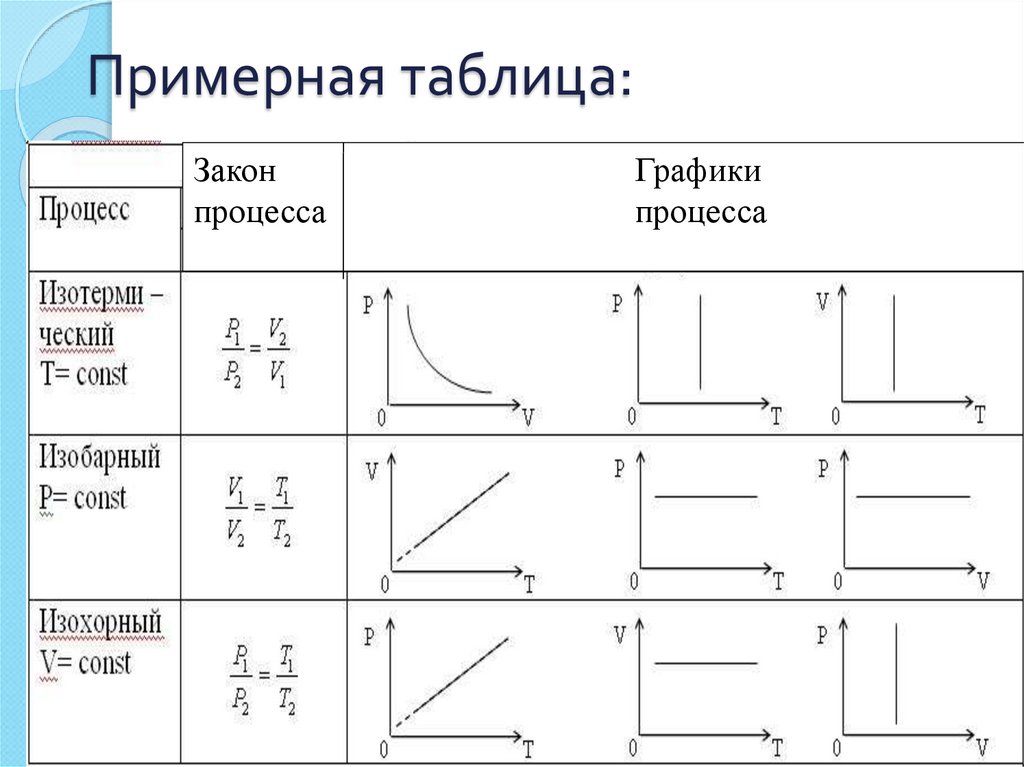
26. Примерная таблица:
Законпроцесса
Графики
процесса





















 physics
physics








