Similar presentations:
Газовые законы. Уравнение состояния идеального газа
1. Газовые законы
2. Уравнение состояния идеального газа
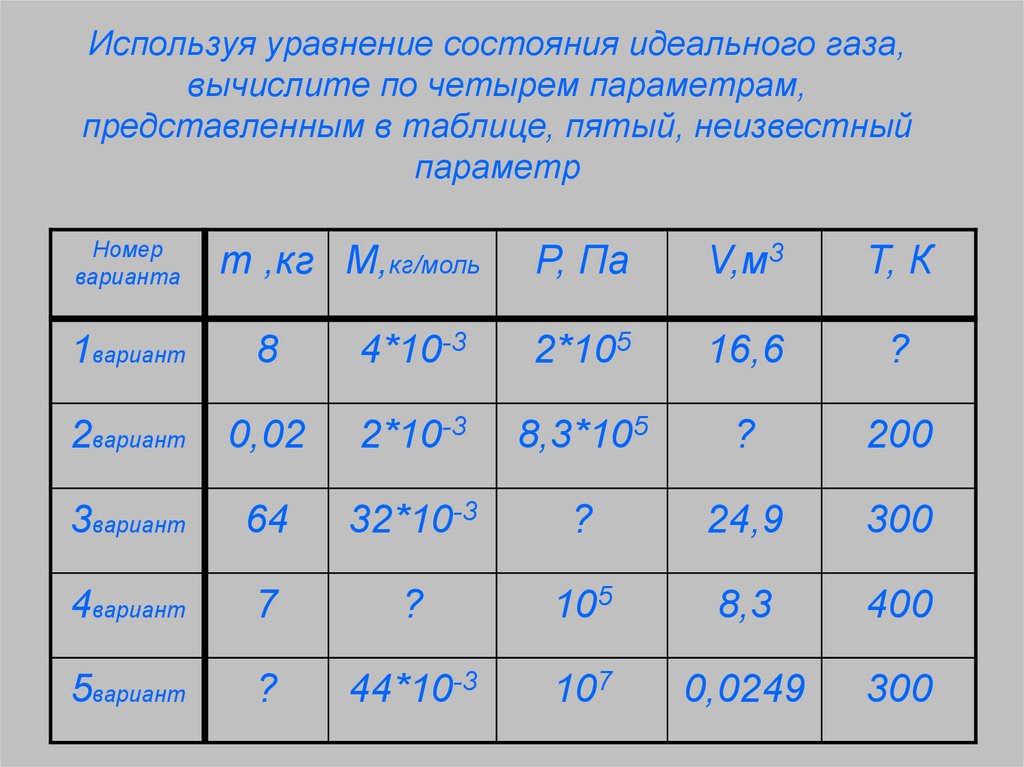
3. Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный
параметрНомер
варианта
m ,кг М,кг/моль
P, Па
V,м3
Т, К
1вариант
8
4*10-3
2*105
16,6
?
2вариант
0,02
2*10-3
8,3*105
?
200
3вариант
64
32*10-3
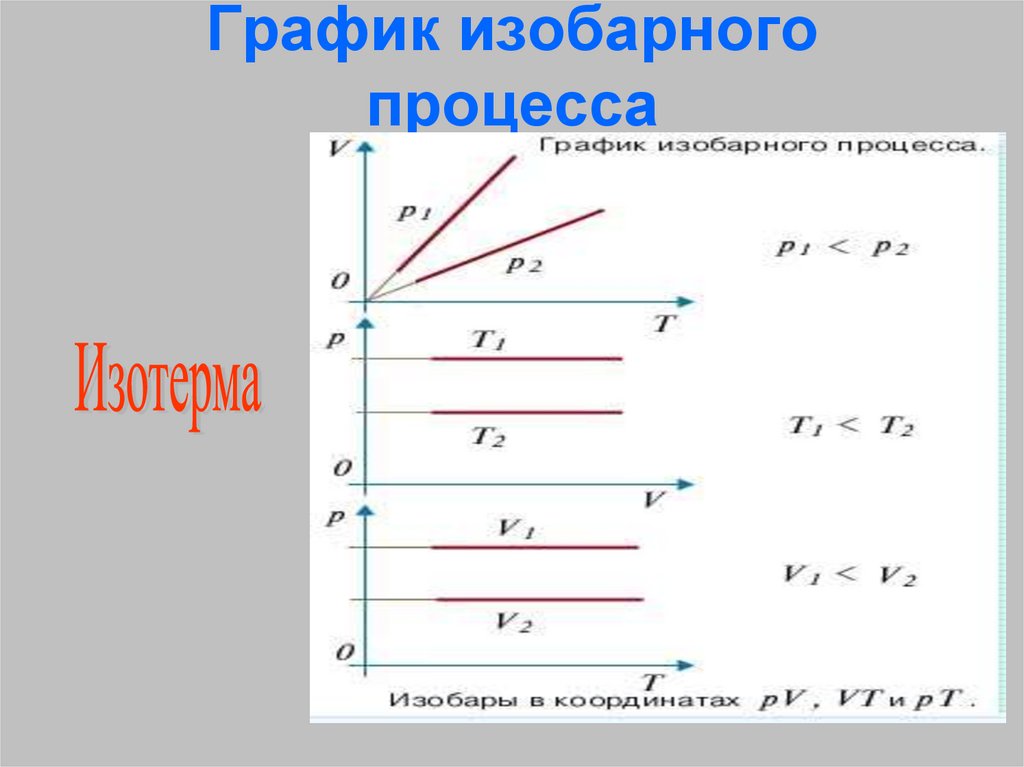
?
24,9
300
4вариант
7
?
105
8,3
400
5вариант
?
44*10-3
107
0,0249
300
4. С помощью Уравнения состояния идеального газа можно исследовать процессы, в которых при постоянной массе один из параметров:
давление, объём или температураостаются постоянными.
5. Изопроцессы – процессы, протекающие при неизменном значении одного из параметров “изо” - постоянство
6.
Изопроцессыизотермический
изобарный
изохорный
7.
8.
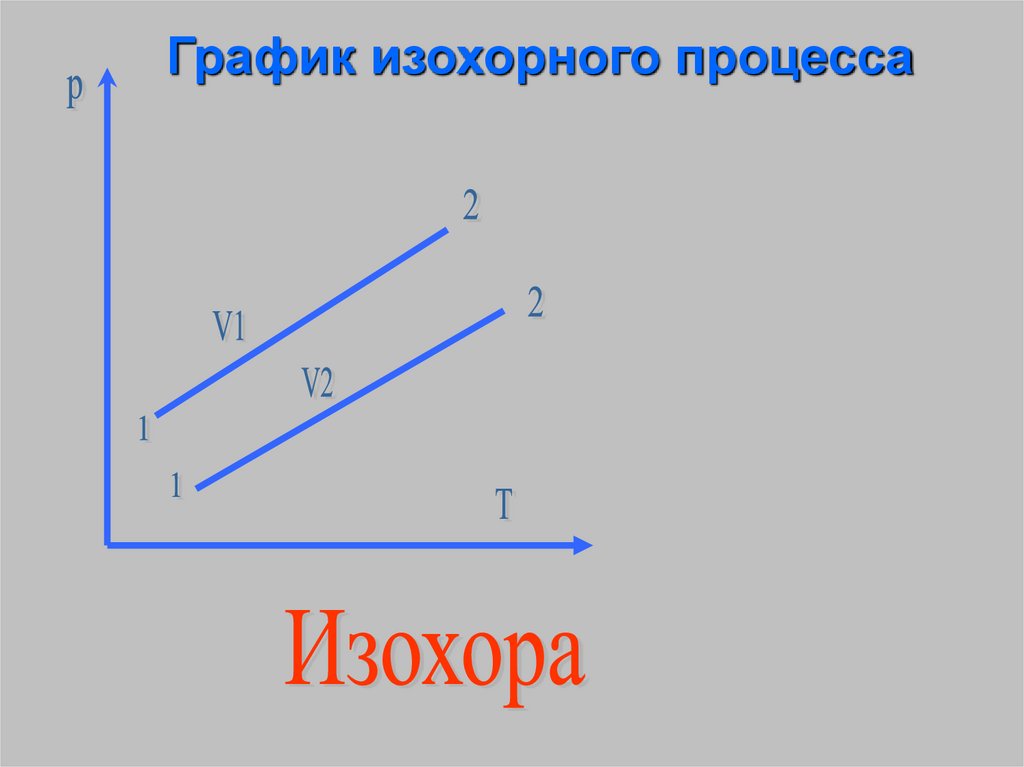
Изохорный процесс процесс изменениясостояния
термодинамической
системы протекающий при
постоянном объёме.
(от греческих слов isosравный, chora – занимаемое
9.
• модель10.
1787 г. Ж. Шарль французский физикэкспериментальным путём
исследовал зависимость давления
газа от температуры.
11. Вывод закона для изохорного процесса
PV=mRT/M - уравнение Менделеева-Клапейронапри m=const и V=const получаем уравнение:
Закон
Шарля
12.
р1/T1 = р2/Т2Для газа данной массы отношение давления
к температуре остаётся постоянным при
неизменном объёме.
13.
График изохорного процесса14.
15.
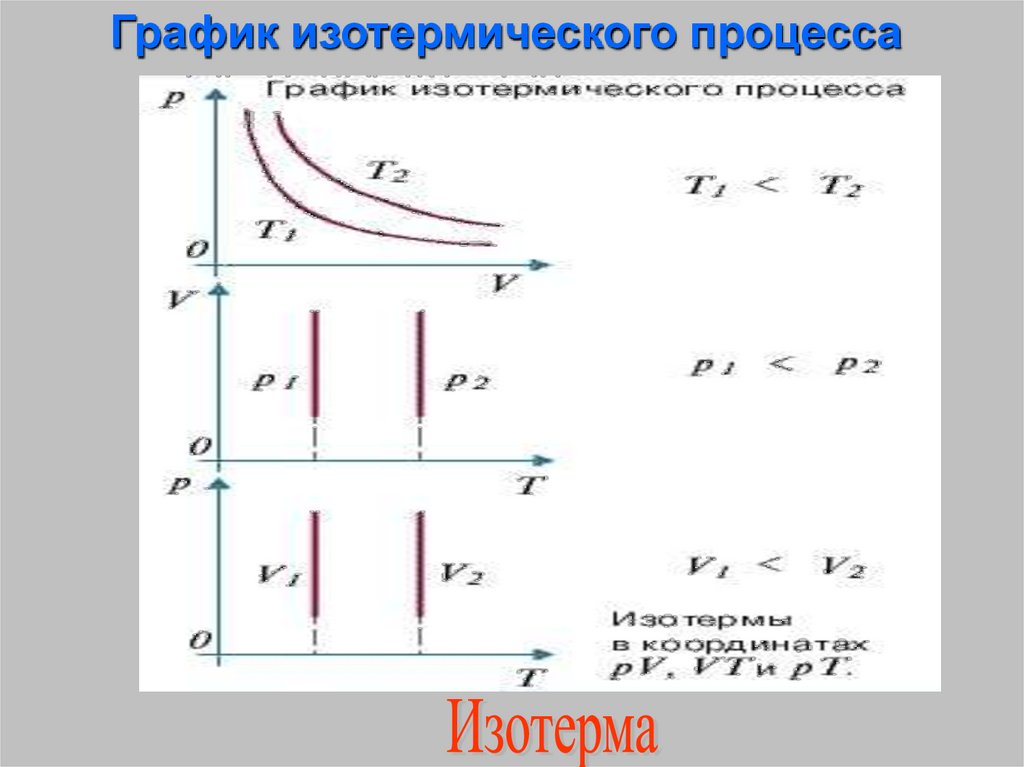
Изотермический процесс –процесс изменения состояния
термодинамической системы
протекающий при постоянной
температуре
(от греческих слов isos- равный,
therme – тепло)
16.
• модель17.
1662 г. из экспериментабыло получено
Р. Бойлем (английским
учёным) уравнение,
устанавливающее связь
между давлением и
объемом газа при
постоянной температуре,
а в 1676 г. независимо от
него Э. Мариоттом.
(французским учёным)
Роберт Бойль
Эдмон Мариотт
18. Вывод закона для изотермического процесса
pave = mRT/μ – закон МенделееваКлапейронапри m=const и Т=const, получаем
уравнение:
Закон
БойляМариотта
19. закон Бойля-Мариотта
р1V1 = р2V2Для газа данной массы
произведение давления газа на
его объём остаётся постоянной
при неизменной температуре.
20.
График изотермического процесса21. Изобарный процесс - процесс изменения состояния термодинамической системы протекающий при постоянном давлении. (от греческих
Изобарный процесс • процесс изменения состояниятермодинамической системы
протекающий при постоянном
давлении.
(от греческих слов isosравный, baros – тяжесть, вес)
22.
• модель23.
1802 г. французский физикЖ. Гей-Люссак провел
экспериментальное
исследование зависимости
объёма газа от температуры.
Жозеф Луи Гей-Люссак
24. Вывод закона для изобарного процесса
PV=mRT/μ - уравнение МенделееваКлапейронапри m=const и р=const, получаем
уравнение:
Закон
Гей-Люссака
25. Закон Гей-Люссака
V1/Т1 = V2/T2 –Для газа данной массы отношение
объёма газа и его температуры
остаётся постоянным при
неизменном давлении
26. График изобарного процесса
27. Задание 1
Задание 2A. P V = const
В. V Т = const
Б.
Г.
P
= const
V
V
= const
T
Какая из формул описывает закон
Вариант 1
Вариант 2
Бойля-Мариотта?
Гей-Люссака?
28. Задание 2
Задание 3З
а
д
а
н
и
е
А.
В.
Менделеев, Клапейрон
Бойль, Мариотт
Б.
Г.
Шарль
Гей- Люссак
Каким ученым принадлежит закон, описывающий …
К
а
к
и
м
у
ч
е
н
ы
м
п
р
и
н
а
д
л
е
ж
и
т
з
а
к
о
н
,
о
п
и
Вариант 1
В
а
р
и
а
н
з
о
б
а
р
н
ы
й
п
р
о
ц
е
ы
в
а
ю
щ
и
й
Вариант 2
т
В
Изобарный процесс?
И
с
с
с
?
а
р
и
а
н
т
изотермический
процесс?
и
з
о
т
е
п
р
м
р
о
и
ц
ч
е
е
с
с
с
к
?
и
й
29.
А.Б.
р
р
Задание 4
Т
В.
Г.
р
T
V
V
Какой график соответствует
Вариант 1
Вариант 2
изохорному процессу?
изотермическому
процессу?
V
30. Задание 4
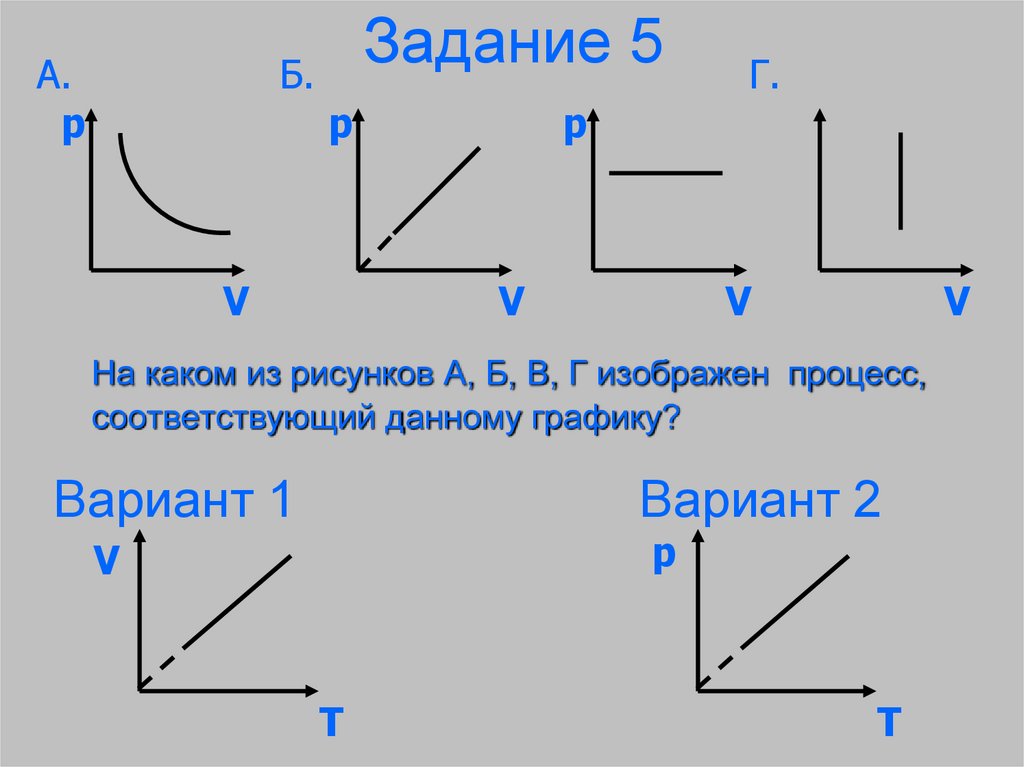
А.p
Задание 5
Б.
p
V
Г.
p
V
V
V
На каком из рисунков А, Б, В, Г изображен процесс,
соответствующий данному графику?
Вариант 1
Вариант 2
p
V
T
T
31. Задание 5
• Домашнее задание: выполнитьзадание в тетради с формулой и
расчетами со слайда №3 и тест со
слайдов №28-32

























 physics
physics








