Similar presentations:
Уравнение состояния идеального газа. Изопроцессы
1.
16.12.2021Уравнение состояния
идеального газа.
Изопроцессы.
2. план
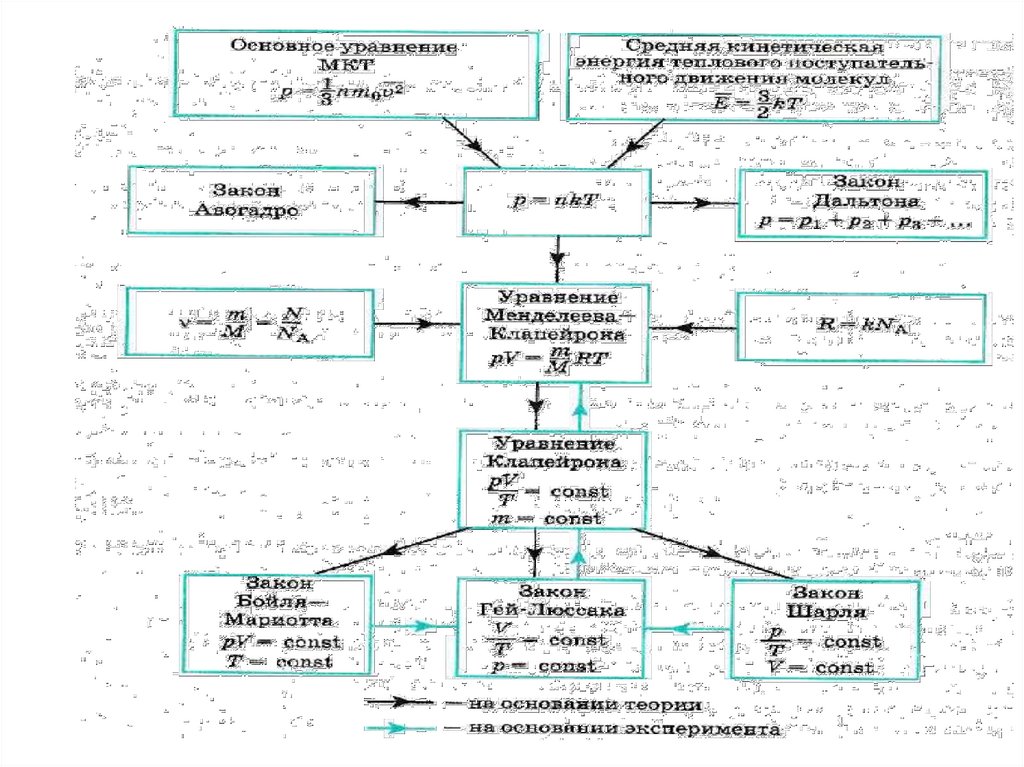
1. Уравнение состояния идеального газа.(Клапейрона)
2. Уравнение Менделеева - Клапейрона
3. Понятие «ИЗОПРОЦЕССЫ»
4. Виды изопроцессов
5. Газовые законы
6. Графическое представление газовых
законов
3.
Просмотр видеоурокаhttps://yandex.ru/video/preview/?text=дистанц
ионно%2010%20класс.уравнение%20менделе
ева%20клапейрона.Газовые%20законы&path
=wizard&parent-reqid=163958256019027210351915083226511327-vla1-3228-vla-l7balancer-8080-BAL7185&wiz_type=vital&filmId=173043242567237
29633
4. Вопросы:
Как называется модель на которойрассматривают состояние газообразных тел
(идеальный газ)
Какими параметрами характеризуется
состояние идеального газа
( давление, объём,
температура)
5.
• Как называются эти параметры(макроскопические)
• Как термодинамический параметр
давление связан с микроскопическими
параметрами?
(основное уравнение МКТ)
• Как объём связан с микроскопическими
параметрами?
(объём обратно пропорционален
концентрации)
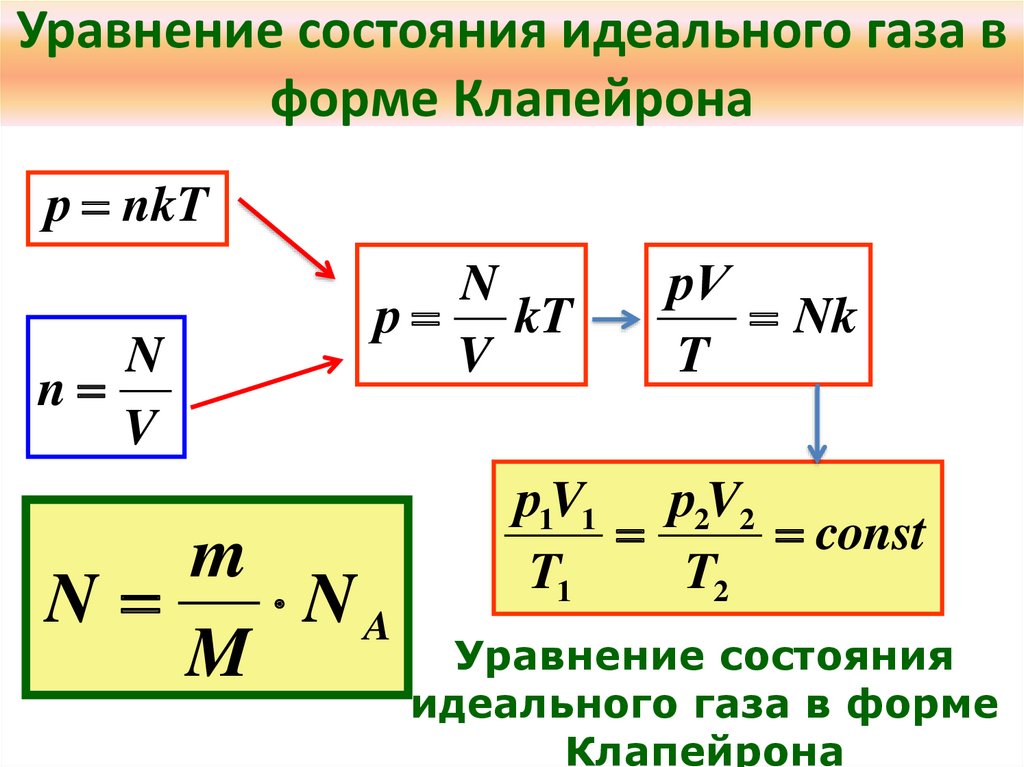
6. Уравнение состояния идеального газа в форме Клапейрона
р nkTN
n
V
N
р kT
V
m
N
NA
M
рV
Nk
T
р1V1 р2V2
const
T1
T2
Уравнение состояния
идеального газа в форме
Клапейрона
7.
Менделеев Дмитрий Иванович(8.II.1834–2.II.1907)
• Обобщив уравнение
Клапейрона,
в 1874 вывел общее
уравнение состояния
идеального газа
8.
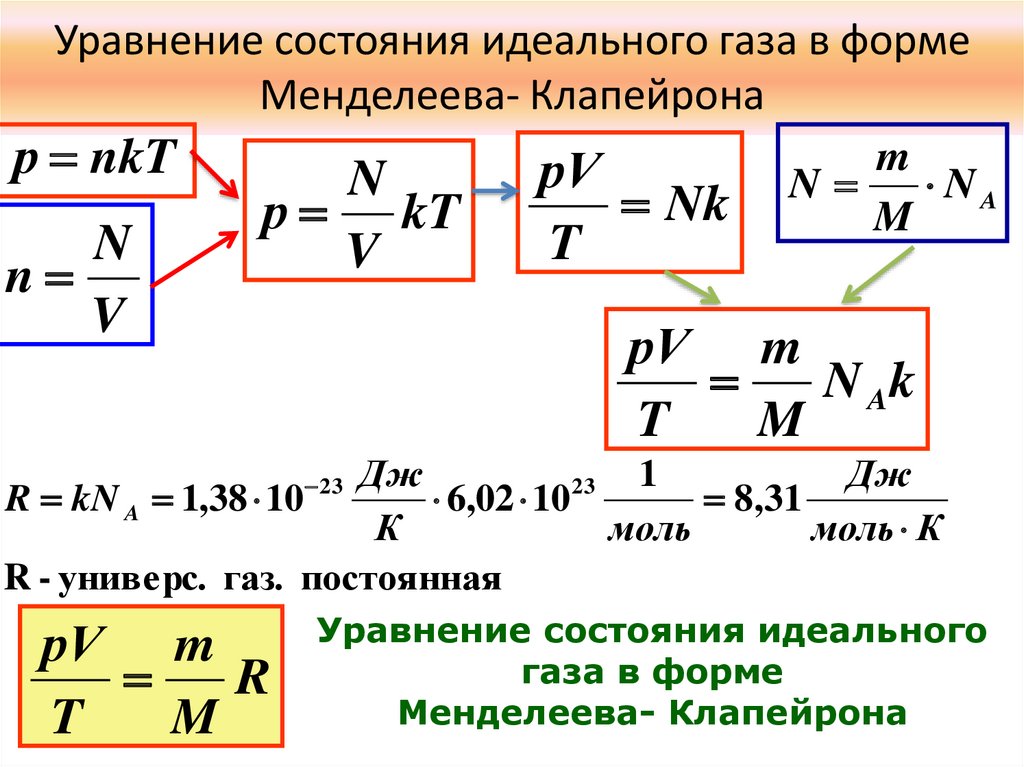
Уравнение состояния идеального газа в формеМенделеева- Клапейрона
р nkT
N
n
V
N
р kT
V
рV
Nk
T
m
N
NA
M
рV m
N Ak
T
M
Дж
1
Дж
23
R kN A 1,38 10
6,02 10
8,31
К
моль
моль К
R - универс. газ. постоянная
23
рV m
R
T
M
Уравнение состояния идеального
газа в форме
Менделеева- Клапейрона
9. Универсальная газовая постоянная
• Произведение постояннойБольцмана k= 1,38*10 Дж/К и
числа АвогадроN = 6*10 моль
R= 8,31 Дж/ (моль* К)
10. Практическое применение уравнения состояния:
1. В термометрах…• Уравнение позволяет
определить одну из
величин, характеризующих
состояние, если известны
две другие величины
• Это используют в
термометрах
11.
Уравнение состояния - первое иззамечательных обобщений в физике, с
помощью которых свойства разных
веществ выражаются через одни и те же
основные величины. Именно к этому
стремиться физика - к нахождению
общих законов, не зависящих от тех или
иных веществ. Газы, существенно
простые по своей природе, дали первый
пример такого обобщения.
12. Процесс изменения состояния идеального газа при неизменном значении одного из макроскопических параметров - изопроцесс
13. 2. В газовых законах…
• Зная уравнениесостояния, можно
сказать, как протекают
в системе процессы
при определённых
внешних условиях
14. 3. В молекулярной физике…
• Зная уравнениесостояния, можно
определить, как
меняется состояние
системы, если она
совершает работу или
получает теплоту от
окружающих тел
15.
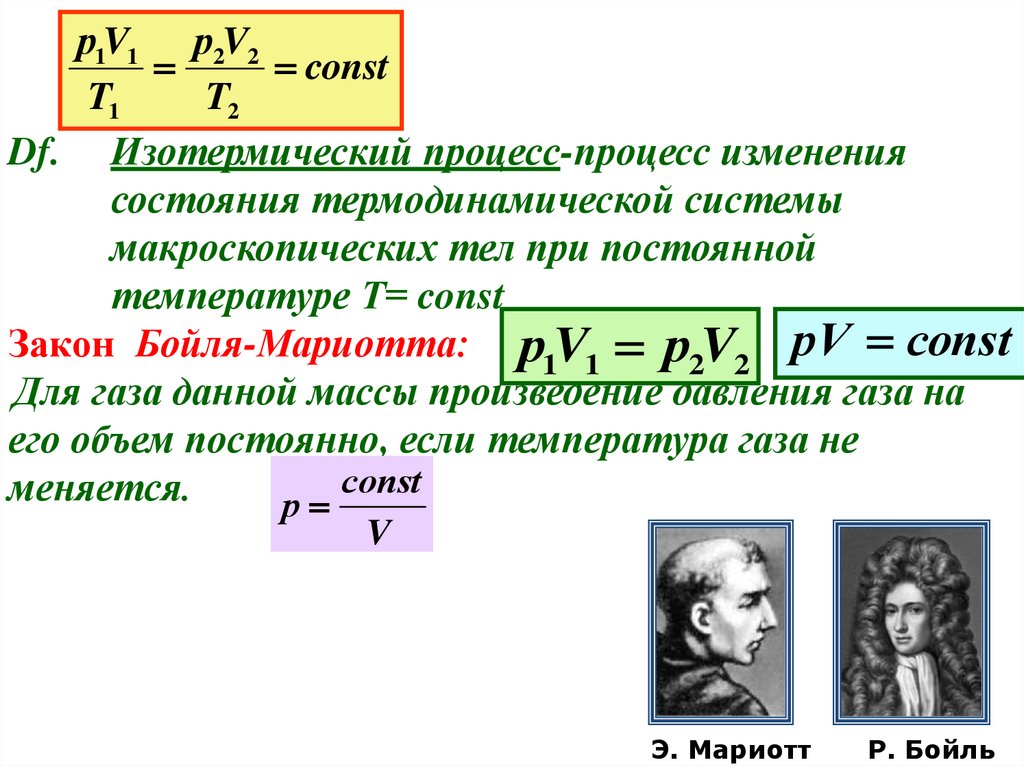
р1V1 р2V2const
T1
T2
Df. Изотермический процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянной
температуре Т= const
Закон Бойля-Мариотта: р1V1 р2V2 рV соnst
Для газа данной массы произведение давления газа на
его объем постоянно, если температура газа не
соnst
меняется.
р
V
Э. Мариотт
Р. Бойль
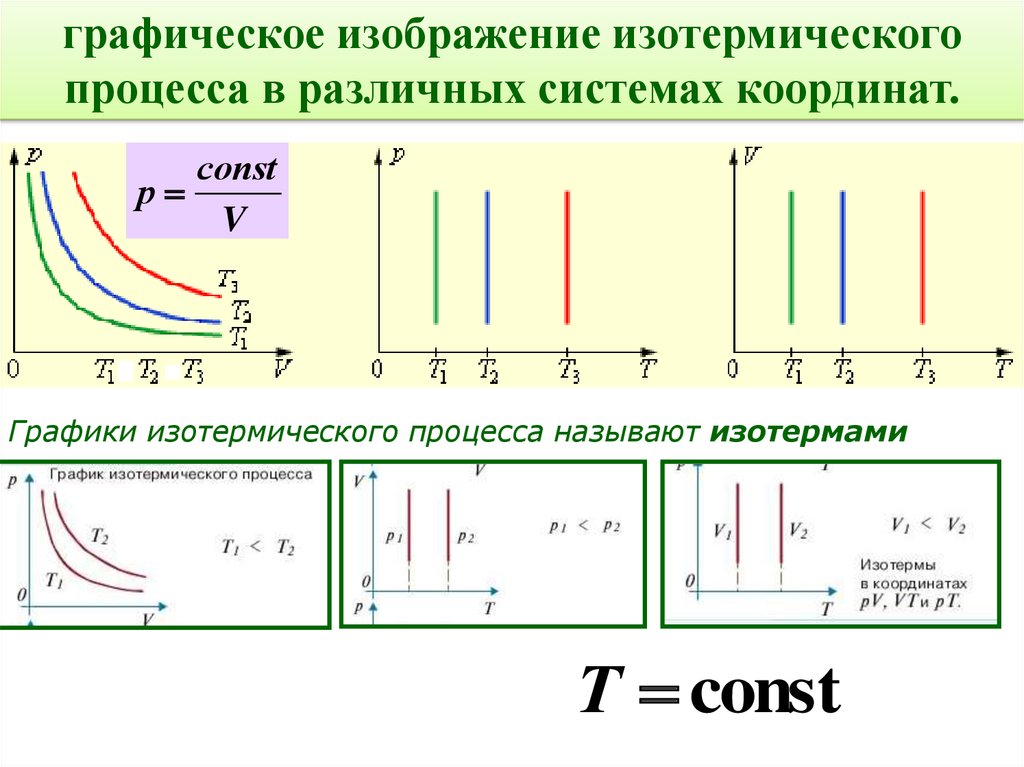
16.
графическое изображение изотермическогопроцесса в различных системах координат.
соnst
р
V
Графики изотермического процесса называют изотермами
Т const
17.
р1V1 р2V2const
T1
T2
Ж. Шарль
Изохорный процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянном объеме
V= const
Закон Шарля:
Для газа данной массы отношение давления газа к
температуре постоянно, если объем газа не меняется.
Df.
р1 р2
Т1 Т 2
р
const
Т
р Т соnst
18.
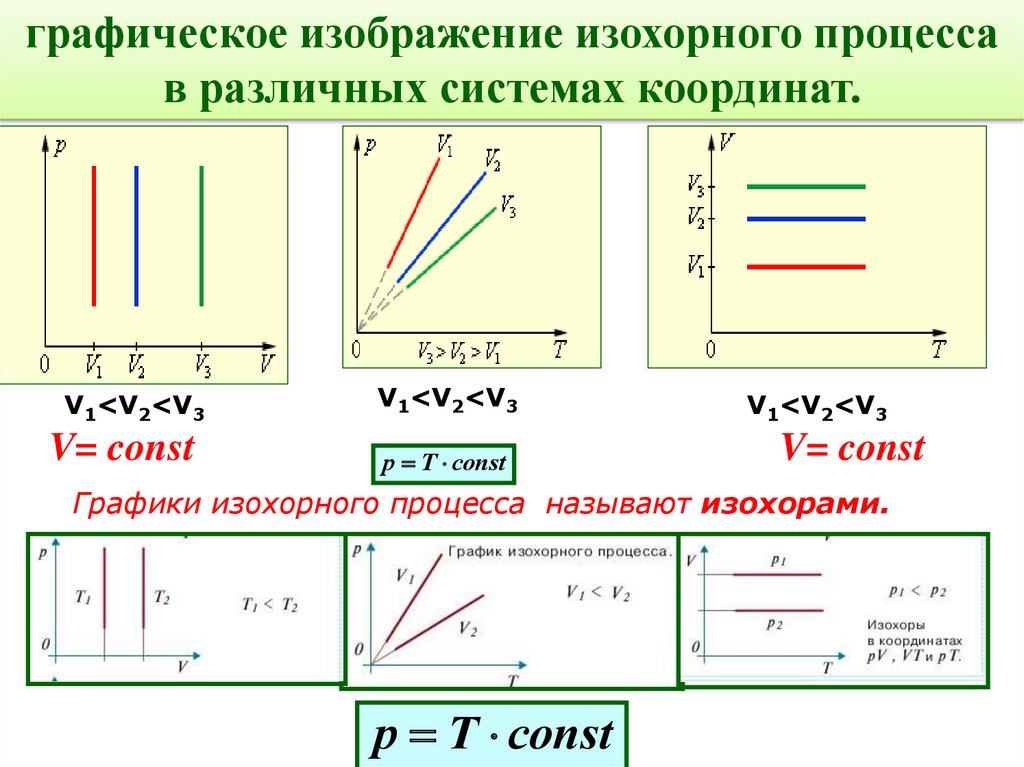
графическое изображение изохорного процессав различных системах координат.
V1<V2<V3
V= const
V1<V2<V3
р Т соnst
V1<V2<V3
V= const
Графики изохорного процесса называют изохорами.
р Т соnst
19.
р1V1 р2V2const
T1
T2
Df. Изобарный процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянном
давлении р= const
Закон Гей-Люссака:
Для газа данной массы отношение объема газа к
абсолютной температуре постоянно, если давление
газа не меняется.
V1 V2
T1 T2
V
соnst V T соnst
T
Ж. Гей-Люссак
20.
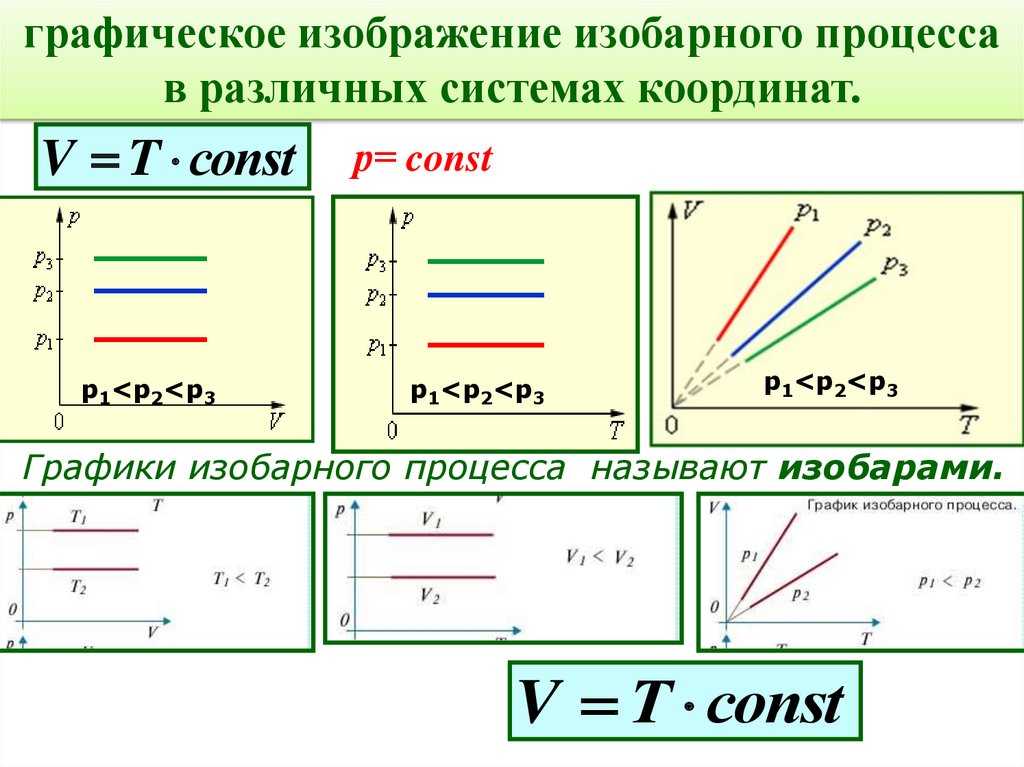
графическое изображение изобарного процессав различных системах координат.
V T соnst
р1<р2<р3
р= const
р1<р2<р3
р1<р2<р3
Графики изобарного процесса называют изобарами.
V Т соnst
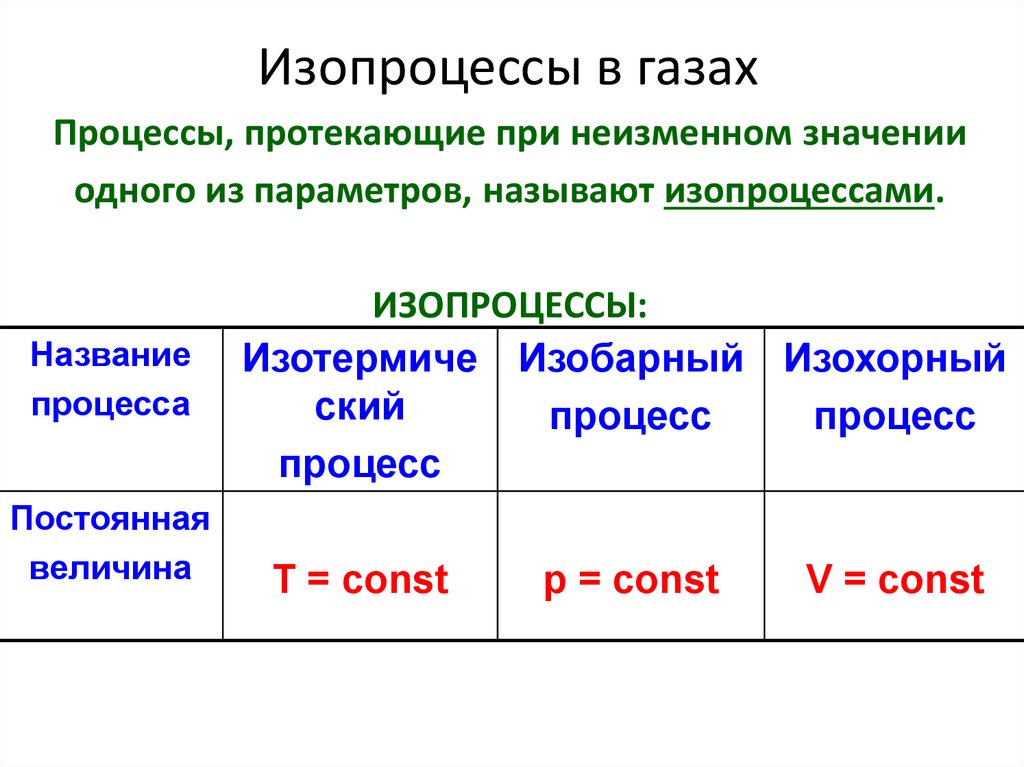
21. Изопроцессы в газах
Процессы, протекающие при неизменном значенииодного из параметров, называют изопроцессами.
Название
процесса
Постоянная
величина
ИЗОПРОЦЕССЫ:
Изотермиче Изобарный Изохорный
ский
процесс
процесс
процесс
T = const
p = const
V = const
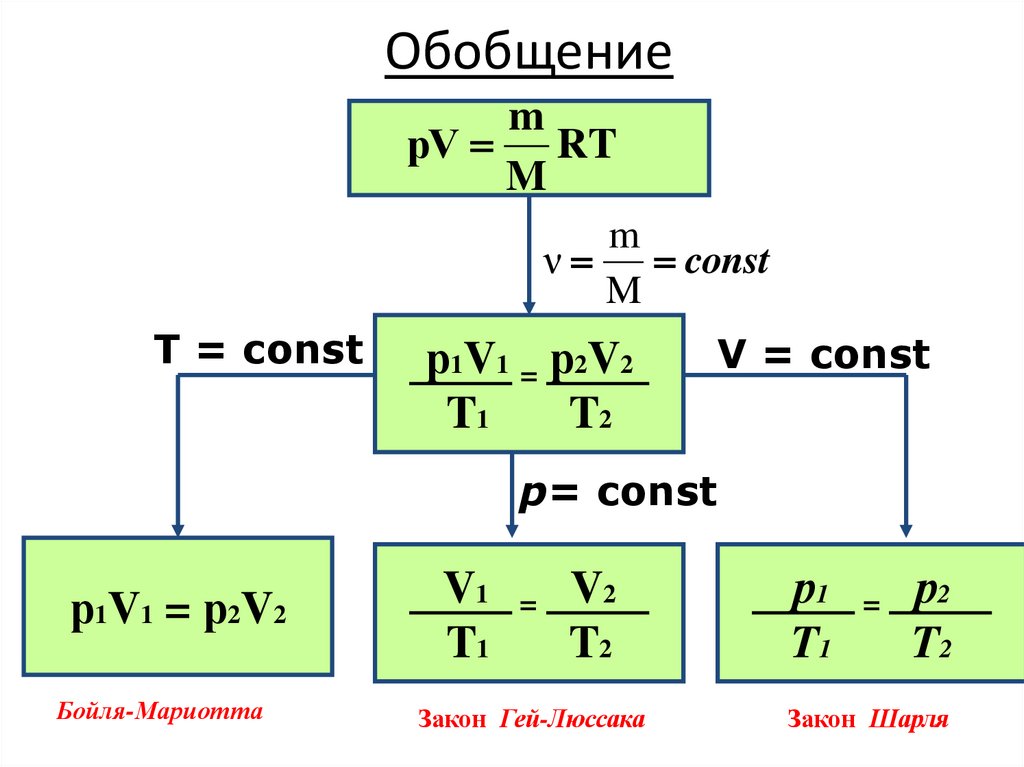
22. Обобщение
mрV RT
M
m
ν
const
M
T = const
р1V1 = р2V2
T1
T2
V = const
р= const
р1V1 = р2V2
Бойля-Мариотта
V1
T1
=
V2
T2
Закон Гей-Люссака
р1
T1
=
р2
T2
Закон Шарля
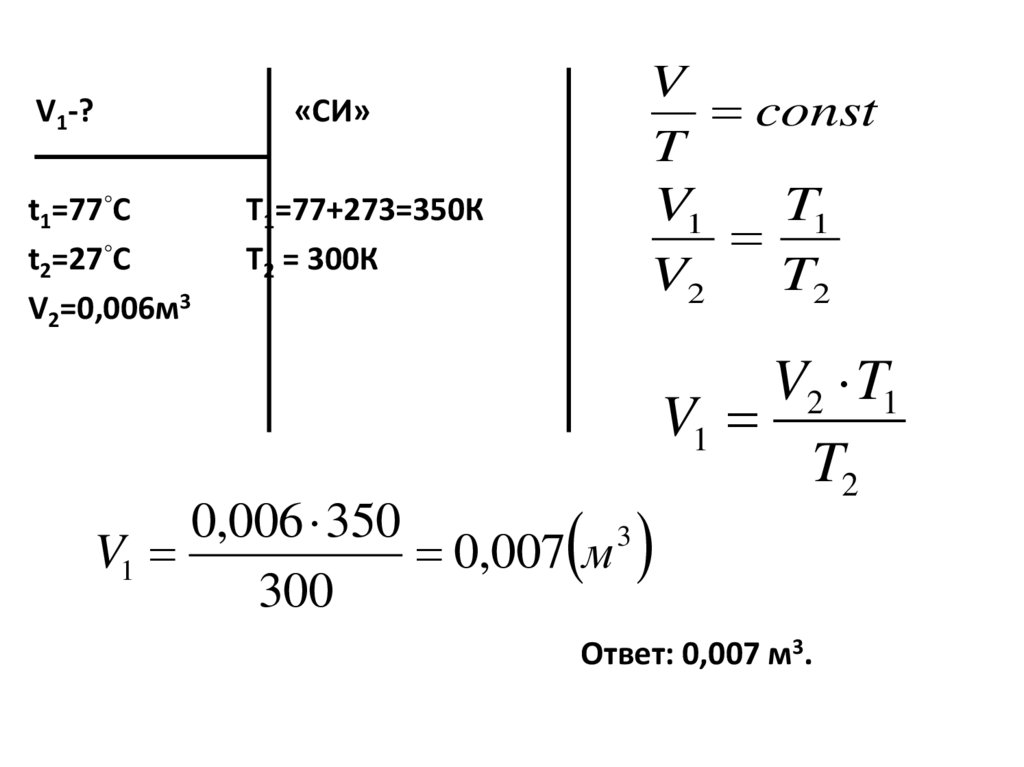
23. Задачи:
4. Какой объём будет занимать газ притемпературе 77◦С, если при 27◦С его
объём равен 0,006 м3,при постоянном
давлении.
24.
25.
V1-?t1=77◦С
t2=27◦С
V2=0,006м3
V
const
T
«СИ»
V1
T1
V2
T2
Т1=77+273=350К
Т2 = 300К
0,006 350
3
V1
0,007 м
300
V2 T1
V1
T2
Ответ: 0,007 м3.
26. Для чего нужно уравнение состояния?
• Уравнение состояния позволяет определитьодну из величин, характеризующих состояние,
например температуру, если известны две
другие величины. Это и используют в
термометрах.
• Зная уравнение состояния, можно сказать, как
протекают в системе различные процессы при
определенных внешних условиях: например,
как будет меняться давление газа, если
увеличивать его объем при неизменной
температуре, и т. д.
• Зная уравнение состояния, можно определить,
как меняется состояние системы, если она
совершает работу или получает теплоту от
окружающих тел.
27.
Перейти по ссылке :http://kornev-school.ru/f10_MendeleevClapeyron_equation.html
Решить задачи 1-6.
28. Задача №1
Газ при давлении 200 кПа итемпературе 17 С имеет объем 5 л.
Чему равен объем (л) этой массы
газа при давлении 100 кПа и
температуре – 3 С?
29. Задача №2
• В баллоне вместимостью25,6 л находится 1,04 кг азота при
давлении 3,55 МПа. Определить
температуру газа
30. Задача №3
• Какой объем ( в литрах) 1 гводорода занимает при
нормальных условиях
( 273 К, 101 кПа)?
31. Задача №4
Определите массу водорода, находящегося вбаллоне вместимостью 20 л под давлением
830 кПа при температуре 17 °С.
32. Вопросы для повторения:
Что называют уравнением состояния?Какая форма уравнения состояния
содержит больше информации:
уравнение Клапейрона или
Менделеева — Клапейрона?
Почему газовая постоянная R
называется универсальной?
Для чего нужно уравнение состояния?






















 physics
physics








