Similar presentations:
Уравнение состояния идеального газа
1.
2. Уравнение состояния идеального газа.
Клапейрон Бенуа Поль Эмиль(1799–1864)
французский физик и инженер. Родился
26 января 1799 в Париже. Окончил
Политехническую школу (1818). Работал
в Институте инженеров путей
сообщения в Петербурге (1820–1830).
По возвращении во Францию стал
профессором Школы мостов и дорог в
Париже.
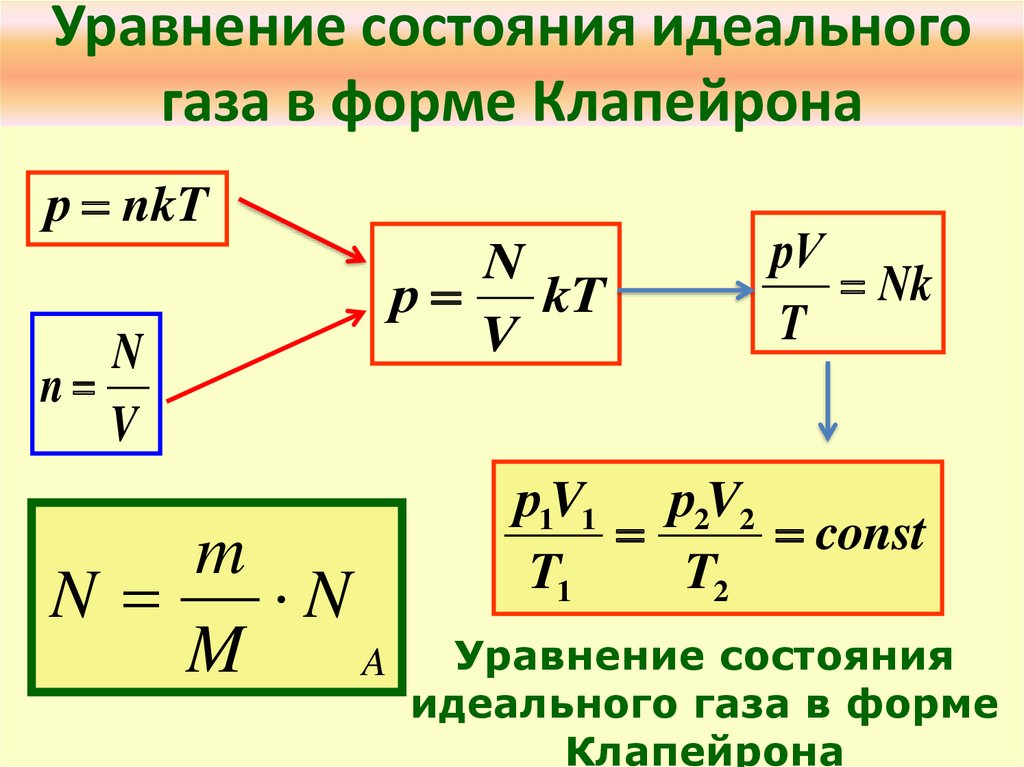
3. Уравнение состояния идеального газа в форме Клапейрона
р nkTN
n
V
m
N
N
M
A
N
р
kT
V
рV
Nk
T
р1V1 р2V2
const
T1
T2
Уравнение состояния
идеального газа в форме
Клапейрона
4.
Менделеев Дмитрий Иванович(8.II.1834–2.II.1907)
• Обобщив уравнение
Клапейрона,
в 1874 вывел общее
уравнение состояния
идеального газа
5.
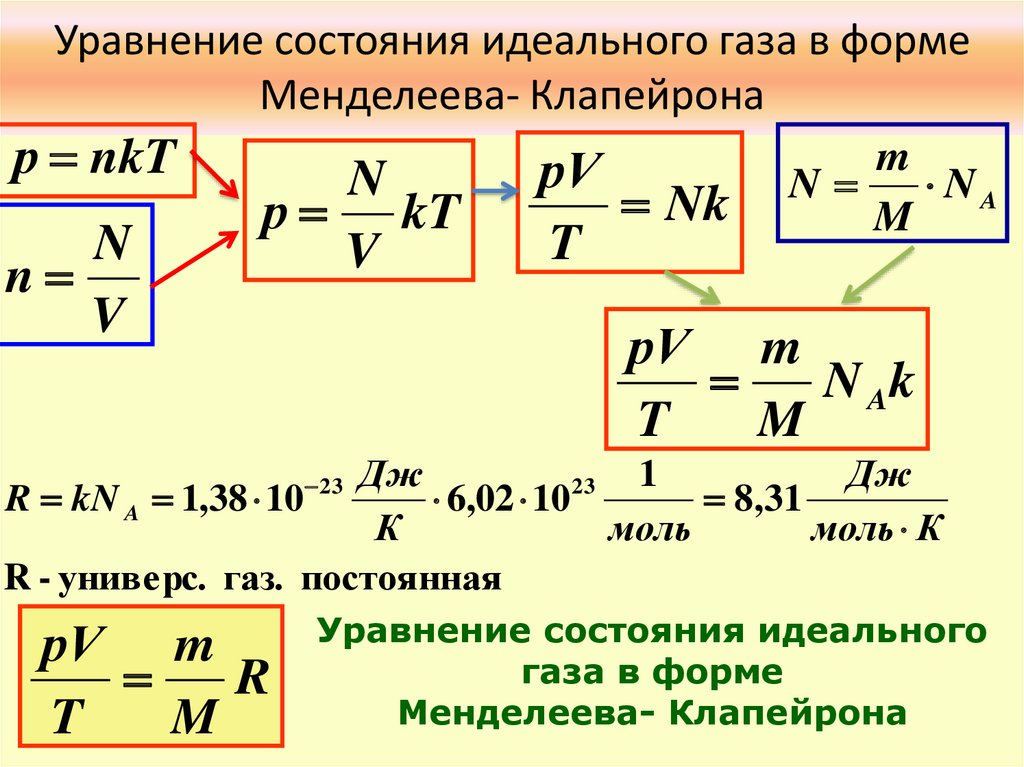
Уравнение состояния идеального газа в формеМенделеева- Клапейрона
р nkT
N
n
V
N
р kT
V
рV
Nk
T
m
N
NA
M
рV m
N Ak
T
M
Дж
1
Дж
23
R kN A 1,38 10
6,02 10
8,31
К
моль
моль К
R - универс. газ. постоянная
23
рV m
R
T
M
Уравнение состояния идеального
газа в форме
Менделеева- Клапейрона
6. Практическое применение уравнения состояния:
1. В термометрах…• Уравнение позволяет
определить одну из
величин, характеризующих
состояние, если известны
две другие величины
• Это используют в
термометрах
7. 2. В газовых законах…
• Зная уравнениесостояния, можно
сказать, как протекают
в системе процессы
при определённых
внешних условиях
8. 3. В молекулярной физике…
• Зная уравнениесостояния, можно
определить, как
меняется состояние
системы, если она
совершает работу или
получает теплоту от
окружающих тел
9.
р1V1 р2V2const
T1
T2
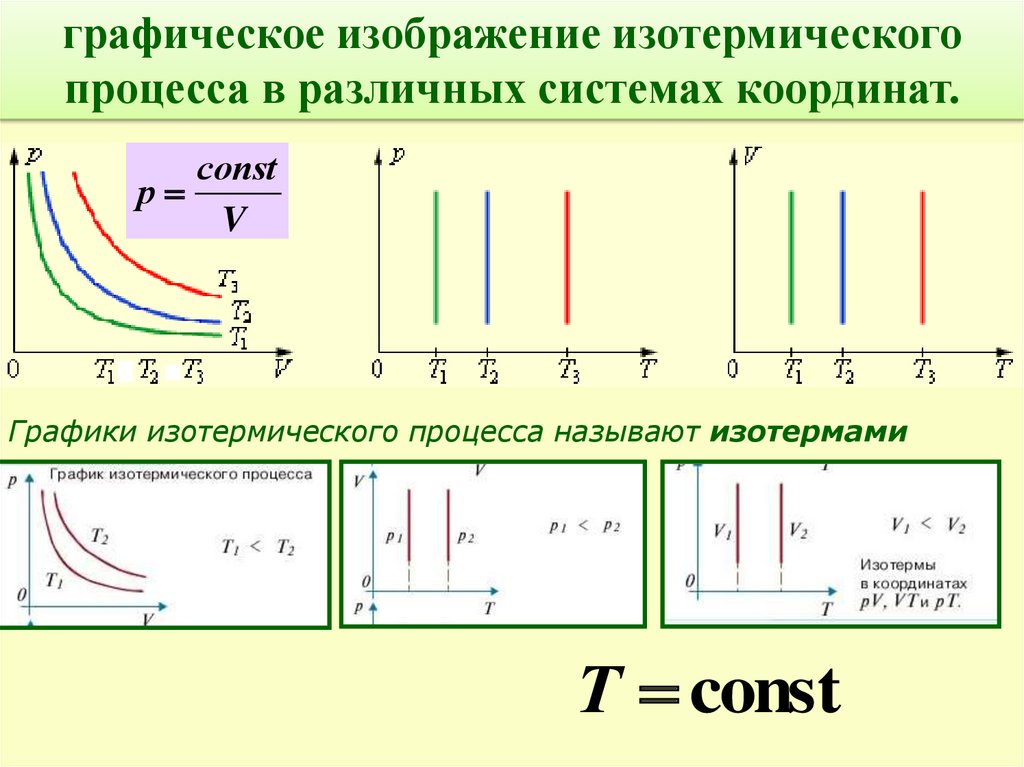
Опр. Изотермический процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянной
температуре Т= const
Закон Бойля-Мариотта: р1V1 р2V2 рV соnst
Для газа данной массы произведение давления газа на
его объем постоянно, если температура газа не
соnst
меняется.
р
V
Э. Мариотт
Р. Бойль
10.
графическое изображение изотермическогопроцесса в различных системах координат.
соnst
р
V
Графики изотермического процесса называют изотермами
Т const
11.
р1V1 р2V2const
T1
T2
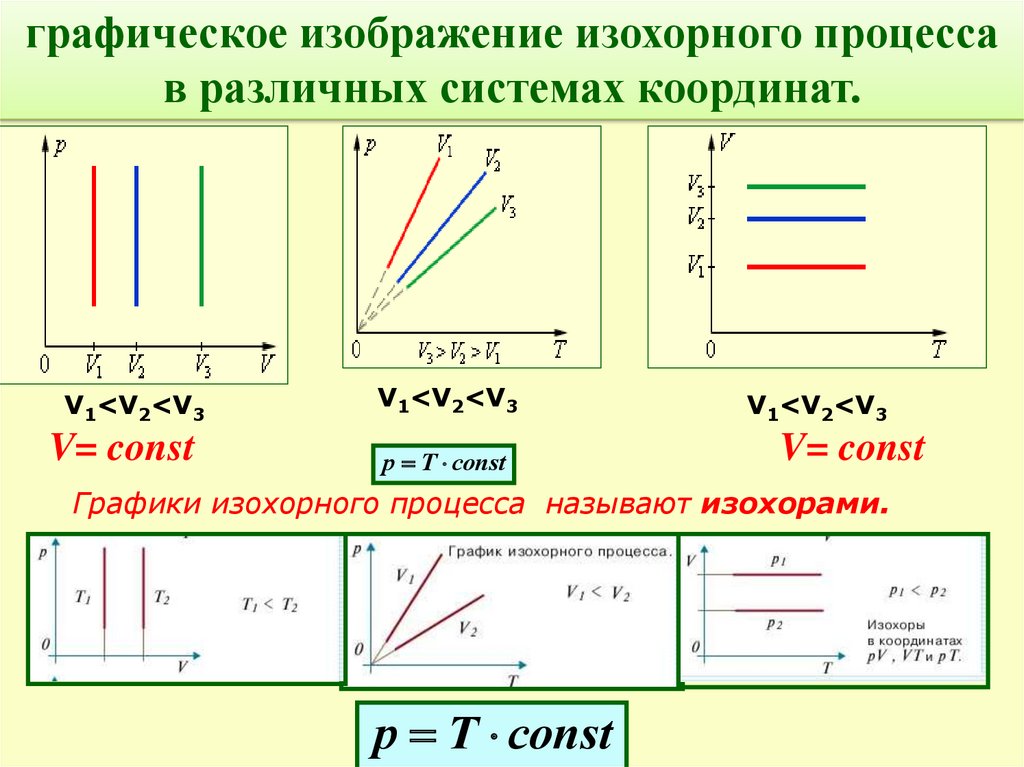
Опр. Изохорный процесс-процесс изменения Ж. Шарль
состояния термодинамической системы
макроскопических тел при постоянном объеме
V= const
Закон Шарля:
Для газа данной массы отношение давления газа к
температуре постоянно, если объем газа не меняется.
р1 р2
Т1 Т 2
р
const
Т
р Т соnst
12.
графическое изображение изохорного процессав различных системах координат.
V1<V2<V3
V= const
V1<V2<V3
р Т соnst
V1<V2<V3
V= const
Графики изохорного процесса называют изохорами.
р Т соnst
13.
р1V1 р2V2const
T1
T2
Опр. Изобарный процесс-процесс изменения
состояния термодинамической системы
макроскопических тел при постоянном
давлении р= const
Закон Гей-Люссака:
Для газа данной массы отношение объема газа к
абсолютной температуре постоянно, если давление
газа не меняется.
V1 V2
T1 T2
V
соnst V T соnst
T
Ж. Гей-Люссак
14.
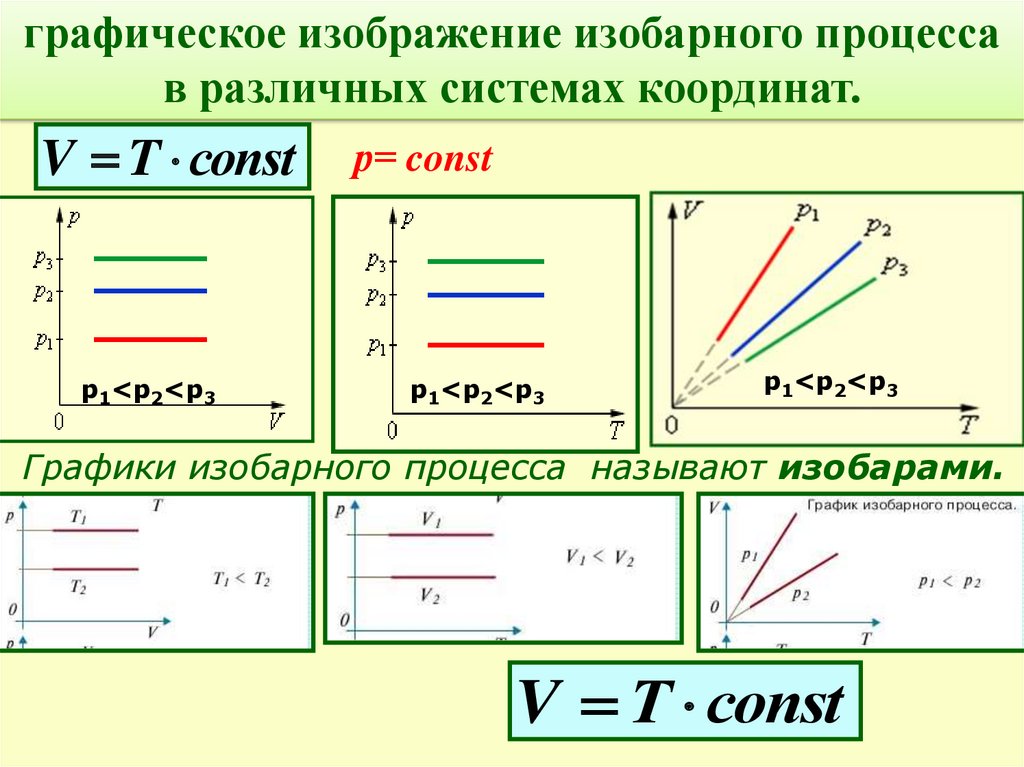
графическое изображение изобарного процессав различных системах координат.
V T соnst
р1<р2<р3
р= const
р1<р2<р3
р1<р2<р3
Графики изобарного процесса называют изобарами.
V Т соnst
15. Изопроцессы в газах
Процессы, протекающие при неизменном значенииодного из параметров, называют изопроцессами.
Название
процесса
Постоянная
величина
ИЗОПРОЦЕССЫ:
Изотермиче Изобарный Изохорный
ский
процесс
процесс
процесс
T = const
p = const
V = const
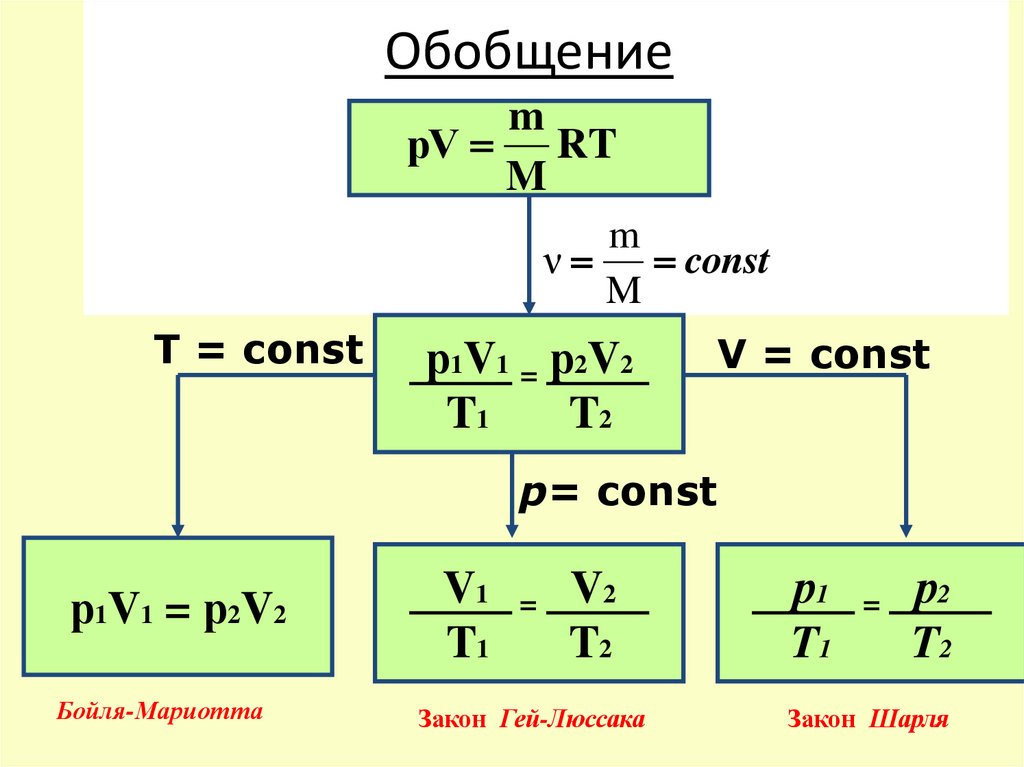
16. Обобщение
mрV RT
M
m
ν
const
M
T = const
р1V1 = р2V2
T1
T2
V = const
р= const
р1V1 = р2V2
Бойля-Мариотта
V1
T1
=
V2
T2
Закон Гей-Люссака
р1
T1
=
р2
T2
Закон Шарля
17. Домашнее задание
§Видеопрезентация к
уроку:https://www.youtube.com/watch?v
=N8RpIGy_6OA
https://www.youtube.com/watch?v=CKga
BHejsXE











 physics
physics








