Similar presentations:
Комплексный подход при лечении сахарного диабета 2 типа
1.
Комплексный подходпри лечении сахарного
диабета 2 типа
Лекция при поддержке Представительства ЗАК «АстраЗенека Ю-Кей Лимитед» в РК
Представлена информация в рамках зарегистрированных в РK показаний.
Номер одобрения KZ -1623
Мнение лектора не всегда может совпадать с точкой зрения компании АстраЗенека
Лекция предназначена для врачей эндокринологов, терапевтов, ВОП.
2.
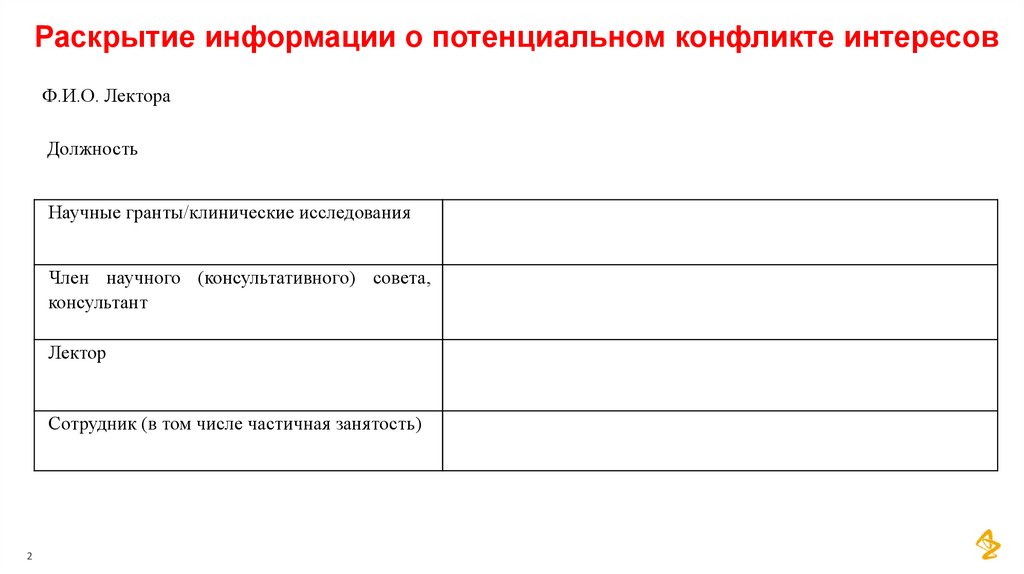
Раскрытие информации о потенциальном конфликте интересовФ.И.О. Лектора
Должность
Научные гранты/клинические исследования
Член научного (консультативного) совета,
консультант
Лектор
Сотрудник (в том числе частичная занятость)
2
3.
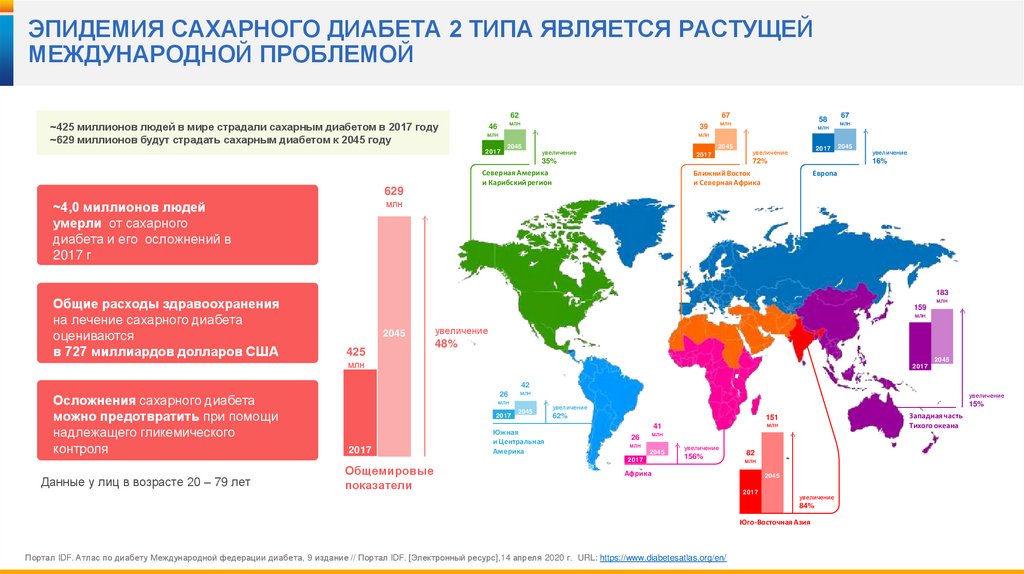
ЭПИДЕМИЯ САХАРНОГО ДИАБЕТА 2 ТИПА ЯВЛЯЕТСЯ РАСТУЩЕЙМЕЖДУНАРОДНОЙ ПРОБЛЕМОЙ
62
~425 миллионов людей в мире страдали сахарным диабетом в 2017 году
~629 миллионов будут страдать сахарным диабетом к 2045 году
67
млн
46
млн
2045
2045
увеличение
2017
35%
67
млн
Северная Америка
и Карибский регион
2017
увеличение
72%
2045
увеличение
16%
Ближний Восток
и Северная Африка
Европа
млн
~4,0 миллионов людей
умерли от сахарного
диабета и его осложнений в
2017 г
Общие расходы здравоохранения
на лечение сахарного диабета
оцениваются
в 727 миллиардов долларов США
млн
млн
2017
629
58
млн
39
183
млн
159
млн
2045
425
увеличение
48%
2045
млн
2017
42
Осложнения сахарного диабета
можно предотвратить при помощи
надлежащего гликемического
контроля
26
млн
млн
2017
2017
2045
Южная
и Центральная
Америка
увеличение
15%
увеличение
62%
Общемировые
показатели
млн
41
млн
26
млн
2045
2017
Данные у лиц в возрасте 20 – 79 лет
Западная часть
Тихого океана
151
увеличение
156%
82
млн
Африка
2045
2017
увеличение
84%
Юго-Восточная Азия
Портал IDF. Атлас по диабету Международной федерации диабета, 9 издание // Портал IDF. [Электронный ресурс],14 апреля 2020 г. URL: https://www.diabetesatlas.org/en/
4.
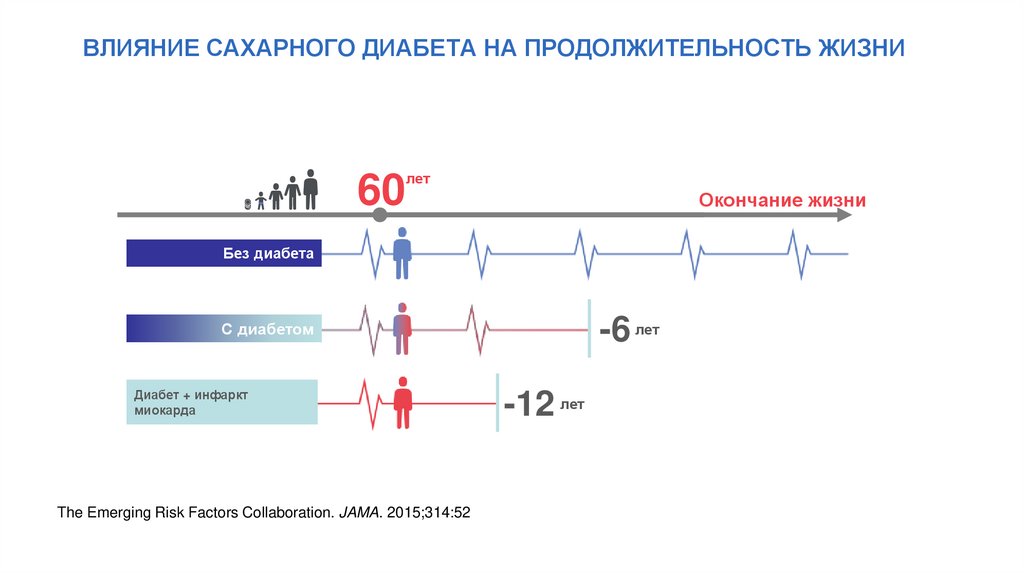
ВЛИЯНИЕ САХАРНОГО ДИАБЕТА НА ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ60
лет
Окончание жизни
Без диабета
-6 лет
С диабетом
Диабет + инфаркт
миокарда
The Emerging Risk Factors Collaboration. JAMA. 2015;314:52
-12 лет
5.
САХАРНЫЙ ДИАБЕТ И СЕРДЕЧНО-СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ2/3 смертей от
сахарного
диабета
связано с сердечнососудистыми
заболеваниями
Low Wang CC, et al. Circulation. 2016;133(24):2459-502. DOI: 10.1161/CIRCULATIONAHA.116.022194.
6.
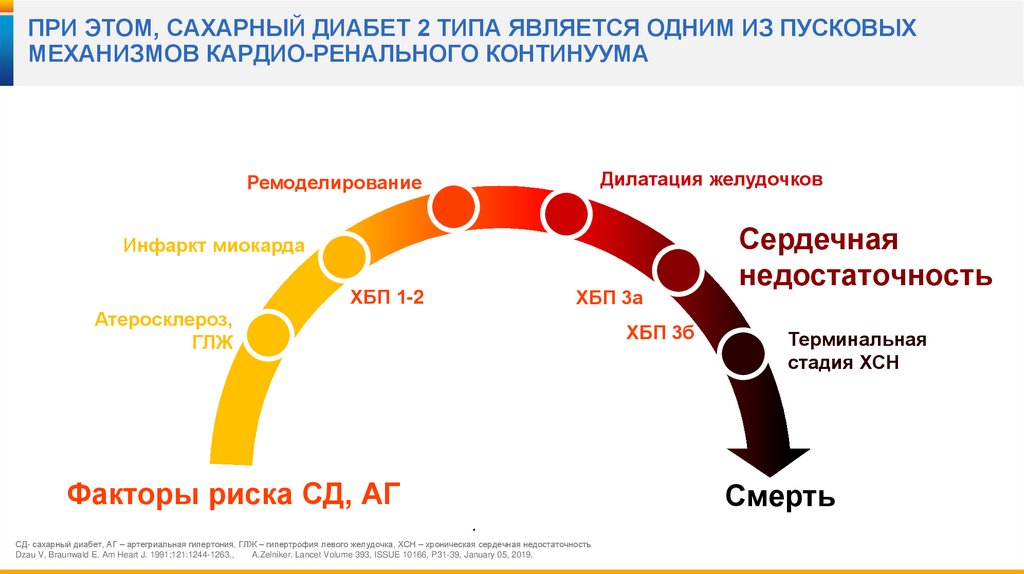
ПРИ ЭТОМ, САХАРНЫЙ ДИАБЕТ 2 ТИПА ЯВЛЯЕТСЯ ОДНИМ ИЗ ПУСКОВЫХМЕХАНИЗМОВ КАРДИО-РЕНАЛЬНОГО КОНТИНУУМА
Дилатация желудочков
Ремоделирование
Инфаркт миокарда
ХБП 1-2
ХБП 3а
Атеросклероз,
ГЛЖ
ХБП 3б
Факторы риска СД, АГ
Сердечная
недостаточность
Терминальная
стадия ХСН
Смерть
.
СД- сахарный диабет, АГ – артегриальная гипертония, ГЛЖ – гипертрофия левого желудочка, ХСН – хроническая сердечная недостаточность
Dzau V, Braunwald E. Am Heart J. 1991;121:1244-1263.,
A.Zelniker. Lancet Volume 393, ISSUE 10166, P31-39, January 05, 2019.
7.
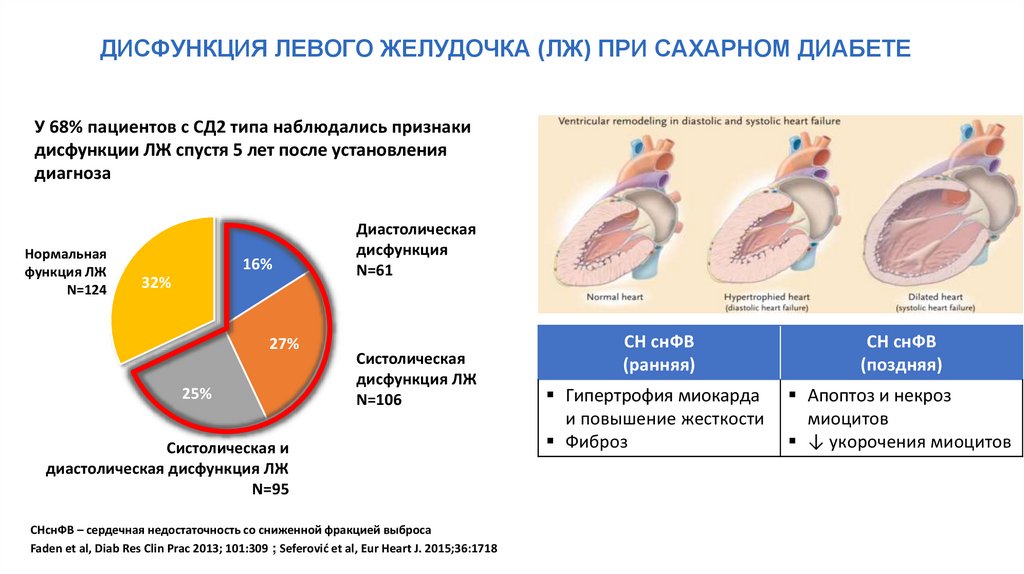
ДИСФУНКЦИЯ ЛЕВОГО ЖЕЛУДОЧКА (ЛЖ) ПРИ САХАРНОМ ДИАБЕТЕУ 68% пациентов с СД2 типа наблюдались признаки
дисфункции ЛЖ спустя 5 лет после установления
диагноза
Нормальная
функция ЛЖ
N=124
16%
32%
27%
25%
Диастолическая
дисфункция
N=61
Систолическая
дисфункция ЛЖ
N=106
Систолическая и
диастолическая дисфункция ЛЖ
N=95
СНснФВ – сердечная недостаточность со сниженной фракцией выброса
Faden et al, Diab Res Clin Prac 2013; 101:309 ; Seferović et al, Eur Heart J. 2015;36:1718
СН снФВ
(ранняя)
СН снФВ
(поздняя)
Гипертрофия миокарда
и повышение жесткости
Фиброз
Апоптоз и некроз
миоцитов
↓ укорочения миоцитов
8.
ПАЦИЕНТ, САХАРНЫЙ ДИАБЕТ 2 ТИПА ДИАГНОСТИРОВАН 3 ГОДА НАЗАДСергей, 57 лет
HbA1c 7,8%
СКФ 93 мл/мин
ИМТ 31 кг/м2
АД 150/90 мм рт.ст.
Дислипидемия (ЛПНП 3,6 ммоль/л, ТГ 1,6 ммоль/л)
Факторы риска!!
Получает:
Гипотетический пациент
Метформин 2000 мг,
Эналаприл 20 мг
Розувастатин 20 мг
Hb1Ac – гликированный гемоглобин, ИМТ – индекс массы тела, СКФ – скорость клубочковой фильтрации, АД – артериальное давление,
ЛПНП- липопротеиды низкой плотности, ТГ - триглицериды
9.
«С моментапостановки СД2т
я очень боюсь
слепоты или
ампутации…
Гипотетический пациент
СД2Т – сахарный диабет 2 типа
10.
…Сердечнаянедостаточность?
Нефропатия?
Что это?»
Гипотетический пациент
11.
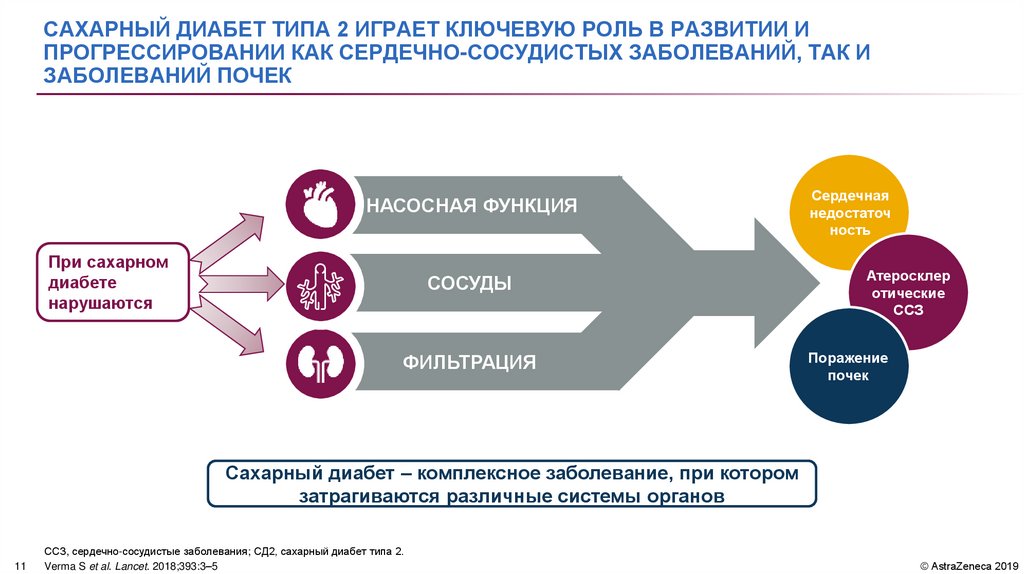
САХАРНЫЙ ДИАБЕТ ТИПА 2 ИГРАЕТ КЛЮЧЕВУЮ РОЛЬ В РАЗВИТИИ ИПРОГРЕССИРОВАНИИ КАК СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, ТАК И
ЗАБОЛЕВАНИЙ ПОЧЕК
НАСОСНАЯ ФУНКЦИЯ
При сахарном
диабете
нарушаются
СОСУДЫ
ФИЛЬТРАЦИЯ
Сердечная
недостаточ
ность
Атеросклер
отические
ССЗ
Поражение
почек
Сахарный диабет – комплексное заболевание, при котором
затрагиваются различные системы органов
11
ССЗ, сердечно-сосудистые заболевания; СД2, сахарный диабет типа 2.
Verma S et al. Lancet. 2018;393:3–5
© AstraZeneca 2019
12.
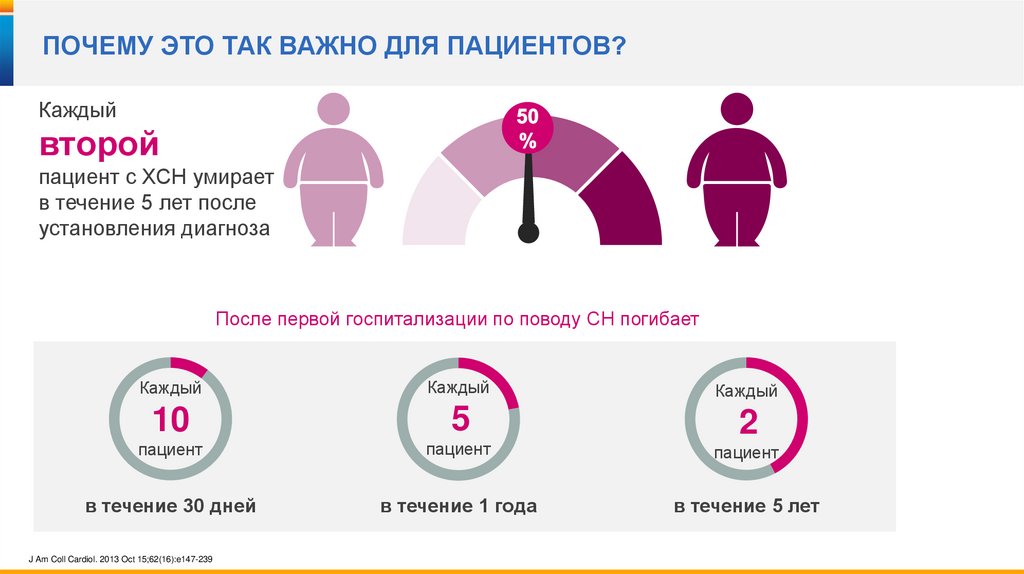
ПОЧЕМУ ЭТО ТАК ВАЖНО ДЛЯ ПАЦИЕНТОВ?Каждый
второй
пациент с ХСН умирает
в течение 5 лет после
установления диагноза
После первой госпитализации по поводу СН погибает
Каждый
Каждый
Каждый
10
5
пациент
пациент
2
пациент
в течение 30 дней
в течение 1 года
в течение 5 лет
J Am Coll Cardiol. 2013 Oct 15;62(16):e147-239
13.
ЗАДЕРЖКА В ИНТЕНСИФИКАЦИИ ТЕРАПИИ НА 6 МЕСЯЦЕВ УВЕЛИЧИВАЕТ РИСКСЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ У ПАЦИЕНТОВ С СД2 ТИПА1,2
Британская клиническая практика (база данных CPRD)1
HbA1c
>7% через
12 мес
6-месячная задержка интенсификации терапии
+ 2 ПССП / ПССП + Инсулин
Немедленная интенсификация 2
ПССП / ПССП + Инсулин
Отсрочка терапии приводит к:1
• Значимо повышенному риску ИМ (ОР 1,26 ДИ 1,13 - 1,40; p<0,01)
• Значимо повышенному риску СС событий (ОР 1,20, 95% ДИ 1,13 - 1,28;
p<0,01)
ПССП – пероральные сахароснижающие препараты, СД– сахарный диабет, Hb1Ac – гликированный гемоглобин
1. Paul S. et al. Diabetologia. 2013; 56(Suppl1):S534. 2. Holman RR et al. N Engl J Med. 2008; 359:1577–1589.
5 лет
Диагноз СД 2
n=110,543
Увеличенный риск
в группе задержки
интенсификации
терапии
20%
26%
ССЗ
ИМ
14.
ОПРЕДЕЛИМ ГРУППУ СС РИСКА ПАЦИЕНТА ДЛЯ ДАЛЬНЕЙШЕГО ВЫБОРАТЕРАПИИ
Очень
высокий риск
Пациенты с СД и диагностированным ССЗ или
поражением другого органа-мишени или >3 больших
факторов риска
или ранним развитием СД 1 типа с большой его длительностью
(>20 лет)
Высокий риск
Пациенты с СД длительностью >10 лет без поражения органовмишеней и одним любым дополнительным фактором риска (возраст ,
АГ, курение, дислипидемия)
Умеренный риск
Молодые пациенты с СД 1 типа в возрасте <35 лет или с СД 2 типа в
возрасте <50 лет с длительностью СД <10 лет без других факторов
риска
СД – сахарный диабет, ССЗ – сердечно-сосудистое заболевание
Cosent no F et at. Online ahead of prnt Eur Heart J. 2019.
15.
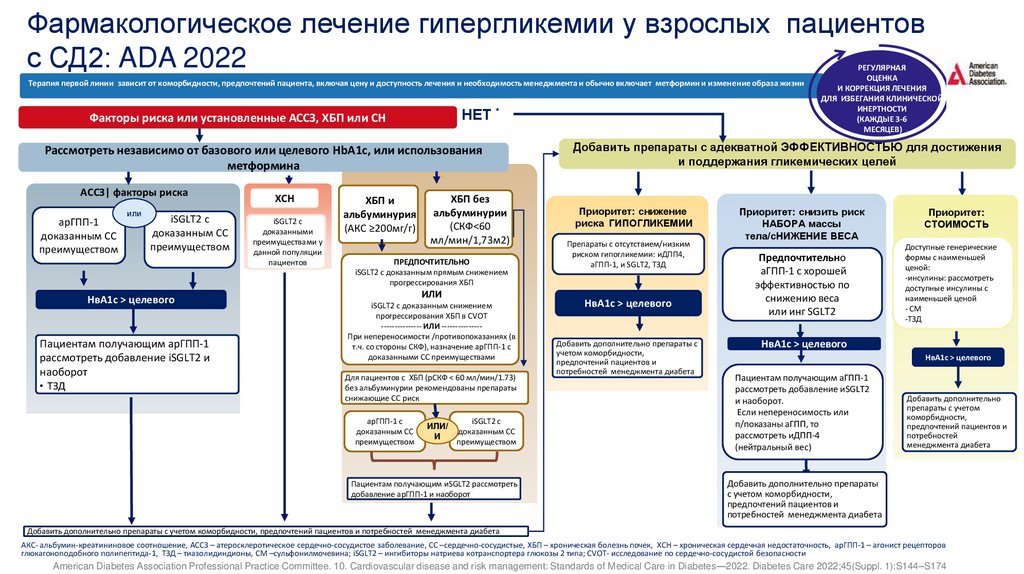
Фармакологическое лечение гипергликемии у взрослых пациентовс СД2: ADA 2022
Терапия первой линии зависит от коморбидности, предпочтений пациента, включая цену и доступность лечения и необходимость менеджмента и обычно включает метформин и изменение образа жизни
НЕТ *
Факторы риска или установленные АССЗ, ХБП или СН
Рассмотреть независимо от базового или целевого HbA1c, или использования
метформина
АССЗ| факторы риска
арГПП-1
доказанным СС
преимуществом
или
iSGLT2 с
доказанным СС
преимуществом
НвА1с > целевого
Пациентам получающим арГПП-1
рассмотреть добавление iSGLT2 и
наоборот
• ТЗД
ХСН
iSGLT2 с
доказанными
преимуществами у
данной популяции
пациентов
ХБП и
альбуминурия
(АКС ≥200мг/г)
ХБП без
альбуминурии
(СКФ<60
мл/мин/1,73м2)
ПРЕДПОЧТИТЕЛЬНО
iSGLT2 с доказанным прямым снижением
прогрессирования ХБП
ИЛИ
iSGLT2 с доказанным снижением
прогрессирования ХБП в CVOT
--------------- ИЛИ --------------При непереносимости /противопоказаниях (в
т.ч. со стороны СКФ), назначение арГПП-1 с
доказанными СС преимуществами
Для пациентов с ХБП (рСКФ < 60 мл/мин/1.73)
без альбуминурии рекомендованы препараты
снижающие СС риск
арГПП-1 с
доказанным СС
преимуществом
ИЛИ/
И
iSGLT2 с
доказанным СС
преимуществом
Пациентам получающим иSGLT2 рассмотреть
добавление арГПП-1 и наоборот
Novo Nordisk®
РЕГУЛЯРНАЯ
ОЦЕНКА
И КОРРЕКЦИЯ ЛЕЧЕНИЯ
ДЛЯ ИЗБЕГАНИЯ КЛИНИЧЕСКОЙ
ИНЕРТНОСТИ
(КАЖДЫЕ 3-6
МЕСЯЦЕВ)
Добавить препараты с адекватной ЭФФЕКТИВНОСТЬЮ для достижения
и поддержания гликемических целей
Приоритет: снижение
риска ГИПОГЛИКЕМИИ
Препараты с отсутствием/низким
риском гипогликемии: иДПП4,
аГПП-1, и SGLT2, ТЗД
НвА1с > целевого
Добавить дополнительно препараты с
учетом коморбидности,
предпочтений пациентов и
потребностей менеджмента диабета
Приоритет: снизить риск
НАБОРА массы
тела/сНИЖЕНИЕ ВЕСА
Предпочтительно
аГПП-1 с хорошей
эффективностью по
снижению веса
или инг SGLT2
Приоритет:
СТОИМОСТЬ
Доступные генерические
формы с наименьшей
ценой:
-инсулины: рассмотреть
доступные инсулины с
наименьшей ценой
- СМ
-ТЗД
НвА1с > целевого
НвА1с > целевого
Пациентам получающим аГПП-1
рассмотреть добавление иSGLT2
и наоборот.
Если непереносимость или
п/показаны аГПП, то
рассмотреть иДПП-4
(нейтральный вес)
Добавить дополнительно
препараты с учетом
коморбидности,
предпочтений пациентов и
потребностей
менеджмента диабета
Добавить дополнительно препараты
с учетом коморбидности,
предпочтений пациентов и
потребностей менеджмента диабета
Добавить дополнительно препараты с учетом коморбидности, предпочтений пациентов и потребностей менеджмента диабета
АКС- альбумин-креатининовое соотношение, АССЗ – атеросклеротическое сердечно-сосудистое заболевание, СС –сердечно-сосудистые, ХБП – хроническая болезнь почек, ХСН – хроническая сердечная недостаточность, арГПП-1 – агонист рецепторов
глюкагоноподобного полипептида-1, ТЗД – тиазолидиндионы, СМ –сульфонилмочевина; iSGLT2 – ингибиторы натриева котранспортера глюкозы 2 типа; CVOT- исследование по сердечно-сосудистой безопасности
American Diabetes Association Professional Practice Committee. 10. Cardiovascular disease and risk management: Standards of Medical Care in Diabetes—2022. Diabetes Care 2022;45(Suppl. 1):S144–S174
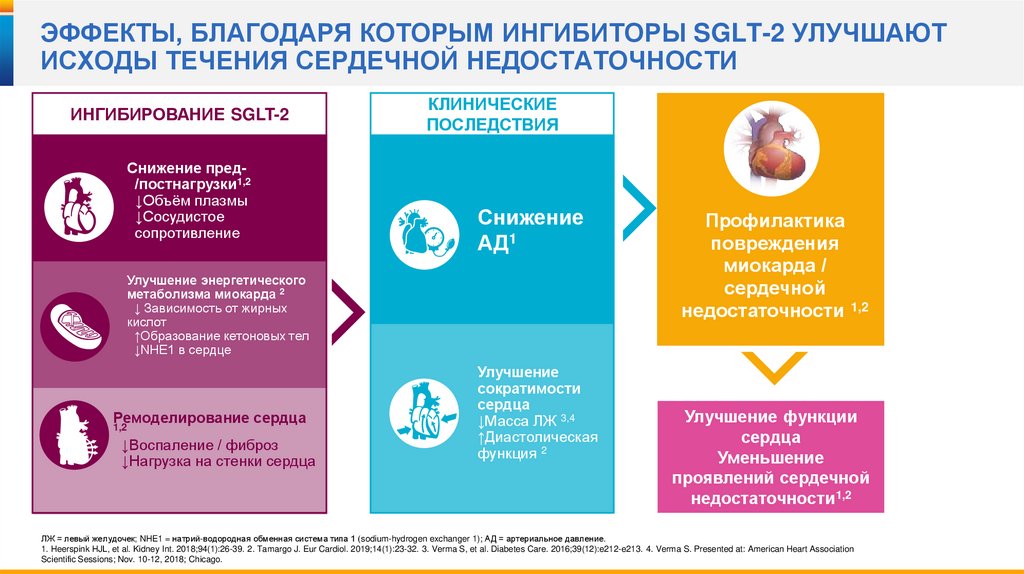
16.
ЭФФЕКТЫ, БЛАГОДАРЯ КОТОРЫМ ИНГИБИТОРЫ SGLT-2 УЛУЧШАЮТИСХОДЫ ТЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
ИНГИБИРОВАНИЕ SGLT-2
Снижение пред/постнагрузки1,2
↓Объём плазмы
↓Сосудистое
сопротивление
КЛИНИЧЕСКИЕ
ПОСЛЕДСТВИЯ
Снижение
АД1
Улучшение энергетического
метаболизма миокарда 2
↓ Зависимость от жирных
кислот
↑Образование кетоновых тел
↓NHE1 в сердце
Ремоделирование
сердца
1,2
↓Воспаление / фиброз
↓Нагрузка на стенки сердца
Улучшение
сократимости
сердца
↓Масса ЛЖ 3,4
↑Диастолическая
функция 2
Профилактика
повреждения
миокарда /
сердечной
недостаточности 1,2
Улучшение функции
сердца
Уменьшение
проявлений сердечной
недостаточности1,2
ЛЖ = левый желудочек; NHE1 = натрий-водородная обменная система типа 1 (sodium-hydrogen exchanger 1); АД = артериальное давление.
1. Heerspink HJL, et al. Kidney Int. 2018;94(1):26-39. 2. Tamargo J. Eur Cardiol. 2019;14(1):23-32. 3. Verma S, et al. Diabetes Care. 2016;39(12):e212-e213. 4. Verma S. Presented at: American Heart Association
Scientific Sessions; Nov. 10-12, 2018; Chicago.
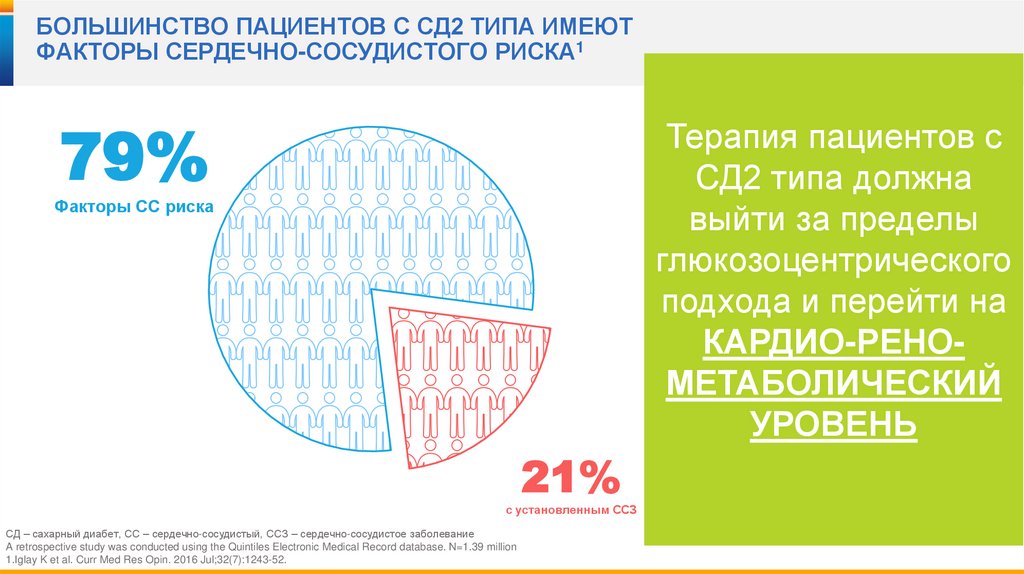
17.
БОЛЬШИНСТВО ПАЦИЕНТОВ С СД2 ТИПА ИМЕЮТФАКТОРЫ СЕРДЕЧНО-СОСУДИСТОГО РИСКА1
79%
Терапия пациентов с
СД2 типа должна
выйти за пределы
глюкозоцентрического
подхода и перейти на
КАРДИО-РЕНОМЕТАБОЛИЧЕСКИЙ
УРОВЕНЬ
Факторы СС риска
21%
с установленным ССЗ
СД – сахарный диабет, СС – сердечно-сосудистый, ССЗ – сердечно-сосудистое заболевание
A retrospective study was conducted using the Quintiles Electronic Medical Record database. N=1.39 million
1.Iglay K et al. Curr Med Res Opin. 2016 Jul;32(7):1243-52.
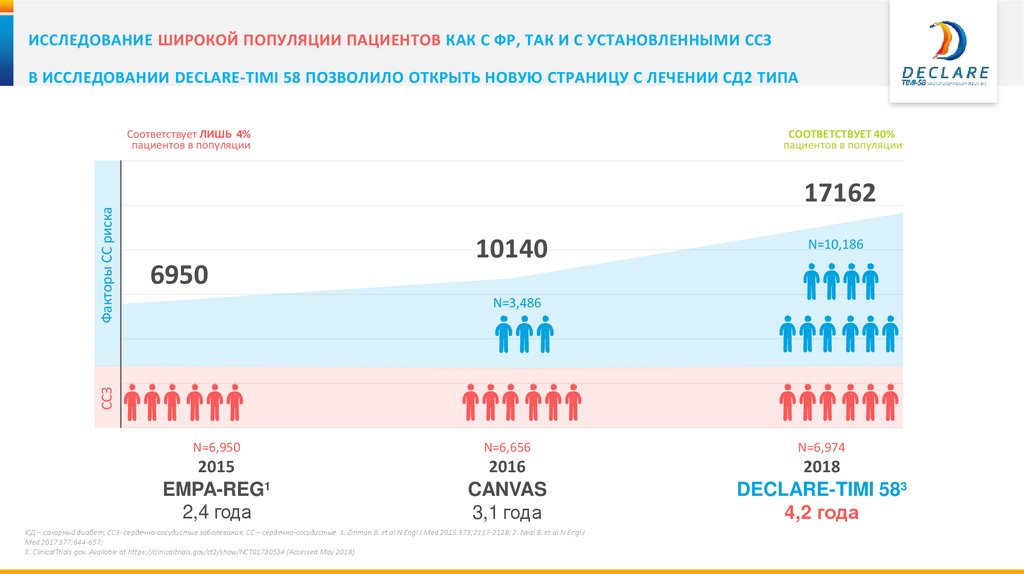
18.
ИССЛЕДОВАНИЕ ШИРОКОЙ ПОПУЛЯЦИИ ПАЦИЕНТОВ КАК С ФР, ТАК И С УСТАНОВЛЕННЫМИ ССЗВ ИССЛЕДОВАНИИ DECLARE-TIMI 58 ПОЗВОЛИЛО ОТКРЫТЬ НОВУЮ СТРАНИЦУ С ЛЕЧЕНИИ СД2 ТИПА
СООТВЕТСТВУЕТ 40%
пациентов в популяции
17162
6950
10140
N=10,186
N=3,486
ССЗ
Факторы СС риска
Соответствует ЛИШЬ 4%
пациентов в популяции
N=6,950
N=6,656
N=6,974
2015
2016
2018
EMPA-REG1
2,4 года
CANVAS
3,1 года
DECLARE-TIMI 583
4,2 года
iСД – сахарный диабет, ССЗ- сердечно-сосудистые заболевания, СС – сердечно-сосудистые 1. Zinman B. et al N Engl J Med 2015.373;2117-2128; 2. Neal B. et al N Engl J
Med 2017 377:644-657;
3. ClinicalTrials gov. Available at https://clinicaltrials.gov/ct2/show/NCT01730534 (Accessed May 2018)
19.
>17 000ПАЦИЕНТОВ
60% ИЗ НИХ – БЕЗ ССЗ
Единственное крупномасштабное
рандомизированное КИ с
включением широкой популяции
пациентов ( от факторов сс риска
до УАССЗ)
39% ПАЦИЕНТОВ В ПОПУЛЯЦИИ
СООТВЕТСТВУЮТ КРИТЕРИЯМ
ВКЛЮЧЕНИЯ2,3
>4,0 ЛЕТ1
ССЗ – сердечно-сосудистые заболевния
1.
Wiviott S.D et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes N Engl J Med 2019; 380:347-357
2.
Wittbrodt ET, Green J, Latham K, et al. Generalizability of sodium-glucose cotransporter-2 inhibitor cardiovascular outcomes trial enrollment criteria to the US type 2 diabetes population [Poster]. Presented at the 15th Annual World Congress on Insulin Resistance, Diabetes &
Cardiovascular Disease; November 30-December 2, 2017; Los Angeles, CA.
3.
Data on file. AstraZeneca Pharmaceuticals LP. 3. Raz I, Mosenzon O, Bonaca MP, et al. DECLARE-TIMI 58: participants' baseline characteristics. [published online ahead of print February 14, 2018]. Diabetes Obes Metab. 2018. doi:10.1111/dom.13217.
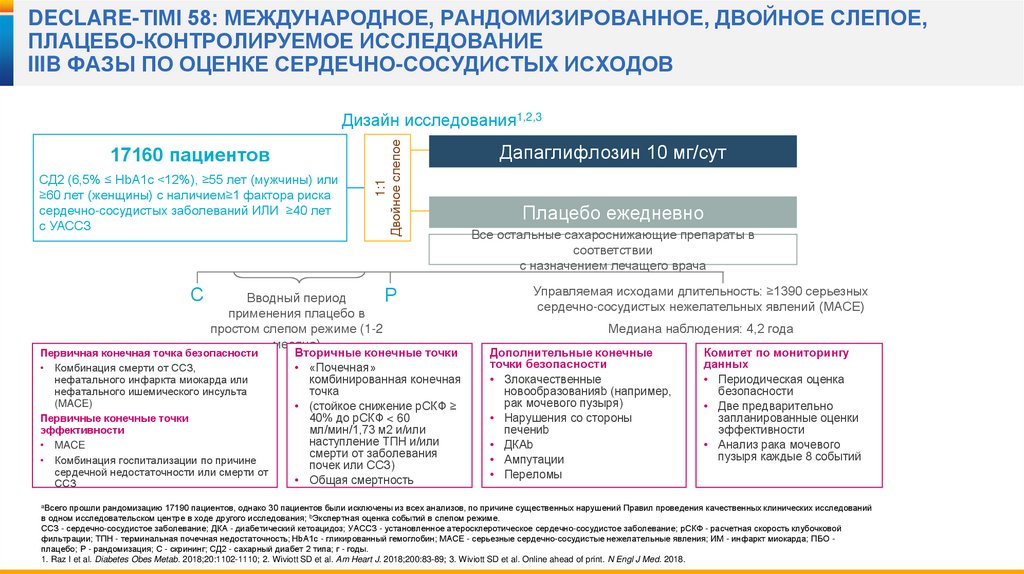
20.
DECLARE-TIMI 58: МЕЖДУНАРОДНОЕ, РАНДОМИЗИРОВАННОЕ, ДВОЙНОЕ СЛЕПОЕ,ПЛАЦЕБО-КОНТРОЛИРУЕМОЕ ИССЛЕДОВАНИЕ
IIIB ФАЗЫ ПО ОЦЕНКЕ СЕРДЕЧНО-СОСУДИСТЫХ ИСХОДОВ
17160 пациентов
СД2 (6,5% ≤ HbA1c <12%), ≥55 лет (мужчины) или
≥60 лет (женщины) с наличием≥1 фактора риска
сердечно-сосудистых заболеваний ИЛИ ≥40 лет
с УАССЗ
С
1:1
Двойное слепое
Дизайн исследования1,2,3
Р
Вводный период
применения плацебо в
простом слепом режиме (1-2
месяца)
Первичная конечная точка безопасности
• Комбинация смерти от ССЗ,
нефатального инфаркта миокарда или
нефатального ишемического инсульта
(MACE)
Первичные конечные точки
эффективности
• MACE
• Комбинация госпитализации по причине
сердечной недостаточности или смерти от
ССЗ
Вторичные конечные точки
• «Почечная»
комбинированная конечная
точка
• (стойкое снижение рСКФ ≥
40% до рСКФ < 60
мл/мин/1,73 м2 и/или
наступление ТПН и/или
смерти от заболевания
почек или ССЗ)
• Общая смертность
Дапаглифлозин 10 мг/сут
Плацебо ежедневно
Все остальные сахароснижающие препараты в
соответствии
с назначением лечащего врача
Управляемая исходами длительность: ≥1390 серьезных
сердечно-сосудистых нежелательных явлений (MACE)
Медиана наблюдения: 4,2 года
Дополнительные конечные
точки безопасности
• Злокачественные
новообразованияb (например,
рак мочевого пузыря)
• Нарушения со стороны
печениb
• ДКАb
• Ампутации
• Переломы
Комитет по мониторингу
данных
• Периодическая оценка
безопасности
• Две предварительно
запланированные оценки
эффективности
• Анализ рака мочевого
пузыря каждые 8 событий
aВсего прошли рандомизацию 17190 пациентов, однако 30 пациентов были исключены из всех анализов, по причине существенных нарушений Правил проведения качественных клинических исследований
в одном исследовательском центре в ходе другого исследования; bЭкспертная оценка событий в слепом режиме.
ССЗ - сердечно-сосудистое заболевание; ДКА - диабетический кетоацидоз; УАССЗ - установленное атеросклеротическое сердечно-сосудистое заболевание; рСКФ - расчетная скорость клубочковой
фильтрации; ТПН - терминальная почечная недостаточность; HbA1c - гликированный гемоглобин; МАСЕ - серьезные сердечно-сосудистые нежелательные явления; ИМ - инфаркт миокарда; ПБО плацебо; Р - рандомизация; С - скрининг; СД2 - сахарный диабет 2 типа; г - годы.
1. Raz I et al. Diabetes Obes Metab. 2018;20:1102-1110; 2. Wiviott SD et al. Am Heart J. 2018;200:83-89; 3. Wiviott SD et al. Online ahead of print. N Engl J Med. 2018.
21.
В ИССЛЕДОВАНИЕ ВКЛЮЧАЛИСЬ ПАЦИЕНТЫ С СД 2 ТИПАИ МНОЖЕСТВЕННЫМИ СС ФАКТОРАМИ РИСКА, ЛИБО УСТАНОВЛЕННЫМИ
СС ЗАБОЛЕВАНИЯМИ
Критерии включения:
Критерии исключения:
● Женщины или мужчины;
возраст ≥ 40 лет
● HbA1c ≥12% или <6,5% с ограничением числа пациентов с
уровнем HbA1c от 6,5% до <7% примерно до 5%
● Диагноз СД2
● Клиренс креатинина < 60 мл/мин (рассчитанный по
формуле Кокрофта-Голта)
● Повышенный риск развития ССЗ в
соответствии с 2 категориями:
● Гематурия неясного генеза
множественные факторы риска
развития ССЗ или установленное ● Наличие рака мочевого пузыря или злокачественного
новообразования (за исключением немеланомного рака
атеросклеротическое ССЗ
кожи) в течение последних 5 лет
● Рецидивирующие инфекции мочевыводящих путей
● Острое сердечно-сосудистое или цереброваскулярное
событие за 8 недель до рандомизации
● Применение ингибитора НГЛТ2, пиоглитазона или
розиглитазона
.
СС - сердечно-сосудистый; HbA1c - гликированный гемоглобин; СД2 - сахарный диабет 2 типа.
Raz I et al. Diabetes Obes Metab. 2018;20:1102-1110.
22.
КАТЕГОРИИ СЕРДЕЧНО-СОСУДИСТОГО РИСКА В DECLARE-TIMI 58Множественные факторы риска
развития ССЗ (МФР):
Установленное атеросклеротическое
сердечно-сосудистое заболевание (УАССЗ):
Возраст
≥55 лет (мужчины), ≥60 лет (женщины)
Возраст ≥40 лет
И ≥1 дополнительного фактора риска:
Артериальная гипертензия (≥1 из
следующих показателей)
ХС-ЛПНП > 130 мг/дл (> 3,36 ммоль/л)
Прием гиполипидемических препаратов
АД > 140/90 мм рт. ст. на момент
включения в исследование
Прием антигипертензивных препаратов
Курение в настоящее время
≥5 сигарет/сут в течение ≥1 года
Ишемическая болезнь сердца (любое из нижеперечисленного)
Дислипидемия (≥1 из следующих
показателей)
И ≥1 дополнительные диагнозы:
Цереброваскулярное заболевание (любое из
нижеперечисленного)
ИМ
ЧКВ
АКШ
≥50% стеноз ≥2 коронарных артерий
Ишемический инсульт
Стентирование или эндартерэктомия сонных артерий
Заболевание периферических артерий (любое из
нижеперечисленного)
Стентирование периферической артерии или хирургическая
реваскуляризация
Ампутация нижней конечности по причине ЗПА
Симптоматическая ПХ и ЛПИ < 0,90 за последние 12 месяцев.
ЛПИ - лодыжечно-плечевой индекс; АД - артериальное давление; АКШ - шунтирование коронарной артерии; СС - сердечно-сосудистый; ПХ - перемежающаяся хромота; ХС-ЛПНП - холестерин липопротеинов низкой плотности; ИМ - инфаркт миокарда; мес. - месяцы; ЗПА заболевание периферических артерий; ЧКВ - чрескожное коронарное вмешательство.
Wiviott SD et al. Supplemental materials. Am Heart J. 2018;200:83-89.
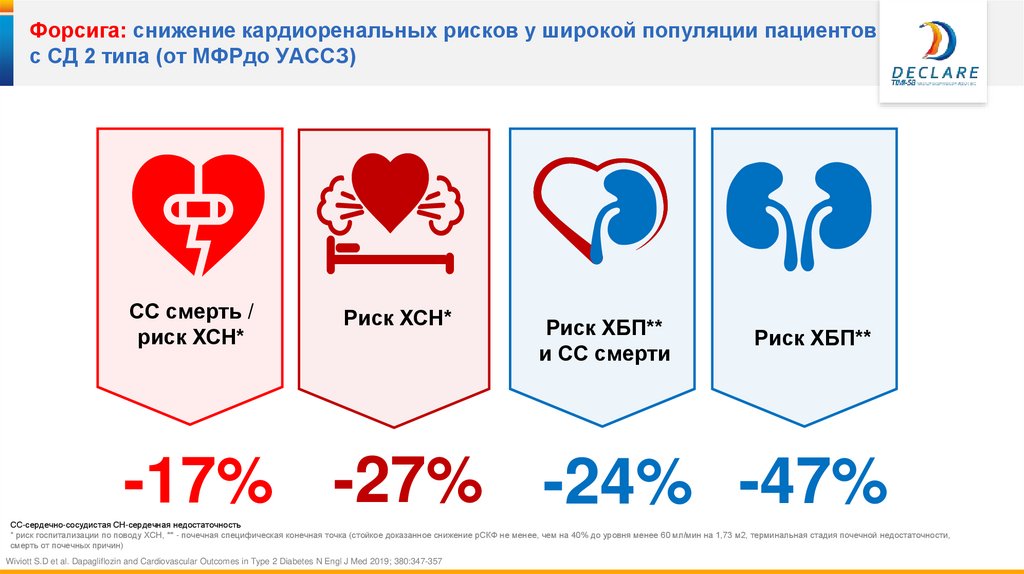
23.
Форсига: снижение кардиоренальных рисков у широкой популяции пациентовс СД 2 типа (от МФРдо УАССЗ)
СС смерть /
риск ХСН*
Риск ХСН*
Риск ХБП**
и СС смерти
Риск ХБП**
-17% -27% -24% -47%
СС-сердечно-сосудистая СН-сердечная недостаточность
* риск госпитализации по поводу ХСН, ** - почечная специфическая конечная точка (стойкое доказанное снижение рСКФ не менее, чем на 40% до уровня менее 60 мл/мин на 1,73 м2, терминальная стадия почечной недостаточности,
смерть от почечных причин)
Wiviott S.D et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes N Engl J Med 2019; 380:347-357
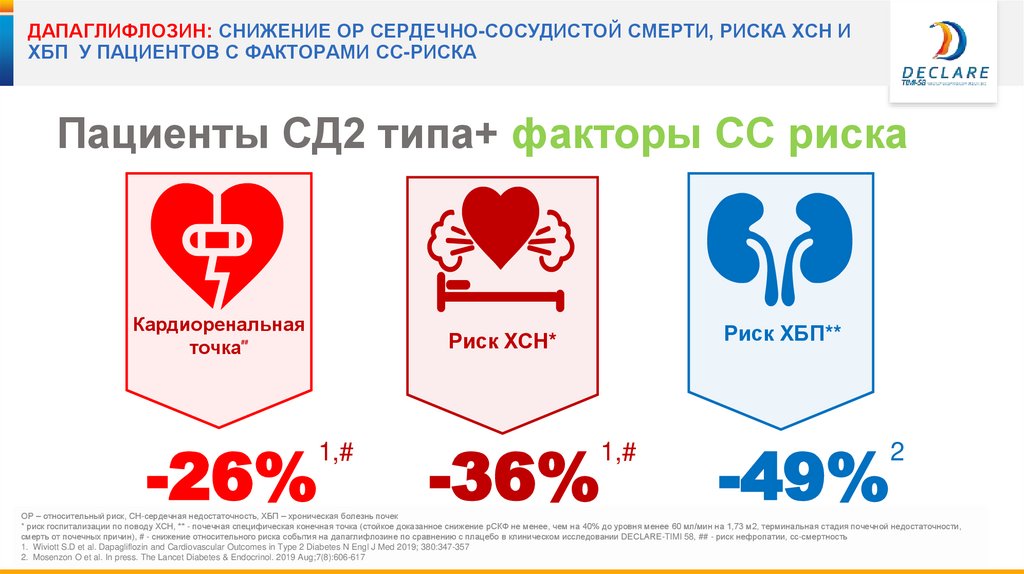
24.
ДАПАГЛИФЛОЗИН: СНИЖЕНИЕ ОР СЕРДЕЧНО-СОСУДИСТОЙ СМЕРТИ, РИСКА ХСН ИХБП У ПАЦИЕНТОВ С ФАКТОРАМИ СС-РИСКА
Пациенты СД2 типа+ факторы СС риска
Кардиоренальная
точка
-26%
Риск ХБП**
Риск ХСН*
##
1,#
-36%
1,#
-49%
2
ОР – относительный риск, СН-сердечная недостаточность, ХБП – хроническая болезнь почек
* риск госпитализации по поводу ХСН, ** - почечная специфическая конечная точка (стойкое доказанное снижение рСКФ не менее, чем на 40% до уровня менее 60 мл/мин на 1,73 м2, терминальная стадия почечной недостаточности,
смерть от почечных причин), # - снижение относительного риска события на дапаглифлозине по сравнению с плацебо в клиническом исследовании DECLARE-TIMI 58, ## - риск нефропатии, сс-смертность
1. Wiviott S.D et al. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes N Engl J Med 2019; 380:347-357
2. Mosenzon O et al. In press. The Lancet Diabetes & Endocrinol. 2019 Aug;7(8):606-617
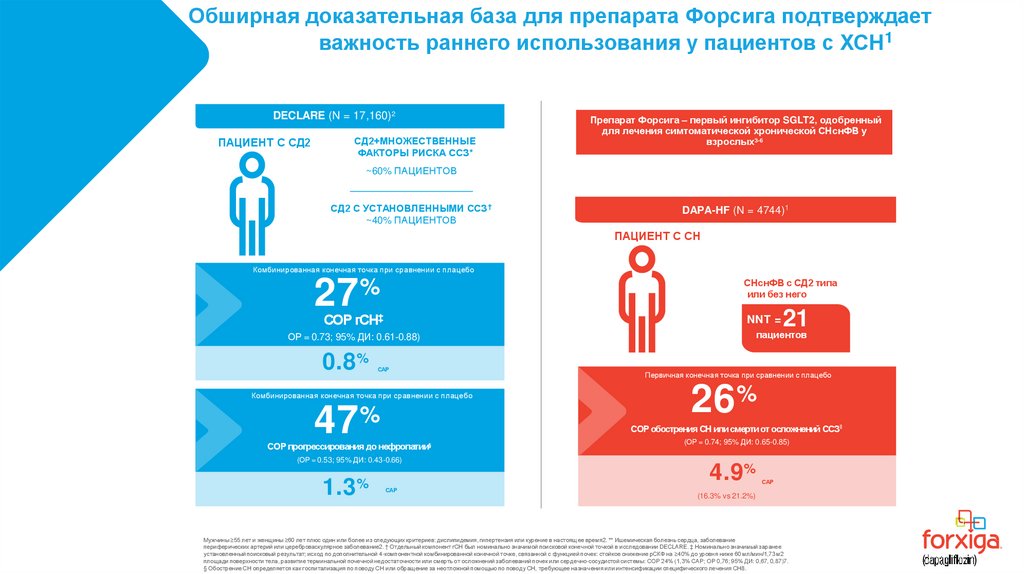
25.
Обширная доказательная база для препарата Форсига подтверждаетважность раннего использования у пациентов с ХСН1
DECLARE (N = 17,160)2
ПАЦИЕНТ С СД2
СД2+МНОЖЕСТВЕННЫЕ
ФАКТОРЫ РИСКА ССЗ*
Препарат Форсига – первый ингибитор SGLT2, одобренный
для лечения симтоматической хронической СНснФВ у
взрослых3-6
~60% ПАЦИЕНТОВ
СД2 С УСТАНОВЛЕННЫМИ ССЗ †
~40% ПАЦИЕНТОВ
DAPA-HF (N = 4744)1
ПАЦИЕНТ С СН
Комбинированная конечная точка при сравнении с плацебо
27
СНснФВ с СД2 типа
или без него
%
СОР гСН‡
NNT =
0.8%
САР
Комбинированная конечная точка при сравнении с плацебо
47%
(ОР = 0.53; 95% ДИ: 0.43-0.66)
1.3
Первичная конечная точка при сравнении с плацебо
26%
СОР обострения СН или смерти от осложнений ССЗ‖
СОР прогрессирования до нефропатии§
%
21
пациентов
ОР = 0.73; 95% ДИ: 0.61-0.88)
САР
(ОР = 0.74; 95% ДИ: 0.65-0.85)
4.9%
САР
(16.3% vs 21.2%)
Мужчины ≥55 лет и женщины ≥60 лет плюс один или более из следующих критериев: дислипидемия, гипертензия или курение в настоящее время2. ** Ишемическая болезнь сердца, заболевание
периферических артерий или цереброваскулярное заболевание2. † Отдельный компонент гСН был номинально значимой поисковой конечной точкой в исследовании DECLARE. ‡ Номинально значимый заранее
установленный поисковый результат; исход по дополнительной 4-компонентной комбинированной конечной точке, связанной с функцией почек: стойкое снижение рСКФ на ≥40% до уровня ниже 60 мл/мин/1,73 м2
площади поверхности тела, развитие терминальной почечной недостаточности или смерть от осложнений заболеваний почек или сердечно-сосудистой системы: СОР 24% (1,3% САР; ОР 0,76; 95% ДИ: 0,67, 0,87)7.
§ Обострение СН определяется как госпитализация по поводу СН или обращение за неотложной помощью по поводу СН, требующее назначения или интенсификации специфического лечения СН8.
26.
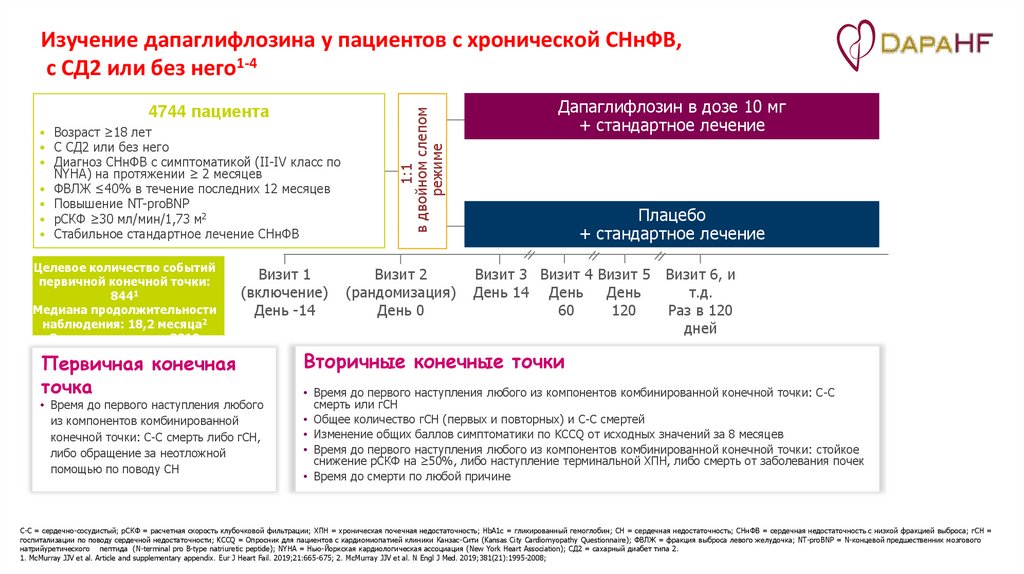
4744 пациента• Возраст ≥18 лет
• С СД2 или без него
• Диагноз СНнФВ с симптоматикой (II-IV класс по
NYHA) на протяжении ≥ 2 месяцев
• ФВЛЖ ≤40% в течение последних 12 месяцев
• Повышение NT-proBNP
• рСКФ ≥30 мл/мин/1,73 м2
• Стабильное стандартное лечение СНнФВ
Целевое количество событий
первичной конечной точки:
8441
Медиана продолжительности
наблюдения: 18,2 месяца2
Завершение: июль 2019
года3
Первичная конечная
точка
Визит 1
(включение)
День -14
• Время до первого наступления любого
из компонентов комбинированной
конечной точки: С-С смерть либо гСН,
либо обращение за неотложной
помощью по поводу СН
1:1
в двойном слепом
режиме
Изучение дапаглифлозина у пациентов с хронической СНнФВ,
с СД2 или без него1-4
Визит 2
(рандомизация)
День 0
Дапаглифлозин в дозе 10 мг
+ стандартное лечение
Плацебо
+ стандартное лечение
Визит 3 Визит 4 Визит 5
День 14 День
День
60
120
Визит 6, и
т.д.
Раз в 120
дней
Вторичные конечные точки
• Время до первого наступления любого из компонентов комбинированной конечной точки: С-С
смерть или гСН
• Общее количество гСН (первых и повторных) и С-С смертей
• Изменение общих баллов симптоматики по KCCQ от исходных значений за 8 месяцев
• Время до первого наступления любого из компонентов комбинированной конечной точки: стойкое
снижение рСКФ на ≥50%, либо наступление терминальной ХПН, либо смерть от заболевания почек
• Время до смерти по любой причине
С-С = сердечно-сосудистый; рСКФ = расчетная скорость клубочковой фильтрации; ХПН = хроническая почечная недостаточность; HbA1c = гликированный гемоглобин; СН = сердечная недостаточность; СНнФВ = сердечная недостаточность с низкой фракцией выброса; гСН =
госпитализации по поводу сердечной недостаточности; KCCQ = Опросник для пациентов с кардиомиопатией клиники Канзас-Сити (Kansas City Cardiomyopathy Questionnaire); ФВЛЖ = фракция выброса левого желудочка; NT-proBNP = N-концевой предшественник мозгового
натрийуретического пептида (N-terminal pro B-type natriuretic peptide); NYHA = Нью-Йоркская кардиологическая ассоциация (New York Heart Association); СД2 = сахарный диабет типа 2.
1. McMurray JJV et al. Article and supplementary appendix. Eur J Heart Fail. 2019;21:665-675; 2. McMurray JJV et al. N Engl J Med. 2019;381(21):1995-2008;
27.
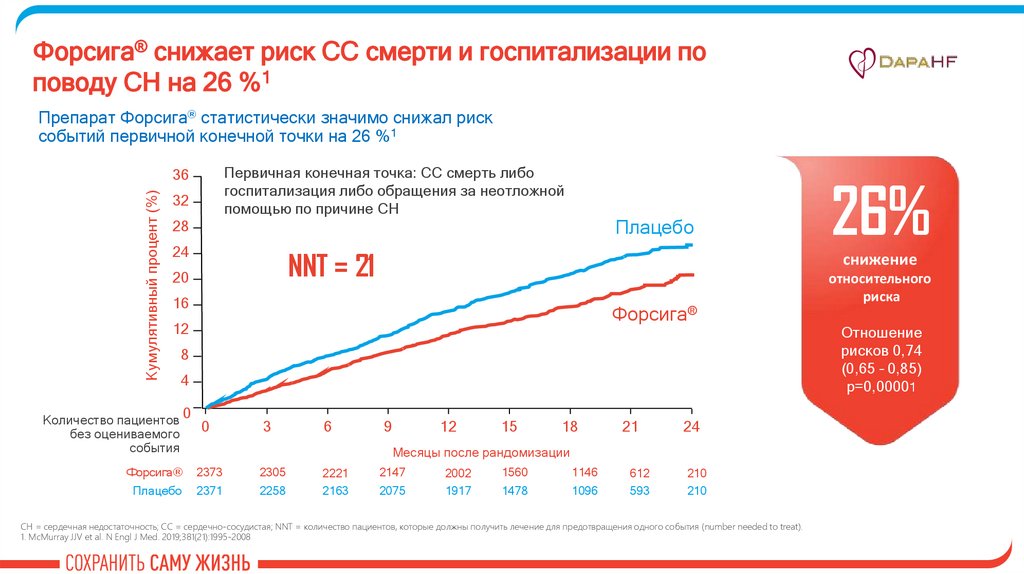
Форсига® снижает риск СС смерти и госпитализации поповоду СН на 26 %1
Препарат Форсига® статистически значимо снижал риск
событий первичной конечной точки на 26 %1
Первичная конечная точка: СС смерть либо
госпитализация либо обращения за неотложной
помощью по причине СН
Кумулятивный процент (%)
36
32
Плацебо
28
24
NNT = 21
20
снижение
16
Форсига®
12
8
4
Количество пациентов
без оцениваемого
события
0
0
3
6
9
12
15
18
21
24
612
593
210
210
Месяцы после рандомизации
Форсига®
2373
2305
Плацебо
2371
2258
2221
2163
26%
2147
2075
2002
1917
1560
1146
1478
1096
СН = сердечная недостаточность; СС = сердечно-сосудистая; NNT = количество пациентов, которые должны получить лечение для предотвращения одного события (number needed to treat).
1. McMurray JJV et al. N Engl J Med. 2019;381(21):1995-2008
относительного
риска
Отношение
рисков 0,74
(0,65 – 0,85)
p=0,00001
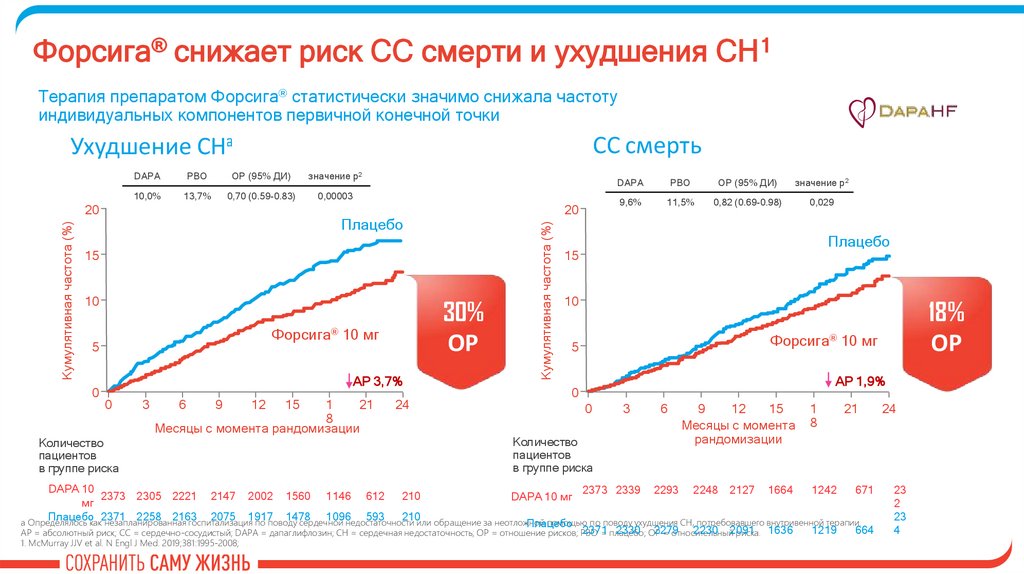
28.
Форсига® снижает риск СС смерти и ухудшения СН 1Терапия препаратом Форсига® статистически значимо снижала частоту
индивидуальных компонентов первичной конечной точки
СС смерть
Ухудшение СНa
PBO
ОР (95% ДИ)
значение p2
10,0%
13,7%
0,70 (0.59-0.83)
0,00003
Кумулятивная частота (%)
20
20
Плацебо
15
10
5
0
30%
ОР
Форсига® 10 мг
АР 3,7%
0
3
6
9
1
21
8
Месяцы с момента рандомизации
Количество
пациентов
в группе риска
12
15
24
Кумулятивная частота (%)
DAPA
DAPA
PBO
ОР (95% ДИ)
значение p2
9,6%
11,5%
0,82 (0.69-0.98)
0,029
Плацебо
15
10
Форсига® 10 мг
5
AР 1,9%
0
0
Количество
пациентов
в группе риска
3
6
9
12
15
Месяцы с момента
рандомизации
1
8
21
DAPA 10
2373 2339 2293 2248 2127 1664
1242
671
2373 2305 2221 2147 2002 1560 1146 612
210
DAPA 10 мг
мг
Плацебо 2371 2258 2163 2075 1917 1478 1096 593
210
a Определялось как незапланированная госпитализация по поводу сердечной недостаточности или обращение за неотложной
помощью по поводу ухудшения СН, потребовавшего внутривенной терапии.
Плацебо
2371
2330 ОР
2279
2230 2091
1219
664
AР = абсолютный риск; СС = сердечно-сосудистый; DAPA = дапаглифлозин; СН = сердечная недостаточность; ОР = отношение рисков; PBO
= плацебо;
= относительный
риска. 1636
1. McMurray JJV et al. N Engl J Med. 2019;381:1995-2008;
18%
ОР
24
23
2
23
4
29.
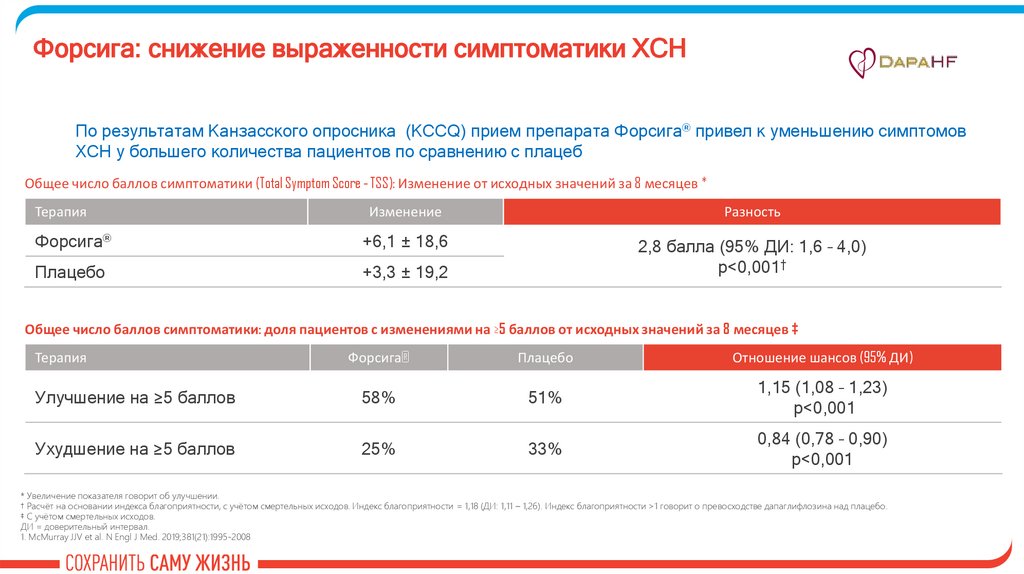
Форсига: снижение выраженности симптоматики ХСНПо результатам Канзасского опросника (KCCQ) прием препарата Форсига® привел к уменьшению симптомов
ХСН у большего количества пациентов по сравнению с плацеб
Общее число баллов симптоматики (Total Symptom Score - TSS): Изменение от исходных значений за 8 месяцев *
Терапия
Изменение
Разность
Форсига®
+6,1 ± 18,6
Плацебо
+3,3 ± 19,2
2,8 балла (95% ДИ: 1,6 – 4,0)
p<0,001†
Общее число баллов симптоматики: доля пациентов с изменениями на ≥5 баллов от исходных значений за 8 месяцев ‡
Форсига®
Плацебо
Отношение шансов (95% ДИ)
Улучшение на ≥5 баллов
58%
51%
1,15 (1,08 – 1,23)
p<0,001
Ухудшение на ≥5 баллов
25%
33%
0,84 (0,78 – 0,90)
p<0,001
Терапия
* Увеличение показателя говорит об улучшении.
† Расчёт на основании индекса благоприятности, с учётом смертельных исходов. Индекс благоприятности = 1,18 (ДИ: 1,11 – 1,26). Индекс благоприятности >1 говорит о превосходстве дапаглифлозина над плацебо.
‡ С учётом смертельных исходов.
ДИ = доверительный интервал.
1. McMurray JJV et al. N Engl J Med. 2019;381(21):1995-2008
30.
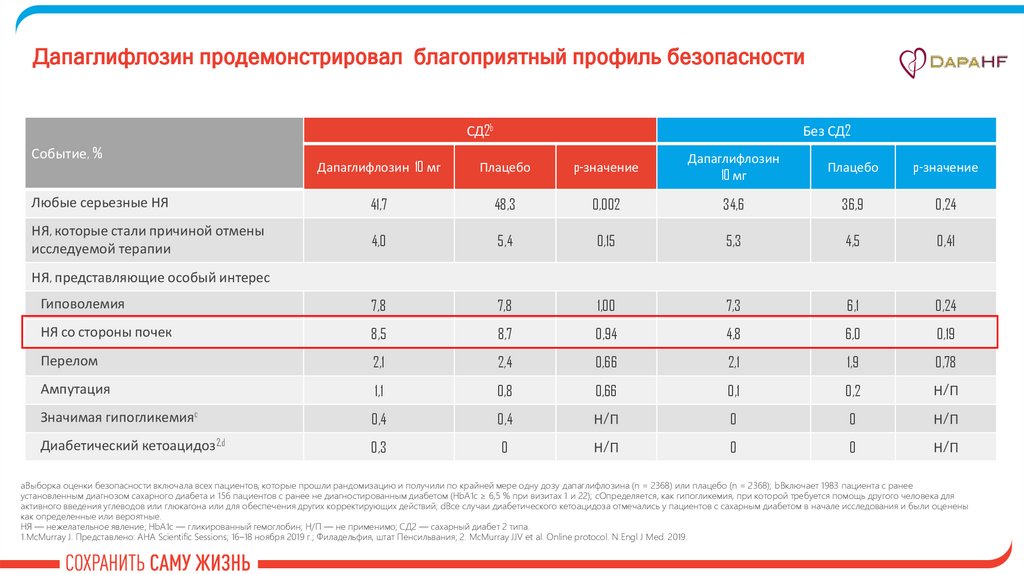
Дапаглифлозин продемонстрировал благоприятный профиль безопасностиСД2b
Событие, %
Без СД2
Дапаглифлозин 10 мг
Плацебо
p-значение
Дапаглифлозин
10 мг
Плацебо
p-значение
Любые серьезные НЯ
41,7
48,3
0,002
34,6
36,9
0,24
НЯ, которые стали причиной отмены
исследуемой терапии
4,0
5,4
0,15
5,3
4,5
0,41
Гиповолемия
7,8
7,8
1,00
7,3
6,1
0,24
НЯ со стороны почек
8,5
8,7
0,94
4,8
6,0
0,19
Перелом
2,1
2,4
0,66
2,1
1,9
0,78
Ампутация
1,1
0,8
0,66
0,1
0,2
Н/П
Значимая гипогликемияc
0,4
0,4
Н/П
0
0
Н/П
Диабетический кетоацидоз2,d
0,3
0
Н/П
0
0
Н/П
НЯ, представляющие особый интерес
aВыборка оценки безопасности включала всех пациентов, которые прошли рандомизацию и получили по крайней мере одну дозу дапаглифлозина (n = 2368) или плацебо (n = 2368); bВключает 1983 пациента с ранее
установленным диагнозом сахарного диабета и 156 пациентов с ранее не диагностированным диабетом (HbA1c ≥ 6,5 % при визитах 1 и 22); cОпределяется, как гипогликемия, при которой требуется помощь другого человека для
активного введения углеводов или глюкагона или для обеспечения других корректирующих действий; dВсе случаи диабетического кетоацидоза отмечались у пациентов с сахарным диабетом в начале исследования и были оценены
как определенные или вероятные.
НЯ — нежелательное явление; HbA1c — гликированный гемоглобин; Н/П — не применимо; СД2 — сахарный диабет 2 типа.
1.McMurray J. Представлено: AHA Scientific Sessions; 16–18 ноября 2019 г.; Филадельфия, штат Пенсильвания; 2. McMurray JJV et al. Online protocol. N Engl J Med. 2019.
31.
25.03.2022Новое показание!
Сахарный диабет 2-го типа
Препарат Форсига показан взрослым пациентам от 18 лет и старше для лечения недостаточно
контролируемого сахарного диабета 2-го типа в сочетании с диетой и физическими нагрузками в качестве:
- монотерапии, когда применение метформина считается нецелесообразным или противопоказанным
- комбинированной терапии в сочетании с другими лекарственными препаратами для лечения диабета 2-го
типа
Сердечная недостаточность
Препарат Форсига показан взрослым пациентам от 18 лет и старше для лечения симптоматической
хронической сердечной недостаточности со сниженной фракцией выброса.
Хроническая болезнь почек
Препарат Форсига показан взрослым пациентам от 18 лет и старше для лечения хронической болезни почек.
Регистрационные удостоверения: Форсига™ 10 мг - РК-ЛС-5№023472, Форсига™ 5мг - РК-ЛС-5№023471, дата первой регистрации 15.01. 2018 г., действительно до 15.01.2023 г.
Дата пересмотра текста инструкции Форсига™ - 25. 03. 2022 г., №N049906 (5мг), №N049907 (10 мг)
Т О Л Ь К О Д Л Я В Н У Т Р Е Н Н Е ГО И С П О Л Ь З О В А Н И Я
32.
Рекомендации по дозированию в зависимости от функции почекРекомендуемая доза в зависимости от рСКФ (мл/мин/1,73 м2)
Терапия/популяция пациентов
Сахарный диабет 2-го типа
показан взрослым пациентам от 18 лет и старше для лечения
недостаточно контролируемого сахарного диабета 2-го типа в
сочетании с диетой и физическими нагрузками в качестве:
- монотерапии, когда применение метформина считается
нецелесообразным или противопоказанным
- комбинированной терапии в сочетании с другими
лекарственными препаратами для лечения диабета 2-го
типа;
Сердечная недостаточность
показан взрослым пациентам от 18 лет и старше для лечения
симптоматической хронической сердечной недостаточности со
сниженной фракцией выброса.
Хроническая болезнь почек
показан взрослым пациентам от 18 лет и старше для лечения
хронической болезни почек.
>25
менее 25
Терминальная стадия
почечной
недостаточность,
требующая диализ
Коррекции дозы
не требуется
Опыт применения
дапаглифлозина у
пациентов с СКФ
<25 мл/мин
ограничен, поэтому
не рекомендуется
начинать терапию
дапаглифлозином у
таких пациентов.
Противопоказано
Регистрационные удостоверения: Форсига™ 10 мг - РК-ЛС-5№023472, Форсига™ 5мг - РК-ЛС-5№023471, дата первой регистрации 15.01. 2018 г., действительно до 15.01.2023 г.
Дата пересмотра текста инструкции Форсига™ - 25. 03. 2022 г., №N049906 (5мг), №N049907 (10 мг)
33.
КСИГДУО XRЕДИНСТВЕННАЯ ФИКСИРОВАННАЯ
КОМБИНАЦИЯ иНГЛТ2
И МЕТФОРМИНА ПРОЛОНГИРОВАННОГО
ВЫСВОБОЖДЕНИЯ РАЗРЕШЕННАЯ
*
ДЛЯ СТАРТА
И ПРОДОЛЖЕНИЯ ТЕРАПИИ СД2 ТИПА1–2
СД 2 типа у взрослых пациентов в дополнение к диете и физическим упражнениям для улучшения гликемического контроля 1
иНГЛТ-2 – ингибитор натрий-глюкозното транспортера 2 типа, СД – сахарный диабет
1. Ксигдуо XR 5 мг/1000 мг № РК-ЛС-5№023816, 07.09.2018, дата истечения 7.09.2023 ОХЛП Ксигдуо XR дата последнего пересмотра 17.07.2020г., N030529 Ксигдуо XR 10 мг/1000 мг № РК-ЛС-5№023814, 07.09.2018, дата
истечения 7.09.2023 ОХЛП Ксигдуо XR дата последнего пересмотра 17.07.2020г., N030531
.2.Plosker G. L. Drugs. 2012; 72: 2289–2312. 3. Klip et al. Diabetes Care. 1990; 13: 696–704. M. Fineman et al. Abstract 243, Oral presentation EASD 2017, Lisbon.
34.
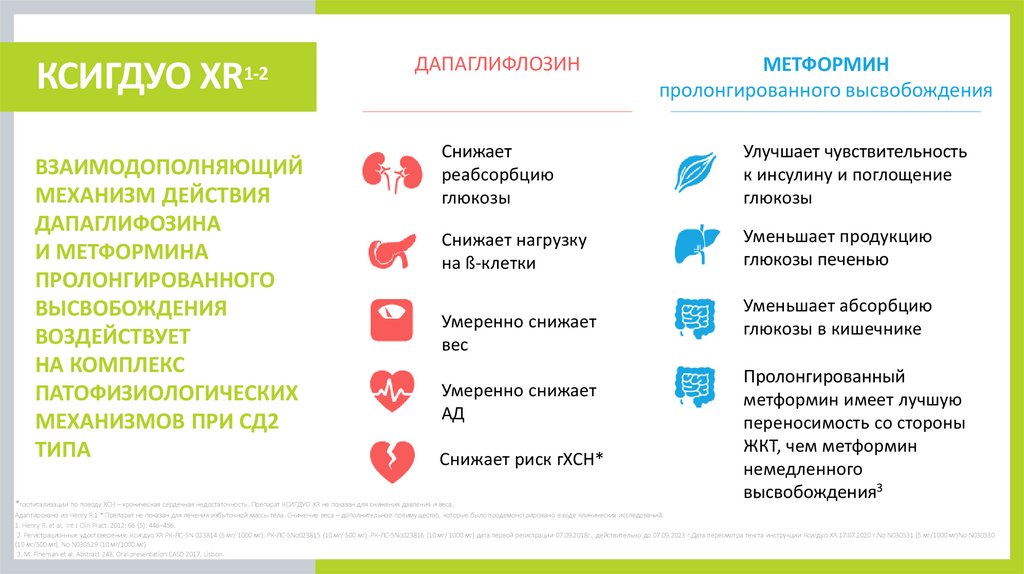
КСИГДУО XR1-2
ВЗАИМОДОПОЛНЯЮЩИЙ
МЕХАНИЗМ ДЕЙСТВИЯ
ДАПАГЛИФОЗИНА
И МЕТФОРМИНА
ПРОЛОНГИРОВАННОГО
ВЫСВОБОЖДЕНИЯ
ВОЗДЕЙСТВУЕТ
НА КОМПЛЕКС
ПАТОФИЗИОЛОГИЧЕСКИХ
МЕХАНИЗМОВ ПРИ СД2
ТИПА
ДАПАГЛИФЛОЗИН
МЕТФОРМИН
пролонгированного высвобождения
Снижает
реабсорбцию
глюкозы
Улучшает чувствительность
к инсулину и поглощение
глюкозы
Снижает нагрузку
на ß-клетки
Уменьшает продукцию
глюкозы печенью
Умеренно снижает
вес
Умеренно снижает
АД
Снижает риск гХСН*
*госпитализации по поводу ХСН – хроническая сердечная недостаточность. Препарат КСИГДУО XR не показан для снижения давления и веса.
Уменьшает абсорбцию
глюкозы в кишечнике
Пролонгированный
метформин имеет лучшую
переносимость со стороны
ЖКТ, чем метформин
немедленного
высвобождения3
Адаптировано из Henry R.1 * Препарат не показан для лечения избыточной массы тела. Снижение веса – дополнительное преимущество, которые было продемонстрировано в ходе клинических исследований.
1. Henry R. et al. Int J Clin Pract. 2012; 66 (5): 446–456.
2. Регистрационные удостоверения: Ксигдуо XR РК-ЛС-5N 023814 (5 мг/ 1000 мг), РК-ЛС-5No023815 (10 мг/ 500 мг), РК-ЛС-5No023816 (10 мг/ 1000 мг) дата первой регистрации 07.09.2018г., действительно до 07.09.2023 г.Дата пересмотра текста инструкции Ксигдуо XR 17.07.2020 г.No N030531 (5 мг/1000 мг)No N030530
(10 мг/500 мг), No N030529 (10 мг/1000 мг)
3. M. Fineman et al. Abstract 243, Oral presentation EASD 2017, Lisbon
35.
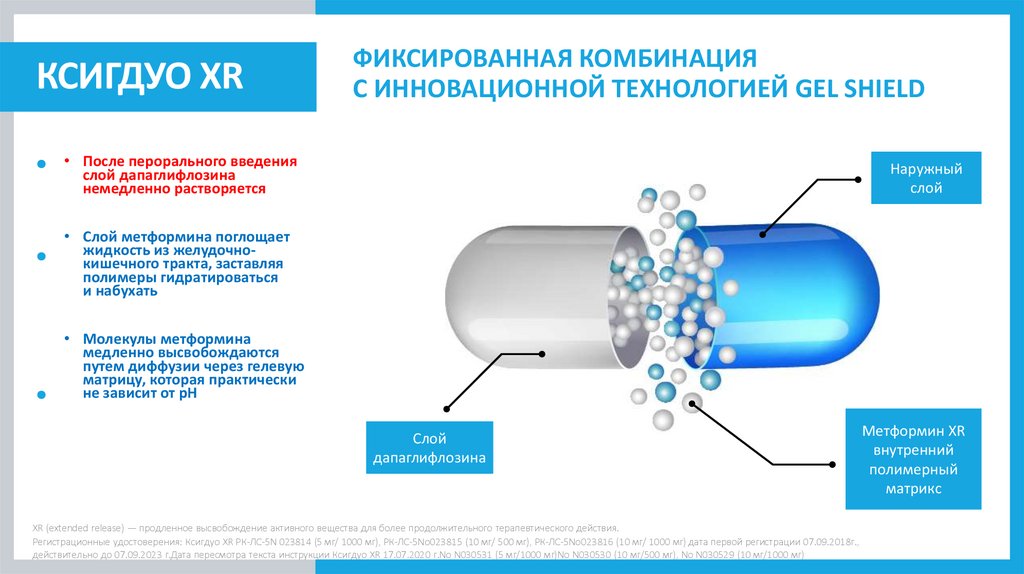
КСИГДУО XRФИКСИРОВАННАЯ КОМБИНАЦИЯ
С ИННОВАЦИОННОЙ ТЕХНОЛОГИЕЙ GEL SHIELD
• После перорального введения
слой дапаглифлозина
немедленно растворяется
Наружный
слой
• Слой метформина поглощает
жидкость из желудочнокишечного тракта, заставляя
полимеры гидратироваться
и набухать
• Молекулы метформина
медленно высвобождаются
путем диффузии через гелевую
матрицу, которая практически
не зависит от рН
Слой
дапаглифлозина
XR (extended release) — продленное высвобождение активного вещества для более продолжительного терапевтического действия.
Регистрационные удостоверения: Ксигдуо XR РК-ЛС-5N 023814 (5 мг/ 1000 мг), РК-ЛС-5No023815 (10 мг/ 500 мг), РК-ЛС-5No023816 (10 мг/ 1000 мг) дата первой регистрации 07.09.2018г.,
действительно до 07.09.2023 г.Дата пересмотра текста инструкции Ксигдуо XR 17.07.2020 г.No N030531 (5 мг/1000 мг)No N030530 (10 мг/500 мг), No N030529 (10 мг/1000 мг)
Метформин XR
внутренний
полимерный
матрикс
36.
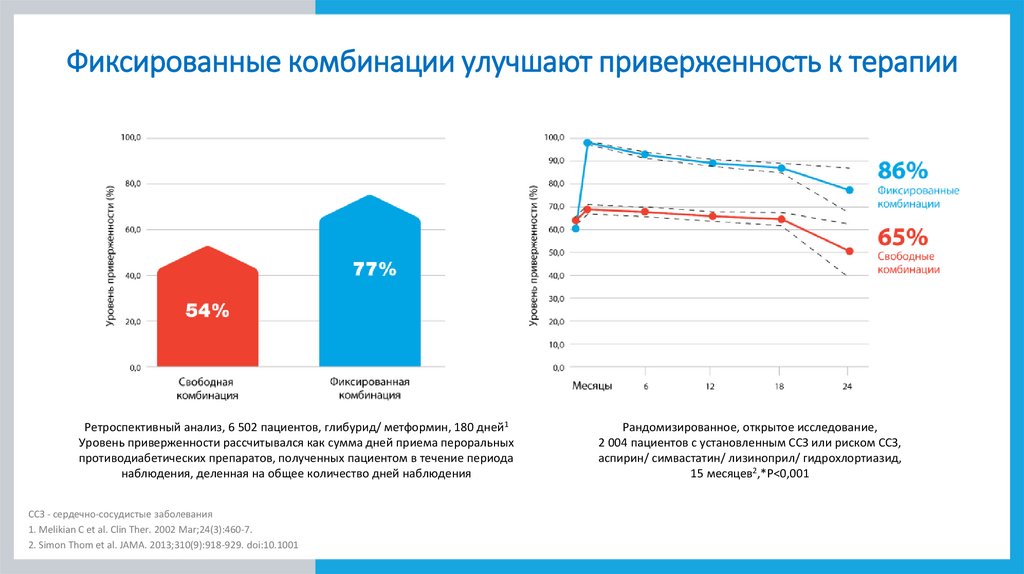
Фиксированные комбинации улучшают приверженность к терапииРетроспективный анализ, 6 502 пациентов, глибурид/ метформин, 180 дней1
Уровень приверженности рассчитывался как сумма дней приема пероральных
противодиабетических препаратов, полученных пациентом в течение периода
наблюдения, деленная на общее количество дней наблюдения
ССЗ - сердечно-сосудистые заболевания
1. Melikian C et al. Clin Ther. 2002 Mar;24(3):460-7.
2. Simon Thom et al. JAMA. 2013;310(9):918-929. doi:10.1001
Рандомизированное, открытое исследование,
2 004 пациентов с установленным ССЗ или риском ССЗ,
аспирин/ симвастатин/ лизиноприл/ гидрохлортиазид,
15 месяцев2,*P<0,001
37.
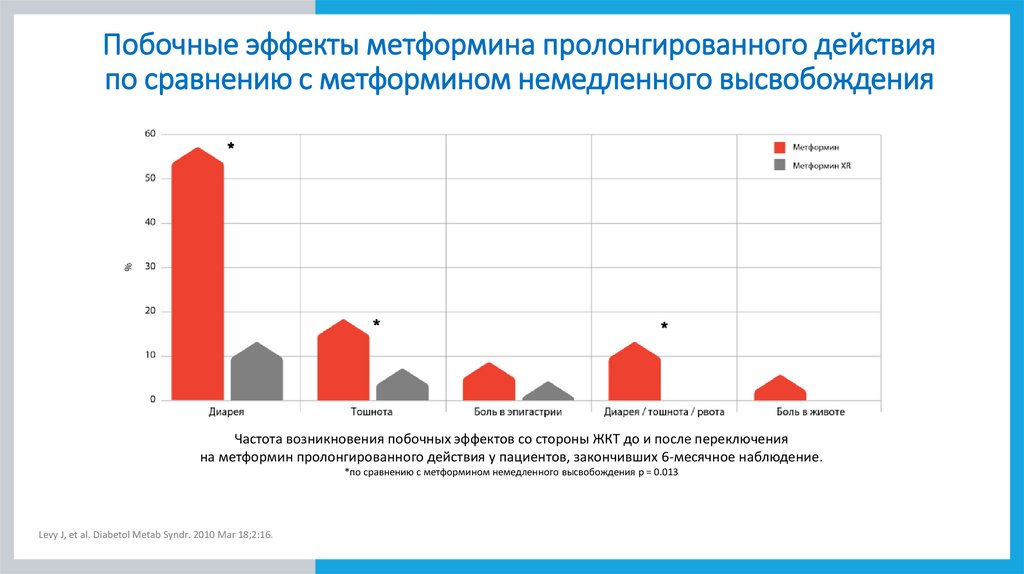
Побочные эффекты метформина пролонгированного действияпо сравнению с метформином немедленного высвобождения
Частота возникновения побочных эффектов со стороны ЖКТ до и после переключения
на метформин пролонгированного действия у пациентов, закончивших 6-месячное наблюдение.
*по сравнению с метформином немедленного высвобождения p = 0.013
Levy J, et al. Diabetol Metab Syndr. 2010 Mar 18;2:16.
38.
КСИГДУО XRДАПАГЛИФЛОЗИН +
МЕТФОРМИН
ПРОЛОНГИРОВАННОГО
ДЕЙСТВИЯ
СОЕДИНЕНИЕ
КЛАССИКИ
И ИННОВАЦИИ!
Удобство и гибкость дозирования
ОДНОКРАТНЫЙ
ПРИЁМ С ЕДОЙ
10 МГ ДАПА/
1000 МГ МЕТ XR
5 МГ ДАПА/
1000 МГ МЕТ XR
+
МАКСИМАЛЬНАЯ
СУТОЧНАЯ ДОЗА
2 ТАБЛЕТКИ Х
5 МГ/1000 МГ
Регистрационные удостоверения: Ксигдуо XR РК-ЛС-5N 023814 (5 мг/ 1000 мг), РК-ЛС-5No023815 (10 мг/ 500 мг), РК-ЛС-5No023816 (10 мг/ 1000 мг) дата первой регистрации 07.09.2018г., действительно до
07.09.2023 г.Дата пересмотра текста инструкции Ксигдуо XR 17.07.2020 г.No N030531 (5 мг/1000 мг)No N030530 (10 мг/500 мг), No N030529 (10 мг/1000 мг)
39.
Краткая общая характеристика лекарственного препарата Форсига™Торговое наименование Форсига™
Международное непатентованное название Дапаглифлозин
Показания к применению.
Cахарный диабет 2-го типа Препарат Форсига™ показан у взрослых пациентов с недостаточным контролем сахарного диабета 2-го типа в сочетании с диетой и физическими нагрузками в качестве: монотерапии,
когда применение метформина считается нецелесообразным или противопоказанным; комбинированной терапии в сочетании с другими лекарственными препаратами для лечения диабета 2-го типа;
Сердечная недостаточность Препарат Форсига™ показан взрослым пациентам от 18 лет и старше для лечения симптоматической хронической сердечной недостаточности со сниженной фракцией выброса.
Хроническая болезнь почек Препарат Форсига показан взрослым пациентам от 18 лет и старше для лечения хронической болезни почек.
Способ применения и дозы
Режим дозирования Препарат Форсига™ применяется внутрь один раз в день независимо от приема пищи. Таблетки следует проглатывать целиком.
Способ применения.
Сахарный диабет 2-го типа Рекомендуемая доза дапаглифлозина составляет 10 мг один раз в сутки. С целью снижения риска гипогликемии при применении дапаглифлозина в комбинации с препаратами
инсулина или препаратами, повышающими секрецию инсулина, например, производными сульфонилмочевины, может потребоваться снижение дозы препаратов инсулина или препаратов, повышающих секрецию
инсулина.
Сердечная недостаточность Рекомендуемая доза дапаглифлозина составляет 10 мг один раз в сутки. В исследовании применения дапаглифлозина для предупреждения неблагоприятных исходов при сердечной
недостаточности (исследование DAPA-HF), дапаглифлозин применяется в сочетании с другими препаратами для лечения сердечной недостаточности.
Хроническая болезнь почек Рекомендуемая доза дапаглифлозина составляет 10 мг один раз в сутки. В исследовании влияния дапаглифлозина на почечные исходы у пациентов с хронической болезнью почек
(DAPA-CKD) дапаглифлозин применяется в сочетании с другими препаратами для лечения хронической болезни почек.
Основные побочные действия Очень часто (≥ 1/10): гипогликемия (при применении в комбинации с производным сульфонилмочевины или инсулином); Часто (≥ 1/100 ≤1/10): вульвовагинит, баланит и
сопутствующие инфекции половых органов, инфекции мочевыводящих путей; головокружение; сыпь; боль в спине; дизурия, полиурия; дислипидемия; сниженный почечный клиренс креатинина в начале терапии;
повышение значения гематокрита.
Противопоказания Повышенная индивидуальная чувствительность к любому компоненту препарата; сахарный диабет 1-го типа; диабетический кетоацидоз; почечная недостаточность, при которой расчетная СКФ
(рСКФ) ниже 25 мл/мин/1.73 м2 (для начала терапии); терминальная стадия заболевания почек, требующая диализа (из-за ограниченного опыта проведения клинических исследований); наследственная
непереносимость лактозы, недостаточность лактазы и глюкозо-галактозная непереносимость;беременность и период грудного вскармливания; детский и подростковый возраст до 18 лет (безопасность и
эффективность не изучены).
Особые указания
Беременность и период лактации. Отсутствуют данные об использовании дапаглифлозина у беременных женщин. При обнаружении беременности, лечение дапаглифлозином должно быть прекращено. Из-за
возможного возникновения серьезных побочных реакций у детей, применение препарата Форсига™ не рекомендуется во время кормления грудью.
Дети. Безопасность и эффективность дапаглифлозина у пациентов младше 18 лет не изучалась.
Условия отпуска по рецепту .
Название и адрес производителя АстраЗенека АБ, 18 СЕ-151 85, Содерталье, Швеция, тел.: +46 8 553 260 00 Факс: +46 8 553 290
Наименование, адрес и контактные данные организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств потребителей и ответственной за
пострегистрационное наблюдение за безопасностью лекарственного средства: Представительство ЗАК “АстраЗенека Ю-Кей Лимитед”, Республика Казахстан, г. Алматы, 050022, ул. Шевченко, 144, тел. +7 727
232 14 15;+7 701 0326745
e-mail: adverse.events.kz@astrazeneca.com
Регистрационные удостоверения: Форсига™ 10 мг - РК-ЛС-5№023472, Форсига™ 5мг - РК-ЛС-5№023471, дата первой регистрации 15.01. 2018 г., действительно до 15.01.2023 г.
Дата пересмотра текста инструкции Форсига™ - 25. 03. 2022 г., №N049906 (5мг), №N049907 (10 мг)
Перед назначением и применением необходимо внимательно прочитать инструкцию по медицинскому применению.
40.
Краткая инструкция по медицинскому применению лекарственногосредства Ксигдуо XR™
Торговое наименование Ксигдуо XR™
Международное непатентованное название Дапаглифлозин и метформин
Наименование лекарственного препарата Ксигдуо XR, таблетки, покрытые пленочной оболочкой, с пролонгированным высвобождением,5 мг/1000 мг. Ксигдуо XR, таблетки, покрытые пленочной оболочкой, с пролонгированным
высвобождением,10 мг/500 мг. Ксигдуо XR, таблетки, покрытые пленочной оболочкой, с пролонгированным высвобождением,10 мг/1000 мг.
Показания к применению.
Препарат Ксигдуо XR показан взрослым с сахарным диабетом 2-го типа в качестве дополнения к диете и физическим упражнениям для улучшения гликемического контроля. Дапаглифлозин показан взрослым с сахарным
диабетом 2-го типа и установленным сердечно-сосудистым заболеванием или с наличием множественных факторов риска сердечно-сосудистых заболеваний для снижения риска госпитализации, связанной с сердечной
недостаточностью.
Способ применения и дозы
Режим дозирования Дозировку следует подбирать на основании текущей схемы лечения пациента, эффективности и переносимости, не превышая максимальную рекомендуемую суточную дозу 10 мг дапаглифлозина и 2000
мг метформина пролонгированного высвобождения, равную двум таблеткам дозировки 5 мг/1000 мг один раз в день.
Способ применения. Ксигдуо XR принимают внутрь один раз в день, вечером во время приема пищи. Таблетку следует проглотить целиком, не разламывать и не разжевывать.
Основные побочные действия Очень часто (≥ 1/10): гипогликемия (при применении в комбинации с производным сульфонилмочевины или инсулином); расстройства пищеварительного тракта (тошнота, рвота, диарея, боль в животе,
потеря аппетита (могут возникнуть во время начала терапии). Часто (≥ 1/100 до ≤1/10): инфекции половых органов (баланит, в т.ч. кандидозный; вагинальная инфекция, генитальная инфекция, в т.ч. кандидозная,
вульвовагинальный кандидоз, вульвовагинит, вульвит, баланопостит, генитальная инфекция у мужчин, инфекция мочеполового тракта, абсцесс полового органа, абсцесс вульвы и вагинит бактериальный); инфекции
мочевыводящих путей (цистит, инфекция мочеполового тракта, в т.ч. вызванная кишечной палочкой, пиелонефрит, тригонит, уретрит, инфекция почек и простатит); нарушение вкуса (металлический вкус); усиленное
мочеиспускание (полиурия, поллакиурия); боль в спине.
Противопоказания повышенная чувствительность к активному веществу или к любому из вспомогательных веществ; острый или хронический метаболический ацидоз, включая лактоацидоз, диабетический кетоацидоз, с комой
или без нее; диабетическая прекома; тяжелая почечная недостаточность (СКФ ниже 30 мл/мин/1,73 м2), терминальная стадия почечной недостаточности, пациенты на диализе; острые состояния, приводящие к нарушению функции
почек (обезвоживание, тяжелая инфекция, шок);острые или хронические заболевания, вызывающие тканевую гипоксию (сердечная недостаточность, легочная недостаточность, недавно перенесенный инфаркт миокарда, шок);
печеночная недостаточность; острая алкогольная интоксикация, алкоголизм;редкое наследственное заболевание непереносимости галактозы, дефицит лактазы Лаппа или мальабсорбция глюкозы-галактозы; беременность и период
лактации; детский возраст до 18 лет.
Особые указания
Беременность и период лактации. Контролируемые исследования применения препарата Ксигдуо XR у беременных женщин не проводились. При подтверждении беременности прием препарата следует прекратить. Из-за возможного
возникновения серьезных побочных реакций у детей, применение Ксигдуо XR не рекомендуется во время кормления грудью.
Дети. Эффективность и безопасность препарата Ксигдуо XR в педиатрической популяции до 18 лет не изучалась.
Условия отпуска по рецепту .
Название и адрес производителя АстраЗенека АБ, 18 СЕ-151 85, Содерталье, Швеция, тел.: +46 8 553 260 00 Факс: +46 8 553 290
Наименование, адрес и контактные данные организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств потребителей и ответственной за пострегистрационное
наблюдение за безопасностью лекарственного средства: Представительство ЗАК “АстраЗенека Ю-Кей Лимитед”, Республика Казахстан, г. Алматы, 050022, ул. Шевченко, 144, тел. +7 727 232 14 15; +7 701 0326745
e-mail: adverse.events.kz@astrazeneca.com
Регистрационные удостоверения: Ксигдуо XR РК-ЛС-5N 023814 (5 мг/ 1000 мг), РК-ЛС-5No023815 (10 мг/ 500 мг), РК-ЛС-5No023816 (10 мг/ 1000 мг) дата первой регистрации 07.09.2018г., действительно до 07.09.2023 г.
Дата пересмотра текста инструкции Ксигдуо XR 17.07.2020 г.No N030531 (5 мг/1000 мг)No N030530 (10 мг/500 мг), No N030529 (10 мг/1000 мг)
Перед назначением и применением необходимо внимательно прочитать инструкцию по медицинскому применению.

















 medicine
medicine








