Similar presentations:
Ковалентная связь
1. Ковалентная связь
2. К чему стремится любой «одинокий» атом?
• В одиночном состоянии онэнергетически нестабилен
• Атому нужно завершить свой
внешний энергетический
уровень
3.
Химическая связь – этосилы взаимодействия,
которые соединяют
отдельные атомы в
молекулы, ионы,
кристаллы.
4.
Величина валентности элементаопределяется числом химических связей, которые
атом элемента образует с
другими атомами.
5.
У элементов главных подгрупп это электронывнешнего энергетического уровня. Они
расположены дальше от ядра и менее прочно
связаны с ним. В зависимости от способа
образования завершённых электронных структур
атомов различают несколько видов химической
связи.
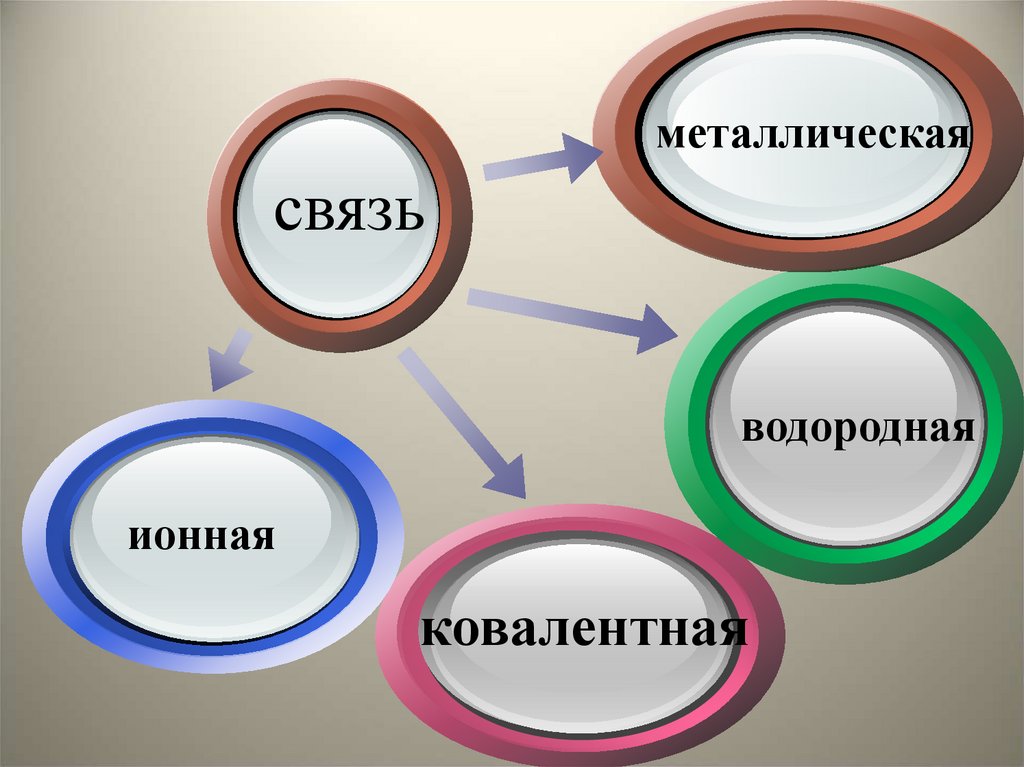
6.
металлическаясвязь
Click to
add Titl
водородная
ионная
ковалентная
7.
В образовании ковалентнойсвязи принимают участие
неспаренные валентные
электроны атома, которые
располагаются на внешнем
уровне по одному.
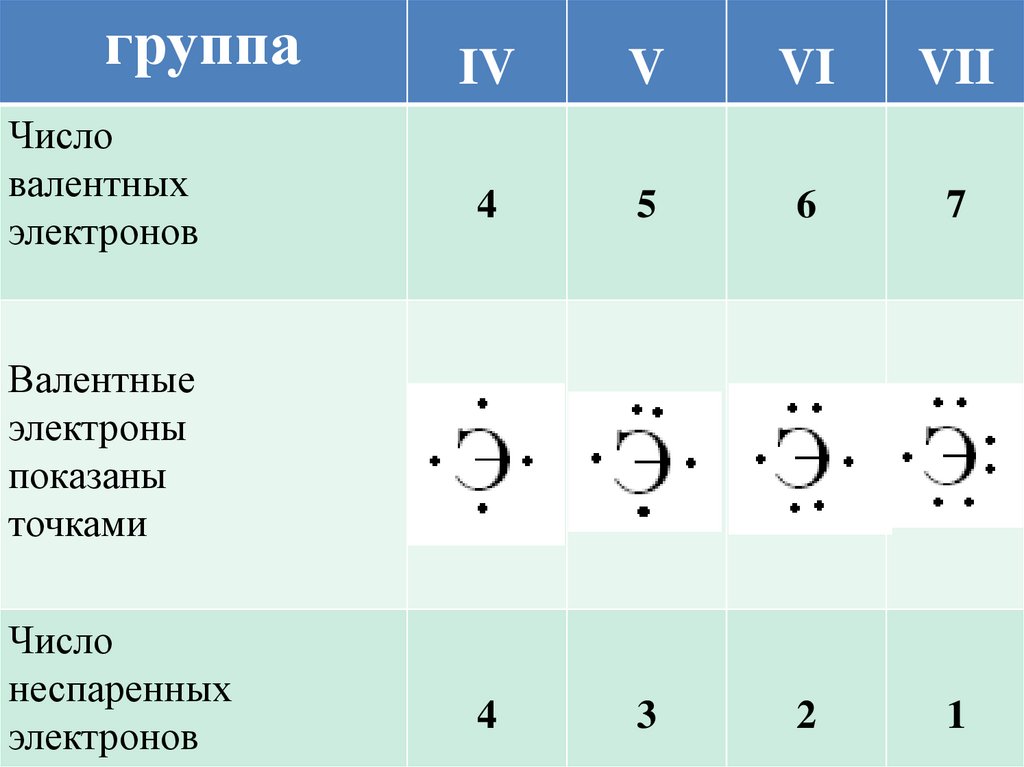
8.
группаЧисло
валентных
электронов
IV
V
VI
VII
4
5
6
7
4
3
2
1
Валентные
электроны
показаны
точками
Число
неспаренных
электронов
9.
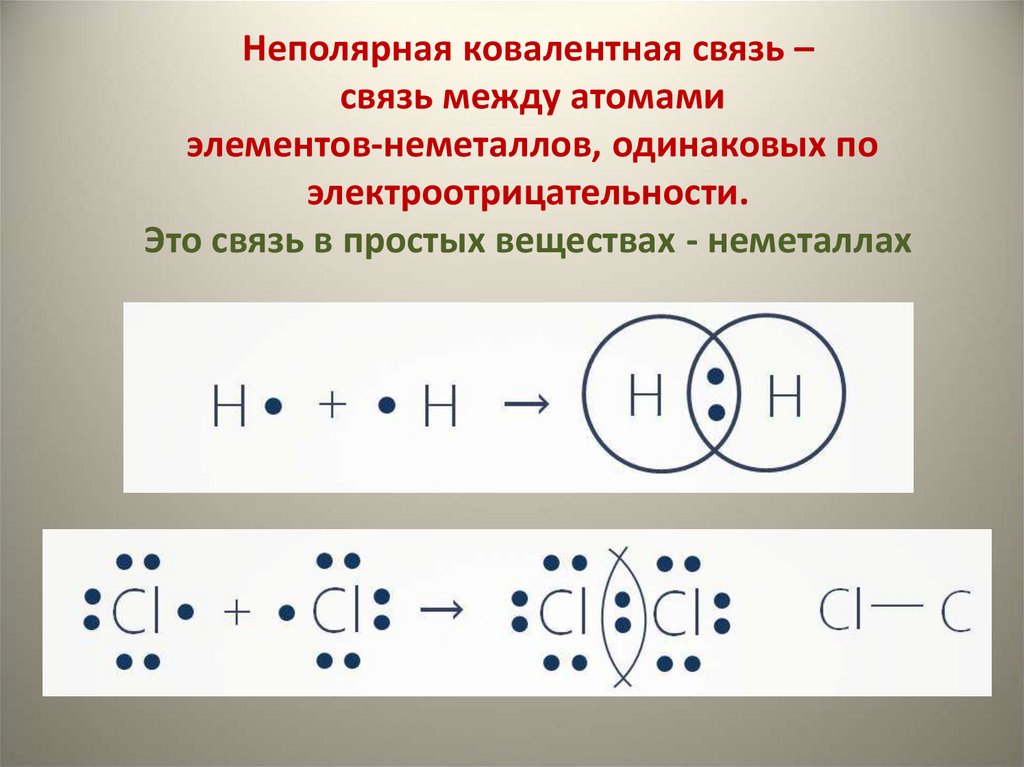
10. Неполярная ковалентная связь – связь между атомами элементов-неметаллов, одинаковых по электроотрицательности. Это связь в
простых веществах - неметаллах11.
ковалентной неполярнойНеспаренные Общая или поделённая
электроны
пара электронов
Между ядрами образуется сгущение
отрицательного заряда, который
притягивает к себе ядра атомов.
12.
Для завершения внешнего слоя каждому атому нехватает по 1е-.За счёт образования ковалентной
связи каждый атом в молекуле приобретает
завершённый внешний слой.
13.
+7N2е- 5е-
14.
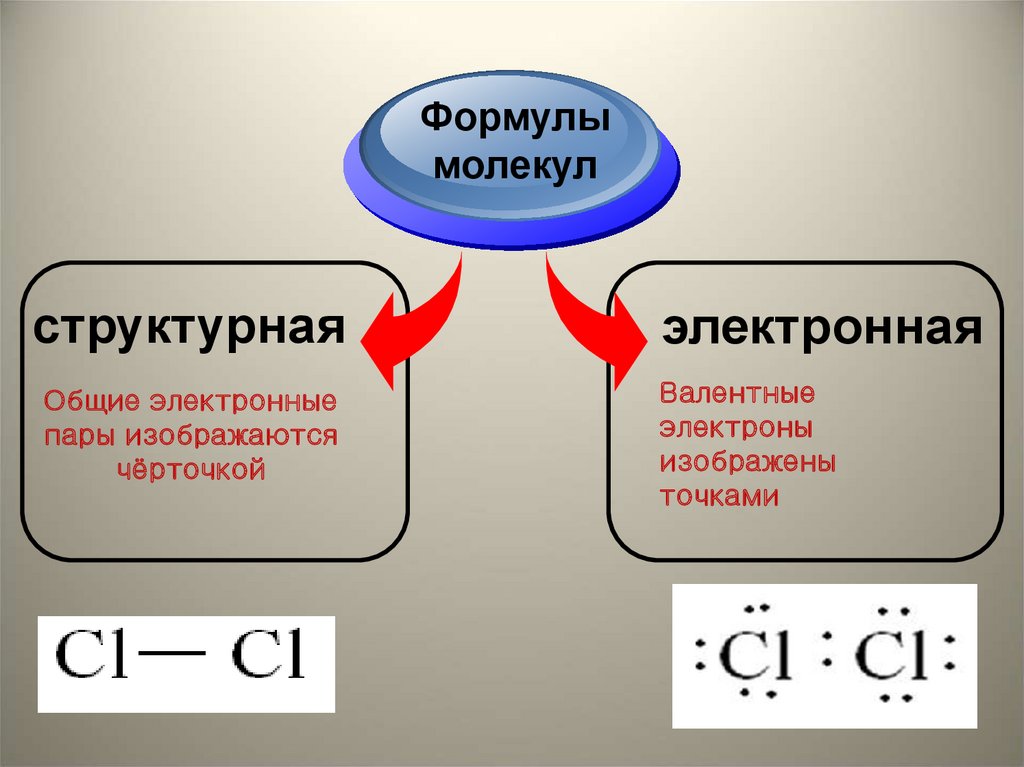
Формулымолекул
структурная
Общие электронные
пары изображаются
чёрточкой
электронная
Валентные
электроны
изображены
точками
15.
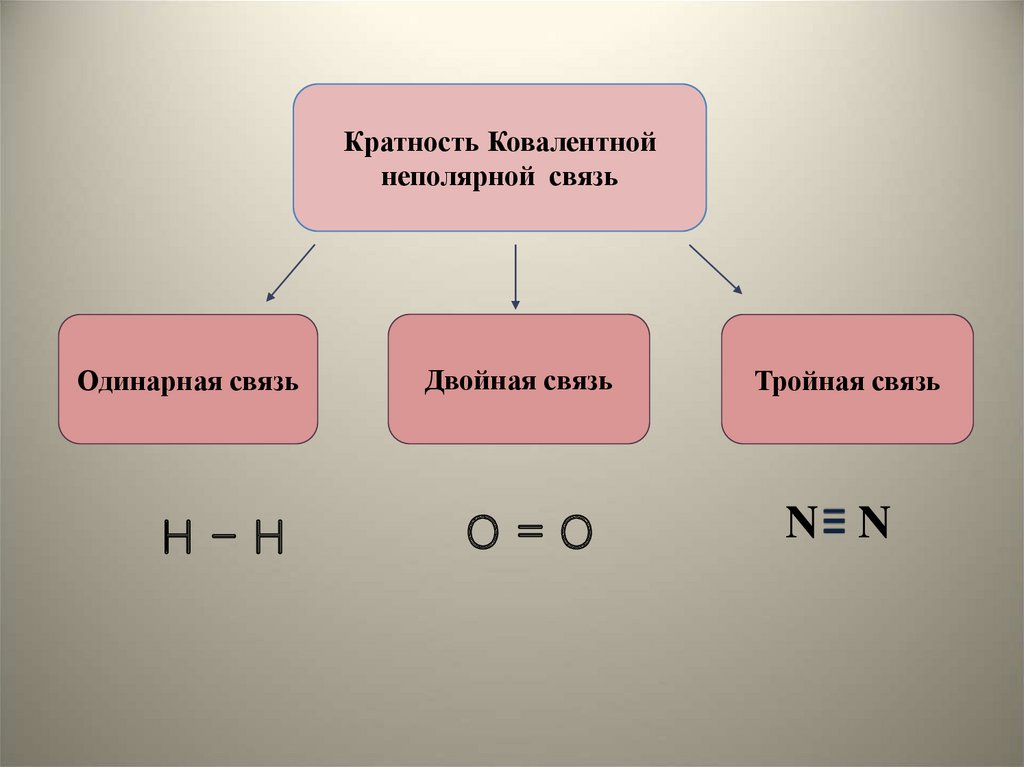
Кратность Ковалентнойнеполярной связь
Одинарная связь
Н-Н
Двойная связь
О=О
Тройная связь
N N
16. Длина связи – это расстояние между ядами атомов в молекуле. Чем больше кратность связи, тем меньше её длина, тем прочнее эта
связь17.
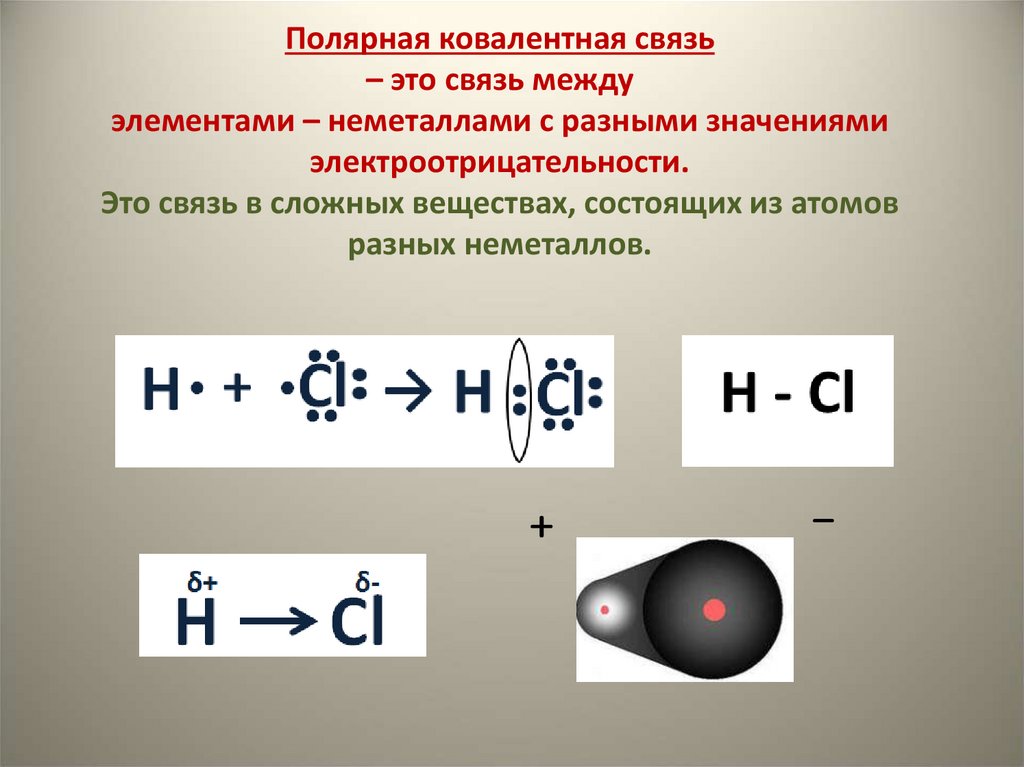
18. Полярная ковалентная связь – это связь между элементами – неметаллами с разными значениями электроотрицательности. Это связь в
сложных веществах, состоящих из атомовразных неметаллов.
+
-
19.
20.
21.
22.
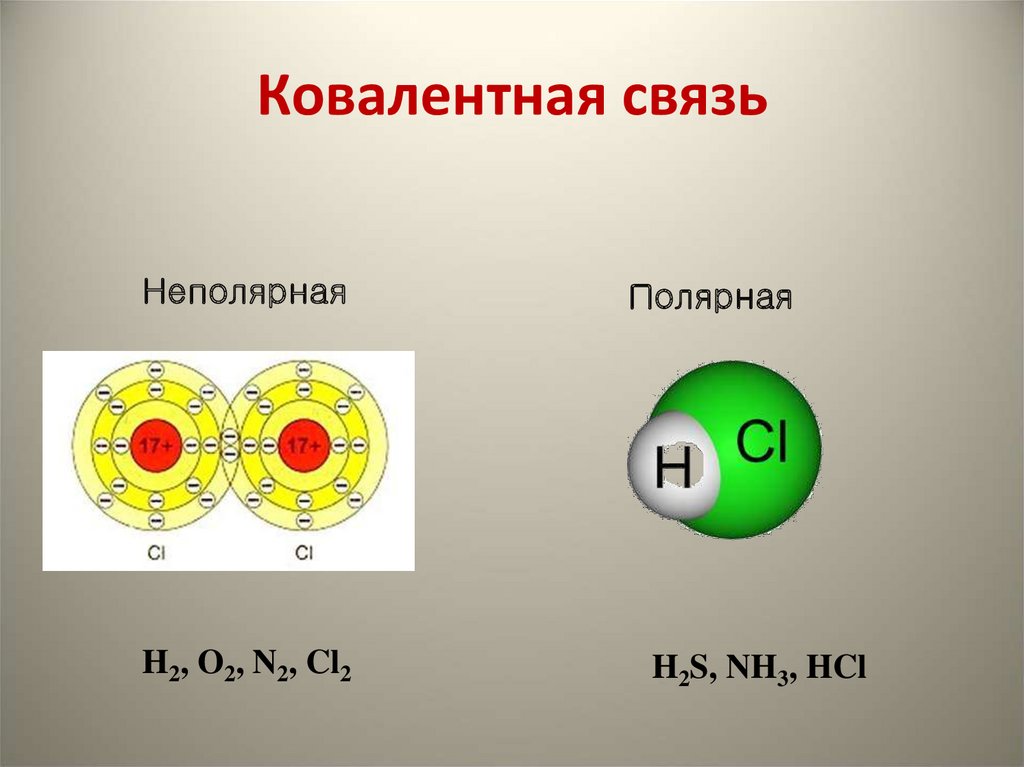
23. Ковалентная связь
НеполярнаяH2, O2, N2, Cl2
Полярная
H2S, NH3, HCl
24.
25.
26. Домашнее задание
• Параграф 11 упр.4,5• Параграф 12 упр. 5,6
• В процессе изучения параграфа выписать в
тетрадь все определения, правила, схемы
образования веществ



















 chemistry
chemistry








