Similar presentations:
Ковалентная связь. Электроотрицательность (ЭО)
1. ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ §32, упр. 3, 4, 5
12.
Упр. 3.Охарактеризуйте химические элементы литий, бериллий и бор по плану:• порядковый номер;
• положение в периодической системе (номер периода, номер группы, подгруппа);
• число протонов в ядре атома;
• число энергетических уровней;
• общее число электронов;
• число электронов на внешнем энергетическом уровне.
Литий:
•3
• 2-й период,
IА-группа
• 3p+
• 2 ЭУ
• 3e• 1e-(внешн.)
Бериллий:
•4
• 2-й период,
IIА-группа
• 4p+
• 2 ЭУ
• 4e• 2e- (внешн.)
Бор:
•5
• 2-й период,
IIIА-группа
• 5p+
• 2 ЭУ
• 5e• 3e- (внешн.)
2
3.
Упр. 4. Определите количество электронов, которое нужно отдать илиприсоединить для получения завершённого внешнего энергетического уровня
атомам следующих химических элементов: кислород, натрий, хлор, магний.
Кислород расположен в VIА-группе, т.е. имеет 6 внешних электронов.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен забрать 2 электрона.
Натрий расположен в IА-группе, т.е. имеет 1 внешний электрон.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен отдать 1 электрон с третьего уровня.
Хлор расположен в VIIА-группе, т.е. имеет 7 внешних электронов.
Для получения завершенного (8-электронного) внешнего (третьего) уровня, он
должен забрать 1 электрон.
Магний расположен во IIА-группе, т.е. имеет 2 внешних электрона.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен отдать 2 электрона с третьего уровня.
3
4.
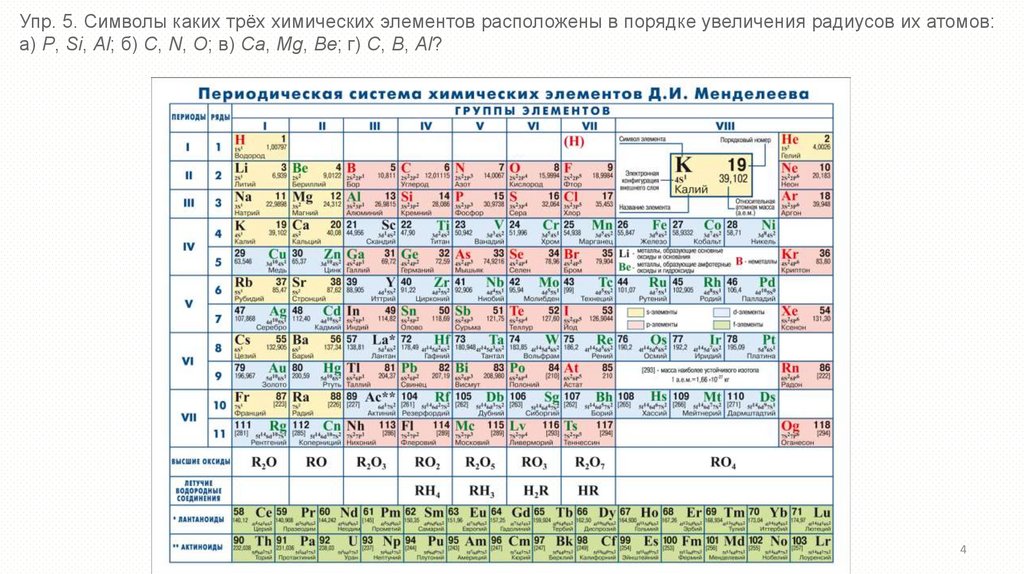
Упр. 5. Символы каких трёх химических элементов расположены в порядке увеличения радиусов их атомов:а) P, Si, Al; б) C, N, O; в) Ca, Mg, Be; г) C, B, Al?
4
5. КОВАЛЕНТНАЯ СВЯЗЬ ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО)
ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙКОВАЛЕНТНАЯ СВЯЗЬ
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ (ЭО)
Учитель химии: Наумова А.А.
6.
О2, N2, Fe, Cu, NH3, H2, HF, H2O, CH46
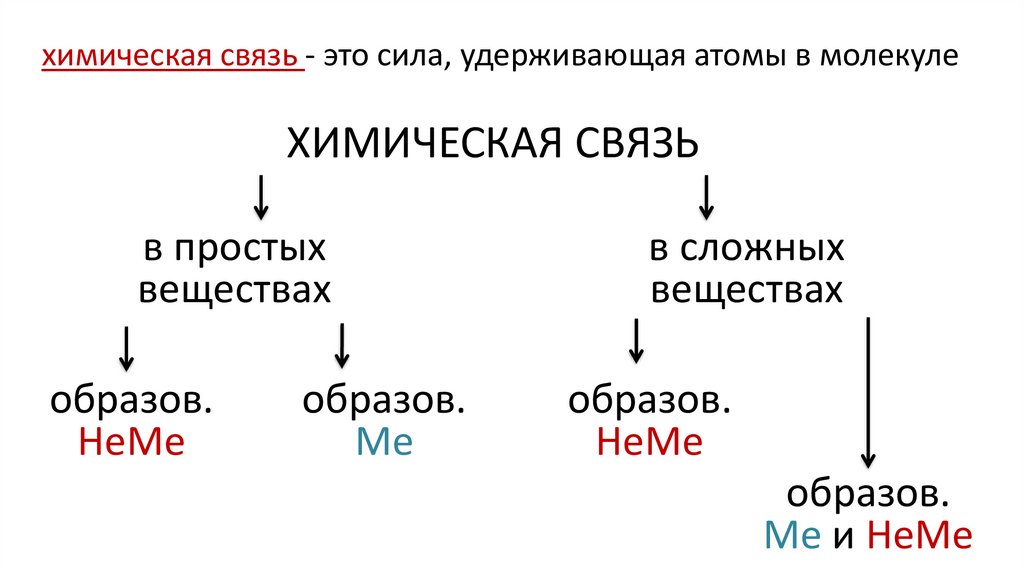
7. ХИМИЧЕСКАЯ СВЯЗЬ
химическая связь - это сила, удерживающая атомы в молекулеХИМИЧЕСКАЯ СВЯЗЬ
в простых
веществах
образов.
НеМе
образов.
Ме
в сложных
веществах
образов.
НеМе
образов.
Me и НеМе
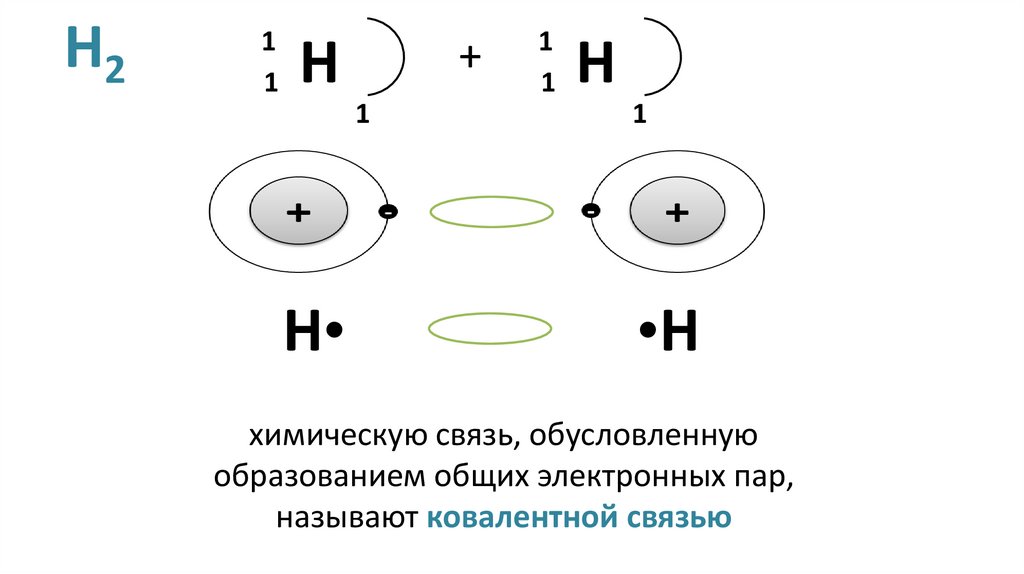
8. H2
11
H
+
1
H
1
1
H
1
•H
химическую связь, обусловленную
образованием общих электронных пар,
называют ковалентной связью
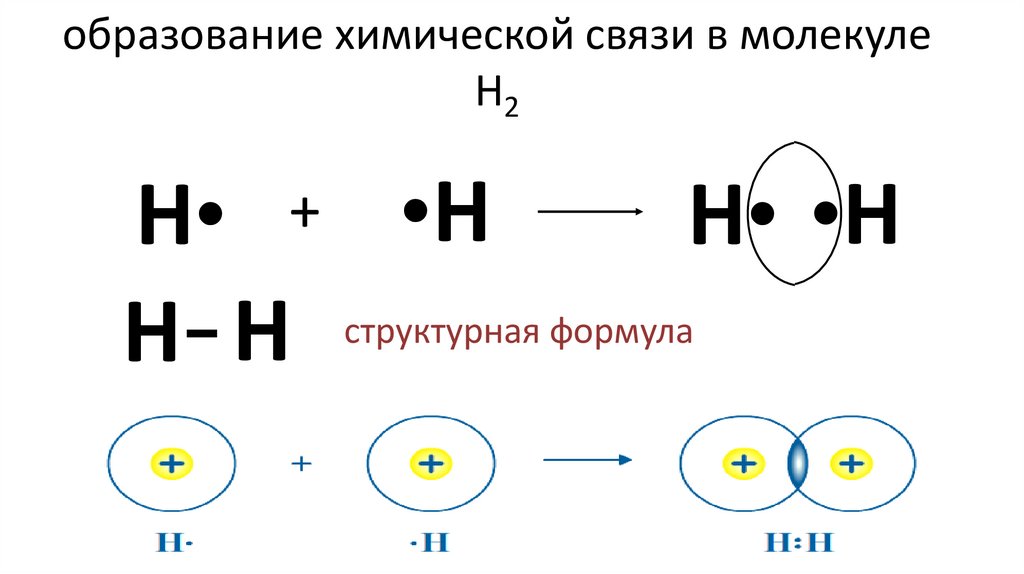
9. образование химической связи в молекуле Н2
H• + •HH• •H
структурная
формула
H- H
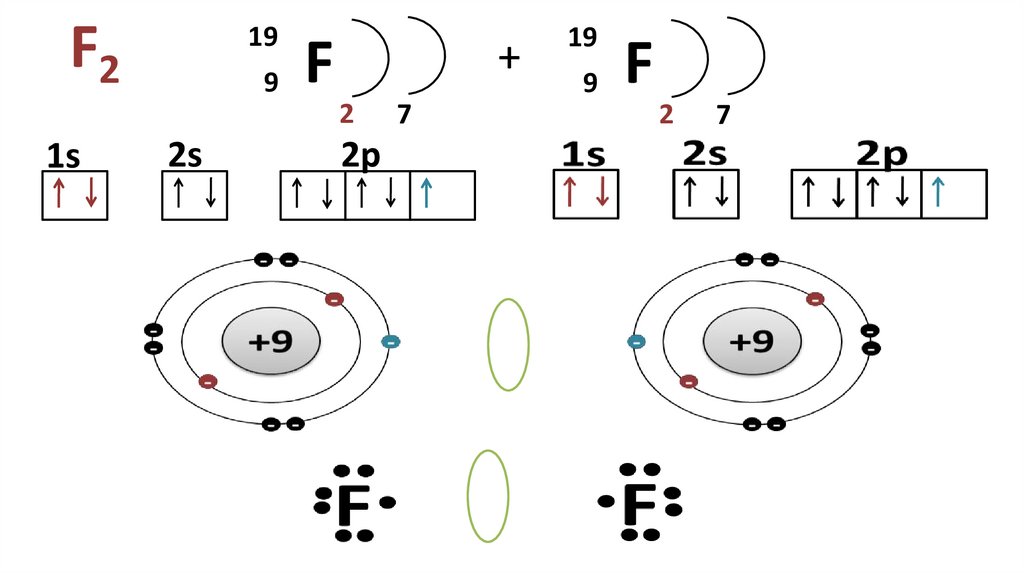
10. F2
199 F
+
2
1s
2s
2p
7
19
9
F
2
7
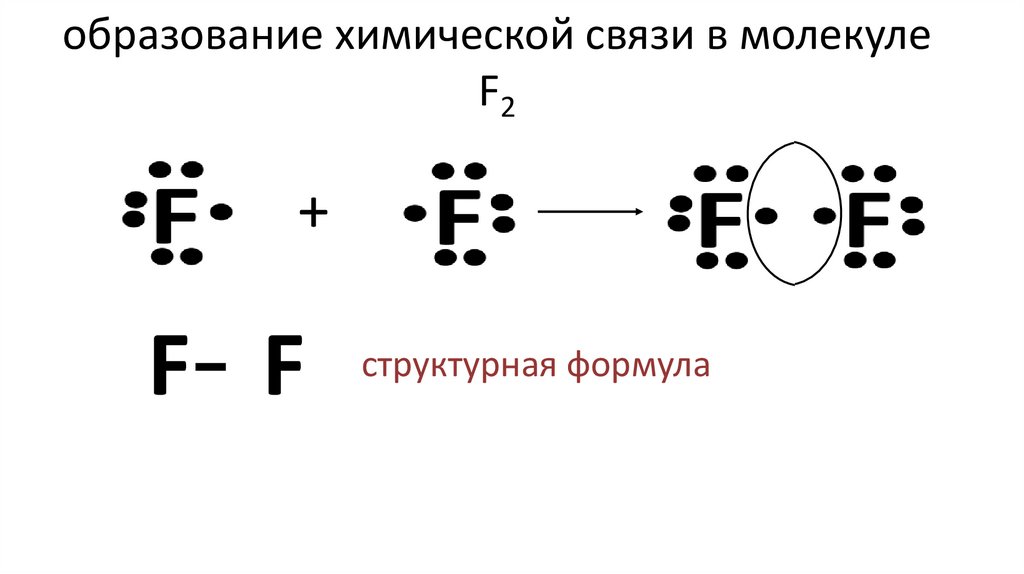
11. образование химической связи в молекуле F2
+F- F
структурная формула
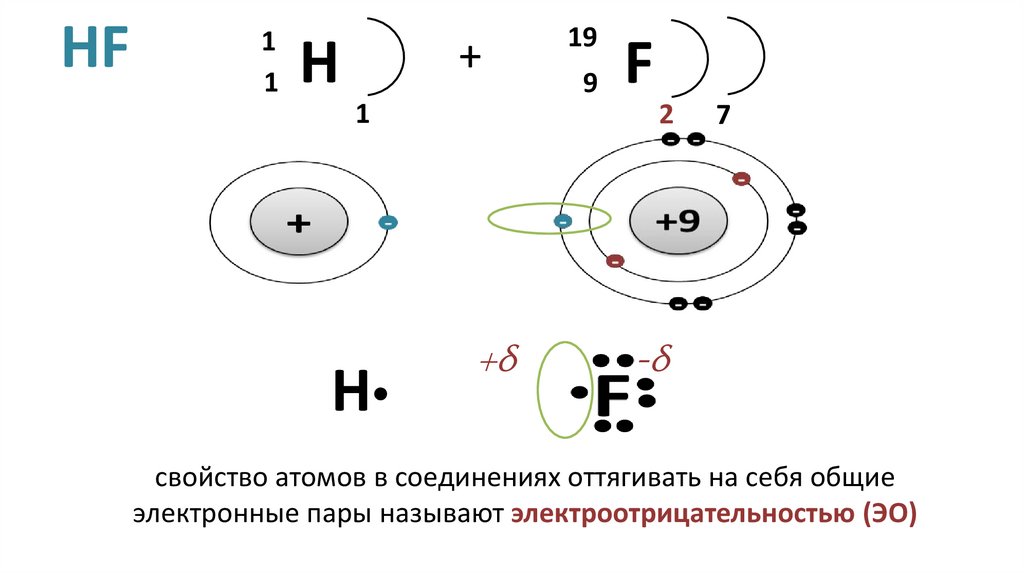
12. HF
11
H
+
1
H
19
9
F
2
+δ
7
-δ
свойство атомов в соединениях оттягивать на себя общие
электронные пары называют электроотрицательностью (ЭО)
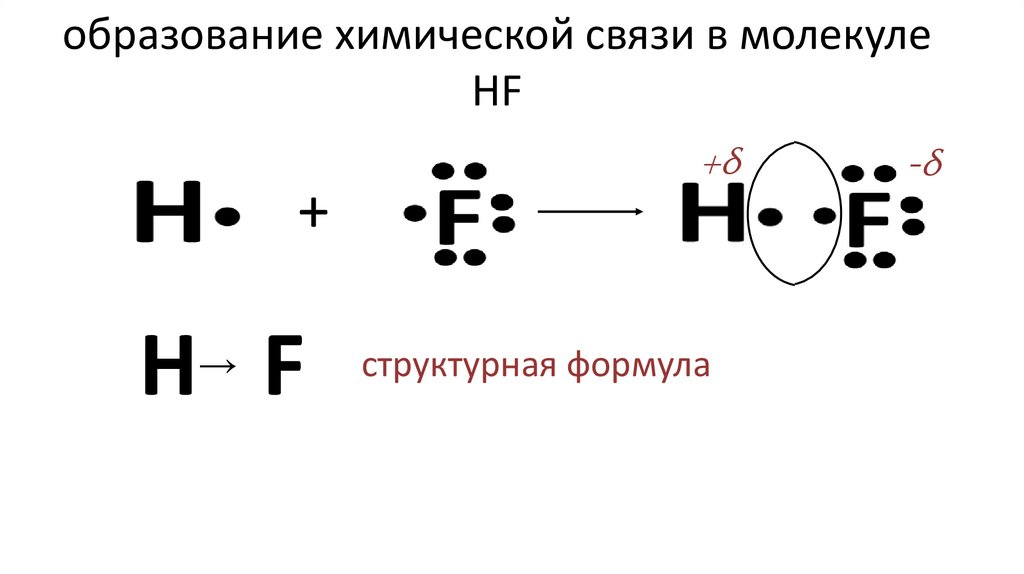
13. образование химической связи в молекуле HF
+H F
→
+δ
структурная формула
-δ
14.
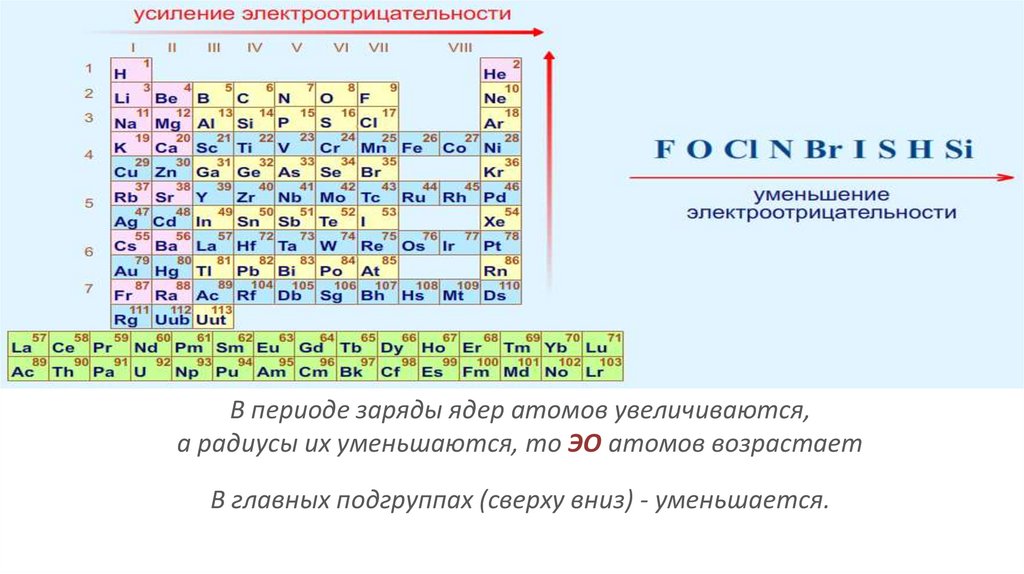
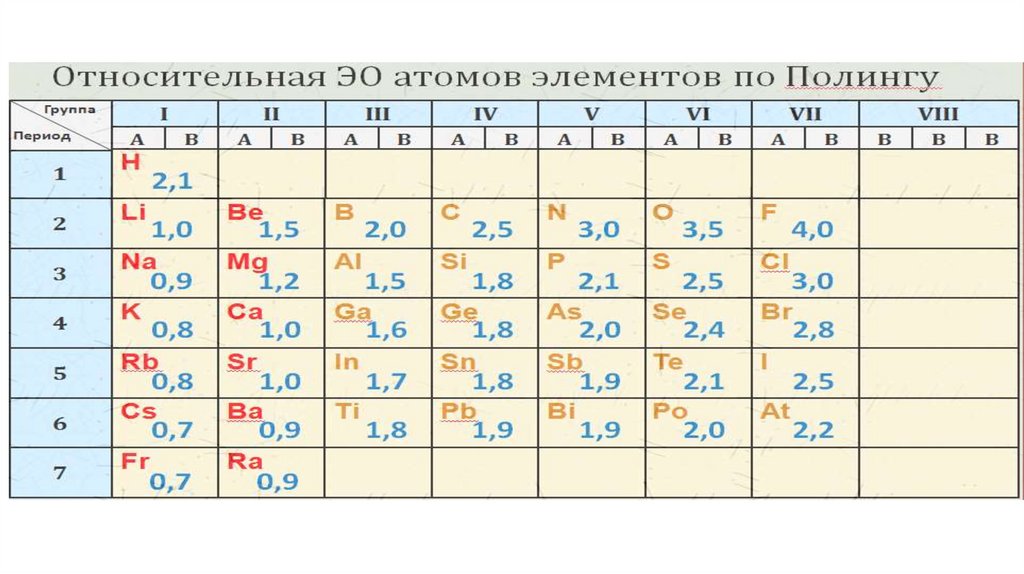
В периоде заряды ядер атомов увеличиваются,а радиусы их уменьшаются, то ЭО атомов возрастает
В главных подгруппах (сверху вниз) - уменьшается.
15.
16.
17.
• Химическую связь, образованную между атомамихимических элементов – неметаллов (НеМе)
• А) различающихся по относительной ЭО, называют
ковалентной полярной связью
• Б) с одинаковой относительной ЭО называют
ковалентной неполярной связью
18. СПАСИБО ЗА ВНИМАНИЕ! Д/З §35 упр. 4,5; §36 учить конспект, составить схемы образования химических связей: О2, N2, NH3, H2O, CH4
1819.
РЕЗЕРВУпр 1. Расположите в порядке увеличения прочности химической связи вещества с
формулами S2, Cl2, N2 и обоснуйте правильность своего решения. Как будет изменяться
длина связи в молекулах составленного вами ряда?
Упр.2. В какой из молекул — хлороводорода НСl или фтороводорода HF — ковалентная
химическая связь более полярна?
Упр. 3. В следующих предложениях впишите пропущенные слова и выражения:
«Ковалентная химическая связь образуется за счёт .... По числу общих электронных пар
она бывает .... По ЭО ковалентную связь делят на ... и ...».
19



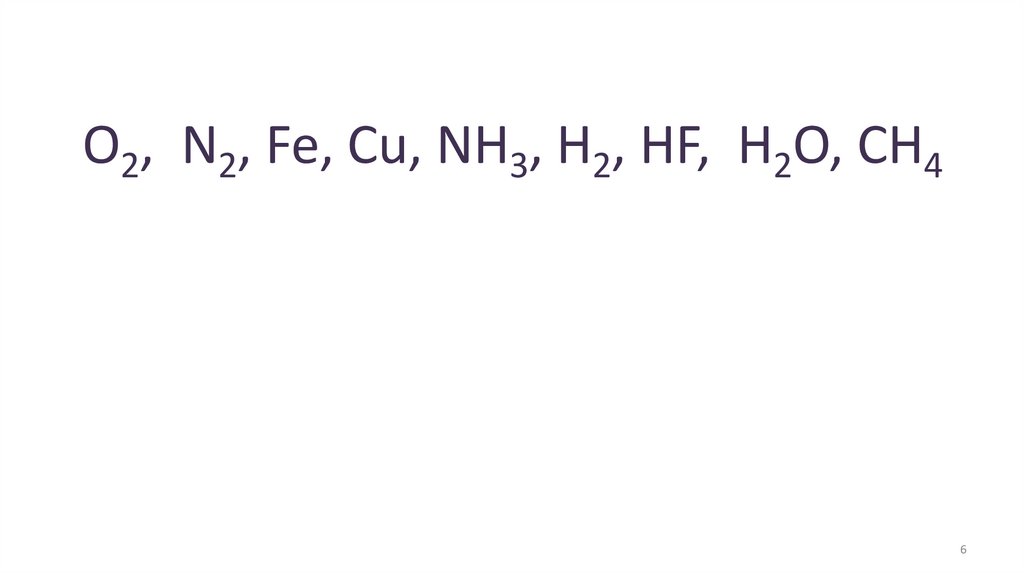




 chemistry
chemistry








