Similar presentations:
Ковалентная химическая связь
1. Ковалентная химическая связь
Тема урока:Ковалентная
химическая связь
8 класс урок химии.
УМК О.С. Габриелян
Автор – преподаватель
химии Золаева К.В.
2021г.
2. Цели урока:
Ознакомить учащихся с видами ковалентной связиСформировать понятия о механизме образования
ковалентной неполярной химической связи
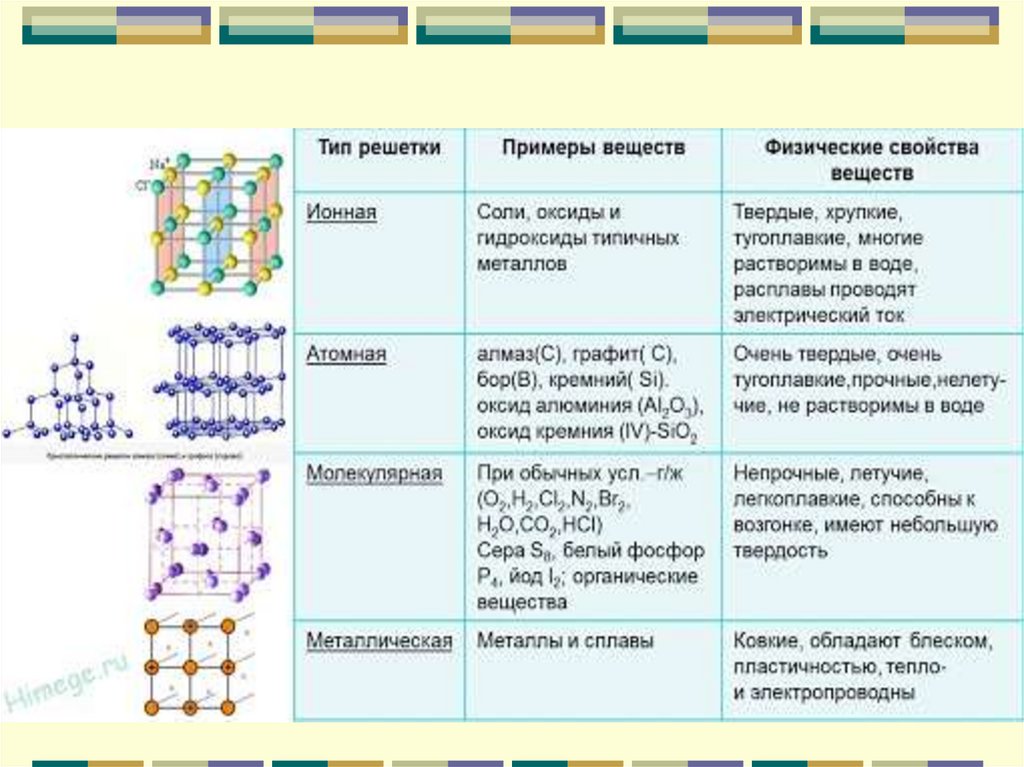
познакомиться с типами кристаллических решеток, их
взаимосвязью с видами химической связи и влиянием на
физические свойства веществ; дать представление о законе
постоянства состава веществ.
3. Содержание:
1.2.
3.
4.
5.
6.
Повторение ранее изученного материала
Решение самостоятельной работы с последующей
взаимопроверкой по эталону
Столкновение с проблемными вопросами
Изучение схем образования ковалентной связи на примере
молекулы водорода
Знакомство с типами ковалентной связи
Рассмотрение типов кристаллических решеток
4.
1. Как меняются свойства атомов элементов одного периода?2. Как меняются свойства атомов элементов одной группы?
3. К чему стремятся все атомы?
4. Что происходит с атомами при отдаче и присоединении электронов?
5. Как называется связь между ионами?
6. Между какими атомами образуется ионная связь?
5. Самостоятельная работа
ВАРИАНТ 11.Определите элемент со схемой
распределения электронов в атоме 2, 8, 4:
а) Mg; б) Si; в) Cl; г) S.
2. Максимальное число электронов на
третьем энергетическом уровне:
а) 14; б) 18; в) 8; г) 24.
3. Сколько орбиталей в атоме водорода, на
которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
4. Атом какого химического элемента
содержит три протона?
а) B; б) P; в) Al; г) Li.
5. Атом какого химического элемента
имеет заряд ядра +22?
а) Na; б) P; в) О; г) Ti.
6. Число нейтронов в атоме марганца
равно:
а) 25; б) 29; в) 30; г) 55.
ВАРИАНТ 2
1. Определите элемент со схемой
распределения электронов в атоме 2, 8, 8:
а) Na; б) P; в) Al; г) Ar.
2. Максимальное число электронов на
четвертом энергетическом уровне:
а) 14; б) 32; в) 26; г) 18.
3. Сколько орбиталей в атоме гелия, на
которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
4. Атом какого химического элемента
содержит десять электронов?
а) S; б) H; в) Ne; г) Li.
5. Атом какого химического элемента
имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
6. Число нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
6. Ответы
Вариант 11.б
2.б
3.а
4.г
5.г
6.в
Вариант 2
1.г
2.б
3.а
4.в
5.в
6.г
7.
Итак, атомы металлов отдают электроны, атомы неметалловпринимают электроны, стремясь завершить свой внешний
уровень, при этом образуются ионы. Связь между ионами
называется ионной.
8. Проблема:
Может ли образовываться связь между атомами неметаллов?Как образуется связь между атомами неметаллов, которые
имеют сходную тенденцию к присоединению электронов?
Как образуются молекулы простых газообразных веществ?
9. Схема образования молекулы водорода
Электроннаяформула молекулы
водорода
H·+·H→H(:)H
Электронные
формулы внешнего
слоя атомов
водорода
H–H
Структурная
формула молекулы
водорода
Связь между атомами в
молекуле водорода
осуществляется за счет общей
электронной пары. Такая
связь называется ковалентной.
В § 35 найдите,
прочитайте и выпишите
в тетрадь определение
ковалентной связи.
10. Типы ковалентной связи
Ковалентная связьполярная
неполярная
11. Задание
Запишите схему образования ковалентной связи на примеремолекул – хлора, кислорода, азота.
Как связана валентность с числом ковалентных связей?
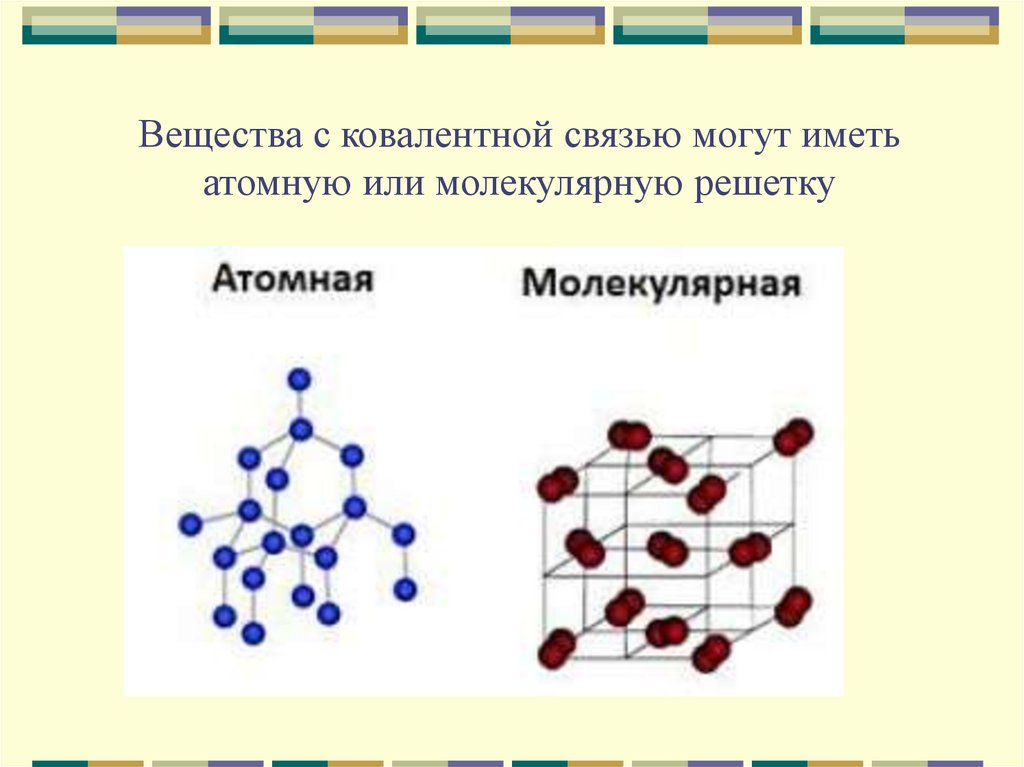
12. Вещества с ковалентной связью могут иметь атомную или молекулярную решетку
13.
14. Закрепление материала- игра «Выбери лишнее»
1.2.
3.
4.
5.
MgS, H2, KCl, NaF
HCl, HBr, HI, N2
Н2О, O2, F2, Cl2
O2, CuCl2, AgI, Li
MgO, H2, F2, O2
15. Домашнее задание:
§35 №4,616. Для составления «картины деятельности» на уроке закончите предложение:
Сегодня на урокемы узнали…
Мы учились…
Мы смогли…
На уроке было
легко…
На уроке было
трудно…
Урок понравился,
потому что…
Урок не
понравился,
потому что…
На следующем
уроке
необходимо
17. Использованные источники
Мякинник Т.Н., Манкевич Н.В., Романовец Г.С.,Славинская Л.А. Уроки химии, 8 класс - Мн.:ООО
«Юнипресс»,2003
Загашев И.О., Заир-Бек С.И. Критическое мышление:
технология развития. –СПб.: «Альянс «Дельта», 2003
Габриелян О.С., Остроумов И.Г., Сладков С.А. Химия, 8
класс – Москва «Просвещение», 2020
Радецкий А.М. Химия, Дидактический материал, 8-9
классы – Москва «Просвещение», 2018















 chemistry
chemistry








